
 English
English
 French
French
Obstructive sleep apnea syndrome: Epidemiological, clinical and paraclinical aspects of the first cases in Lome
Syndrome d’apnées obstructives durant le sommeil: Aspects épidémiologiques, cliniques et paracliniques des premiers cas à Lomé
KS. Adjoh 1, AS. Adambounou1, AG. Gbadamassi1, P. Efalou1, AR. Ouedraogo2, KA. Aziagbe1, W. Foma3, W. Dolou3, MA. Dijibril4, M. Belo5
1: Service de Pneumologie, CHU Sylvanus Olympio. Lomé-Togo
2: Service de Pneumologie, CHU Yalgado Ouedraogo. Ouagadougou-Burkina Faso
3: Service d’Oto-Rhino-Laryngologie, CHU Sylvanus Olympio. Lomé-Togo
4: Service de Médecine interne, CHU Sylvanus Olympio. Lomé-Togo
5: Service de Neurologie, CHU Sylvanus Olympio. Lomé-Togo
Corresponding author
Dr ADAMBOUNOU Stéphane
Service de Pneumologie – CHU Sylvanus OLYMPIO (Lomé –TOGO)
Email: amentos@yahoo.fr
ABSTRACT
Introduction. Obstructive Sleep Apnea Syndrome (OSAS) is a condition that has been timely initiated in Togo. The objective of this study was to present the epidemiological, clinical and polygraphic aspects of the first cases diagnosed.
Method. It was a cross-sectional, descriptive and analytical study of patients referred for consultation for clinical suspicion of an OSA. The study period was extended from 1 July 2013 to 30 June 2015. Diagnostic confirmation was made by a polygraph recording.
Results. Fifty-one patients were recruited. The sex ratio was 2.64. The mean age was 49.0± 12.1 years for males and 42.6±11.3 years for females. Neck circumference was excessive in 11(29.7%) men (˃44 cm) and 03(21.4%) women (˃41 cm). The referring physicians were mainly neurologists (62.7%) and cardiologists (11.8%), with morning headache and reactive hypertension respectively. The notion of familial ronchopathy was noted in 54.9% of cases. Snoring, present in 82.3%, constituted a social discomfort in 88.1% of the cases. The mean Epworth score was 13.7± 04.0. The index of hypopnea was greater than 30 in 16 (43.2%) men and 03 (21.4%) women.
Conclusion. OSAS is a reality in sub-Saharan Africa. It is important to set up a suitable circuit of diagnostic and therapeutic care.
KEYWORDS: Epidemiology, clinical, sleep apnea syndrome, Africa.
RÉSUMÉ
Introduction. Le syndrome d’apnées obstructives durant le sommeil (SAOS) est une affection dont la prise en charge a timidement débuté au Togo. L’objectif de cette étude était de présenter les aspects épidémiologiques, cliniques et polygraphiques des premiers cas diagnostiqués.
Méthodologie. Il s’est agi d’une étude transversale, descriptive et analytique de patients référés en consultation pour suspicion clinique d’un SAOS. La période d’étude s’est étendue du 1er Juillet 2013 au 30 Juin 2015. La confirmation diagnostique a été faite par une polygraphie ventilatoire.
Résultats. Cinquante et un patients ont été recrutés. La sex ratio était de 2,64. L’âge moyen des patients était de 49,0±12,1 ans chez les hommes et de 42,6±11,3 ans chez les femmes. La circonférence du cou était excessive chez 11(29,7%) hommes (˃44 cm) et chez 03(21,4%) femmes (˃41 cm). Les principaux médecins référents étaient les neurologues (62,7%) et les cardiologues (11,8%) avec comme motif majeur respectivement des céphalées matinales et une hypertension artérielle. La notion de ronchopathie familiale a été notée dans 54,9% des cas. Les ronflements, présents dans 82,3%, constituaient une gêne sociale dans 88,1% des cas. Le score d’Epworth moyen était de 13,7±04,0. L’index d’apnées hypopnées était supérieur à 30 chez 16(43,2%) hommes et 03(21,4%) femmes.
Conclusion. Le SAOS est une réalité en Afrique sub-saharienne. Il importe de mettre en place un circuit adapté de soins diagnostiques et thérapeutiques.
MOTS CLÉS: Epidémiologie, clinique, syndrome d’apnées du sommeil, Afrique.
INTRODUCTION
Le syndrome d’apnées obstructives durant le sommeil (SAOS) est une pathologie fréquente dont la prévalence, dans la population générale, est estimée à 5% dans les pays développés [1]. Les sujets apnéiques sont à risque de pathologies essentiellement cardiovasculaires et neurologiques [2, 3]. Dans les pays occidentaux, cette affection est reconnue comme un problème de santé publique [1], et est prise en charge depuis une trentaine d’années grâce aux travaux de Guilleminault [4] et de Sullivan [5]. Dans les pays sub-sahariens, elle est méconnue de la population générale et même du personnel médical [6]. Au Togo, le SAOS a longtemps été sous diagnostiqué du fait de l’absence d’outils diagnostiques et de circuit de prise en charge. L’acquisition, depuis peu, d’un polygraphe ventilatoire (PV) a permis d’initier la prise en charge des troubles respiratoires survenant au cours du sommeil, en particulier le SAOS. L’objectif principal de notre étude était de présenter le profil des premiers cas de SAOS diagnostiqués chez des adultes à Lomé (Togo). De manière spécifique, il s’était agi d’identifier les facteurs de risque du SAOS, de déterminer la fréquence des signes fonctionnels, de ressortir les particularités épidémiologiques, cliniques et para cliniques du SAOS.
METHODS
Cadre d’étude
La clinique Biasa, une structure sanitaire privée de Lomé (Togo), a servi de cadre à notre étude. Lomé, capitale du Togo, est une ville qui hébergeait 1.638.416 d’habitants. Le Laboratoire de sommeil de la clinique Biasa était composé d’une chambre à un lit dédiée pour l’enregistrement des cas présomptifs
de SAOS.
Type et période d’étude
Il s’est agi d’une étude transversale, descriptive et analytique, menée du 1er Juillet 2013 au 30 Juin 2015, soit une période de deux années. Collecte des données La consultation en médecine du sommeil était assurée, de façon hebdomadaire, par un pneumologue formé à la prise en charge des troubles respiratoires liés au sommeil. Chaque patient était ensuite adressé en consultation oto-rhino-laryngologique (ORL) pour la recherche d’une cause locale éventuelle de SAOS. Une fiche d’enquête était renseignée à chaque étape de la prise en charge des patients pour recueillir leurs caractéristiques socio-démographiques, leurs symptômes, les données cliniques et polygraphiques. La polygraphie ventilatoire nocturne (PVN) était réalisée en hospitalisation. A l’admission, un infirmier accueillait le patient, lui réexpliquait le principe et le but de l’analyse. Les paramètres (tension arté- rielle, pouls, poids, taille, tour de cou, périmètre ombilical, tour de taille, tour de hanche) du patient étaient pris par l’infirmier. Ensuite, il procédait à la mise en place du PV. La tension artérielle (TA) et le
pouls étaient repris le matin dès le réveil. La lecture des enregistrements se faisait automatiquement, puis de façon manuelle par le médecin spécialiste. Le matériel utilisé était un PV de marque CIDELEC
type CID102L Il était composé de capteur du flux nasal, de capteur de son, de capteurs de position, de
capteur pour la pression sus-sternale et d’un oxymètre permettant d’enregistrer des signaux validés.
Analyse des données
La saisie, le traitement statistique et l’analyse des données ont été réalisés à l’aide du logiciel SPSS version 2.1. Les variables qualitatives ont été comparées avec le test de Khi-deux. Le seuil de signification a été moins de 0,05.
Considérations éthiques
Le consentement éclairé de chaque patient était obtenu avant l’enrôlement dans l’étude. L’anonymat des patients a été assuré par la codification de la fiche d’enquête.
Population d’étude
Critères d’inclusion
Nous avons retenu les patients âgés d’au moins 18 ans, enregistrés à Lomé, confirmés apnéiques sur la
base d’arguments polygraphiques (Index Apnées Hypopnées supérieur à 5 par heure), qui ont consenti de participer à l’étude.
Critères de non inclusion
N’ont pas été inclues dans l’étude, les personnes pré-sentant des habitudes (prise de somnifères et/ ou d’excitants, travail posté) pouvant induire une modification du cycle veille/sommeil, dont le diagnostic de SAOS a été fait ailleurs qu’à Lomé, déjà traités avec un appareil de pression positive
continue (PPC).
Critères d’exclusion
Nous avons exclu de l’étude, les patients dont l’IAH était inférieur à 5 par heure ou dont le SAS était de type central.
RESULTATS
Caractéristiques épidémiologiques et anthropomé-triques de la population d’étude
Durant la période d’étude, une PVN a été réalisée chez 63 patients. Le diagnostic de SAOS a été confirmé chez 54 patients. Une proportion de 94,4% des patients répondait à nos critères.
La population étudiée était constituée de 37 hommes et de 14 femmes; soit une sex-ratio de 2,64. L’âge moyen des hommes était de 49,0±12,1 ans, celui des femmes de 42,6±11,3 ans (p=0,058). Une proportion de 51,4% des hommes et 21,4% des femmes (p=0,042) était âgée d’au moins 50 ans. Parmi les patients, 75,7% des hommes et 71,4% des femmes vivaient en couple (p=0,065). Une proportion de 92,2% des patients étaient professionnellement actifs. Tous les patients étaient instruits.
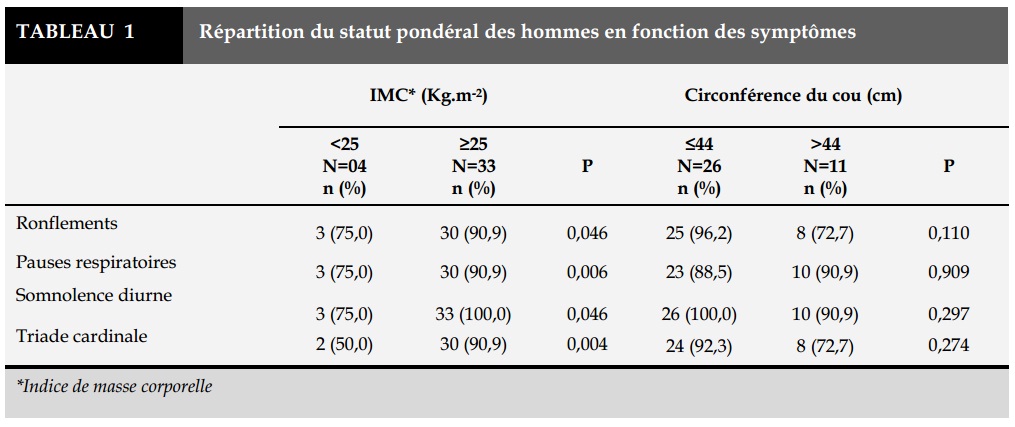
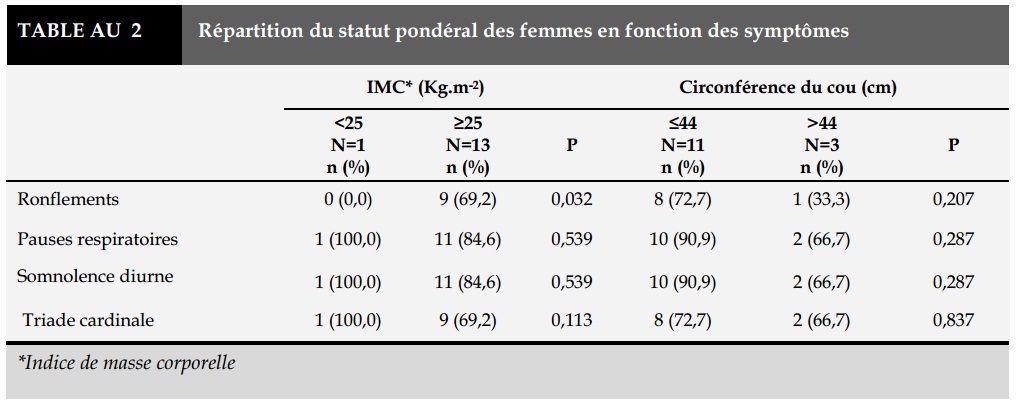
L’indice de masse corporelle (IMC) des hommes était en moyenne de 30,6±5,1 Kg.m-2, celui des femmes de 33,5±5,4 Kg.m-2 (p=0,309). On notait un excès de poids (IMC >25 Kg.m-2) dans 90,2% des cas (30,43% en surcharge pondérale et 69,57% d’obèses). La circonférence du cou était supérieure à 41 cm chez 03 (21,4%) femmes, à 44 cm chez 11 (29,7%) hommes.
Antécédents médicaux
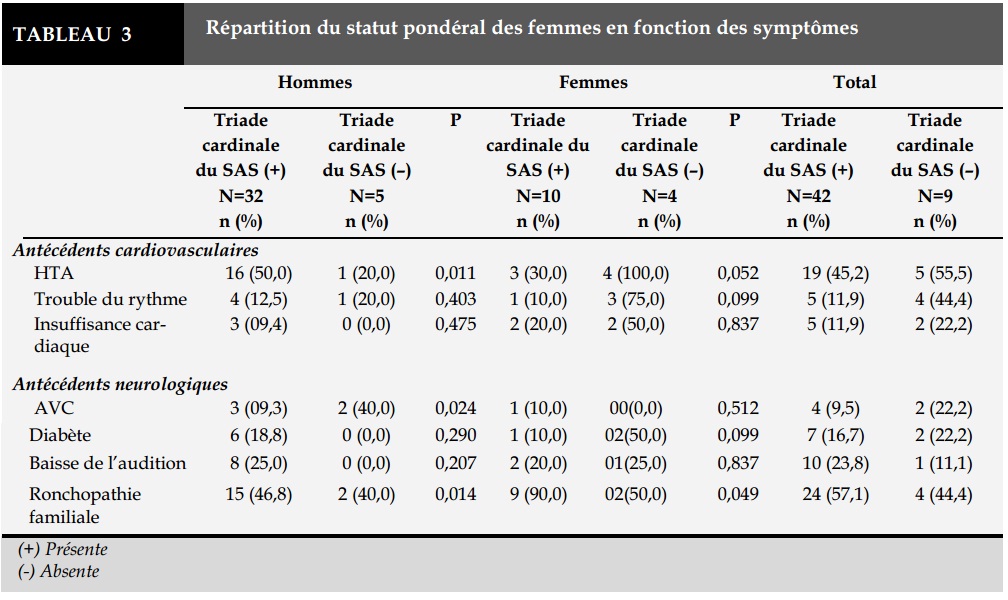
Les antécédents cardiovasculaires recensés étaient l’hypertension artérielle (HTA) (47,0%), les troubles du rythme cardiaque (17,6%) et une insuffisance cardiaque (13,7%). Le diabète, de type 2, était noté dans 17,6% des cas. On retrouvait une notion de ronchopathie familiale, de baisse de l’audition et de la libido respectivement chez 54,9%, 21,5% et 78,4% des patients.
Aspects cliniques
Motifs de consultation
Les motifs de consultation étaient les ronflements (50,1%), les pauses respiratoires au cours du sommeil (33,3%), les troubles du sommeil (41,2%), la nycturie (>2) (09,8%), la sensation de sommeil non récupérateur (25,9%), les céphalées chroniques (47,1%), la somnolence diurne excessive (SDE) (39,2%), l’asthé-nie chronique (39,2%), l’HTA (17,7%).
Les médecins référents étaient un neurologue (62,7%), un cardiologue (11,8%), un pneumologue (09,8%), un médecin généraliste (07,9%), un ORL (03,9%) ou un anesthésiste (03,9%).
Les neurologues référaient pour des céphalées chroniques et une SDE dans 68,7% des cas, les cardiologues pour une HTA (83,3%), les médecins généralistes pour des ronflements (75,0%) et pauses respiratoires (50,0%) et les ORL pour ronflements, pauses respiratoires et nycturie dans 50% des cas chacun.
Habitudes de sommeil
En semaine ouvrée, la durée du sommeil de nuit des hommes était en moyenne de 07,3±1,1 heures et celle des femmes de 07,6±1,6 heures. La sieste, d’une durée moyenne de 41 minutes, était faite par 67,6% des hommes et 64,3% des femmes.
Symptômes du SAOS
Symptômes nocturnes
Les symptômes nocturnes, manifestés par les patients, étaient des pauses respiratoires (89,2% des hommes et 85,7% des femmes), les ronflements (89,2% des hommes et 64,3% des femmes), une nycturie (> 2 fois) (67,6% des hommes et 71,4% des femmes).
Les pauses respiratoires étaient ressenties par le patient comme une sensation d’étouffement dans 68,9% des cas, constatées par l’entourage dans 08,9% des cas.
Chez les 42 patients ronfleurs, les ronflements étaient quotidiens dans 92,8% des cas, et survenaient en décubitus dorsal (14,3%) ou dans toutes les positions (80,9%). Ces ronflements gênaient leur entourage selon 90,9% des hommes et 77,8% des femmes ronfleurs.
Symptômes diurnes
Les symptômes diurnes, rapportés par les patients, étaient le sommeil non récupérateur (83,8% des hommes et 85,7% des femmes), la somnolence diurne excessive (SDE) (94,6% des hommes et 85,7% des femmes), les céphalées chroniques (64,9% des hommes et 85,7% des femmes) et l’asthénie chronique (86,5% des hommes, 92,9% des femmes).
Le score d’Epworth était en moyenne de 13,7±04,0 chez les hommes et de 15,2±04,8 chez les femmes.
Triade cardinale
La triade cardinale (ronflements, pauses respiratoires et SDE) était retrouvée chez 94,4% des hommes de moins de 50 ans contre 84,2% chez les hommes âgés de 50 ans et plus (p =0,168). Chez les
femmes, elle a été notée dans 81,8% chez les moins de 50 ans, et dans 33,3% chez les plus de 50 ans (p
= 0,099).
Examen ORL
L’examen ORL avait identifié 18(35,3%) cas de troubles auditifs à type d’hypoacousie, 07(13,7%) cas de sinusite, 03(05,8%) cas de polypose nasosinusienne et 07(13,7%) cas de macroglossie.
Relations entre les symptômes nocturnes et les symptômes diurnes du SAOS Une proportion de 95,2% des ronfleurs versus 88,9% des non-ronfleurs avait signalé une SDE tandis que 85,7% des ronfleurs versus 77,8% des non-ronfleurs se plaignaient d’un sommeil non récupérateur. Une proportion de 93,3% des patients, qui avaient des pauses respiratoires, était somnolente. L’asthénie chronique était retrouvée chez 91,4% des sujets qui avaient une nycturie supérieure à 2 et chez 86,7% des sujets ayant une nycturie inférieure ou égale à 2.
Relations entre le statut pondéral et les symptômes
Chez les hommes en excès de poids, on retrouvait de façon significative les ronflements (p=0,046), les pauses respiratoires (p=0,006), la somnolence diurne (p=0,046) et la triade cardinale (p=0,004) (Tableau 1).
Chez les femmes de plus de 25 Kg.m-2, seuls les ronflements étaient retrouvés de façon significative (p=0,032) (Tableau 2).
Triade cardinale et antécédents
Parmi les hommes présentant la triade cardinale, on retrouvait de façon significative un antécédent personnel d’HTA ou de ronchopathie familiale. Cette dernière était également notée de façon significative (p= 0,049) chez les femmes ayant la triade cardinale (Tableau 3).
Données polygraphiques
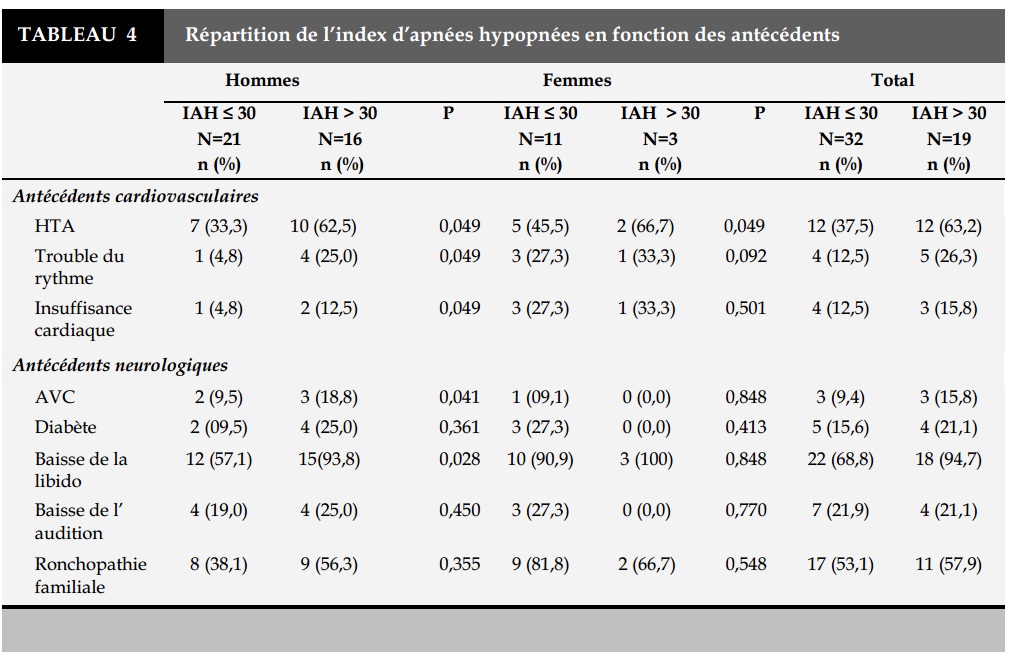
L’index apnées hypopnées (IAH) était compris entre ]5-14]/h chez 13,5% des hommes et 57,1% des femmes, entre [15-30]/h chez 43,2% des hommes et 21,4% des femmes. L’IAH était sévère, (>30/h) chez 43,2% des hommes et 21,5% des femmes. L’index de ronflements (IR) était supérieur à 50/heure chez tous les patients. L’index de désaturation en oxygène (IDO), avec un seuil à 4%, était en moyenne de 26,9±17,3/h chez les hommes et de 19,2±12,9/h chez les femmes. La saturation en oxygène (SpO2) minimale était en moyenne de 73,7±10,7% en air ambiant.
Dans tous les cas, les événements respiratoires survenaient dans toutes les positions.
Relations entre l’IAH, les antécédents et les symptômes
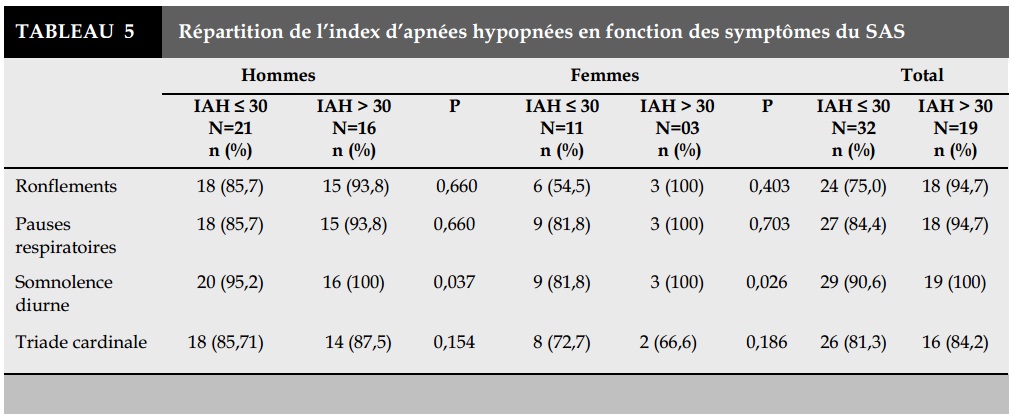
Dans le groupe des patients qui avaient un IAH supérieur à 30/h, 63,2% avaient une HTA, 26,3% un trouble du rythme cardiaque, 21,1% étaient diabé-tiques (Tableau 4), et tous étaient somnolents (Tableau5).
DISCUSSION
Cadre et méthode d’étude
La clinique BIASA a servi de cadre à notre étude car elle était la seule structure sanitaire de Lomé qui disposait d’un laboratoire de sommeil équipé d’un PV.
Le statut privé de cette structure pourrait en avoir limité financièrement l’accès à la population.
Nous avons utilisé un PV pour la confirmation des SAOS. L’examen de référence pour le diagnostic du SAOS est la polysomnographie (PSG) car elle permet de coupler les anomalies respiratoires aux différents stades du sommeil [7]. Le coût élevé de cet appareil justifie son utilisation limitée aux grands laboratoires de sommeil et pour les cas de SAOS non élucidés par le PV. Ainsi, même dans les pays développés, le PV garde un intérêt dans la stratégie diagnostique des SAOS. Ailleurs, comme au Bénin [8] et au Vietnam [9], les premiers cas de SAOS ont été diagnostiqués à l’aide d’un oxymètre nocturne, outil moins performant que le PV.
Le taux de participation élevé (94,4%) s’explique par l’intérêt que portent les populations à cette pathologie, qui jusque-là, était méconnue de tous [8]. Il en était de même pour Le Thuong et al. au Vietnam en 2010 qui avaient enregistré un taux de participation de 93,92% [10].
L’effectif des patients semble faible pour une ville d’environ 1,6 millions d’habitants. Dans une enquête
de prévalence réalisée à Lomé, 11,38% de la population présentait la triade cardinale du SAOS et serait donc susceptible de développer la maladie [11]. Ce faible effectif peut s’expliquer par la méconnaissance de la pathologie par la population [8]. D’autre part, les médecins de Lomé, malgré un niveau de connaissance théorique moyen sur la maladie, n’ont pas les bons réflexes pour détecter les cas suspects et les orienter dans un circuit de soins diagnostique et thé-rapeutique adapté [6]. L’acquisition du PV par la clinique était récente. Il est possible que la communication n’ait pas été suffisante. Somme toute, la prise en charge du SAOS à Lomé était à ses débuts.
Le même constat a été fait dans l’étude de LeThuong et al. au Vietnam en 2010, dont l’effectif de l’échantillon était de 263 patients en deux ans, soit 131,5 cas par an pour une population de 7,5 millions d’habitants de Ho Chi Minh ville [10].
Caractéristiques de la population d’étude
Une proportion de 56,9% des patients avait un âge inférieur à 50 ans ; ce qui cadre bien avec le profil de la population togolaise qui était essentiellement jeune. Alors que les progrès en matière de santé ont permis d’augmenter l’espérance de vie des occidentaux, les populations des pays du tiers monde sont majoritairement jeunes. Notre population d’étude s’apparente à celle de Le Thuong et al. dont 72,88% des sujets avaient un âge inférieur à 60 ans [10].
On notait une prédominance masculine, comme dans les études de Young et al. (3,69) [1], Laaban et al. (2,94) [3] et Trzépizur et al. (2,9) [12]. Tous nos patients étaient instruits. Une proportion de 65% de la population d’étude de Le Thuong et al. avait un haut niveau intellectuel [10]. Les personnes instruites s’adresseraient facilement en consultation de médecine moderne que les personnes non instruites.
Aussi bien dans notre étude que dans celle de Meslier et al., près de trois quarts des sujets étaient mariés [13]. La gêne sociale induite par les ronflements du sujet apnéique et les anomalies respiratoires constatées par le/la conjoint(e) sont des motifs d’incitation à consulter.
Statut pondéral
L’évaluation du statut pondéral a permis d’identifier 90,2% de sujets en excès de poids dont 30,4% en surcharge pondérale et 69,5% d’obèses. Ces résultats sont proches de ceux de Laaban et al. [3] et Laraqui et al. [14] dont la population d’étude était composée respectivement de 65,8% et de 65,9% d’obèses. La notion d’obésité ne signe pas obligatoirement un SAOS. En effet, dans l’étude de Maleej et al. [15], portant sur une population d’obèses, 35% ne présentaient aucune manifestation clinique, ni polygraphique de SAOS. On remarque que 09,8% des sujets apnéiques avaient une corpulence normale. C’est dire qu’un SAOS peut s’installer en absence d’obésité car il existe bien d’autres facteurs favorisants.
Motifs de référence
Une proportion élevée (68,8%) des patients, présentant des céphalées chroniques, était adressée par un neurologue contre 31,2% pour les autres spécialistes avec une différence statistiquement significative. Ceci s’explique par le fait que les neurologues attribuent une place importante au SAOS dans les étiologies des céphalées chroniques, motif fréquent de consultation en neurologie. De même, une forte proportion de patients (83,3%) qui présentaient une HTA avait été adressée par un cardiologue contre 16,7% pour tous les autres mé-decins avec une significativité de la différence. Le SAOS est une étiologie à rechercher en cas d’HTA rebelle au traitement anti-hypertenseur. En effet, le
stress cardiovasculaire induit par les troubles respiratoires et gazométriques durant le sommeil peuvent progressivement favoriser des complications cardiovasculaires à type d’HTA, de troubles du rythme cardiaque [2, 3, 16].
Antécédents médicaux
L’HTA et le diabète étaient présents respectivement chez 47,0% et 17,6% des patients. Dans l’étude de Laaban et al., l’HTA et le diabète étaient respectivement présents chez 54,0% et 22,0% des patients [3]. Ces deux affections peuvent être des complications d’un SAOS négligé. D’où l’intérêt d’un dépistage précoce du SAOS et une prise en charge adéquate. La baisse de la libido était notée, comme antécédent médical, chez 78,4% des patients, mais n’avait pas été signalée comme motif de consultation. Certes, plusieurs affections [17] pourraient être à l’origine de cet état de fait mais il ne faudrait pas perdre de vue que le SAOS peut également être en cause, surtout chez le sujet jeune. Hirshkowitz et al., dans leur étude sur les troubles érectiles, avaient noté que 43,8% des patients avaient un IAH supérieur 5 [18].
Signes cliniques
Les ronflements étaient retrouvés chez 82,3% des patients parmi lesquels 92,8% étaient des ronfleurs habituels (plus de 3 fois par semaine). Un peu plus de la moitié des ronfleurs était âgée de plus de 50 ans. Cela pourrait s’expliquer par la diminution de la tonicité des muscles dilatateurs des voies aériennes supérieures (VAS) qui survient avec l’âge. Ces résultats sont similaires à ceux de Laraqui et al. [14] qui avaient retrouvé que 60,22% des sujets apnéiques ronfleurs étaient âgés de plus de 50 ans. Selon l’étude de Meslier et al., la prévalence des ronflements était de 71,3% dans la population générale [13]. Dans notre étude, le sexe n’avait pas d’influence statistiquement significative dans la survenue des ronflements. En revanche, 90,9% des hommes et toutes les femmes qui ronflaient avait un IMC excé-dentaire de léger à sévère. Ces résultats sont semblables à ceux obtenus par Laraqui et al. où 98,86% des patients avaient un IMC supérieur à 25 Kg.m-2 [14]. La surcharge pondérale, voire l’obésité, favoriserait une infiltration graisseuse des VAS réduisant ainsi la filière oro-pharyngée. Dans la présente étude, c’était la somnolence qui était plus marquée chez les apnéiques sévères. Cela est la conséquence de la fragmentation du sommeilqui en altère la qualité. Cette somnolence peut être réversible sous traitement par PPC. Toutefois, en cas d’un retard diagnostique et thérapeutique, l’hypoxie chronique peut entrainer des lésions oxydatives irréversibles dans tout le système nerveux central, et particulièrement dans les régions impliquées dans l’éveil [29]. Les pauses respiratoires ont été peu rapportées comme motif de consultation ou de référence. En effet, elles sont difficiles à identifier cliniquement. La détection de ces pauses respiratoires peut être fonction de la durée de l’apnée. Une meilleure analyse sémiologique des ronflements à l’interrogatoire des patients, et surtout de leur entourage, est nécessaire pour ressortir leur existence. On recherchera, en particulier, le caractère irrégulier et la reprise brusque des ronflements après un laps de silence.
Données polygraphiques
L’IDO était en moyenne de 26,9/h chez les hommes et de 19,2/h chez les femmes dans notre étude. Le risque de désaturation est dû à la fréquence et à la durée des troubles respiratoires [20].
Le SAOS était sévère chez 43,2% des hommes et chez 21,5% des femmes avec une différence statistiquement significative. Certaines études ont rapporté une prédominance masculine du SAOS avant l’âge de 50 ans. Au-delà de cette limite d’âge qui correspond à la période de ménopause chez la femme, la fréquence tendrait à s’égaliser [1]. Un antécédent de baisse de la libido a été noté, de façon significative, chez 93,8% des hommes ayant un SAOS sévère contre 57,1%. La sévérité du SAOS peut donc affectée la vie sexuelle des patients. L’HTA était significativement présente chez les hommes et les femmes ayant un SAOS sévère. Des résultats similaires ont été obtenus dans l’étude menée par Laaban et al. où l’on notait la présence d’une HTA chez 53,5% des hommes et 62,4% des femmes en cas de SAS sévère contre 37,6% et 60,8% respectivement chez les hommes et les femmes apnéiques non sé- vères [3]. Toutes les personnes qui avaient un SAOS sévère étaient somnolentes. La SDE peut être le reflet de la sévérité d’un SAOS. Le SAOS est donc une étiologie à rechercher devant toute plainte de SDE sans cause évidente. En effet, d’autres affections peuvent très bien se manifester par une SDE [21]. La réalisation d’une PVN ou d’une PSG permettrait d’affirmer ou d’infirmer le diagnostic de SAOS. Toutefois, l’absence de somnolence n’écarte pas un SAOS. Dans l’étude de Trzépizur et al. la corrélation entre la sévé- rité du SAOS et la SDE était faible [12]. Toutes les études confirment nos résultats selon lesquels les complications médicales, essentiellement cardiovasculaires et neurovasculaires, sont plus fré- quentes en cas de SAOS sévère [2, 3, 19]. La survenue d’un diabète est aussi possible [22]. En effet, 25% des hommes présentant un SAOS sévère étaient diabétiques.
CONCLUSION
La prise en charge du SAOS est à ses débuts en Afrique sub-saharienne. Cette affection reste sousdiagnostiquée à Lomé (Togo) où elle touche plus les adultes jeunes de sexe masculin. L’obésité en est le principal facteur favorisant. La pluralité des signes fonctionnels fait du SAOS une affection au carrefour de plusieurs spécialités.
Remerciements
Nous remercions le Dr Moïse FIADJOE et tout le personnel de la clinique Biasa de Lomé (Togo). La présence de la triade cardinale, associant ronflements, pauses respiratoires et SDE chez tout patient, doit inciter au dépistage du SAOS. De même, dans l’enquête étiologique de manifestations cardiovasculaires ou neurovasculaires, la recherche active d’un SAOS devrait être systématique. Il est impératif d’intensifier sa prise en charge par la mise en place de laboratoires de sommeil, en particulier en milieu hospitalier.
CONFLIT D’INTÉRÊT
Les auteurs déclarent n’avoir aucun conflit d’intérêt.
REFERENCES
1. Young T, Peppard P, Gottlieb D. Epidemiology of obstructive sleep apnea : A population health perspective. Am J Respir Crit Care Med. 2002; 165(9) : 1217-39.
2. Peppard P, Young T, Palta M, Skatrud J. Prospective study of the association between sleep disordered breathing and hypertension. N Engl J Med. 2000 ; 342 : 1378-84.
3. Laaban JP, Mounier L, Roque d’Or Castelo, Veale D, Blacher J, Meloni B et al. Cardiovascular risk factors in men and women with obstructive sleep apnea syndrom. Respiratory Medecine 2010 ; 104 : 1063-8.
4. Guilleminault C, Tilkian A, Dement W. The sleep apnea syndromes. Annu Rev Med. 1976; 27:465-84.
5. Sullivan C, Issa F, Berthon-Jones M, Eves L. Reversal of obstructive sleep apnea by continuous positive airway pressure applied through the nares. Lancet 1981 ; 1 (8225) : 862-5.
6. Adambounou AS, Adjoh KS, Ouédraogo AR, Efalou P, Aziagbé KA, Hounsou SE et al. Etat des lieux des connaissances et attitudes des médecins de Lomé sur le syndrome d’apnées du sommeil. J Fran Viet Pneu 2016 ; 21(7) : 7-14.
7. Krieger J. Place de la polysomnographie dans le syndrome d’apnées obstructives du sommeil. In : Weitzenblum E., Racineux J. Syndrome d'apnées obstructives du sommeil. Paris: Masson 2004; 6 : 83-104.
8. Ade S, Ade G, Agodekpessi G, Wachimou P, Houenassi M, Gninafon M. Le syndrome d’apnée du sommeil : une réalité méconnue en Afrique. Rev Pneumol Trop 2012 ; 17 :13-15.
9. Nguyen Thi Hong A, Nguyen Xuan Bich H. Validation de l’oxymétrie dans le diagnostic du syndrome d’apnées obstructives du sommeil. J Fran Viet Pneu 2012 ; 03(7) : 28-31.
10. Le Thuong V, Dang Vu T, Nguyen Thi Ngoc B, Lam Quoc D, Dang Thi Bich N, Vu Hoai N et al. Le syndrome d’apnée du sommeil au Vietnam. J Fran Viet Pneu 2010 ; 01(2) : 115-20.
11. Adambounou AS, Adjoh KS, Aziagbé KA, Foma W, Gbadamassi AG, Tougan A et al. Prévalence des symptômes du syndrome d’apnées du sommeil à Lomé. J Fran Viet Pneu 2016 ; 22(7) : 32-9.
TABLES
REFERENCES
1. Young T, Peppard P, Gottlieb D. Epidemiology of obstructive sleep apnea : A population health perspective. Am J Respir Crit Care Med. 2002; 165(9) : 1217-39
2. Peppard P, Young T, Palta M, Skatrud J. Prospective study of the association between sleep disordered breathing and hypertension. N Engl J Med. 2000 ; 342 : 1378-84.
3. Laaban JP, Mounier L, Roque d’Or Castelo, Veale D, Blacher J, Meloni B et al. Cardiovascular risk factors in men and women with obstructive sleep apnea syndrom. Respiratory Medecine 2010 ; 104 : 1063-8.
4. Guilleminault C, Tilkian A, Dement W. The sleep apnea syndromes. Annu Rev Med. 1976; 27:465-84.
5. Sullivan C, Issa F, Berthon-Jones M, Eves L. Reversal of obstructive sleep apnea by continuous positive airway pressure applied through the nares. Lancet 1981 ; 1 (8225) : 862-5.
6. Adambounou AS, Adjoh KS, Ouédraogo AR, Efalou P, Aziagbé KA, Hounsou SE et al. Etat des lieux des connaissances et attitudes des médecins de Lomé sur le syndrome d’apnées du sommeil. J Fran Viet Pneu 2016 ; 21(7) : 7-14.
7. Krieger J. Place de la polysomnographie dans le syndrome d’apnées obstructives du sommeil. In : Weitzenblum E., Racineux J. Syndrome d'apnées obstructives du sommeil. Paris: Masson 2004; 6 : 83-104.
8. Ade S, Ade G, Agodekpessi G, Wachimou P, Houenassi M, Gninafon M. Le syndrome d’apnée du sommeil : une réalité méconnue en Afrique. Rev Pneumol Trop 2012 ; 17 :13-15.
9. Nguyen Thi Hong A, Nguyen Xuan Bich H. Validation de l’oxymétrie dans le diagnostic du syndrome d’apnées obstructives du sommeil. J Fran Viet Pneu 2012 ; 03(7) : 28-31.
10. Le Thuong V, Dang Vu T, Nguyen Thi Ngoc B, Lam Quoc D, Dang Thi Bich N, Vu Hoai N et al. Le syndrome d’apnée du sommeil au Vietnam. J Fran Viet Pneu 2010 ; 01(2) : 115-20.
11. Adambounou AS, Adjoh KS, Aziagbé KA, Foma W, Gbadamassi AG, Tougan A et al. Prévalence des symptômes du syndrome d’apnées du sommeil à Lomé. J Fran Viet Pneu 2016 ; 22(7) : 32-9.
ARTICLE INFO
DOI: 10.12699/jfvp.8.24.2017.10
Conflict of Interest
Non
Date of manuscript receiving
07/9/2017
Date of publication after correction
15/11/2017
Article citation
Adjoh. KS, Adambounou. AS, Gbadamassi. AG,Efalou. P, Ouedraogo. AR, Aziagbe. KA, Foma. W, Dolou. W, . Dijibril. MA, Belo. M. J Func Vent Pulm 2017; 24(8): 10-17.