
 English
English
 French
French
Epidemioclinical and progressive aspects of pulmonary embolism in the Pulmonology & Phtisiology Department of the Sylvanus Olympio University Hospital Center in Lome
Aspects épidémiocliniques et évolutifs de l’embolie pulmonaire dans le Service de Pneumo-Phtisiologie du Centre Hospitalier Universitaire SylvanusOlympio de Lomé
AG. Gbadamassi, KS. Adjoh, AK. Aziagbe, AM. Ounteini, E. Pwemdéou, AS. Adambounou
Department of Pulmonology & Phtisiology of Sylvanus Olympio UHC. Lome—Togo
Corresponding author
Abdou Gafarou GBADAMASSI
Department of Pulmonology & Phtisiology of Sylvanus Olympio UHC. BP 60579 Lome - Togo
Email: agbadamassi@gmail.com
DOI: 10.12699/jfvpulm.9.26.2018.8
ABSTRACT
Introduction. The authors report 30 cases of pulmonary embolism diagnosed in Lome in the Pulmonology & Phtisiology Department of the SylvanusOlympio University Hospital Center. The purpose of this work was to determine the frequency, to describe the signs, and to study the evolution of pulmonary embolism.
Method. Any patient over the age of 15 admitted to hospital for suspicion of pulmonary embolism and confirmed by thoracic CT was eligible for this study.
Results. The prevalence of pulmonary embolism was 2.03% with an average age of 51.55±16.61 years and predominance of the male. The most common risk factors were prolonged immobilization (40%), obesity (20%) and HIV infection (16.6%). Cardiovascular collapse was found in 20% of cases. The Wells score was high in 16.6% of the cases. The D-Dimer was greater than 2000 ng/mL in 53.3%. Electrocardiography, frontal chest X-ray, and cardiac ultrasound were normal in 23%, 33.3%, and 20% of cases, respectively. They showed mainly indirect signs of acute heart and lung symptoms. Venous Doppler ultrasound of limbs was normal in 30%. The treatment was classic. The average duration of hospitalization was 10.7± 5.2 days. Hospital mortality was 16.6%.
Conclusion. Pulmonary embolism is infrequent, difficult to treat and very lethal in pulmonology in Togo. We must insist on prevention.
KEYWORDS: Pulmonary embolism, pulmonology, Subsaharan Africa.
RÉSUMÉ
Introduction. Les auteurs rapportent 30 cas d’embolie pulmonaire diagnostiquée à Lomé dans le service de Pneumophtisiologie du Centre Hospitalier Universitaire SylvanusOlympio. Le but de ce travail était de déterminer la fréquence, de décrire les signes et d’étudier l’évolution de l’embolie pulmonaire.
Méthode. Etait éligible au protocole tout patient de plus de 15 ans hospitalisé pour suspicion d’embolie pulmonaire et confirmée par l’angioscanner thoracique.
Résultats. La prévalence de l’embolie pulmonaire était de 2,03% avec une moyenne d’âge de 51,55±16,61 ans et une prédominance du sexe masculin. Les facteurs de risque les plus retrouvés étaient l’immobilisation prolongée (40%), l’obésité (20%) et l’infection à VIH (16,6%). Le collapsus cardio-vasculaire était retrouvé dans 20% des cas. Le score de Wells était élevé dans 16,6% des cas. Les D-Dimères étaient supérieures à 2000 ng/mL dans 53,3%. L’électrocardiographie, la radiographie pulmonaire de face, et l’échographie cardiaque étaient normales respectivement dans 23,0%; 33,3% et 20% des cas. Elles montraient majoritairement des signes indirects de cœur pulmonaire aigué. L’échographie doppler veineux des membres était normale dans 30%. Le traitement était classique. La durée moyenne d’hospitalisation était de 10,7±5,2 jours. La mortalité hospitalière était de 16,6%.
Conclusion. L’embolie pulmonaire est peu fréquente, difficile à traiter et très létale en milieu pneumologie au Togo. Il faudra insister sur la prévention.
MOTS CLÉS: Embolie pulmonaire, pneumologie, Afrique Subsaharienne.
INTRODUCTION
L’embolie pulmonaire (EP) se définit comme l’oblitération brutale (totale ou partielle) du tronc de l’artère pulmonaire ou d’une de ses branches par un corps étranger circulant, le plus souvent fibrino-cruorique [1]. Ce corps étranger provient d'une thrombose veineuse profonde (TVP), le plus souvent au niveau des membres inférieurs [2]. L’EP est une urgence diagnostique et thérapeutique.
D’une manière générale, la maladie thromboembolique veineuse (MTEV) qui regroupe la thrombose veineuse et l’EP reste toujours un problème de santé publique dans le monde malgré les multiples avancées thérapeutiques actuelles. Selon les sources, l’incidence annuelle de la TVP serait de 120 pour 100 000 en France et de 60 à 100 pour 100 000 au niveau international; l’incidence annuelle de l’EP, qui en est la conséquence principale, se situerait entre 60 et 111 pour 100 000 en France et entre 23 et 107 pour 100 000 sur le plan international. La MTEV serait responsable d’une mortalité déclarée en France de 7,2 pour 100 000 mais, selon les estimations issues des séries autopsiques internationales, entre 0,8 et 1% des patients hospitalisés seraient concernés par une EP [3,4].
En Afrique Subsaharienne, la prévalence hospitalière de l’EP était de 1,76% en 2013 [5] puis 6,1% en 2016[6]à Cotonou (Bénin), et de 1,7% en 2011 à Bamako (Mali) [7].
A Lomé, au Togo, la prévalence hospitalière de la MTEV et de l’EP était respectivement de 3,05% et 0,7% en 2013 dans le service de cardiologie du centre hospitalier universitaire (CHU) SylvanusOlympio [8] alors que celle de l’EP seule dans le service de cardiologie du CHU Campus en 2015 était de 3,1% [9].
Notre étude a pour objectif de faire l’état des lieux de l’EP dans le service de pneumo-phtisiologie du CHU SylvanusOlympio en décrivant plus spécifiquement ses aspects épidémiologiques, diagnostiques, thérapeutiques et évolutifs.
MATÉRIELS ET MÉTHODES
Il s’agit d’une étude prospective descriptive et analytique, sur une période de deux ans allant du 1er janvier 2015 au 31 décembre 2016, réalisée dans le service de pneumo-phtisiologie du CHU- Sylvanus Olympio de Lomé. Étaient inclus dans notre étude les patients des deux sexes âgés de plus de 15 ans, hospitalisés dans le service pour embolie pulmonaire confirmée par l’angioscanner thoracique. La collecte des données a été réalisée par les médecins du service à l’aide d’une fiche d’enquête préétablie.
Les données sociodémographiques; cliniques: mode de début, présence de facteurs de risque de MTEV, douleur thoracique, hémoptysie, dyspnée, toux, collapsus cardiovasculaire, avec l’évaluation du score de Wells [5]; paracliniques: D-dimères, électrocardiogramme, échographie doppler cardiaque, échographie doppler veineux des membres inférieurs; thérapeutiques et évolutives avaient été étudiées. Les résultats descriptifs sont sous forme de pourcentage pour les variables qualitatives et par moyenne et écarts types pour les variables quantitatives. Les comparaisons de moyennes ont été réalisées par des tests t de Student et les comparaisons de pourcentages par des tests du Chi2. Le logiciel d’analyse utilisé est STATA/SE 14.0. Les tests statistiques ont été réalisés avec un seuil de significativité de 5%.
RÉSULTATS
Durant la période de notre étude, 1476 patients ont été hospitalisés dont 30 cas d’embolie pulmonaire soit une prévalence hospitalière de 2,03%. Les hommes représentaient 70% (p=0,019) des cas soit une sex-ratio H/F de 2,33. L’âge moyen était de 51,55 ans ± 16,61 ans avec des extrêmes de 22 ans et 83 ans. Trois patients (10%) étaient âgés de plus de 60 ans. Les tranches d’âge les plus touchées dans notre série étaient 41 – 50 ans et 51 - 60 ans avec respectivement 26,66% et 20% avec des p>0,05.
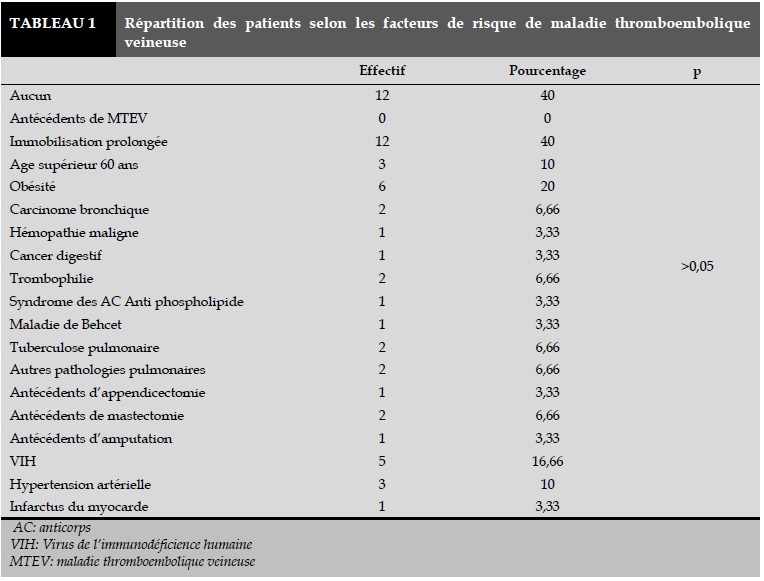
Une proportion de 86,66% des patients provenait d’un milieu urbain. Un tabagisme actif était retrouvé chez 23,33% des patients. La durée moyenne d’évolution des symptômes avant l’admission était de 2,3±7,8 jours avec des extrêmes de 1 et 13 jours. Le facteur de risque de MTEV le plus retrouvé était l’immobilisation prolongée. Après régression logistique avec l’ensemble des facteurs, aucun d’entre eux n’était significativement prédominant (Tableau 1).
Sur le plan clinique, à l’admission, on retrouvait des patients en détresse respiratoire (26,67%), un état de choc cardiogénique (20%). Les symptômes fonctionnels respiratoires retrouvés étaient la douleur thoracique (73,33%), la dyspnée (70%), l’hémoptysie (33,33%), et la toux (16,66%).
L’examen pleuro-pulmonaire avait noté un syndrome de condensation pulmonaire (23,33%), un syndrome d’épanchement pleural liquidien (3,33%).
L’examen physique était normal dans 73,33% des cas. Les patients avaient des signes d’insuffisance ventriculaire droite aigue dans 16,66% des cas et des signes de thrombophlébite dans 20% des cas. Le Score de Wells était faible (coté de 1 à 2) chez 26,66% des patients, modéré (coté de 3 à 5) chez 56,66%, et élevé (supérieur ou égal à 6) chez 16,66%.
Sur le plan biologique, les D-Dimères réalisés par la méthode ÉLISA étaient supérieures à 2000 ng/mL chez 53,33% des patients, et entre 550-2000 ng/ml chez 23,33%. Une proportion de 76,66% des patients avaient donc des D-Dimères >550 ng/mL avec un p =0,12. La troponine réalisée chez un seul patient était supérieure à 60 ng/L.
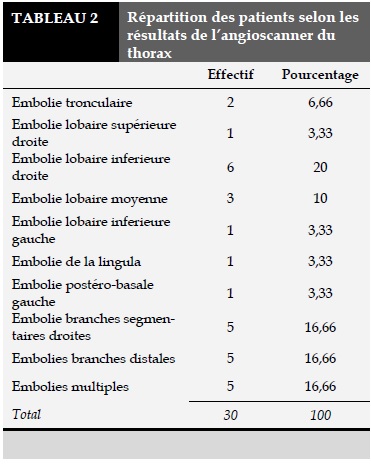
Les résultats de l’angioscanner thoracique sont résumés dans le Tableau 2. La localisation lobaire inferieure droite était la plus objectivée avec 20% (p=0,9).
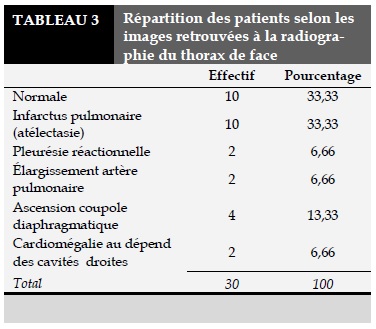
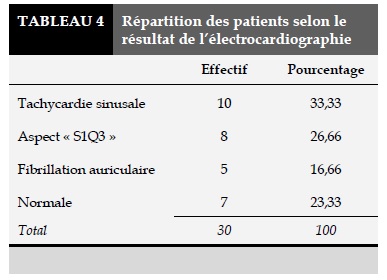
Les résultats de la radiographie du thorax incidence de face sont résumés dans le Tableau 3. Les résultats de l’ECG sont résumés dans le Tableau 4. L’échographie cardiaque transthoracique avait été réalisée chez 73,33% des cas. Elle avait objectivé des signes cœur pulmonaire dans la majorité des cas. Elle avait retrouvé un thrombus dans deux cas et était normale dans 20% des cas. L’écho-doppler vasculaire des membres inférieurs réalisé chez 83,33% des patients, avait objectivé une thrombose veineuse profonde des membres inférieurs dans 53,33%, et dans 30% des cas il n’yavait pas de thrombose veineuse.
Sur le plan thérapeutique tous nos patients avaient été mis initialement sous traitement anti coagulant par de l’héparine à bas poids moléculaire (HBPM). Il s’agissait de l’exonaparine à dose curative en fonction du poids associé aux anti-vitamines K (fluindione chez 80% et acénocoumarol chez 20%) à partir du 2ème jour de traitement avec HBPM.
Le traitement symptomatique comportait la mise au repos strict les premiers jours d’hospitalisation, une oxygénothérapie, une administration d’antalgiques au besoin, le traitement du choc cardiogénique, une ponction pleurale évacuatrice.
La durée moyenne d’hospitalisation était de 10,73 jours ± 5,18 jours avec des extrêmes allant de 2 à 20 jours.
La durée totale du traitement était de 6 mois. L’évolution était marquée par un taux de guérison de 70% après 6 mois de traitement anticoagulant, avec 2 cas de récidive. Le taux de mortalité hospitalière de l’embolie pulmonaire dans notre série était de 16,66%. Les causes de décès étaient le choc cardiogénique (2 cas), et la mort subite (3 cas).
DISCUSSION
Durant la période de notre étude, la prévalence hospitalière de l’embolie pulmonaire était de 2,03%. Notre résultat est proche de ceux récemment retrouvés dans les service de cardiologie d’Afrique Subsaharienne: 3,1% en 2015 au Togo [9]; et 6,1% en 2016 au Bénin [6]; 1,21% en 2018 au Mali(10); et 0,23% en 2018 au Cameroun [11]. Les prévalences européennes sont plus élevées (10,7%) [12] que celles d’Afrique Subsaharienne. Le déficit du plateau technique, et le défaut d’accès aux soins pourrait expliquer la faible prévalence en Afrique Subsaharienne.
L’âge moyen de nos patients était de 51,55±16,61 ans. Nos résultats concordent avec plusieurs études africaines notamment celles de Pessinaba et al. au Togo[9], et de Diall et al. au Mali[7], qui avaient trouvé respectivement des âges moyen de 52,7±14,4 ans, et 51±16,9 ans. Les tranches d’âge les plus touchées dans notre série étaient 41–50 ans et 51-60 ans avec respectivement 26,66% et 20%. Diall [7] et Pessinaba[9] avaient fait ce même constat avec les tranches d’âge les plus touchées qui étaient respectivement 31-40 ans et 51-60 ans, 30–45 ans et 45-60 ans. L’embolie pulmonaire touche plus généralement les sujets âgés de plus de 60 ans dans les pays à revenus élevés [12]. Dans les pays à revenus faibles ou intermédiaires au contraire ce sont les sujets de moins de 60 ans qui sont le plus touchés.
Les hommes sont majoritairement touchés dans notre étude (70% des cas). Ce constat n’a pas été fait dans les autres études africaines où on note plutôt une prédominance de femmes [7,9,10].
Les principaux facteurs favorisants retrouvés dans notre série étaient l’immobilisation prolongée, l’obésité et l’infection à VIH. Les études africaines effectuées en milieu cardiologique avaient retrouvé en plus de nos facteurs, les comorbidités cardiovasculaires (l’hypertension artérielle, les phlébites, le cœur pulmonaire chronique, l’insuffisance cardiaque): [7,9-11].
Les signes fonctionnels respiratoires retrouvés dans notre sont identiques a ceux retrouvés dans la littérature [7,9-11].
A l’admission, nos patients présentaient une détresse respiratoire dans 26,66% des cas, et un état de choc cardiogénique dans 20% des cas. La majorité des patients était reçue à l’admission dans un état grave en milieu africain comme l’avait montré aussi une étude au Bénin qui avait retrouvé 38,46% d’EP massive [5]. Bounameaux et al. avaient signalé un chiffre largement plus bas (5%) des patients admis avec une EP massive dans les pays européens [13]. Ceci peut s’expliqué par le retard de diagnostic en milieu africain.
Les patients confirmés d’EP de notre série avec un score de Wells faible étaient 26,66%.Cependant, ils avaient des D-Dimères élevées. Le dosage des D-Dimères était donc un élément essentiel de notre démarche diagnostique de par sa valeur prédictive négative forte. Il avait permis la poursuite des investigations par la réalisation de l’angioscanner thoracique spiralé. Ceci est une attitude recommandée par des sociétés savantes [12,14].
Sur le plan de l’imagerie médicale, l’angioscanner thoracique réalisé chez tous les patients avait objectivé le thrombus dans 100% des cas. Ceci n’avait pas été le cas dans l’étude de Pessinaba[9]. Notre étude ne nous permet pas de nous prononcer sur la spécificité de cet examen néanmoins dans la littérature, la sensibilité et la spécificité de l’angioscanner spiralé thoracique varient respectivement de 70 à 90 % et de 90 à 96 % selon les études et le type d’angioscanner [15,16]. Et du fait que cet examen n’est pas invasif, il est devenu le gold standard dans le diagnostic de l’EP en détrônant l’angiographie pulmonaire qui est plutôt un examen très invasif [14]. Un examen angioscanner thoracique spiralé normal est un critère fondamental pour exclure l’EP chez les patients présentant un score clinique de probabilité faible ou intermédiaire. Cependant, chez les patients avec un score élevé, un examen normal nécessite la réalisation ultérieure de l’angiographie pulmonaire ou d’une scintigraphie de ventilation pulmonaire [14]. La radiographie du thorax (RT) effectué chez tous les patients était anormale dans 66,67% des cas et avec un infarctus pulmonaire dans 33,33% des cas, une ascension coupole diaphragmatique dans 13,33% des cas. Elle n’avait objectivé aucun signe indirect chez Pessinaba[9]. Par contre, l’étude malienne [7] révèle une anomalie chez 63,3% des patients (hypertension artérielle pulmonaire, l’hyperclarté localisée, atélectasie, un épanchement liquidien pleural et une cardiomégalie). La RT n’est pas décisive dans le diagnostic de l’EP.
L’ECG effectuée chez tous les patients était assez très contributive en mettant en évidence des signes d’un cœur pulmonaire chez 76% des patients comme dans plusieurs études [7,9]. L’échographie cardiaque transthoracique, comme l’ECG, fournit assez d’éléments pour l’orientation diagnostique de cette pathologie[7]. Cependant, dans une étude, elle a démontré une sensibilité faible (50%) [17]. Sur le plan thérapeutique, tous les patients étaient traités par héparine à bas poids moléculaire (HBPM) à dose curative, suivi de l’introduction des anti-vitamines K comme le recommandent les études [14,18]. Sur le plan évolutif, la durée moyenne du traitement des patients en hospitalisation dans notre série est de 10,73±5,18 jours avec des extrêmes allant de 2 à 20 jours. Sous traitement anticoagulant curatif avec bonne observance thérapeutique, 70% des patients étaient guéris après 3 à 6 mois, avec une récidive dans 6,66% et un taux de mortalité hospitalière de 16,66%. Des résultats similaires ont été trouvés, avec une durée moyenne d’hospitalisation de 14,5 jours [9]. Les taux de mortalité hospitalière très élevé (entre 10% et 19,5%) avaient été observés dans les études africaines [7,9–11]. Ce taux de mortalité élevé par rapport aux pays à revenu élevé [19] s’explique par le retard d’admission, la faiblesse du plateau technique, le coût élevé de la prise en charge de l’EP [5].
CONCLUSION
L’embolie pulmonaire demeure une pathologie dont la prévalence en Afrique reste faible avec une mortalité très élevée surtout à cause du coût élevé de son diagnostic et de son traitement. Toutefois sa prévalence est probablement sous-estimée. Elle demeure une pathologie à forte prédominance féminine contrairement à ce que notre étude a révélé. Il s’agit d’une pathologie qui touche plus les adultes jeunes en milieu africain. Les facteurs risque et les comorbidités les plus retrouvées étaient l’immobilisation prolongée, l’obésité, et l’âge>60 ans.
Actuellement la confirmation diagnostique est de plus en plus aisée avec l’accessibilité de l’angioscanner thoracique. Le traitement préventif chez les patients à risque demeure la stratégie la plus efficace contre cette pathologie.
CONFLIT OF INTEREST
Non.
REFERENCES
1. Cohen A. Embolie pulmonaire. In: Cardiologie et pathologies cardiovasculaires. Paris, Estem 1997; 775 - 816.
2. Torbicki A, Perrier A, Konstantinides S, Agnelli G, Galie N, Pruszczyk P et al. Guidelines on the diagnosis and management of acute pulmonary embolism: the task force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC). Eur Heart J2008; 29(18): 2276-315.
3. Pottier P,Planchon B, Pistorius MA, Grolleau JY. Facteurs de risque et incidence de la maladie thromboembolique veineuse en médecine interne : une étude descriptive prospective sur 947 patients hospitalisés. Rev Médecine Interne 2001;156(4):329.
4. Bénard E, Lafuma A, Ravaud P. Epidémiologie de la maladie thromboembolique veineuse. Presse Médicale 2005;1018(6):411.
5. Houénassi M, Sacca- Véhounkpe J, Tchabi Y, AkindèsDossou-Yovo R, Saïzonou F, Biaou O, et al. Evaluation de la prise en charge de l’embolie pulmonaire dans un pays à faible niveau socio-économique : cas du Bénin. Cardiologie Tropicale, 2013; 136:1-9.
6. Hounkponou Amoussou-Guenou MKE, Houénassi DM, Tchabi Y, Oloude EN, Assani S, et al. Study on the Evaluation of the Cardiologic Management of Pulmonary Embolism at the University Hospital of Cotonou. J Angiol Vasc Surg 2016; 1: 005.
7. Diall I, Coulibaly S, Minta I, Ba H, Diakite M, et al. Causes, signs and outcome of 30 patients with pulmonary embolus. Mali Med2011; 26: 3-6.
8. Pio M, Baragou S, Afassinou Y, Atta S, Hachimou A, Ehlan K et al. Actualité sur la maladie thromboembolique veineuse au CHU Sylvanus Olympio de Lomé. J Rech Scien UnivLomé. 2013; 15(1): 93-100.
9. Pessinaba S, Atti YDM, Baragou S, Pio M, Afassinou Y, Kpélafia M, et al. Embolie pulmonaire au centre hospitalier universitaire Campus de Lomé (Togo): étude rétrospective à propos de 51 cas. Pan Afr Med J 2017;27:129.
10. Menta I, Coulibaly S, Ba HO, Traore D, Walbane M, Camara Y, et al. Pulmonary Embolism in Hospitalization in the Department of Cardiology of Gabriel Toure University Hospital. World Journal of Cardiovascular Diseases 2018; 8: 18-23.
11. Kamdem F, Ngahane BHM, Hamadou B, Mongyui A, Doualla MS, Jingi AM, et al. Epidemiology, Clinical Presentations and In-Hospital Mortality of Venous Throm-boembolism at the Douala General Hospit-al: A Cross-Sectional Study in Cameroon, Sub-Saharan Africa. World Journal of Car-diovascular Diseases 2018, 8: 123-132.
12. Pernod G, Caterino J, Maignan M, Tissier C, Kassis J, Lazarchick J, et al. D-Dimer Use and Pulmonary Embolism Diagnosis in Emergency Units: Why Is There
13. Such a Difference in Pulmonary Embolism Prevalence between the United States of America and Countries Outside USA? Fukumoto Y, editor. PLoS ONE. 2017;12(1):e0169268.
14. Bounameaux H, Becker F, Bertoletti L, Nendaz M, Robert-Ebadi H, Righini M, Perrier A. Embolie pulmonaire : place des scores diagnostiques et pronostiques. Rev Med Suisse 2010 ; 6 : 282-6.
15. Zamorano JL, Achenbach S, Baumgartner H, Bax JJ, Bueno H, et al. ESC Guidelines on the diagnosis and management of acute pulmonary embolism: The Task Force for the 0Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC)Endorsed by the European Respiratory Society (ERS). Eur Heart J 2014; 14;35(43):3033–73.
16. Stein PD, Fowler SE, Goodman LR, Gottschalk A, Hales CA, Hull RD, et al. Multidetector Computed Tomography for Acute Pulmonary Embolism. N Engl J Med 2006; 1;354(22):2317–27.
17. Winer-Muram HT, Rydberg J, Johnson MS, Tarver RD, Williams MD, Shah H, et al. Suspected Acute Pulmonary Embolism: Evaluation with Multi–Detector Row CT versus Digital Subtraction Pulmonary Arteriography. Radiology 2004; 1;233(3):806–15.
18. Miniati M, Monti S, Pratali L, Di Ricco G, Marini C, Formichi B, et al. Value of transthoracic echocardiography in the diagnosis of pulmonary embolism: results of a prospective study in unselected patients. Am J Med 110(7):528–35.
19. Melissopoulou M, Ancion A, Lancellotti P. Recommandations Européennes concernant la prise en charge de l’embolie pulmonaire. Rev Med Liège 2014; 69 : 11 : 594-599.
20. Olié V, Chin F, Lamarche-Vadel A, De Peretti C. La maladie veineuse thromboembolique: patients hospitalisés et mortalité en France en 2010. Bull Epidémiol Hebd 2013; (33-34): 417-24.
TABLES
REFERENCES
1. Cohen A. Embolie pulmonaire. In: Cardiologie et pathologies cardiovasculaires. Paris, Estem 1997; 775 - 816.
2. Torbicki A, Perrier A, Konstantinides S, Agnelli G, Galie N, Pruszczyk P et al. Guidelines on the diagnosis and management of acute pulmonary embolism: the task force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC). Eur Heart J2008; 29(18): 2276-315.
3. Pottier P,Planchon B, Pistorius MA, Grolleau JY. Facteurs de risque et incidence de la maladie thromboembolique veineuse en médecine interne : une étude descriptive prospective sur 947 patients hospitalisés. Rev Médecine Interne 2001;156(4):329.
4. Bénard E, Lafuma A, Ravaud P. Epidémiologie de la maladie thromboembolique veineuse. Presse Médicale 2005;1018(6):411.
5. Houénassi M, Sacca- Véhounkpe J, Tchabi Y, AkindèsDossou-Yovo R, Saïzonou F, Biaou O, et al. Evaluation de la prise en charge de l’embolie pulmonaire dans un pays à faible niveau socio-économique : cas du Bénin. Cardiologie Tropicale, 2013; 136:1-9.
6. Hounkponou Amoussou-Guenou MKE, Houénassi DM, Tchabi Y, Oloude EN, Assani S, et al. Study on the Evaluation of the Cardiologic Management of Pulmonary Embolism at the University Hospital of Cotonou. J Angiol Vasc Surg 2016; 1: 005.
7. Diall I, Coulibaly S, Minta I, Ba H, Diakite M, et al. Causes, signs and outcome of 30 patients with pulmonary embolus. Mali Med2011; 26: 3-6.
8. Pio M, Baragou S, Afassinou Y, Atta S, Hachimou A, Ehlan K et al. Actualité sur la maladie thromboembolique veineuse au CHU Sylvanus Olympio de Lomé. J Rech Scien UnivLomé. 2013; 15(1): 93-100.
9. Pessinaba S, Atti YDM, Baragou S, Pio M, Afassinou Y, Kpélafia M, et al. Embolie pulmonaire au centre hospitalier universitaire Campus de Lomé (Togo): étude rétrospective à propos de 51 cas. Pan Afr Med J 2017;27:129.
10. Menta I, Coulibaly S, Ba HO, Traore D, Walbane M, Camara Y, et al. Pulmonary Embolism in Hospitalization in the Department of Cardiology of Gabriel Toure University Hospital. World Journal of Cardiovascular Diseases 2018; 8: 18-23.
11. Kamdem F, Ngahane BHM, Hamadou B, Mongyui A, Doualla MS, Jingi AM, et al. Epidemiology, Clinical Presentations and In-Hospital Mortality of Venous Throm-boembolism at the Douala General Hospit-al: A Cross-Sectional Study in Cameroon, Sub-Saharan Africa. World Journal of Car-diovascular Diseases 2018, 8: 123-132.
12. Pernod G, Caterino J, Maignan M, Tissier C, Kassis J, Lazarchick J, et al. D-Dimer Use and Pulmonary Embolism Diagnosis in Emergency Units: Why Is There
13. Such a Difference in Pulmonary Embolism Prevalence between the United States of America and Countries Outside USA? Fukumoto Y, editor. PLoS ONE. 2017;12(1):e0169268.
14. Bounameaux H, Becker F, Bertoletti L, Nendaz M, Robert-Ebadi H, Righini M, Perrier A. Embolie pulmonaire : place des scores diagnostiques et pronostiques. Rev Med Suisse 2010 ; 6 : 282-6.
15. Zamorano JL, Achenbach S, Baumgartner H, Bax JJ, Bueno H, et al. ESC Guidelines on the diagnosis and management of acute pulmonary embolism: The Task Force for the 0Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC)Endorsed by the European Respiratory Society (ERS). Eur Heart J 2014; 14;35(43):3033–73.
16. Stein PD, Fowler SE, Goodman LR, Gottschalk A, Hales CA, Hull RD, et al. Multidetector Computed Tomography for Acute Pulmonary Embolism. N Engl J Med 2006; 1;354(22):2317–27.
17. Winer-Muram HT, Rydberg J, Johnson MS, Tarver RD, Williams MD, Shah H, et al. Suspected Acute Pulmonary Embolism: Evaluation with Multi–Detector Row CT versus Digital Subtraction Pulmonary Arteriography. Radiology 2004; 1;233(3):806–15.
18. Miniati M, Monti S, Pratali L, Di Ricco G, Marini C, Formichi B, et al. Value of transthoracic echocardiography in the diagnosis of pulmonary embolism: results of a prospective study in unselected patients. Am J Med 110(7):528–35.
19. Melissopoulou M, Ancion A, Lancellotti P. Recommandations Européennes concernant la prise en charge de l’embolie pulmonaire. Rev Med Liège 2014; 69 : 11 : 594-599.
20. Olié V, Chin F, Lamarche-Vadel A, De Peretti C. La maladie veineuse thromboembolique: patients hospitalisés et mortalité en France en 2010. Bull Epidémiol Hebd 2013; (33-34): 417-24.
ARTICLE INFO
DOI: 10.12699/jfvpulm.9.26.2018.8
Conflict of Interest
Non
Date of manuscript receiving
14/01/2018
Date of publication after correction
15/4/2018
Article citation
Gbadamassi AG, Adjoh KS, Aziagbe AK, Ounteini AM, Pwemdéou E, Adambounou AS. Epidemioclinical and progressive aspects of pulmonary embolism in the Pulmonology & Phtisiology Department of the Sylvanus Olympio University Hospital Center in Lome. J Func Vent Pulm 2018;26(9):8-13.