
 English
English
 French
French
La mesure du monoxyde d’azote (NO) dans l’air expiré comme marqueur inflammatoire des voies aériennes
Measurement of exhaled nitric oxide (NO) as a marker of airway inflammation
S. Duong-Quy, N.N. Le-Dong, T. Hua-Huy, A.T. Dinh-Xuan
Service de Physiologie - Explorations Fonctionnelles. Hôpital Cochin - Paris
Faculté de Médecine - Port Royal. Université Paris Descartes. France
Corresponding author
Dr. DUONG-QUY Sy
Service de Physiologie - EFR. Hôpital Cochin. 75014 Paris - France
E-mail: sduongquy.jfvp@gmail.com
ABSTRACT
Detection of NO from bronchopulmonary origin in exhaled air is now possible through measuring devices using the principle of chemiluminescence. The major technical advantage of these devices is to allow to measure the fraction of NO in gaseous form, of the order of 1 part per billion (ppb). In healthy subject, the concentration of NO measured in exhaled air varied from 5 to 25 ppb during a quiet ventilation in normoxia.
It is likely that a small part of the concentration of NO quantity measured in exhaled air comes from either alveoli or small airways. The consisting findings showing that there is an increase of NO quantity formed in the lung of subjects with asthma, suggests on the one hand, the involvement of inducible NOS in bronchial inflammation of asthma and justifies on the other hand, the use of exhaled NO measurement as biomarker of bronchial inflammation.
The most considerable advantage of the measurement of exhaled NO in comparison with other classical conventional explorations is that this method can directly assess the phenomenon of airway inflammation that characterizes the pathology of asthma while other techniques measure only secondary changes of ventilation. The sensitivity of the measurement of NO is considered better than that of FEV1, because of a significant change of FENO occurs very early for 2 weeks while a change in FEV is detectable after 3 months.
KEYWORDS: NO, exhaled NO, FENO, inducible NOS, FEV1, inflammation, asthma
RÉSUMÉ
La détection du NO d'origine bronchopulmonaire dans l'air expiré est désormais possible grâce à des appareils de mesure utilisant le principe de la chimiluminescence. L'avantage technique majeure de ces appareils est de permettre de doser des fractions de NO, sous sa forme gazeuse, de l'ordre de 1 par 1 milliard (ppb). Chez le sujet sain, la quantité de NO mesurée dans l'air expiré varie entre 5 et 25 ppb au cours d'une ventilation calme en normoxie.
Il est probable qu'une petite partie de la quantité du NO mesuré dans l'air expiré provienne soit des alvéoles, soit des petites voies aériennes. Il existe des résultats concordants montrant une augmentation de la quantité du NO formé dans les poumons des sujets asthmatiques, suggérant, d'une part, l'implication de la NOS inductible dans l'inflammation bronchique de la maladie asthmatique et justifiant, d'autre part, l'utilisation du NO mesuré dans l'air expiré comme marqueur de l'inflammation bronchique.
Le point d’avantage le plus considérable de la mesure du NO en comparaison avec d’autres explorations classiques est que la mesure du NO permet d’évaluer directement le phénomène d’inflammation bronchique qui caractérise la pathologie de l’asthme lors que d’autre techniques ne mesurent que les changements secondaires de la ventilation. La sensibilité de la mesure du NO est considérée comme meilleure que celle de VEMS, car le changement significatif de FENO se manifeste très précoce pendant 2 semaines tandis que un changement sur la VEMS ne soit détectables qu’après 3 mois.
MOTS CLES: NO, NO expiré, FENO, NOS inductible, VEMS, inflammation, asthme
INTRODUCTION
Le monoxyde d'azote (NO) est un dérivé nitré endogène ubiquitaire dont les diverses propriétés biologiques en font un médiateur paracrine singulier par son caractère protéiforme et la place fondamentale qu'il occupe dans de nombreux processus physiologiques. Les implications du NO en physiopathologie cardiovasculaire, qui sont les plus anciennement connues, ont été largement décrites ces dernières années [1-4].
Le NO est également un neuromédiateur mettant en communication divers circuits neuronaux aussi bien centraux que périphériques. Il est, avec le peptide vasointestinal, l'un des principaux médiateurs du système nonadrénergique – noncholinergique inhibiteur [4]. Enfin, du fait de la présence d'un électron célibataire, le NO est aussi considéré comme un radical libre dérivé de l'oxygène (RLO) dont la réaction avec d'autres RLO, tel l'anion superoxide (O2-), peut générer des molécules dont le pouvoir oxydant, encore plus important que celui du NO, pourrait être extrêmement délétère pour le métabolisme cellulaire. Cette cytotoxicité potentielle constitue, en quelque sorte, le revers de la médaille des propriétés biologiques du NO.
De plus, elle en limite l'utilisation thérapeutique qui est pour l'instant réservée à certains cas d'hypertension artérielle (HTAP) sévère de l'adulte [5], d'HTAP persistente du nouveau-né [6], et d'hypoxémie réfractaire du syndrome de détresse respiratoire aiguë de l'adulte et de l'enfant [7]. Cette mise au point sera essentiellement consacrée au NO en tant que marqueur de l'inflammation bronchique.
BIOLOGIE DU NO
Les NO synthases
Le NO est formé à partir de l'un des deux atomes d'azote terminal chimiquement équivalents du groupement guanidine de la L-arginine, d'une part, et de l'oxygène moléculaire (O2), d'autre part [1]. L'autre produit de synthèse, formé de manière stoechiométrique avec le NO, est la L-citrulline. Cette dernière provient également de la L-arginine qui est d'abord hydroxylée en NG-hydroxy-L-arginine.
La réaction de biosynthèse du NO et de la Lcitrulline à partir de la L-arginine et de l'O2 est sous la dépendance d'une famille d'enzymes, les NO synthases (NOS), dont il existe au moins trois isoformes pour lesquelles les ADN complémentaires ont été clonés. Schématiquement, ces trois isoformes – qui sont codées par trois gènes distincts localisés sur les chromosomes 7, 12 et 17 – diffèrent entre elles par leurs fonctions, leurs localisations cellulaires et leurs caractéristiques biochimiques. Les isoformes présentes dans les cellules endothéliales, d'une part, et les cellules nerveuses, d'autre part, appartiennent à la famille des NOS constitutives, c'est-à-dire celles dont l'expression – normalement présente à l'état physiologique – permet la synthèse du NO respectivement en tant que médiateur paracrine de la relaxation du muscle lisse vasculaire et neurotransmetteur.
A l'inverse, l'isoforme macrophagique appartient à la famille des NOS inductibles, c'est-à-dire celles dont l'expression – normalement absente à l'état physiologique – ne se manifeste que dans des états pathologiques tel le choc septique induit par les endotoxines bactériennes. Bien que normalement présente dans la cellule (endothéliale ou neuronale), l'isoforme constitutive de la NOS n'est pas active en l'absence d'une augmentation transitoire du calcium intracellulaire et de l'activation de la calmoduline qui en résulte. L'activité de la NOS constitutive se traduit par la production d'une faible quantité de NO pendant une période brève.
A l'opposé, l'induction du gène codant pour la NOS inductible (normalement absente de la cellule) donne lieu à la synthèse de novo de cette protéine qui, une fois présente, devient continuellement active du fait de sa liaison quasi-irréversible à la calmoduline. Ceci explique la relative indépendance de cette isoforme par rapport au calcium intracellulaire. L'activité de la NOS inductible est responsable d'une production beaucoup plus importante (qui devient cytotoxique aux concentrations ainsi atteintes) en comparaison avec la production physiologique du NO provenant de l'activité de la NOS constitutive.
Cependant, la classification actuelle concernant les NOS constitutive et inductible semble inadéquate dans des cellules qui, comme les cellules épithéliales bronchiques et nasales, expriment de façon quasipermanente la NOS inductible [8, 9]. L'expression constitutive de la NOS inductible serait due à la situation particulière de ces cellules qui sont constamment exposées à des aérocontaminants et à divers stimulus pro-inflammatoires d'origine atmosphérique. Il est probable que l'expression de la NOS inductible puisse être, dans ce cas, bénéfique dans la mesure où le NO ainsi produit participe à la défense immunitaire non spécifique des voies aériennes [10].
Cellules pulmonaires synthétisant le NO
De nombreuses cellules pulmonaires peuvent exprimer soit l'une, soit l'autre, parfois même les deux isoformes (constitutive et inductible) de la NOS [11]. Ainsi, la synthèse du NO a été mise en évidence avec des types cellulaires aussi variées que les macrophages, les polynucléaires neutrophiles, les fibroblastes, l'endothélium vasculaire, le muscle lisse bronchique et vasculaire, l'épithélium des voies aériennes et les terminaisons nerveuses [12]. L'existence de la NOS constitutive a été démontrée au niveau de l'endothélium vasculaire pulmonaire et des terminaisons nerveuses innervant l'arbre trachéobronchique humain. La NOS inductible est surtout exprimée par la cellule épithéliale, dont la capacité de synthèse du NO est d'autant plus importante qu'il existe une inflammation bronchique, que celle-ci soit passagère (infections virales des voies aériennes supérieures) ou plus ou moins permanente (maladie asthmatique).
NO ET INFLAMMATION BRONCHIQUE
NO et lésions oxydatives cellulaires
En présence d'O2-, le NO, qui est également un composé radicalaire, est métabolisé en anion peroxynitrite, dont la cytotoxicité est une cause d'hyperréactivité bronchique expérimentale [13]. Ainsi, la production en excès du NO résultant de l'expression de l'isoforme inductible de la NOS par des cellules inflammatoires des voies aériennes a une double signification. Premièrement, l'excès de NO dans les voies aériennes peut être considéré comme un reflet de l'inflammation bronchique. Deuxièmement, le NO et les RLO formés à partir du NO, constituent une source d'agression du métabolisme cellulaire par le stress oxydatif qu'ils induisent.
La cytotoxicité du NO est en majeure partie due à l'inhibition d'enzymes impliquées soit dans la respiration mitochondriale soit dans la réplication de l'ADN. Compte tenu des relations existant entre les processus inflammatoires et le radical NO, il semble donc nécessaire de quantifier la production du NO dans les voies aériennes des sujets ayant une inflammation bronchique aiguë et/ou chronique.
Utilisation du NO expiré comme marqueur de l'inflammation bronchique
La détection du NO d'origine bronchopulmonaire dans l'air expiré est désormais possible grâce à des appareils de mesure utilisant le principe de la chimiluminescence. L'avantage technique majeure de ces appareils est de permettre de doser des fractions de NO, sous sa forme gazeuse, de l'ordre de 1 par 1 milliard (ppb) [14-16]. Chez le sujet sain, la quantité de NO mesurée dans l'air expiré varie entre 5 et 25 ppb au cours d'une ventilation calme en normoxie [16, 17].
Il est probable qu'une petite partie de la quantité du NO mesuré dans l'air expiré provienne soit des alvéoles [17], soit des petites voies aériennes [16]. Cependant, il est maintenant admis que la majeure partie du NO recueilli dans le gaz expiré provient des voies aériennes supérieures [18, 19] et ce d'autant plus qu'il existe une inflammation localisée à ce niveau [20]. Il existe des résultats concordants montrant une augmentation de la quantité du NO formé dans les poumons des sujets asthmatiques [21-24], suggérant, d'une part, l'implication de la NOS inductible dans l'inflammation bronchique de la maladie asthmatique [25] et justifiant, d'autre part, l'utilisation du NO mesuré dans l'air expiré comme marqueur de l'inflammation bronchique [26].
Il existe plusieurs arguments plaidant en faveur d'une relation étroite entre l'augmentation du NO dans l'air expiré et l'inflammation pulmonaire. Premièrement, il existe une évolution parallèle entre la concentration du NO exhalé et l'inflammation des voies aériennes, notamment au cours des infections virales des voies aériennes supérieures ; le NO augmentant à l'acmé de la maladie pour revenir à la normale avec la régression des symptômes [27]. Deuxièmement, un traitement anti-inflammatoire avec des glucocorticoïdes inhalés réduit la production excessive du NO chez des patients asthmatiques en la ramenant à un niveau comparable à celui des sujets sains [24, 28].
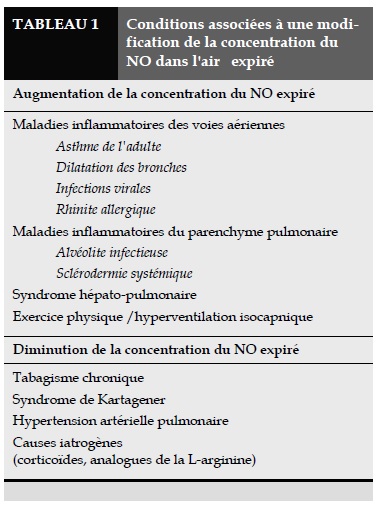
La diminution de la production pulmonaire du NO est visible dès la 48ème heure après le début de la corticothérapie [29, 30] avec, de plus, un effet dépendant de la dose puisque la concentration du NO exhalé est d'autant plus réduite que la posologie de corticoïdes inhalés est importante [31]. Enfin, l'augmentation de la concentration du NO dans l'air expiré n'est pas spécifique à l'asthme mais serait plutôt liée à l'inflammation des voies aériennes et du parenchyme pulmonaire telle que l'on peut trouver dans d'autres maladies comme la dilatation des bronches [32] et l'alvéolite infectieuse [33] (Tableau 1).
La concentration du NO dans l'air expiré peut également être augmentée chez des patients cirrhotiques porteurs d'un syndrome hépatopulmonaire [34], au cours duquel les troubles des échanges gazeux sont probablement en partie liés à une vasodilatation pulmonaire inadéquate, conséquence d'un excès de production pulmonaire endogène du NO. De même, le débit du NO mesuré dans l'air expiré est augmenté lors des manœuvres entraînant une vasodilatation de la circulation trachéobronchique tels que l'exercice et l'hyperventilation isocapnique d'air sec [35], suggérant l'implication de la NOS constitutive dans le contrôle du calibre des vaisseaux bronchiques.
Cependant, même si la mesure du NO dans l'air expiré est une méthode non invasive, simple et reproductible pour évaluer la formation du NO par l'appareil bronchopulmonaire, cette mesure ne peut néanmoins refléter, à elle seule, toute l'activité de la NOS constitutive de la cellule endothéliale vasculaire pulmonaire car elle ne tient pas compte de la quantité de NO libéré dans la lumière vasculaire qui est rapidement capté par l'hémoglobine circulante [36]. Cette méthode ne permet pas non plus de préciser les différentes sources cellulaires du NO que l'on mesure dans l'air expiré. Enfin, toutes les maladies inflammatoires des voies aériennes ne sont pas obligatoirement associées à une augmentation de la concentration du NO dans l'air expiré. Citons, à titre d'exemples, la bronchite chronique post-tabagique [23, 37] et la mucoviscidose où la concentration du NO dans l'air expiré est soit diminuée (tabagisme chronique) soit peu différente (mucoviscidose) par rapport aux valeurs normales.
Il existe des raisons théoriques et pratiques justifiant l'utilisation de la mesure du NO dans l'air expiré pour évaluer l'inflammation bronchique. Les raisons théoriques peuvent être résumées ainsi. Premièrement, l'isoforme inductible de la NOS est très sensible aux stimulus inflammatoires. Le corollaire de ceci est que tout processus inflammatoire touchant les voies aériennes est susceptible d'entraîner une augmentation de la production du NO par les cellules cibles de l'inflammation. Inversement, tout agent thérapeutique pouvant faire régresser l'inflammation bronchique est susceptible de diminuer la production endogène pulmonaire de NO, en inhibant l'activité de la NOS inductible. L'efficacité des glucocorticoïdes, qui réduisent à la fois l'inflammation des voies aériennes et la production bronchique du NO, en est une bonne illustration [24, 28-31]. Les raisons pratiques pour utiliser la mesure du NO expiré comme marqueur de l'inflammation bronchique sont évidentes. La première tient du caractère totalement non-invasif de cette méthode. La deuxième réside dans la relative simplicité des manœuvres respiratoires à effectuer par le sujet dont l'air expiré (à partir duquel le NO est quantifié) est recueilli au cours d'une ventilation normale, au repos et à volume courant.
Cependant, pour être validée, la mesure du NO expiré – comme toute autre méthode dont l'utilisation est encore relativement récente – a besoin de passer avec succès l'épreuve du temps. Pour cela, il nous faut des preuves concernant la reproductibilité des résultats qui, pour l'instant, ne sont rapportés que par quelques équipes dans le monde. Nul doute qu'une fois validé, cet examen aura sa place dans l'exploration fonctionnelle respiratoire de routine et nous permettra à la fois de suivre l'évolution de l' inflammation bronchique et d'évaluer l'efficacité des agents thérapeutiques supposés agir sur cette inflammation.
MESURE DU NO EXPIRE DANS L’ASTHME
L’asthme est caractérisé par une inflammation chronique des voies aériennes, une hyperréactivité bronchique et une contraction anormale du muscles lisses bronchiques. La mesure de concentration du NO dans l’air expiré est une nouvelle technique d’exploration dans l’asthme permettant d’évaluer de manière subjective et précise le niveau de l’inflammation des voies aériennes. La technique a été proposée à la fin des années 1990 et devient une mesure en routine dans plusieurs services.
Technique de mesure
Il y a deux methodes principales pour mesurer le NO expire, ce sont [38] la mesure directe (on-line) où le flux d’air expire du sujet est analysé en temps reels dans un circuit fermé et [39] la mesure indirecte (off line) où le volume d’aire expire du sujet est conservé dans un sac pour une analyse postérieure. Cependant, il n’y a pas de différence entre deux méthodes concernant les principes d’échantillonnage de l’air expiré. Le résultat du NO expiré est exprimé en ppb, c’est le rapport du volume du NO par volume total de l’air expiré (1ppb = 1 part milliard du volume).
La concentration du NO expire est variable en fonction du débit expiratoire (la FENO est diminué considérablement lors que le débit augmente). Pour cette raison, il faut une coopération du sujet afin de garder un niveau constant du débit pendant la mesure. Dans les premières études, les débits utilisés étaient différents donc la comparaison du résultat entre ces études est très difficile. A partir de l’année 2005, l’ATS et l’ERS standardisent le débit expiratoire à 50 ml/s [40]. Les analyseurs commercialisés utilisent cette valeur.
La concentration FENO subit aussi une fluctuation causée par le NO dans l’air ambiant, il est nécessaire de vérifier le NO ambiant avant chaque mesure, ou plus idéalement, d’utiliser une source de gaz sans NO (< 5ppb), comme l’air médical ou l’air filtré du NO.
Le NO est aussi accumulé dans la cavité nasale en haute concentration et cette quantité importante du NO peut biaiser le résultat final du NO expiré par la bouche. Pour éviter la contamination du NO nasal, le sujet doit expirer contre une résistance de 5-20 cm H2O pour assurer une fermeture de voile de palais mou séparant la trachée et la cavité nasale.
Le sujet se met en une position confortable, et branché avec l’annalyseur par un embout boucale. La mesure commence par une inspiration maximale jus qu’au volume pulmonaire total, cette manœuvre n’est pas obligatoire si le sujet présent les limitations de respiration. En suite, le sujet expire immédiatement sans tenant en apnée. L’expiration dure environ de 10 secondes, et contre une résistance de 5-20 cmH2O, pendant l’expiration, le débit expiratoire est strictement contrôlé au niveau de 50 ml/s.
Application de la mesure du NO dans l’asthme
Le point d’avantage le plus considerable de la mesure du NO en comparaison avec d’autres explorations classiques (la spirométrie, débitmètre de point …) est que la mesure du NO permet d’évaluer directement le phénomène d’inflammation bronchique qui caractérise la pathologie de l’asthme lors que d’autre techniques ne mesurent que les changements secondaires de la ventilation. La sensibilité de la mesure du NO est considérée comme meilleure que celle de VEMS, car le changement significatif de FENO se manifeste très précoce pendant 2 semaines tandis que un changement sur la VEMS ne soit détectables qu’après 3 mois.
En comparaison avec des explorations qui évaluent l’inflammation (quantification d’éosinophile dans l’expectoration ou dans le liquide de lavage bronchoalvéolaire, ou le test à la métacholine), la mesure du NO montre des avantages car elle est non invasive, facile à réaliser et très précise. Grâce à sa facilité, la mesure du NO servit comme un outil idéal dans les études épidémiologiques pour l’objectif de dépister les patients asthmatiques dans une grande population. L’apparition des nouvelle génération des analyseurs compactes et portables permet de réaliser la mesure en consultation urgente ou à domicile.
Comme la FENO est élevée dans l’asthme, même chez les patients sans anomalies de fonction respiratoire, on peut utiliser la mesure du NO pour détecter ou diagnostiquer l’asthme. La valeur diagnostique du NO a été étudiée par différents auteurs comme Dupont [38], Smith [39] et Berkman [41]. Les résultats ont montré que la FENO permet de diagnostiquer l’asthme avec une sensibilité de 80-90% et une spécificité plus haute que 90%, la valeur diagnostique du NO est meilleure quand la FENO est couplée avec un autre paramètre de spirométrie (VEMS) [39].
La valeur normale du NO ne passe pas le seuil de 20ppb, celui-ci est utilisé comme un seuil de diagnostic pour l’asthme [39]. Cependant, la capacité de dagnostic du NO est limitée par des facteurs de fluctuation comme la présence de l’allergie, l’utilisation des médicaments susceptibles à modifier la synthèse du NO et/ou les inflammations des voies aériennes supérieurees non spécifiques associées. Il est recommandé de combiner la mesure du NO et d’autres explorations fonctionnelles respiratoires en clinique pour assurer une meilleure valeur diagnostique, en particulièrement chez des patients asthmatiques avec le résultat négatif de l’hypersensibilité bronchique à la métacholine.
Le NO expiré est aussi utilisé pour le but d’évaluer la réponse au traitement par corticostéroïdes et optimiser ce traitement. Les premières études ont montré que la FENO est diminuée avec la dose de corticoïdes données par voie inhalée ou orale. La réponse est rapide et inversement proportionnelle à la dose administrée [42-44].
La FENO n’est pas seulement utilisée comme un marqueur de l’inflammation, il est aussi en correlation avec d’autres paramètres quantitatifs en clinique comme la variation du débit de point, la fréquence de l’apparition des symtômes asthmatiques ou le niveau de contrôle de l’asthme. Une variation anormale de FENO peut prédire l’arrivée de crise d’asthme [45]. Une augmentation ou diminution plus de 15% entre 2 mesures montre une aggravation ou amélioration de contrôle de l’asthme. En combinant ces deux facteurs, on peut utiliser le résultat de FENO pour optimizer la dose de traitement du corticostéroïde afin de diminuer la dose au niveau le plus bas possible en gardant toute l’efficacité de contrôle de l’asthme.
CONFLIT D’INTERÊTS
Aucun.
REFERENCES
1. Moncada S, Higgs EA. The L-arginine–nitric oxide pathway. N Engl J Med, 1993; 329: 2002-12.
2. Nathan CF. Nitric oxide as a secretory product of mammalian cells. FASEB J, 1992; 6: 3051-64.
3. Dinh-Xuan AT, Higenbottam TW, Clelland CA, et al. Impairment of endothelium-dependent pulmonaryartery relaxation in chronic obstructive lung disease. N Engl J Med, 1991; 324: 1539-47.
4. Dinh-Xuan AT. Rôles du NO en physiopathologie cardiovasculaire et respiratoire. Arch Int Physiol Biochim Biophys, 1994; 102: A3-9.
5. Pepke-Zaba J, Higenbottam TW, Dinh-Xuan AT, Stone D, Wallwork J. Inhaled nitric oxide as a cause of selective pulmonary vasodilatation in pulmonary hypertension. Lancet, 1991; 338: 1173-4.
6. Rozé JC, Storme L, Zupan V, Morville P, Dinh-Xuan AT, Mercier JC. Echocardiographic investigation of inhaled nitric oxide in newborn babies with severe hypoxaemia. Lancet, 1994; 344: 303-5.
7. Dinh-Xuan AT, Brunet F, Dhainaut JF. Inhaled nitric oxide: the light and shadow of a therapeutic breakthrough. In: Fink MP, Payen D, Eds. Update in intensive care and emergency medicine. Volume 24. Role of nitric oxide in sepsis and ARDS. Berlin, Springer Verlag, 1995: 414-25.
8. Guo FH, de Raeve HR, Rice TW, Stuehr DJ, Thunnissen FBJM, Erzurum SC. Continuous nitric oxide synthesis by inducible nitric oxide synthase in normal human airway epithelium in vivo. Proc Natl Acad Sci USA, 1995; 92: 7809-13.
9. Lundberg JON, Farkas-Szallasi T, Weitzberg E, et al. High nitric oxide production in human paranasal sinuses. Nature Med, 1995; 1: 370-3.
10. Asano K, Chee CBE, Gaston B, et al. Constitutive and inducible nitric oxide synthase gene expression, regulation, and activity in human lung epithelial cells. Proc Natl Acad Sci USA, 1994; 91: 10089-93.
11. Kobzik L, Bredt DS, Lowenstein CJ, et al. Nitric oxide synthase in human and rat lung: immunocytochemical and histochemical localization. Am J Respir Cell Mol Biol, 1993; 9: 371-7.
12. Barnes PJ, Belvisi MG. Nitric oxide and lung disease. Thorax, 1993; 48: 1034-43.
13. Sadeghi-Hashjin G, Folkerts G, Henriks PAJ, et al. Peroxynitrite induces airway hyperresponsiveness in guinea pigs in vitro and in vivo. Am J Respir Crit Care Med, 1996; 153: 1697-701.
14. Sato K, Sakamaki T, Sumino H, et al. Rate of nitric oxide release in the lung and factors influencing the concentration of exhaled nitric oxide. Am J Physiol (Lung Cell Mol Physiol), 1996; 270: L914-20.
15. Robbins RA, Floreani AA, Von Essen SG, et al. Measurement of exhaled nitric oxide by three different techniques. Am J Respir Crit Care Med, 1996; 153: 1631-5.
16. Gustafsson LE, Leone AM, Persson MG, Wiklund NP, Moncada S. Endogenous nitric oxide is present in the exhaled air of rabbits, guinea pigs and humans. Biochem Biophys Res Commun, 1991; 181, 852-7.
17. Borland CDR, Cox Y, Higenbottam TW. Measurement of exhaled nitric oxide in man. Thorax, 1993; 48: 1160-2.
18. Lundberg JON, Weitzberg E, Nordvall SL, Kuylenstierna R, Lundberg JM, Alving K. Primarily nasal origin of exhaled nitric oxide and absence in Kartagener's syndrome. Eur Respir J, 1994; 7: 1501-4.
19. Kimberly B, Nejadnik B, Giraud GD, Holden WE. Nasal contribution to exhaled nitric oxide at rest and during breathholding in humans. Am J Respir Crit Care Med, 1996; 153: 829-36.
20. Martin U, Bryden K, Devoy M, Howarth P. Increased levels of exhaled nitric oxide during nasal and oral breathing in subjects with seasonal rhinitis. J Allergy Clin Immunol, 1996; 97: 768-72.
21. Alving K, Weitzberg E, Lundberg JM. Increased amount of nitric oxide in exhaled air of asthmatics. Eur Respir J, 1993; 6, 1368-70.
22. Kharitonov SA, Yates DH, Robbins RA, Logan-Sinclair RB, Shinebourne EA, Barnes PJ. Increased nitric oxide in exhaled air of asthmatic patients. Lancet, 1994; 343: 133-5.
23. Persson MG, Zetterström O, Agrenius V, Ihre E, Gustafsson LE. Single-breath nitric oxide measurements in asthmatic patients and smokers. Lancet, 1994; 343: 146-7.
24. Garnier P, Fajac I, Dessanges JF, Dall'Ava-Santucci J, Lockhart A, Dinh-Xuan AT. Exhaled nitric oxide during acute changes of airways calibre in asthma. Eur Respir J, 1996; 9: 1134-8.
25. Hamid Q, Springall DR, Riveros-Moreno V, et al. Induction of nitric oxide synthase in asthma. Lancet, 1993; 342: 1510-3.
26. Barnes PJ, Kharitonov SA. Exhaled nitric oxide : a new lung function test. Thorax, 1996; 51: 233-7.
27. Kharitonov SA, Yates DH, Barnes PJ. Increased nitric oxide in exhaled air of normal human subjects with upper respiratory tract infections. Eur. Respir. J. 1995; 8: 295-7.
28. Kharitonov SA, Yates DH, Barnes PJ. Inhaled glucocorticoids decrease nitric oxide in exhaled air of asthmatic patients. Am J Respir Crit Care Med, 1996; 153: 454- 457.
29. Massaro AF, Gaston B, Kita D, Fanta C, Stamler JS, Drazen JM. Expired nitric oxide levels during treatment of acute asthma. Am J Respir Crit Care Med, 1995; 152: 800-3.
30. Yates DH, Kharitonov SA, Robbins RA, Thomas PS, Barnes PJ. Effet of a nitric oxide synthase inhibitor and a glucocorticosteroid on exhaled nitric oxide. Am J Respir Crit Care Med, 1994; 152: 892-6.
31. Kharitonov SA, Yates DH, Chung KF, Barnes PJ. Changes in the dose of inhaled steroid affect exhaled nitric oxide levels in asthmatic patients. Eur Respir J, 1996; 9: 196-201.
32. Kharitonov SA, Wells AU, O'Connor BJ, et al. Elevated levels of exhaled nitric oxide in bronchiectasis. Am J Respir Crit Care Med, 1995; 151: 1889-93.
33. Stewart TE, Valenza F, Ribeiro SP, et al. Increased nitric oxide in exhaled gas as an early marker of lung inflammation in a model of sepsis. Am J Respir Crit Care Med, 1995; 151: 713-8.
34. Sogni P,Garnier P, Gadano A, et al. Endogenous pulmonary nitric oxide production measured from exhaled air is increased in patients with severe cirrhosis. J Hepatol, 1995; 23: 471-3.
35. Persson MG, Wiklund NP, Gustafsson LE. Endogenous nitric oxide in single exhalations and the change during exercise. Am Rev Respir Dis, 1993; 148; 1210-4.
36. Dinh-Xuan AT. Rôle du monoxyde d'azote en physiologie respiratoire et dans la physiopathologie des maladies pulmonaires. Rev Mal Respir, 1996; 13: sous presse.
37. Kharitonov SA, Robbins RA, Yates DH, Keatings V, Barnes PJ. Acute and chronic effects of cigarette smoking on exhaled nitric oxide. Am J Respir Crit Care Med, 1995; 152: 609-12.
38. Dupont, L.J., Demedts, M.G., Verleden, G.M. Prospective evaluation of the validity of exhaled nitric oxide for the diagnosis of asthma. Chest 2003; 123, 751–756.
31. Smith, A.D., Cowan, J.O., Filsell, S., McLachlan, C., Monti-Sheehan, G., Jackson, P., Taylor, D.R. Diagnosing asthma: comparisons between exhaled nitric oxide measurements and conventional tests. Am. J. Respir. Crit. Care Med.2004; 169, 473–478.
32. American Thoracic Society; European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide. Am J Respir Crit Care Med. 2005; 171: 912-930.
33. Berkman, N., Avital, A., Breuer, R., Bardach, E., Springer, C., Godfrey, S. Exhaled nitric oxide in the diagnosis of asthma: comparison with bronchial provocation tests. Thorax 2005;60, 383–388.
34. Kharitonov SA, Yates DH, Barnes PJ. Inhaled glucocorticoids decrease nitric oxide in exhaled air of asthmatic patients. Am. J. Respir. Crit. Care Med. 1996; 153:454–7.
35. Jatakanon, A., Kjaritonov, S.A., Lim, S., Barnes, P.J. Effect of differing doses of inhaled budesonide on markers of airway inflammation in patients with mild asthma. Thorax 1999; 54, 108–114.
36. Jones, S.L., Herbison, P., Cowan, J.O., Flannery, E.M., Hancox, R.J., McLachlan, C.R., Taylor, D.R. Exhaled NO and assessment of anti-inflammatory effects of inhaled steroid: dose–response relationship. Eur. Respir. J. 2002; 20, 601–608.
37. Massaro, A.F., Gaston, B., Kita, D., Fanta, C., Stamler, J.S., Drazen, J.M. Expired nitric oxide levels during treatment of acute asthma. Am. J. Respir. Crit. Care Med. 1995; 152, 800–803.
TABLE
REFERENCES
1. Moncada S, Higgs EA. The L-arginine–nitric oxide pathway. N Engl J Med, 1993; 329: 2002-12.
2. Nathan CF. Nitric oxide as a secretory product of mammalian cells. FASEB J, 1992; 6: 3051-64.
3. Dinh-Xuan AT, Higenbottam TW, Clelland CA, et al. Impairment of endothelium-dependent pulmonaryartery relaxation in chronic obstructive lung disease. N Engl J Med, 1991; 324: 1539-47.
4. Dinh-Xuan AT. Rôles du NO en physiopathologie cardiovasculaire et respiratoire. Arch Int Physiol Biochim Biophys, 1994; 102: A3-9.
5. Pepke-Zaba J, Higenbottam TW, Dinh-Xuan AT, Stone D, Wallwork J. Inhaled nitric oxide as a cause of selective pulmonary vasodilatation in pulmonary hypertension. Lancet, 1991; 338: 1173-4.
6. Rozé JC, Storme L, Zupan V, Morville P, Dinh-Xuan AT, Mercier JC. Echocardiographic investigation of inhaled nitric oxide in newborn babies with severe hypoxaemia. Lancet, 1994; 344: 303-5.
7. Dinh-Xuan AT, Brunet F, Dhainaut JF. Inhaled nitric oxide: the light and shadow of a therapeutic breakthrough. In: Fink MP, Payen D, Eds. Update in intensive care and emergency medicine. Volume 24. Role of nitric oxide in sepsis and ARDS. Berlin, Springer Verlag, 1995: 414-25.
8. Guo FH, de Raeve HR, Rice TW, Stuehr DJ, Thunnissen FBJM, Erzurum SC. Continuous nitric oxide synthesis by inducible nitric oxide synthase in normal human airway epithelium in vivo. Proc Natl Acad Sci USA, 1995; 92: 7809-13.
9. Lundberg JON, Farkas-Szallasi T, Weitzberg E, et al. High nitric oxide production in human paranasal sinuses. Nature Med, 1995; 1: 370-3.
10. Asano K, Chee CBE, Gaston B, et al. Constitutive and inducible nitric oxide synthase gene expression, regulation, and activity in human lung epithelial cells. Proc Natl Acad Sci USA, 1994; 91: 10089-93.
11. Kobzik L, Bredt DS, Lowenstein CJ, et al. Nitric oxide synthase in human and rat lung: immunocytochemical and histochemical localization. Am J Respir Cell Mol Biol, 1993; 9: 371-7.
12. Barnes PJ, Belvisi MG. Nitric oxide and lung disease. Thorax, 1993; 48: 1034-43.
13. Sadeghi-Hashjin G, Folkerts G, Henriks PAJ, et al. Peroxynitrite induces airway hyperresponsiveness in guinea pigs in vitro and in vivo. Am J Respir Crit Care Med, 1996; 153: 1697-701.
14. Sato K, Sakamaki T, Sumino H, et al. Rate of nitric oxide release in the lung and factors influencing the concentration of exhaled nitric oxide. Am J Physiol (Lung Cell Mol Physiol), 1996; 270: L914-20.
15. Robbins RA, Floreani AA, Von Essen SG, et al. Measurement of exhaled nitric oxide by three different techniques. Am J Respir Crit Care Med, 1996; 153: 1631-5.
16. Gustafsson LE, Leone AM, Persson MG, Wiklund NP, Moncada S. Endogenous nitric oxide is present in the exhaled air of rabbits, guinea pigs and humans. Biochem Biophys Res Commun, 1991; 181, 852-7.
17. Borland CDR, Cox Y, Higenbottam TW. Measurement of exhaled nitric oxide in man. Thorax, 1993; 48: 1160-2.
18. Lundberg JON, Weitzberg E, Nordvall SL, Kuylenstierna R, Lundberg JM, Alving K. Primarily nasal origin of exhaled nitric oxide and absence in Kartagener's syndrome. Eur Respir J, 1994; 7: 1501-4.
19. Kimberly B, Nejadnik B, Giraud GD, Holden WE. Nasal contribution to exhaled nitric oxide at rest and during breathholding in humans. Am J Respir Crit Care Med, 1996; 153: 829-36.
20. Martin U, Bryden K, Devoy M, Howarth P. Increased levels of exhaled nitric oxide during nasal and oral breathing in subjects with seasonal rhinitis. J Allergy Clin Immunol, 1996; 97: 768-72.
21. Alving K, Weitzberg E, Lundberg JM. Increased amount of nitric oxide in exhaled air of asthmatics. Eur Respir J, 1993; 6, 1368-70.
22. Kharitonov SA, Yates DH, Robbins RA, Logan-Sinclair RB, Shinebourne EA, Barnes PJ. Increased nitric oxide in exhaled air of asthmatic patients. Lancet, 1994; 343: 133-5.
23. Persson MG, Zetterström O, Agrenius V, Ihre E, Gustafsson LE. Single-breath nitric oxide measurements in asthmatic patients and smokers. Lancet, 1994; 343: 146-7.
24. Garnier P, Fajac I, Dessanges JF, Dall'Ava-Santucci J, Lockhart A, Dinh-Xuan AT. Exhaled nitric oxide during acute changes of airways calibre in asthma. Eur Respir J, 1996; 9: 1134-8.
25. Hamid Q, Springall DR, Riveros-Moreno V, et al. Induction of nitric oxide synthase in asthma. Lancet, 1993; 342: 1510-3.
26. Barnes PJ, Kharitonov SA. Exhaled nitric oxide : a new lung function test. Thorax, 1996; 51: 233-7.
27. Kharitonov SA, Yates DH, Barnes PJ. Increased nitric oxide in exhaled air of normal human subjects with upper respiratory tract infections. Eur. Respir. J. 1995; 8: 295-7.
28. Kharitonov SA, Yates DH, Barnes PJ. Inhaled glucocorticoids decrease nitric oxide in exhaled air of asthmatic patients. Am J Respir Crit Care Med, 1996; 153: 454- 457.
29. Massaro AF, Gaston B, Kita D, Fanta C, Stamler JS, Drazen JM. Expired nitric oxide levels during treatment of acute asthma. Am J Respir Crit Care Med, 1995; 152: 800-3.
30. Yates DH, Kharitonov SA, Robbins RA, Thomas PS, Barnes PJ. Effet of a nitric oxide synthase inhibitor and a glucocorticosteroid on exhaled nitric oxide. Am J Respir Crit Care Med, 1994; 152: 892-6.
31. Kharitonov SA, Yates DH, Chung KF, Barnes PJ. Changes in the dose of inhaled steroid affect exhaled nitric oxide levels in asthmatic patients. Eur Respir J, 1996; 9: 196-201.
32. Kharitonov SA, Wells AU, O'Connor BJ, et al. Elevated levels of exhaled nitric oxide in bronchiectasis. Am J Respir Crit Care Med, 1995; 151: 1889-93.
33. Stewart TE, Valenza F, Ribeiro SP, et al. Increased nitric oxide in exhaled gas as an early marker of lung inflammation in a model of sepsis. Am J Respir Crit Care Med, 1995; 151: 713-8.
34. Sogni P,Garnier P, Gadano A, et al. Endogenous pulmonary nitric oxide production measured from exhaled air is increased in patients with severe cirrhosis. J Hepatol, 1995; 23: 471-3.
35. Persson MG, Wiklund NP, Gustafsson LE. Endogenous nitric oxide in single exhalations and the change during exercise. Am Rev Respir Dis, 1993; 148; 1210-4.
36. Dinh-Xuan AT. Rôle du monoxyde d'azote en physiologie respiratoire et dans la physiopathologie des maladies pulmonaires. Rev Mal Respir, 1996; 13: sous presse.
37. Kharitonov SA, Robbins RA, Yates DH, Keatings V, Barnes PJ. Acute and chronic effects of cigarette smoking on exhaled nitric oxide. Am J Respir Crit Care Med, 1995; 152: 609-12.
38. Dupont, L.J., Demedts, M.G., Verleden, G.M. Prospective evaluation of the validity of exhaled nitric oxide for the diagnosis of asthma. Chest 2003; 123, 751–756.
31. Smith, A.D., Cowan, J.O., Filsell, S., McLachlan, C., Monti-Sheehan, G., Jackson, P., Taylor, D.R. Diagnosing asthma: comparisons between exhaled nitric oxide measurements and conventional tests. Am. J. Respir. Crit. Care Med.2004; 169, 473–478.
32. American Thoracic Society; European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide. Am J Respir Crit Care Med. 2005; 171: 912-930.
33. Berkman, N., Avital, A., Breuer, R., Bardach, E., Springer, C., Godfrey, S. Exhaled nitric oxide in the diagnosis of asthma: comparison with bronchial provocation tests. Thorax 2005;60, 383–388.
34. Kharitonov SA, Yates DH, Barnes PJ. Inhaled glucocorticoids decrease nitric oxide in exhaled air of asthmatic patients. Am. J. Respir. Crit. Care Med. 1996; 153:454–7.
35. Jatakanon, A., Kjaritonov, S.A., Lim, S., Barnes, P.J. Effect of differing doses of inhaled budesonide on markers of airway inflammation in patients with mild asthma. Thorax 1999; 54, 108–114.
36. Jones, S.L., Herbison, P., Cowan, J.O., Flannery, E.M., Hancox, R.J., McLachlan, C.R., Taylor, D.R. Exhaled NO and assessment of anti-inflammatory effects of inhaled steroid: dose–response relationship. Eur. Respir. J. 2002; 20, 601–608.
37. Massaro, A.F., Gaston, B., Kita, D., Fanta, C., Stamler, J.S., Drazen, J.M. Expired nitric oxide levels during treatment of acute asthma. Am. J. Respir. Crit. Care Med. 1995; 152, 800–803.
ARTICLE INFO
DOI: 10.12699/jfvp.4.11.2013.16
Conflict of Interest
Non
Date of manuscript receiving
12/11/2012
Date of publication after correction
15/4/2013
Article citation
Duong-Quy S, Le-Dong N.N , Hua-Huy T , Dinh-Xuan A.T . Measurement of exhaled nitric oxide (NO) as a marker of airway inflammation. J Func Vent Pulm 2013;04(11):16-22.