
 English
English
 French
French
Traitement de l’exacerbation de la broncho–pneumopathie chronique obstructive (BPCO)
Treatment of exacerbation of chronic obstructive pulmonary disease (COPD)
Sophie Birolleau
Service de Pneumologie, CHT G. Bourret, Nouméa
Corresponding author
Dr Sophie BIROLLEAU
Service de Pneumologie, CHT G. Bourret, Nouméa
E-mail: birolleau@yahoo.fr
ABSTRACT
Acute exacerbations (AE) of COPD enamel the natural progression of this disease. Learn about the consequences for patients and public health could understand the issue that their management should be fast and efficient.
Exacerbation of COPD is presented as an acute worsening of common symptoms founded in patient with COPD, and requiring at least a medical assessment of the cause and severity, and usually a specific management.
The AE/COPD are a risk factor for faster progression to respiratory disability and are a risk factor for mortality. In physiopathology, the AE/ COPD are characterized by worsening hyperinflation and increased preload of respiratory muscles. They also have an impact on the heart, especially a right heart. The AE/COPD are mostly caused by infectious origins: viral or bacterial or both. Searching and identifying target bacteria may be justified in cases of non-improvement after 48 hours of treatment or in severe cases. The AE/COPD can be treated at home or in hospital according to initial and secondary severity. The therapeutic associate making respiratory system at rest, nebulized bronchodilators, oxygenotherapy if SaO2 or SpO2 <90% and treatment of the cause, if known. The AE/COPD should be regularly reassessed because a secondary worsening in form of respiratory distress or hypercapnic encephalopathy is possible if a baseline status of the patient is not recovered.
KEYWORDS: COPD, exacerbation, respiratory disability, treatment, mortality
RÉSUMÉ
Les exacerbations aiguës (EA) de BPCO émaillent l’évolution naturelle de cette maladie. En connaître les conséquences pour le patient et pour la santé publique permet de comprendre l’enjeu que leur prise en charge efficace et rapide représente.
Une exacerbation de BPCO se présente comme une aggravation aiguë des symptômes habituels présentés par un patient atteint de BPCO, et nécessitant au moins une évaluation médicale de la cause et de la gravité, et le plus souvent une prise en charge thérapeutique spécifique. Les EA/BPCO sont un facteur de risque pour une évolution plus rapide vers le handicap respiratoire et sont un facteur de risque de mortalité. Sur le plan physiopathologique, les EA/BPCO sont caractérisées par l’aggravation de la distension thoracique et de l’augmentation de précharge des muscles respiratoires. Elles ont aussi un retentissement cardiaque, surtout droit. Les EA/BPCO sont en majorité d’origine infectieuse: virale ou bactérienne ou les deux. La recherche et l’identification des germes incriminés peuvent se justifier dans les cas de non amélioration après 48 heures de traitement ou dans les cas graves d’emblée. L’EA/BPCO se traite à domicile ou en centre hospitalier selon la gravité initiale ou secondaire. La prise en charge associe mise au repos de l’appareil respiratoire, nébulisations de bronchodilatateurs, oxygénothérapie si SaO2 ou SpO2 <90% et traitement de la cause lorsqu’elle est connue.
Les EA/BPCO doivent être très régulièrement réévaluées car une aggravation secondaire sous forme de détresse respiratoire ou d’encéphalopathie hypercapnique est possible tant que l’état de base du patient n’est pas récupéré.
MOTS CLES: BPCO, exacerbation, handicap respiratoire, traitement, mortalité
INTRODUCTION
Les exacerbations aiguës de BPCO (EA/BPCO) émaillent l’évolution naturelle de cette maladie. Fréquemment rencontrées par les pneumologues, urgentistes et médecins généralistes, elles constituent un motif de plainte des patients BPCO de plus en plus nombreux en raison de l’épidémiologie du tabagisme et de l’urbanisation de la vie amenant plus rapidement les transmissions infectieuses virales et l’exposition aux polluants.
En connaître les conséquences pour le patient et pour la santé publique permet de comprendre l’ enjeu que leur prise en charge efficace et rapide représente.
QU’EST—CE QU’UNE EXACERBATION DE BPCO ?
Il existe beaucoup de définitions de l’exacerbation de BPCO. Rappelons les principales définitions des Sociétés Savantes:
Définition britannique
Pendant au moins 2 jours consécutifs, présence: d’au moins deux symptômes majeurs: aggravation de la dyspnée de base, de la quantité et de la purulence des expectorations. Ou D’un symptôme majeur et d’un symptôme mineur: augmentation de la rhinorrhée, des sifflements, de la toux, présence d’une fièvre, ou d’une angine.
Définition nord – américaine
Aggravation des symptômes nécessitant le recours à un avis médical, ou à une corticothérapie orale ou à une antibiothérapie.
Définition du GOLD
Aggravation aiguë de la dyspnée habituelle, de la toux et des expectorations chez un patient BPCO, pouvant justifier d’une modification du traitement de fond.
Définition dite de consensus Aggravation persistante de l’état du patient par rapport à l’état basal:
• Majoration des symptômes (dyspnée, toux, expectorations).
• De début brutal.
• Depuis plus de 24 heurs.
• Nécessitant une modification du traitement habituel.
On perçoit d’emblée la difficulté à cadrer le sujet face à des définitions différentes, basées surtout sur un abord empirique et clinique du patient. La physiopathologie complexe et encore incomplètement connue du mécanisme des exacerbations de BPCO est exclue de toutes ces définitions. De plus, la diversité des définitions explique les résultats variés des études cliniques traitant le sujet de la prise en charge médicale d’une exacerbation de BPCO.
En pratique
Une exacerbation de BPCO (EA/BPCO) se présente comme une aggravation aiguë des symptômes habituels présentés par un patient atteint de BPCO, et nécessitant au moins une évaluation médicale de la cause et de la gravité, et le plus souvent une prise en charge thérapeutique spécifique. Les études cliniques concernant le sujet doivent d’ abord être lues avec une analyse critique préalable et indispensable de la définition retenue par les auteurs pour l’exacerbation de BPCO.
Remarque
Certains auteurs français distinguent entre exacerbation et décompensation. Le terme décompensation étant utilisé pour les exacerbations mettant en jeu le pronostic vital du patient [1, 2].
QUELS SONT LES RISQUES D’ UNE EXACERBATION DE BPCO ?
Les exacerbations altèrent la qualité de vie des patients, accélèrent le déclin de la fonction respiratoire, ont un coût non négligeable et sont responsables d’une morbi-mortalité non nulle.
Les exacerbations de BPCO altèrent considérablement la qualité de vie des patients. Un patient récupère lentement et progressivement sa qualité de vie antérieure à l’exacerbation de BPCO en moyenne en 6 mois. Si entre-temps, une nouvelle exacerbation survient, la qualité de vie antérieure n’est pas récupérée (Figure 1). Les exacerbations de BPCO contribuent au déclin du VEMS et accélèrent la vitesse de dégradation des paramètres fonctionnels respiratoires. Chez les patients présentant de fréquentes exacerbations, le déclin du VEMS annuel est majoré de 8 ml/an.
Selon les études, la mortalité varie de 2.5 à 30 % pendant l’hospitalisation, 20% dans les deux premiers mois, 20 à 33% dans les 6 premiers mois et 23 à 43% dans la première année. A trois ans, la mortalité est de 49%, et chez les patients hypercapniques, la survie est encore moins longue, 2 ans. La fréquence des exacerbations influence la mortalité: 50% de décès à 5 ans chez les patients présentant une à deux exacerbations par an, et 70% chez ceux présentant trois exacerbations ou plus par an.
En pratique
Les EA/BPCO sont un facteur de risque pour une évolution plus rapide vers le handicap respiratoire et sont un facteur de risque de mortalité.
QUELLES SONT LES CAUSES DES EXACERBATIONS DE BPCO ?
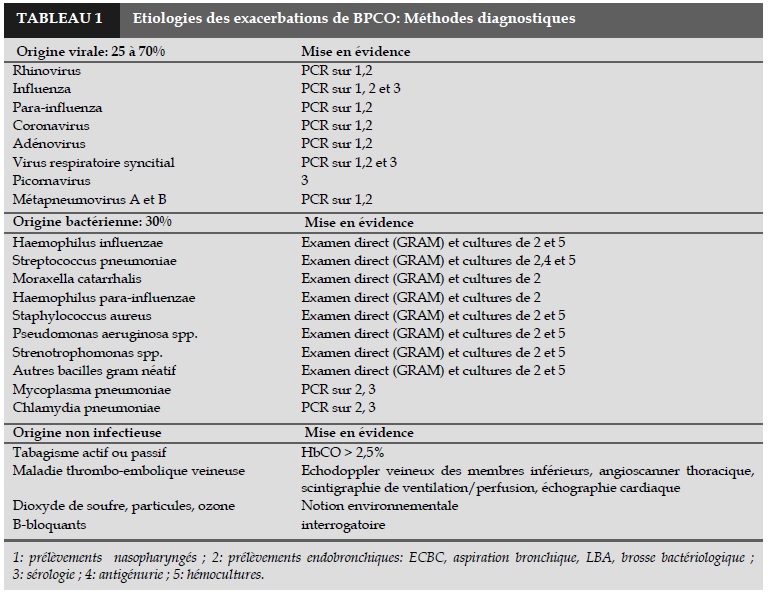
Dans 30% des cas, la cause est bactérienne. Dans 25% à 70% des cas, elle est virale. Dans 25% des cas, elle est à la fois virale et bactérienne et dans 20% des cas, elle n’est pas retrouvée (Tableau 1).
Il faut toujours rechercher la poursuite ou la reprise d’un tabagisme, une exposition à d’autres irritants domestiques ou professionnels, une modification du traitement habituel et une maladie thromboembolique veineuse décrite par certains auteurs comme responsables de 25% des exacerbations.
En ce qui concerne les exacerbations nécessitant une prise en charge hospitalière, elles sont 70 à 80% d’ origine virale.
En pratique
Les EA/BPCO sont en majorité d’origine infectieuse: virale ou bactérienne ou les deux. La recherche et l’identification des germes incriminés peuvent se justifier dans les cas de non amélioration après 48 heures de traitement ou dans les cas graves d’ emblée.
QUELLES SONT LES CONSEQUENCES PHYSIOPATHOLOGIES DES EXACERBATIONS ?
Inflammation des voies aériennes
Lors d’une EA/BPCO d’origine bactérienne, la charge infectieuse locale augmente et génère une réponse de l’organisme qui aboutit à une augmentation de l’inflammation locale en raison de l’afflux local de polynucléaires neutrophiles qui libèrent des cytokines pro-inflammatoires (TNF-α, Il-8) et des protéinases (comme l’élastase leucocytaire).
Par ailleurs, un stress oxydatif se met en place avec excrétion sur place de métalloprotéinases, d’élastase leucocytaire et inhibition des facteurs antiprotéasiques.
Plus la charge bactérienne est élevée, plus la réponse inflammatoire est importante.
Inflammation systémique
Chez un patient atteint de BPCO à l’état stable, les taux sériques de TNF-α, d’Il-8 et de la CRP sont un peu au-dessus de la normale. Lors d’une EA/BPCO, ces taux augmentent encore plus sans que l’on puisse situer un cut-off spécifique de l’EA/BPCO ou de sa résolution.
Anomalies fonctionnelles respiratoires
L’augmentation de la distension thoracique se met en place par l’allongement du temps de vidange alvéolaire expiratoire. Plus la fréquence respiratoire est élevée, plus ce phénomène s’aggrave car à chaque expiration, le patient ne peut atteindre le temps nécessaire à une vidange alvéolaire complète: c’est l’augmentation du volume alvéolaire téléexpiratoire (Figure 2).
Lorsque le patient est en distension thoracique, il ventile à haut volume pulmonaire, proche de sa capacité pulmonaire totale. Ce déplacement vers la partie plate sur la courbe de compliance respiratoire met le patient dans une position où les variations de pression n’entraînent qu’une petite variation de volume, ce qui augmente la charge de pression inspiratoire.
De plus, la distension thoracique entraîne une diminution de la capacité vitale (CV) et génère une pression expiratoire positive intrinsèque.
La distension et l’augmentation de résistance des voies aériennes sont responsables d’une augmentation de l’effort musculaire respiratoire nécessaire à la ventilation, sur des muscles par ailleurs altérés.
Par ailleurs, on observe une diminution du VEMS, du débit expiratoire de point (DEP) et de la CVF.
Altération des échanges gazeux
L’hypoxémie est due à une aggravation des anomalies de ventilation/perfusion. Elles–mêmes sont responsables d’une augmentation de l’espace–mort phsyiologique et donc d’une hypoventilation alvéolaire et d’une hypercapnie. L’hypercapnie est majorée par l’augmentation de production de CO2 par l’organisme en hypermétabolisme lié au stress de la maladie et de sa cause.
Interaction cœur–poumons
L’aggravation de la distension thoracique et d’une PEPi entraînent une diminution du retour veineux au coeur droit. Ceci entraîne une augmentation de la résistance vasculaire pulmonaire, ce qui augmente la post-charge du ventricule droit. A leur tour, ces augmentations de pression télédiastolique du ventricule droit altèrent le remplissage ventriculaire gauche. Le septum interventriculaire est déplacé vers la gauche (VG) pendant la diastole. Lors des EA/ BPCO particulièrement graves, le travail du VG pour assurer une fonction cardiaque adaptée au stress est majoré (Figure 3).
En pratique
Les EA/BPCO sont caractérisées par l’aggravation de la distension thoracique et de l’augmentation de précharge des muscles respiratoires. Elles ont aussi un retentissement cardiaque, surtout droit.
PRISE EN CHARGE THERAPEUTIQUE DES EA/ BPCO
La première étape consiste à analyser la modalité globale de la prise en charge en évaluant la sévérité de l’exacerbation qui guide le choix entre une prise en charge à domicile ou en milieu hospitalier [4, 5].
Quels sont les signes cliniques de gravité ?
A l’examen clinique, le patient présente l’un de ces signes:
Polypnée superficielle > 25/mn au repos, tirage sus -claviculaire et intercostal, balancement thoracoabdominal, signe de Hoover (creusement des derniers espaces intercostaux lors de l’inspiration), dyspnée de repos, ou à la parole, non améliorée par un traitement médical antérieur adapté, cyanose, troubles de la conscience, signes d’encéphalopathie hypercapnique (céphalées, flapping tremor, troubles de la vigilance). La présence de l’un de ces signes doit mettre en alerte et faire orienter le patient vers une prise en charge hospitalière.
Par ailleurs, la façon dont le patient peut se soigner, est entouré est à prendre en compte, sa possibilité de subvenir aux coûts engendrés, ainsi que ses antécédents médicaux.
Où le patient doit-il être pris en charge ?
La présence de signes cliniques de gravité doit faire hospitaliser le patient. Mais, en l’absence de signes de gravité, il convient d’instaurer une surveillance rapprochée du patient afin de s’assurer de l’évolution favorable. En effet, une situation peut s’aggraver et faire reconsidérer les modalités de prise en charge. En centre hospitalier, l’évolution, les paramètres paracliniques permettront de dire si le patient doit ou non être pris en charge en Soins Intensifs (SI).
Un des paramètres important est le résultat de la gazométrie artérielle. Un pH < 7,35 est un signe d’ alerte. Un pH < 7,32 ou une PaO2 < 50 mmHg implique la prise en charge en Soins Intensifs pour l’instauration d’une ventilation mécanique. Cependant, les critères d’admission en SI ne sont pas rigoureusement codifiés. L’évolution défavorable avec un traitement médical maximal bien conduit, la discussion avec les médecins habituels du patient et les médecins des SI sont des éléments de décision de tout premier ordre.
Dans tous les cas, la prise en charge initiale associe [6, 7]:
- Lorsqu’elle est connue et accessible à un traitement: celui de la cause: sevrage tabagique, arrêt de traitement contre-indiqué, etc…
- Le repos afin de diminuer au maximum la précharge musculaire au niveau des muscles respiratoires tant que le patient est dyspnéique au repos et au moindre effort ;
- Puis le lever au fauteuil et la reprise d’une activité physique adaptée à l’état respiratoire du patient le plus précocement possible: l’inactivité entraîne une rapide fonte musculaire chez ces patients déjà désadaptés à l’effort et souvent dénutris ou malnutris. La kinésithérapie expectorante ou de réexpansion n’est pas recommandée dans la phase aiguë de l’EA/BPCO car elle peut aggraver une situation à l’équilibre précaire ;
- Les nébulisations par nébulisateur pneumatique de bronchodilatateurs à forte posologie (salbutamol, ipratropium). Aucun de ces deux traitements n’ayant formellement fait la preuve de sa supériorité dans la prise en charge des EA/BPCO, on peut recourir à l’un ou à l’autre ou au deux (effet additif reconnu) selon la tolérance et l’efficacité observées. Quand c’est possible, il est recommandé de réaliser les nébulisations avec de l’air pulsé, plutôt que de l’oxygène.
Néanmoins, il n’est pas interdit de faire les nébulisations avec un fort débit d’oxygène à condition de ne pas oublier d’en baisser le débit juste après la nébulisation. On administre le produit soit par l’intermédiaire d’un masque naso-buccal, soit par l’intermédiaire d’un embout buccal. Le recours aux dispositifs inhalés (aérosol-doseurs, turbuhalers, inhalers, etc…) est possible si la capacité inspiratoire du patient est suffisante pour obtenir une inhalation profonde et complète, ce qui est rarement le cas dans les premiers jours des EA ; malgré les traitements institués. La posologie est de 30 à 40 mg équivalent par jour pendant 7 à 10 jours (recommandations GOLD) [6].
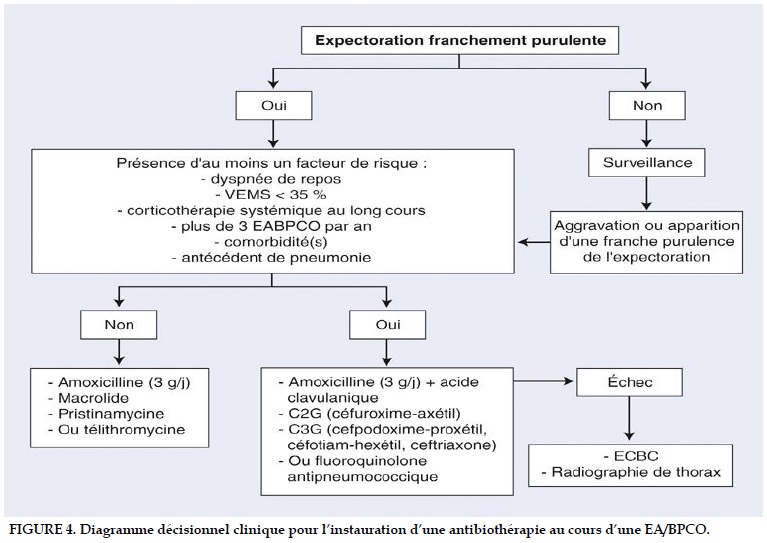
- L’antibiothérapie: elle n’est pas systématique et résulte d’une analyse de facteurs cliniques et biologiques. Ci-dessous, un diagramme décisionnel proposant une démarche d’instauration d’une antiobiothérapie basée sur des données anamnestiques et cliniques (Figure 4). En milieu hospitalier, on peut également s’aider de données paracliniques : la présence d’un foyer alvéolaire sur la radiographie thoracique, la présence de signes biologiques compatibles avec une infection: polynucléose neutrophile, élévation du taux sérique de la CRP, de la procalcitonine, du fibrinogène ou la mise en évidence d’un germe viral ou bactérien sur des prélèvements dirigés (Tableau 1).
Remarque
La théophylline n’est plus recommandée depuis qu’une méta-analyse concernant des études randomisées a montré l’absence d’efficacité de ce traitement [3].
- Place de l’oxygénothérapie: le débit d’oxygène doit être adapté au mieux à la saturation artérielle ou pulsée qui doit varier de deux à trois points autour de 90%. Le risque de vouloir obtenir une saturation meilleure en augmentant le débit d’oxygène est celui de voir apparaître ou s’aggraver une hypercapnie mal tolérée.
Néanmoins, en situation extrême (patient en détresse respiratoire ou en coma aréactif), lorsque la décision d’intuber le patient s’impose, il convient de maintenir une saturation élevée, en recourant à un fort débit d’oxygène même si la capnie augmente, car le risque est à l’hypoxémie et l’hypoxie tissulaire et la ventilation mécanique corrigera le degré de capnie plus ou moins rapidement.
L’administration d’oxygène peut se faire grâce à des masques de type Venturi ou par l’intermédiaire de lunettes nasales. Rarement, on recourt à la sonde nasale. Ce choix se fait de manière empirique en fonction de la disponibilité du matériel et de la tolérance et de l’efficacité pour le patient.
- Place de la ventilation: la ventilation permet de passer un cap lors d’une exacerbation particulièrement sévère, à condition de répondre à des modalités de mise en route et de suivi adaptées au patient. Le recours à la ventilation permet de corriger l’hypoventilation alvéolaire et met au repos les muscles respiratoires.
Indications de la ventilation assistée
La mise en route d’une ventilation est indiquée de façon indiscutable lorsque le pH est inférieur à 7,30, ou lorsque le patient est en coma aréactif, en arrêt cardiaque ou respiratoire. Mais en-dehors de ces cas caricaturaux, il n’existe pas vraiment de critères cliniques ou biologiques indiscutables. En effet, certains patients ont des valeurs gazométriques de base qui peuvent apparaître comme catastrophiques mais avec lesquelles ils s’accommodent au long cours. Inversement, un patient présentant une EA/ BPCO peut garder longtemps des chiffres d’hématose satisfaisants mais au prix d’efforts respiratoires qui ne peuvent qu’aboutir à l’épuisement.
En pratique, lorsqu’il y a une hésitation à l’instauration de la ventilation, le mieux est de mettre en route le traitement médical maximal et de refaire une évaluation clinique et paraclinique 4 à 6 heures après la prise en charge initiale. Si l’état du patient s’est amélioré, on sursoit à la ventilation. Si l’état est stable ou aggravé, on propose une ventilation.
Quelle qu’elle soit, la ventilation doit être initiée dans un secteur hospitalier adapté avec des personnels soignants en nombre et formés à cette technique.
Quelles sont les différentes méthodes de ventilation ?
La grande dichotomie se fait entre ventilation invasive ou non.
- La VNI
Il existe quelques contre-indications: patient agité, non coopérant, claustrophobe.
La VNI se fait à l’aide de ventilateurs dont les modèles en perpétuel renouvellement et recherche d’améliorations technologiques sont pléthores sur le marché médical (Figure 5). Il n’est pas possible d’en présenter une liste exhaustive. Il faut demander aux représentants des différentes marques et modèles de vous montrer ou au mieux de vous laisser à l’essai des modèles que vous pourrez utiliser facilement, en étudier les caractéristiques techniques, la robustesse, la précision, le coût, la maniabilité, etc… Actuellement, on recommande un ventilateur pouvant fonctionner en aide inspiratoire et sur lequel on peut raccorder une entrée d’oxygène. Mais c’est le cas de presque tous les respirateurs modernes qui souvent aussi fonctionnent en volumétrique, et peuvent être utilisés aussi en ventilation invasive.
L’interface avec le patient se fait à l’aide d’un masque. Là encore, les masques proposés dans le commerce sont extrêmement nombreux : de différentes tailles, en matières différentes, avec fuite contrôlée ou non, etc… Dans le cas de l’EA/BPCO, on utilise en première intention un masque facial. Mais certains patients ne le supportent pas et on peut aussi recourir à un masque nasal.
Le réglage des paramètres ventilatoires
Tous les modes ventilatoires peuvent être utilisés: volume contrôlé, ventilation à deux niveaux de pression, aide inspiratoire, ventilation spontanée avec aide inspiratoire (VSAI). La mise en place de la ventilation peut se faire en mode avec circuit avec fuite ou sans fuite. En grande p.
Néanmoins, il semble que l’apport d’une aide inspiratoire (AI) soit le mode ventilatoire le plus confortable pour les patients. On commence donc par instaurer une AI située entre 10 et 20 cm d’eau, en fonction du poids du patient, des risques élevés ou non de barotraumatisme, et de la sévérité initiale de l’hématose. On ajoute une PEEP entre 4 et 6 cm d’eau. L’apport de l’AI est déclenché par la détection par le ventilateur d’un effort inspiratoire fourni par le patient. Il est possible de régler le trigger inspiratoire, c’est-à-dire le seuil de détection par la machine de cet effort inspiratoire afin de ne pas délivrer trop souvent ou à tort cette aide.
La fréquence respiratoire (FR) est laissée libre, avec un seuil minimum en-dessous duquel le ventilateur peut déclencher l’AI. On peut également régler le trigger expiratoire et le temps inspiratoire sur le temps total. Dans le cas d’une EA/BPCO, on tend à augmenter le plus possible le temps expiratoire: le trigger est donc réglé à 50% de la pression et le Ti/ Ttot à 1/3.
Le perfectionnement et la sophistication des respirateurs permet de régler toutes sortes de paramètres: FR maximale, pression maximale, le volume–cible ou le volume minima, y compris sur un mode VSAI, etc…. Certains algorithmes peuvent même calculer la compliance et la résistance de l’appareil thoracopulmonaire et délivrer une pression variable à chaque cycle du patient.
L’ajustement de tous ces paramètres se fait en grande partie par tâtonnement, en interrogeant le patient sur ce qu’il ressent: trop ou pas assez d’air, trop lent, trop rapide, trop fort, etc… et sur les résultats de la gazométrie artérielle de contrôle réalisée avec la VNI en fonctionnement. On comprend aisément qu’il faut donc disposer de temps et de personnel qui assiste le patient au cours des premières heures de VNI.
La persistance de l’hypercapnie fait augmenter l’AI et diminuer la FR, si possible. Tous les autres paramètres sont réglés en fonction de la tolérance du patient. On peut également ajouter de l’oxygène si la PaO2 reste trop basse.
En pratique
L’EA/BPCO se traite à domicile ou en centre hospitalier selon la gravité initiale ou secondaire. La prise en charge associe mise au repos de l’appareil respiratoire, nébulisations de bronchodilatateurs, oxygénothérapie si SaO2 ou SpO2 <90% et traitement de la cause lorsqu’elle est connue.
Les EA/BPCO doivent être très régulièrement réévaluées car une aggravation secondaire sous forme de détresse respiratoire ou d’encéphalopathie hypercapnique est possible tant que l’état de base du patient n’est pas récupéré [8-10].
Remarque
La ventilation invasive requiert une intubation orotrachéale. Ce mode de prise en charge est très spécifique à un service de réanimation. Les difficultés rencontrées se situent surtout au moment du sevrage du respirateur. Certains patients peuvent être transitoirement ou définitivement trachéotomisés.
CONFLIT D’INTERETS
Aucun.
REFERENCES
1. Exacerbation de la BPCO. Cuvelier A, Benhamou D, Lamia B, Muir JF. EMC 6–030–A–30.
2. Exacerbations des bronchopneumopathies chroniques obstructives. G Jébrak, M Aubier. EMC. Médecine d’ urgence. 25–020–C–90.
3. Barr RG, Rowe BH, Camargo CA, et al. Methylxanthines for exacerbations of chronic obstructive pulmonary disease: meta-analysis of randomised trials BMJ 2003; 327: 643-46.
4. Hernandez C, Casas A, Escarrabill J, Alonso J, PuigJunoy J, Farrero E, Vilagut G, Collvinent B, RodriguezRoisin R, Roca J, CHRONIC project. Home hospitalisation of exacerbated chronic obstructive pulmonary disease patients. Eur Respir J 2003; 21: 58.
5. Snow V, Lascher S, Mottur-Pilson C, Joint Expert Panel on Chronic Obstructive Pulmonary Disease of the American College of Chest Physicians and the American College of Physicians-American Society of Internal Medicine. Evidence base for management of acute exacerbations of chronic obstructive pulmonary disease. Ann Intern Med 2001; 134: 595.
6. Celli BR, MacNee W, ATS/ERS Task Force. Standards for the diagnosis and treatment of patients with COPD: a summary of the ATS/ERS position paper. Eur Respir J 2004; 23: 932.
7. Rabbat A, Guetta A, Lorut C, Lefebvre A, Roche N, Huchon G. Prise en charge des exacerbations aiguës de BPCO. Rev Mal Respir 2010; 27: 939-53.
8. Tillie-Leblond I, Marquette CH, Perez T, Scherpereel A, Zanetti C, Tonnel AB, Remy-Jardin M. Pulmonary embolism in patients with unexplained exacerbation of chronic obstructive pulmonary disease: prevalence and risk factors. Ann Intern Med 2006; 144: 390.
9. Rizkallah J, Man SF, Sin DD. Prevalence of pulmonary embolism in acute exacerbations of COPD: a systematic review and metaanalysis. Chest 2009; 135: 786.
10. Zvezdin B, Milutinov S, Kojicic M, Hadnadjev M, Hromis S, Markovic M, Gajic O. A postmortem analysis of major causes of early death in patients hospitalized with COPD exacerbation. Chest 2009; 136: 376.
FIGURES/TABLE

REFERENCES
1. Exacerbation de la BPCO. Cuvelier A, Benhamou D, Lamia B, Muir JF. EMC 6–030–A–30.
2. Exacerbations des bronchopneumopathies chroniques obstructives. G Jébrak, M Aubier. EMC. Médecine d’ urgence. 25–020–C–90.
3. Barr RG, Rowe BH, Camargo CA, et al. Methylxanthines for exacerbations of chronic obstructive pulmonary disease: meta-analysis of randomised trials BMJ 2003; 327: 643-46.
4. Hernandez C, Casas A, Escarrabill J, Alonso J, PuigJunoy J, Farrero E, Vilagut G, Collvinent B, RodriguezRoisin R, Roca J, CHRONIC project. Home hospitalisation of exacerbated chronic obstructive pulmonary disease patients. Eur Respir J 2003; 21: 58.
5. Snow V, Lascher S, Mottur-Pilson C, Joint Expert Panel on Chronic Obstructive Pulmonary Disease of the American College of Chest Physicians and the American College of Physicians-American Society of Internal Medicine. Evidence base for management of acute exacerbations of chronic obstructive pulmonary disease. Ann Intern Med 2001; 134: 595.
6. Celli BR, MacNee W, ATS/ERS Task Force. Standards for the diagnosis and treatment of patients with COPD: a summary of the ATS/ERS position paper. Eur Respir J 2004; 23: 932.
7. Rabbat A, Guetta A, Lorut C, Lefebvre A, Roche N, Huchon G. Prise en charge des exacerbations aiguës de BPCO. Rev Mal Respir 2010; 27: 939-53.
8. Tillie-Leblond I, Marquette CH, Perez T, Scherpereel A, Zanetti C, Tonnel AB, Remy-Jardin M. Pulmonary embolism in patients with unexplained exacerbation of chronic obstructive pulmonary disease: prevalence and risk factors. Ann Intern Med 2006; 144: 390.
9. Rizkallah J, Man SF, Sin DD. Prevalence of pulmonary embolism in acute exacerbations of COPD: a systematic review and metaanalysis. Chest 2009; 135: 786.
10. Zvezdin B, Milutinov S, Kojicic M, Hadnadjev M, Hromis S, Markovic M, Gajic O. A postmortem analysis of major causes of early death in patients hospitalized with COPD exacerbation. Chest 2009; 136: 376.
ARTICLE INFO
DOI: 10.12699/jfvp.3.7.2012.15
Conflict of Interest
Non
Date of manuscript receiving
24/12/2011
Date of publication after correction
15/4/2012
Article citation
Sophie Birolleau. Treatment of exacerbation of chronic obstructive pulmonary disease (COPD). J Func Vent Pulm 2012;03(07):15-22.