
 English
English
 French
French
Mise au point de la technique de provocation à la métacholine: son application dans l’obésité
Development of methacholine challenge test: its application in obesity
T. Tran Thi Diem, S. Duong-Quy
Service de Physiologie - Explorations Fonctionnelles. Hôpital Cochin
Faculté de Médecine. Université Paris Descartes. France
Corresponding author
Dr Trang TRAN THI DIEM
Département de Consultation. Hôpital de Pham Ngoc Thach, HCM
Email: diemtrangy99@yahoo.com
ABSTRACT
Introduction. The airway hyperresponsiveness (AHR) is a major feature of bronchial inflammatory diseases such as asthma. The relationship between AHR and obesity is currently the subject of several researches, whose results are still controversial.
Methods. We conducted a retrospective study of 398 cases of patients with provocation test with methacholine in order to determine the relationship between AHR and obesity and factors influencing the methacholine chalenge tests. To perform this test, the current symptoms, values of FEV1 and FEV1/CVL ratio, contra-indications, and drugs used before the test must be alway considered. Nebulization system which is composed with nebulizer and dosimeter must be regularly calibrated and maintained according to laboratory protocol.
Results. 398 patients were included. 40.7% of the study population (n = 162) had a positive test and 59.3% (n = 236) a negative test. Obese women and men who are overweight have a significant high risk of AHR compared with those whose weight is normal. However, this relationship is stronger among women than men.
Conclusion. Our study shows the relationship between AHR and obesity. The technician competence and respect for the protocol are required to avoid technical factors influencing test results.
KEYWORDS: Bronchial hyperreactivity, asthma, methacholine, FEV1, PD20
RÉSUMÉ
Introduction. L’hyperréactivité bronchique (HRB) est une caractéristique majeure des maladies inflammatoires bronchiques, tel que l’asthme. La relation entre l’HRB et l’obésité fait actuellement l’objet de nombreuses recherches, dont les résultats sont encore controversés.
Méthodes. Nous avons effectué une étude rétrospective portant sur 398 dossiers de patients ayant eu un test de provocation bronchique à la métacholine dans le but de déterminer la relation entre l’HRB et l’obésité et les facteurs influençant les résultats du test à la métacholine. En réalisant le test, il faut toujours tenir compte des symptômes actuels, les valeurs de VEMS et de VEMS/CVL, les contre-indications du test et les médicaments utilisés avant le test. Le système de nébulisation composant le nébuliseur et le dosimètre doit être régulièrement calibré et maintenu selon le protocole du laboratoire.
Résultats. 398 patients ont été inclus. 40,7% de la population étudiée (n=162) a eu un test positif et 59,3% (n=236) un test négatif. Les femmes obèses et les hommes ayant un excès de poids ont un risque d’HRB significativement plus élevé par rapport à ceux dont le poids est normal. Cette relation est cependant plus nette chez les femmes que chez les hommes.
Conclusion. Notre étude montre qu’il existe une relation entre l’HRB et l’obésité. La compétence de technicien et le respect du protocole sont exigés pour éviter les facteurs techniques influençant les résultats de test.
MOTS CLES: hyperréactivité bronchique, asthme, métacholine, VEMS, PD20
INTRODUCTION
L’hyperréactivité bronchique (HRB) est définie par une réponse exagérée des bronches vis-à-vis des stimulants n’ayant pas d’effet chez le sujet sain [1]. La preuve de l’hyperréactivité bronchique peut être apportée en soumettant les bronches du sujet à une irritation contrôlée, reproductible, connue pour ne déclencher aucune réaction chez le sujet sain. Les méthodes de provocation sont nombreuses et ne sont pas toujours comparables entre elles [1, 2].
Les stimulations pharmacologiques et immunologiques contractent la musculature bronchique par un mécanisme direct comme histamine, acétylcholine et ses dérivés (métacholine, carbachol), prostaglandines (PGF2a), leucotriènes.
Les stimulations par des facteurs physico-chimiques, en revanche, induisent une bronchoconstriction par des mécanismes indirects. Ce sont l’exercice, l’hyperventilation isocapnique, l’inhalation de l’air froid et sec, l’inhalation de solutés hyper ou hypotonique.
Cependant, le test de provocation à la métacholine est, actuellement, le plus usuel cliniquement et le mieux standardisé [3]. La métacholine induit une bronchoconstriction de brève durée, en général peu intense et réversible sous des médicaments bronchodilatateurs comme les ß2 adrénergiques. Il est largement utilisé en pratique clinique pour évaluer la présence et l'ampleur de la réaction des voies aériennes. Malgré la disponibilité répandue pendant beaucoup d'années, il semble que les résultats de test à la métacholine sont fréquemment mal interprétés. Il y a un certain nombre d'avertissements importants dans l'interprétation de test à la métacholine qui sont souvent oubliés [4].
Le test de provocation bronchique ont évolué et pris une place importante dans le diagnostic, le suivi et la prise en charge de l'asthme avec assez d'informations dans la littérature pour évaluer leur utilité [2]. Il est utile non seulement pour soit éliminer, soit renforcer un diagnostic de l’asthme, mais aussi dans le cadre d’études épidémiologiques. Pour certains, le degré de réactivité bronchique permet en outre d’ apprécier le pronostic d’un asthme ou de surveiller son évolution sous traitement [6, 7].
Parmi les différents facteurs de risque dans l’asthme, l’obésité est considérée comme un élément important. Actuellement, il existe une augmentation de prévalence de l’asthme et de l’obésité. Certaines études transversales et longitudinales ont montré la relation entre l’asthme et l’obésité qui est plus forte chez les femmes. Cependant, l'association entre l'obésité et l'HRB est actuellement encore les objectifs de nombreuses recherches. Il reste encore des ambiguïtés quant aux relations entre l’HRB et l’obésité. Cette association est plus nette chez les femmes que chez les hommes [6, 7]. Certaines études montrent qu’elle est plus marquée chez les femmes que chez les hommes alors que d’autres ont des résultats inverses [7-9]. Les mécanismes de cette association font actuellement l’objet de nombreuses recherches.
OBJECTIFS DE L’ETUDE
Donc, nous avons donc réalisé cette étude en voulant obtenir deux objectifs suivants:
1. Déterminer les facteurs pathologiques physiques et techniques pris en considération lors de l’interprétation des résultats du test à la métacholine.
2. Évaluer la relation entre l’augmentation de l’index de masse corporelle et l’hyperréactivité bronchique.
MATÉRIEL ET MÉTHODE
Population d’étude
Il s’agit d’une population adulte dont l’âge moyen est de 41 ans. Nous avons réalisé une étude rétrospective de 398 dossiers de patients chez qui le test de provocation bronchique non spécifique à la métacholine a été réalisé pendant un an (de Mars 2006 à Mars 2007) au service des Explorations Fonctionnelles Respiratoires (EFR), Groupe Hospitalier Cochin – Saint Vincent de Paul.
Méthode
Il s’agit d’une méthode de Jan modifiée, dérivée de la méthode dosimétrique de Rosenthal.
Test de métacholine
Conditions générales de réalisation des tests
Les tests sont réalisés dans le service des EFR de l’Hôpital Cochin.
Des précautions
Un médecin entraîné à traiter un bronchospasme et à utiliser le matériel de réanimation doit être immédiatement disponible. A aucun moment, le patient ne doit être laissé sans surveillance. On doit disposer du matériel (stéthoscope, tensiomètre et saturomètre) permettant d’apprécier la sévérité d’un bronchospasme ainsi que des médicaments pour le traiter (β2mimétique pour nébulisation ou pour injection sous cutanée et oxygène). Afin de ne pas exposer le technicien à la métacholine, la pièce doit être correctement ventilée. Il est prudent que des techniciens asthmatiques ne soient pas les réalisateurs de ce test.
Préparation des patients
Au moment de la prise de rendez-vous, les patients doivent êtres informés des médicaments à éviter avant la réalisation du test. Les β2-adrénergique inhalé à courte durée d’action devraient interrompre 6 heures avant le test et les β2-mimétiques de longue durée d’ action avant 48 heures, les théophyllines immédiates 24 heures auparavant, les théophyllines retard 48 heures auparavant. Évidemment, les médicaments susceptibles d’avoir un effet immédiat sur la bronchoconstriction doivent arrêter depuis un temps au moins égal à leur durée d’action biologique.
Tous les patients ayant des contre-indications du test de provocation bronchique à métacholine sont éliminés. Il est à noter qu’un antécédente d’hospitalisation pour asthme en réanimation n’est pas une contre - indication absolue ni même relative, à la réalisation d’un test de provocation bronchique à la métacholine. Toute fois, elle impose des précautions maximales et les indications du test restent très ciblées. Un questionnaire est rempli par le technicien avant de commencer une épreuve de provocation bronchique à la métacholine et après avoir vérifié l'absence de contre-indication absolue. Ces données sont liées à la maladie asthmatique et l’évaluation de la stabilité de la maladie asthmatique.
Contre-indications absolues
• Syndrome obstructif sévère (VEMS <50% ou <1,2l chez l’adulte).
• Infarctus du myocarde <3mois.
• Accident vasculaire cérébral < 3 mois.
• Anévrysme artériel connu.
• Hypertension artérielle non contrôlée (PAS >200; PAD>100).
• Incapacité à comprendre des manœuvres spirométriques demandées.
Contre-indications relatives
• Syndrome obstructif modéré à sévère (VEMS ≤75% ou <1,2 L chez la femme et <1,5 L chez l’homme.
• Infection récente des voies aériennes (>2 semaines).
• Hypertension artérielle.
• Épilepsie sous traitement.
• Obstruction des voies aériennes déclenchée par manœuvres spirométriques.
• Grossesse, allaitement.
• Asthme instable.
• Pneumothorax < 2mois.
Préparation de la métacholine
La poudre de métacholine est diluée avec le sérum physiologique (NaCl 0,9%, pH = 7,4).
La solution doit être conservée à 4°C à l’abri de la lumière. Cette solution doit être réchauffée à température ambiante avant l’utilisation.
Méthode de Jan modifiée
Le nébuliseur est placé entre les dents, la nébulisation est déclenchée automatiquement ou manuellement au début de l’inspiration qui débute à la CRF et se poursuit jusqu’à la CPT, laquelle est maintenue 1 à 2 secondes.
En faisant varier la durée de chaque nébulisation et en répétant les capacités inspiratoires, on peut doubler la dose cumulative sans modifier la concentration de métacholine.
Procédure du test
Les EFR ont été réalisés grâce à un dosimètre DeVilbiss. La variable prise en compte pour la mesure de la réponse bronchique à l’administration de métacholine était le VEMS (Volume Expiratoire Maximale pendant la première seconde). Puis le test se déroule dans l’ordre précisé ci-dessous:
• Informer au patient sur le but et le déroulement du test.
• Vérifier les contre-indications pour le patient.
• Mesurer le VEMS à l’état de base des patients.
• Vérifier VEMS 75% de la théorique et VEMS > 1500 mL.
• Administration du diluant.
- Premier aérosol : 2 bouffées diluant de sérum physiologique (NaCl 0,9%).
- Mesurer le VEMS à 30 secondes et 90 secondes.
But:
* Vérifier l’absence de réactivité trop forte du sujet imposant l’arrêt du protocole, le VEMS diminué doit être moins de 10% de la valeur de l’état de base.
* Obtenir la valeur de référence de VEMS (pour les tests de provocation bronchique est la valeur obtenue avant inhalation de sérum physiologique).
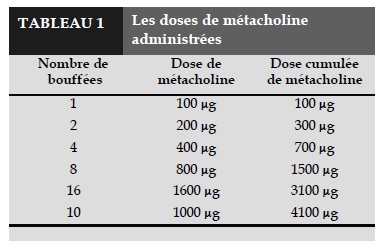
- Inhalation de métacholine (à intervalle de moins de trois minutes) selon la dose indiquée (Tableau 1).
- La dose initiale de 50 μg de métacholine pour un asthme ayant l’un ou l’autre des critères suivants: Connaissance d’une hyperréactivité majeure à un examen antérieur. Asthme instable avec une diminution du Débit Expiratoire de Point matinal. Asthme non traité. Patients sous traitement par des β bloquants.
- Mesurer le VEMS à 30 secondes et à 90 secondes après chaque inhalation. Lors du consensus de l’ATS, publié en 1999, il a été recommandé que la valeur la plus élevée du VEMS obtenue à la suite de chaque dose d’agoniste soit choisie dans le calcul de la réponse. S’il y a une chute de VEMS supérieure ou égale à 20% par rapport du VEMS de référence, on arrête le test.
Si la chute de VEMS supérieure ou égale à 15% mais inférieure à 20% du VEMS de référence, on poursuit le test mais avec dose de métacholine répétée et non doublée. Chute du VEMS ≥ 15 % mais < 20 % à 3100 µg: on administre 1000 µg supplémentaires pour atteindre une dose cumulée de 4100 µg.
Si la chute de VEMS est inférieure à 10% de la valeur de VEMS de référence, on poursuit le test en doublant la dose de métacholine selon le Tableau 1.
- Réaliser la courbe dose-réponse.
• Administrer de 2 à 4 bouffées de bronchodilatateur en spray en fin de test.
• Arrêt du protocole: plusieurs éléments imposent l’arrêt du test.
- La chute de VEMS supérieure ou égale à 20% par rapport à la valeur de VEMS de référence.
- Le test mal exécuté par défaut de coopération de la part du patient.
- Toux durant les manœuvres du VEMS empêchant l’obtention d’un VEMS fiable.
Mesure la réponse bronchique
Pour interpréter le test, il est nécessaire de prendre en considération:
• La qualité des manoeuvres spirométriques effectuées par le patient
• Les symptômes rapportés par le patient pendant le test
• L'importance et la rapidité de l'amélioration après bronchodilatateur.
Les données obtenues lors des tests sont utilisées pour construire la courbe dose –réponse. Le test est positif: lors qu’il y a une chute supérieure ou de 20% du VEMS par rapport au VEMS de référence pour une dose cumulée de métacholine inférieure ou égale à 3100 ou de 4100 μg.
Le test est négatif: la chute de VEMS est inférieure de 20% par rapport au VEMS de référence à une dose cumulée de métacholine de 3100 ou de 4100μg.
La dose de métacholine entraînant une chute de 20% du VEMS est nommée PD20 (Provocative Dose 20). PD20 est calculée par interpolation linéaire entre les deux derniers points de la courbe dose-réponse. La PD20 ne peut pas être calculée si la chute du VEMS est supérieure à 20% dès la première dose.
Analyse statistique
Les données accueillies sont analysées par les logiciels SPSS et Statas. Les VEMS, PD20, CVF sont exprimés sous forme de médianes. La comparaison des Médians ont été par le test t, ANOVA. La corrélation est mesurée par la régression linéaire. Les valeurs de p 0,05 ont été considérées comme statistiquement significatives.
RESULTATS
Description de la population étudiée
Répartition selon le sexe
Il y a au total 398 patients ont été inclus. Dans notre étude, il y a moins d’hommes que de femmes. Les femmes sont de 57,8% (230), alors que les hommes sont de 42,2% (168).
Répartition selon l’âge
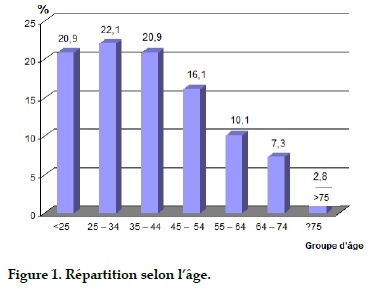
Nous avons réparti les patients par tranches de 10ans d’âge (Tableau 1), les patients dans le groupe de 25 à 34 ans sont plus nombreux (22,1%).
Répartition selon l’IMC
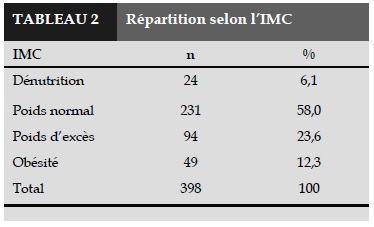
En répartissant des patients selon les différentes catégories en fonction de leur l’IMC, nous avons trouvons que la plupart des patients ont un poids normal. Il y a 23,6% de la population ayant un excès de poids et 12,3% sont obèses (Tableau 2).
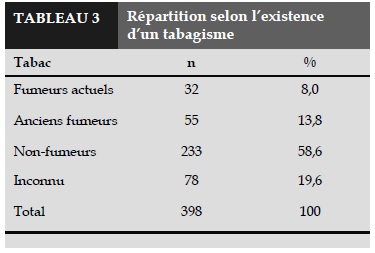
Chez les patients, 8% sont des fumeurs actuels ; 13,8% ont arrêté de fumer avant le début de notre étude, et 58,6% n’ont jamais fumé (Tableau 3).
Degré de l’HRB
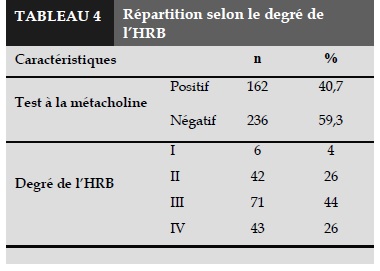
40,7% de notre population (n = 162) a eu un test positif et 59,3% (n = 236) un test négatif (Tableau 4). Nous avons ainsi identifié 4 classes de patients ayant un test positif à la métacholine se basant sur l’analyse de la courbe dose-réponse (PD20). Nous trouvons que les patients appartiennent majoritairement à la troisième classe.
Caractéristiques des groupes de patients répartis selon l’existence ou non d’une d’HRB
Les caractéristiques de la population selon la présence ou l’absence d’HRB
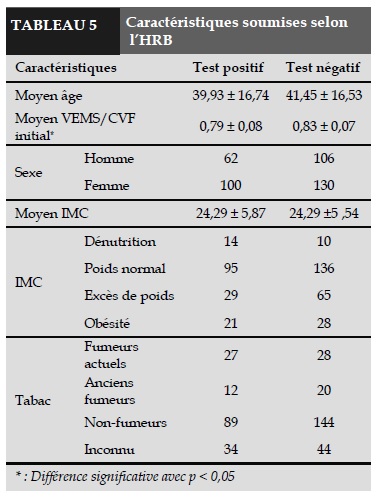
Ces patients ont été divisés en 2 groupes (Tableau 5):
- Les patients avec un test de provocation à la métacholine positif (162 patients avec 100 femmes et 62 hommes ; âge moyen : 39,93 ± 16,74).
- Les patients avec un test de métacholine négatif (236 patients avec 106 femmes et 130 hommes ; âge moyen : 41,45 ± 16,53).
Le rapport VEMS/CVF initial est significativement plus bas chez les patients dont le test est positif (n = 162; 0,79 ± 0,08) par rapport aux patients avec un test négatif (n= 236; 0,83 ± 0,07); p < 0,05.
Parmi 162 patients avec un test de métacholine positif: 14 patients étaient dans le groupe dont l’IMC < 18, 95 patients étaient normaux, 29 avaient un excès de poids, 21 étaient obèses.
27 patients sont des fumeurs actuels et 12 patients sont des anciens fumeurs.
Association entre l’excès de poids ou l’obésité et l’HRB selon le sexe
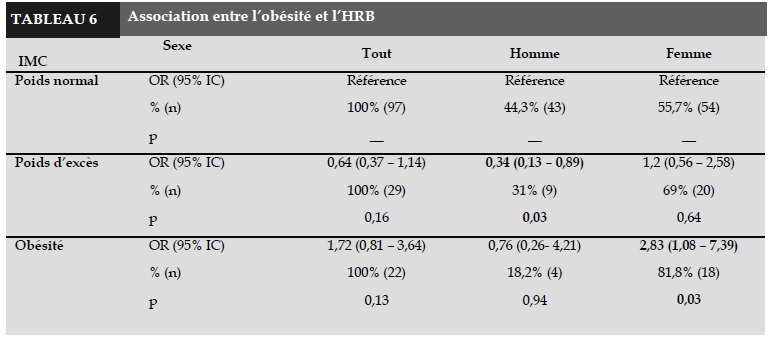
Le Tableau 6 montre qu’après avoir ajusté avec les cofacteurs (âge, tabac, le rapport de VEMS/CVF initial), les femmes obèses avaient un risque d’HRB significativement plus élevé par rapport aux femmes de poids normal (OR = 2,83 ; 95% IC = 1,08 – 7,39). Ce risque a été aussi trouvé chez des hommes ayant un excès de poids, avec OR de 0,34 (95% CI = 0,13 – 0,89), p = 0,03.
DISCUSSION
Les facteurs pathologiques (physiques) et techniques influençant les résultats du test à la métacholine
Le test de provocation à la métacholine est largement utilisé en clinique pour évaluer la présence et la gravité d’ HRB. Ce test est utile dans le diagnostic de l'asthme avec les symptômes typiques ou cohérents tandis que la fonction pulmonaire de base est normal ou avec les manifestations atypiques (toux isolé ou gêne respiratoire à l’exercice…) [3]. En plus, le test à la métacholine a l’avantage de permettre une mesure très exacte des relations entre la dose administrée et l’obstruction bronchique résultant et sont, par conséquent, facilement reproductibles.
Le comité de ATS nous a recommandé d’utiliser la méthode de dosimètre pour le test à la métacholine. Les dosimètres peuvent améliorer l'exactitude et la répétitivité de la dose livrée aux voies aériennes [2]. En plus, ce dispositif permet délivrer l’aérosol uniquement pendant la phase inspiratoire. De ce fait, le gaspillage est minimisé [10]. Donc, ils sont largement utilisés tant en clinique que dans les recherches.
Malgré ces aspects positifs, il faut signaler que nous avons noté à plusieurs facteurs pathologiques ou techniques pouvant influencer sur les réponses du test. Ceux-ci induit les résultats faux-négatifs ou faux-positifs.
Les facteurs pathologiques ou physiques
Les tests faux-positifs sont ceux qui arrivent dans les sujets qui n'ont pas d'asthme. Les tests à la métacholine faux-positifs sont plus communs que des tests faux-négatifs. Ils sont probablement observés chez les individus avec l'asthme non diagnostiqué (sous clinique) et chez les sujets ayant la rhinite. Le reste de ces résultats sera de vrais aspects faux-positifs.
Les tests faux-négatifs sont arbitrairement définis comme des tests négatifs chez les sujets avec des symptômes cliniquement actuels. Une réponse tardive peut être trouvée 2 jours après le test. C'est possible pour une réaction allergique sévère, le haut degré de sensibilité ou l’exposition fréquente ou tous les deux, provoquer la bronchoconstriction chez des patients avec la réactivité normale de voies aériennes.
Des athlètes très performants ou élites sont une exception comme dans cette situation, la bronchoconstriction est induite par l’exercice et le test d'effort peut être positif chez les sujets avec le test à la métacholine normal. Une de causes les plus populaires de test faux-négatifs serait l’utilisation des médicaments qui bloquent la réponse à la métacholine. Ce sont des antagonistes spécifiques (anticholinergiques) ou des antagonistes fonctionnelles (les ≥2-mimétiques, les corticoïdes inhalés, les antidépresseurs tricycliques, phenothiazines, les antihistamines…) [4].
Les facteurs techniques
Dans la méthode de dosimétrie, les patients sont demandés d’inspirer profondément à partir de la CRF et jusqu'à la CPT et puis de faire l’apnée de 5 secondes au niveau de CPT après chaque palier alors que le sujet respire calmement pendant 2 minutes sous le masque d’aérosol dans l’autre méthode. Donc, cet acte est un facteur bronchoprotecteur potentiel et peut produire un test faux-négatif chez les sujets avec l’asthme et l’HRB légères [4]. Les causes nous paraissent susceptibles d’être prises en considération lors de l’interprétation de résultats sont le fonctionnement du système de nébuliseur ; la compétence de techniciens ; la qualité de métacholine.
La mauvaise adaptation entre le canistier et l’embout buccal et /ou mauvais fonctionnement de la valve doseuse peuvent être d’expliquer les anomalies de fonctionnement du système. La production de nébuliseur varie du modèle au modèle et de l'unité à l'unité et peut varier avec le temps comment le nébuliseur est maintenu et nettoyé [11].
La production réelle de chaque nébuliseur utilisé doit être mesurée initialement et à intervalles réguliers. Parce que la performance de nébuliseur peut dans quelque temps varier selon l'utilisation individuelle de laboratoire, la maintenance et des pratiques se nettoyant, chaque laboratoire devrait établir le programme contrôlant son nébuliseur.
Les exigences d’entraînement ou de qualification des techniciens doivent être standardisées pour assurer des résultats de bonne qualité et la sécurité de patient [2]. Parmi les facteurs de mauvaise utilisation, la mauvaise coordination de patient et la corrige de façon satisfaisante de l’investigateur doit être comptée [5].
Recommandations
Aux termes de cette étude, nous recommandons:
• Contrôler régulièrement la performance du système de nébuliseur.
• Etablir et standardiser les exigences de traînement ou de qualification des techniciens.
• L’enregistrement des symptômes actuels.
• La connaissance des médicaments que les patients ont utilisé avant le test.
• Tenir compte les valeurs de VEMS et VEMS/CVL avant le test.
• Vérifier les contre-indications pour la sécurité de patient.
• Informer au patient sur le but et le déroulement du test.
• La coopération de patient.
• Avant d’utiliser, l’essai du fonctionnement de dosimètre et de l’adaptation entre le canistier et l’embout buccal.
• Vérifier la qualité de métacholine utilisant pendant le test.
• Le respect du protocole (choisir la valeur de VEMS)
• Bien nettoyer le nébuliseur après chaque fois d’ utilisation.
• Réaliser plus d’études pour résoudre le problème de la méthode de dosimètre récemment identifié comme la cause d'une haute proportion de tests faux -négatifs.
L’association entre l’hyperréactivité bronchique non spécifique et l’obésité
La relation entre l'obésité et l'HRBNS fait l’objet de nombreuses études. En effet, Chinn et coll. ont trouvé cette association chez 11277 participants à l'étude ECRHS (European Community Respiratory Health Survey) [9], Akshay et coll. ont obtenu le même résultat en réalisant une étude chez 1141 adultes obèses aux Etats - Unis en 2004 [7].
Plusieurs mécanismes ont été proposés pour expliquer cette corrélation
Le premier facteur incriminé est purement mécanique: chez les personnes obèses, l’expansion des poumons est limitée et les volumes pulmonaires notamment la capacité résiduelle fonctionnelle (le volume gazeux présent dans les voies aériennes à la fin d’une expiration normale en ventilation calme) diminue par rapport à celui des sujets normaux [12]. Ces conditions favorisent l’augmentation de l’obstruction des voies aériennes sous l’effet des stimulants physiques ou pharmacologiques (un facteur connu dans HRB) [12].
La respiration aux volumes courants inférieurs induit les réponses contractiles plus grandes des cellules musculaires lisses des voies aériennes [13]. En plus, le petit volume pulmonaire chronique pourrait aussi provoquer le remodelage de la paroi des voies aériennes, en raison de la réorganisation de la matrice extracellulaire ou peut-être en raison des processus uniques à l'obésité lui-même, qui pourrait provoquer un épaississement de la paroi des voies aériennes. En effet, les remaniements de la paroi bronchique sont un mécanisme crucial dans l’HRB.
De plus, les chercheurs suspectent que les tissus adipeux peuvent être à l’origine d’un état inflammatoire chronique, ce qui peut affecter les cellules musculaires lisses des voies aériennes, et causer leur rétrécissement excessif [12]. Ce mécanisme pourrait lier au régime, particulièrement avec des données récentes qui montrent que le fait de manger beaucoup de graisses puissent être associé tant avec l’HRB qu'avec l'asthme [14].
On sait actuellement que l'inflammation systémique est caractérisée par une augmentation de la présence des protéines réactives C (CRP) [12]. La production de CRP est réglée par des cytokines, principalement par l'interleukine 6 (IL-6) et le taux sanguin de CRP reflète l'activité de l’IL-6 chez l'homme. Il a été démontré in vivo que l’IL-6 est sorti par les tissus adipeux sous-cutanés et est ainsi capable d'avoir des effets inflammatoires systémiques, surtout chez des sujets obèses [15].
Parmi les causes possibles, les auteurs suggèrent qu’un déséquilibre hormonal consécutif à l’accumulation de graisses puisse aussi jouer un rôle important. En effet, la leptine - la protéine codée par le gène OB - provoque l'augmentation de l'activité phagocytaire de macrophages et de la production des cytokines pro-inflammatoires comme le TNFα, l’IL-6 et l’IL12 [12]. Ces cytokines pro- inflammatoires contribuent à l'inflammation des voies aériennes dans l’asthme et fournissent un mécanisme possible dans l’HRB chez les obèses [12]. De plus, la découverte que la leptine augmente les réponses inflammatoires immunitaires chez les souris mutées pour le gène OB renforce cette hypothèse [12]. Par ailleurs, une autre hormone produite par les tissus adipeux, l’adiponectine, est dotée des propriétés anti-inflammatoires, se trouve en quantité réduite chez les obèses [16]. Le rôle protégé de cette hormone dans les processus d’inflammation est donc diminué en cas d’augmentation d’IMC ce qui favorise le développement d’une HRB.
Un autre argument vient du fait que les personnes obèses ont des activités physiques diminuées par rapport aux sujets de poids normal. La vie sédentaire favorisant le fait de passer plus de temps à l'intérieur de la maison aboutissent à une exposition plus fréquente aux allergènes de domicile comme poussières, acariens [14]. Ce contact favorise une HRB spécifique notamment chez des sujets atopiques.
L’obésité peut en effet altérer la fonction respiratoire de plusieurs manières, dont les mécanismes restent encore mal compris. Signalons l’étude australienne de Schater et coll. montrant qu’il existe une relation entre l'obésité et les symptômes de l'asthme mais pas avec l'HRB [15].
Dans cette étude, nous n’avons pas trouvé d' augmentation de risque d’HRB ni chez les personnes ayant un excès de poids ni chez les obèses. Mais ce risque ne peut pas être formellement exclu, compte tenu du nombre relativement faible des sujets inclus (n = 398) dans notre étude.
La relation entre l’HRB et l'atopie, l’âge et le tabac a été bien étudiée. C’est pourquoi, nous avons ajusté les cofacteurs (âge, tabac, le ratio de VEMS/CVF initial) pour éviter l’influence de ces facteurs sur les résultats. Dans cette étude, nous avons trouvé qu’ après avoir ajusté avec les cofacteurs (âge, tabac, le ratio de VEMS/CVF initial), les femmes obèses avaient un risque d’HRB significativement plus élevé par rapport aux femmes avec un poids normal (OR = 2,83 ; 95% IC = 1,08 – 7,39). Il n’existe pas de différence significative selon sexe dans le groupe des sujets obèses, probablement dû au petit nombre de patients dans ce groupe (22 patients avec 4 hommes et 18 femmes). Nos résultats correspondent à ceux des études précédentes qui ont montré que la surcharge pondérale et l’obésité étaient associées à l’augmentation du risque d’HRB chez les femmes mais pas chez les hommes. En revanche, deux autres études ont trouvé à la fois chez les hommes et chez les femmes avec une prévalence d‘HRB accrue parallèlement à l'augmentation de l’IMC plus nette chez les hommes que chez les femmes [8, 17].
Bien que les recherches portant sur les mécanismes de la corrélation entre l’HRB et la surcharge pondérale chez les femmes aient progressé ces dernières années, il reste encore des pointsnon résolus sur ce sujet.
Une des explications possibles de cette association est que le calibre des voies aériennes des femmes est plus petit que celui des hommes [7]. Ce mécanisme peut-être exclu car nos résultats sont ajustés avec le rapport de VEMS/CVF initial, indice présentant le calibre des voies aériennes.
Cela peut également être dû à une incidence et une prévalence d'asthme plus élevées chez les femmes que chez les hommes. Ainsi, les hommes ayant un excès de poids avec des symptômes respiratoires et un tabagisme révolu ou actuel pourraient probablement être moins diagnostiqués d'asthme que les femmes en surcharge pondérale avec des symptômes respiratoires et non tabagiques [8].
Les voies aériennes des femmes sont influencées par leurs hormones sexuelles et aussi par les fluctuations cycliques de ces dernières [2]. Havelock Ellis a formulé l’hypothèse, il y a plus d'un siècle, que les voies aériennes sont parmi les organes porteurs de caractéristiques sexuelles secondaires. Dans l'obésité, les concentrations d'œstrogène sont augmentés à cause de l'aromatisation périphérique de l'androstènedione à l'oestrone et la testostérone à l'œstrogène dans le stroma de tissu adipeux [18]. En plus, la diminution de l'hormone sexuelle combinée avec la globuline trouvée dans l'obésité aboutit à l'amplification de l’effet des œstrogènes sur des tissus sensibles [12]. En fait, pendant les cycles menstruels, des niveaux maximaux d'œstrogènes ont été associés aux symptômes accrus d’HRB et la diminution de la fonction pulmonaire chez les femmes asthmatiques [7].
La réactivité des voies aériennes chez les femmes post-ménopausiques diminue par rapport aux femmes pré-ménopausiques [16], et cette réaction augmente en cas de l’utilisation des hormones de substitution(10). Quelques études ont aussi montré que l’œstrogène provoque la production accrue d'IL4 et d’IL-13 de monocytes et augmente la réaction inflammatoire des éosinophiles et le taux sanguin de leptine qui peut être associés au développement d’HRB chez les femmes [12]. Dans cette étude, nous avons aussi trouvé que cette corrélation était significative parmi les hommes ayant un excès de poids. Mais, cette corrélation était trop faible avec un OR de 0,34 (95% CI = 0,13 – 0,89) (p < 0,03). D’après notre étude, il semble que l’ augmentation de IMC chez les hommes est un facteur protecteur contre l’asthme. La limite de notre étude vient du fait que dans les études transversales, telle que la notre, il est difficile d’affirmer le facteur causal entre deux paramètres étudiés. En effet, chez les femmes, la surcharge pondérale peut entraîner l’HRB, mais à l’inverse les sujets asthmatiques peuvent devenir obèses à cause de la maladie, suite à la diminution des activités physiques ou par l’effet d’un traitement par corticoïdes.
CONCLUSION
L’étude de 398 dossiers de patients ayant eu un test de provocation bronchique à la métacholine dans le Service de Physiologie-Explorations Fonctionnelles de l’hôpital Cochin nous a permis de formuler les conclusions suivantes: 1) Il existe une relation entre l’obésité et l’HRB: les femmes obèses et les hommes ayant un excès de poids avaient un risque d’HRB significativement plus élevé par rapport aux sujets ayant un poids normal. Cependant, cette relation est néanmoins plus nette chez les femmes que chez les hommes. 2) Malgré la disponibilité répandue pendant beaucoup d'années, il semble que les résultats de test à la métacholine sont fréquemment mal interprétés. Il y a un certain nombre d'avertissements qui sont souvent oubliés ou oubliés qui est important dans l'interprétation de test à la métacholine.
Remerciement
Les auteurs remercient les Dr N.N. Le-Dong et T. HuaHuy pour leurs aides, et le Pr A.T. Dinh-Xuan pour sa direction dans la recherche.
CONFLIT D’INTERETS
Aucun.
REFERENCES
1. Bricard C, Floret E, Delecluse P, Boury E. Hyperréactivité bronchique non spécifique et test de provocation à la métacholine, Lyon Pharmaceutique 2001; 52, 166-181.
2. American Thoracic Society. Guideline for methacholine and exercise challenge testing. Am J Respir Crit Care Med1999; 161: 309-329.
3. Lockhart A., Malo J.-L. Hyperréactivité bronchique: Définition(s) et historique. Rev Mal Respir 1994; 11: 85-92.
4. Donald W., Cockcroft, MD, FRCP(C). Methacholine challenge. Clin Pulm Med 2007; 14: 1-6
5. Roche N: Aérosol-doseur de métacholine dans les tests de provocation bronchique non spécifique, Thèse de Médecine - Université Paris 7. 1994.
6. Neukirch F, Cartier A. Mesure de l’hyperréactivité bronchique en épidémiologie. Rev Mal Respir 1994; 11: 101-109.
7. Sood A, Beth K, Eid W, Eagleton LE, Henkle JQ, Hopkins-Price P. Obesity is associated with bronchial hyperreponseveness in women, J Asthma 2005; 42: 847-52.
8. Litonjua AA, Sparrow D, Celedon JC, DeMolles D, Weiss ST. Association of body mass index with the development of methacholine airway hyperresponsiveness in men: the Normative Aging Study. Thorax 2002; 57: 581-585.
9. Jarvid D, Chinn S, Burney P. Association of body mass index with respiratory symptoms and atopy: results from European Community Respiratory Heath Survey. Clin Exp Allergy 2002; 32: 831-837.
10. Bertrand Dautzenberg, Patrice Diot. L’aérosolthérapie par nébulisation. Editions Margaux Orange.
11. Merkus, P. J. F. M., E. E. M. van Essen-Zandvliet, E. Parlevliet, G. Borsboom, P. J. Sterk, K. F. Kerrebijn, and P. H. Quanjer. Changes of nebulizer output over the years. Eur Respir J 1992; 5: 488–491.
12.King GG, Brown NJ, Diba C, and all. The effets of body weight to calibre. Eur Respir J 2005; 896-901.
13. Pin J, Godard P. Mécanisme de l’hyperréactivité bronchique: Rôle de l’inflammation des voies aériennes et de l’atopie. Rev Mal Respir 1994; 11: 111-122.
14. Mansell Al, Walders N, Wamboldt MZ, Carter R, Steele DW, Devin JA, Monica TH, Miller AL, Wamboldt FS. Effect of body mass index on response to methacholine bronchial provocation in healthy and asthmatic adolescents. Ped Pulmonol 2006; 41:434–440.
15. Schachter LM, Salome CM, Peat JK, Woolcock AJ. Obesity is a risk for asthma and wheeze but not airway hyperresponsiveness. Thorax 2001; 56: 4-8.
16. Carlos A, Camargo, Sotte T. Prospective study of body mass index, weight change and risk of Adult-onset asthma in women. Arch Intern Med 1999; 159: 2582-9.
17. Chinn S. Asthma and obesity: where are we now? Thorax 2003; 58: 1008-1010.
18. Beuther DA, Sutherland ER. Overweight, Obesity, and Incident Asthma, A Meta-analysis of Prospective Epidemiologic Studies. Am J Respir Crit Care Med 2007; 175: 661–666.
FIGURE/TABLES
REFERENCES
1. Bricard C, Floret E, Delecluse P, Boury E. Hyperréactivité bronchique non spécifique et test de provocation à la métacholine, Lyon Pharmaceutique 2001; 52, 166-181.
2. American Thoracic Society. Guideline for methacholine and exercise challenge testing. Am J Respir Crit Care Med1999; 161: 309-329.
3. Lockhart A., Malo J.-L. Hyperréactivité bronchique: Définition(s) et historique. Rev Mal Respir 1994; 11: 85-92.
4. Donald W., Cockcroft, MD, FRCP(C). Methacholine challenge. Clin Pulm Med 2007; 14: 1-6
5. Roche N: Aérosol-doseur de métacholine dans les tests de provocation bronchique non spécifique, Thèse de Médecine - Université Paris 7. 1994.
6. Neukirch F, Cartier A. Mesure de l’hyperréactivité bronchique en épidémiologie. Rev Mal Respir 1994; 11: 101-109.
7. Sood A, Beth K, Eid W, Eagleton LE, Henkle JQ, Hopkins-Price P. Obesity is associated with bronchial hyperreponseveness in women, J Asthma 2005; 42: 847-52.
8. Litonjua AA, Sparrow D, Celedon JC, DeMolles D, Weiss ST. Association of body mass index with the development of methacholine airway hyperresponsiveness in men: the Normative Aging Study. Thorax 2002; 57: 581-585.
9. Jarvid D, Chinn S, Burney P. Association of body mass index with respiratory symptoms and atopy: results from European Community Respiratory Heath Survey. Clin Exp Allergy 2002; 32: 831-837.
10. Bertrand Dautzenberg, Patrice Diot. L’aérosolthérapie par nébulisation. Editions Margaux Orange.
11. Merkus, P. J. F. M., E. E. M. van Essen-Zandvliet, E. Parlevliet, G. Borsboom, P. J. Sterk, K. F. Kerrebijn, and P. H. Quanjer. Changes of nebulizer output over the years. Eur Respir J 1992; 5: 488–491.
12.King GG, Brown NJ, Diba C, and all. The effets of body weight to calibre. Eur Respir J 2005; 896-901.
13. Pin J, Godard P. Mécanisme de l’hyperréactivité bronchique: Rôle de l’inflammation des voies aériennes et de l’atopie. Rev Mal Respir 1994; 11: 111-122.
14. Mansell Al, Walders N, Wamboldt MZ, Carter R, Steele DW, Devin JA, Monica TH, Miller AL, Wamboldt FS. Effect of body mass index on response to methacholine bronchial provocation in healthy and asthmatic adolescents. Ped Pulmonol 2006; 41:434–440.
15. Schachter LM, Salome CM, Peat JK, Woolcock AJ. Obesity is a risk for asthma and wheeze but not airway hyperresponsiveness. Thorax 2001; 56: 4-8.
16. Carlos A, Camargo, Sotte T. Prospective study of body mass index, weight change and risk of Adult-onset asthma in women. Arch Intern Med 1999; 159: 2582-9.
17. Chinn S. Asthma and obesity: where are we now? Thorax 2003; 58: 1008-1010.
18. Beuther DA, Sutherland ER. Overweight, Obesity, and Incident Asthma, A Meta-analysis of Prospective Epidemiologic Studies. Am J Respir Crit Care Med 2007; 175: 661–666.
ARTICLE INFO
DOI: 10.12699/jfvp.3.6.2012.32
Conflict of Interest
Non
Date of manuscript receiving
12/7/2011
Date of publication after correction
15/01/2012
Article citation
Tran Thi Diem T,Duong-Quy S. Development of methacholine challenge test: its application in obesity. J Func Vent Pulm 2012;03(06):32-40.