
 English
English
 French
French
Cancer bronchique chez les non-fumeurs
Lung cancer in non-smokers
C. Clément-Duchêne, Y. Martinet
Service de Pneumologie. CHU Nancy - France
Corresponding author
Dr C. Clément-Duchêne
Service de Pneumologie, CHU Nancy. France
E-mail: c.clement-duchene@chu-nancy.fr
DOI: 10.12699/jfvp.2.4.2011.15
ABSTRACT
The main etiology of lung cancer is smoking. However, the lung cancer in non-smokers is a major problem of public health. The main causes of lung cancer among non-smokers are still unknown, but passive smoking, radon exposure, the occupational and environmental exposures and some viruses may be involved.
Lung cancer in non-smokers has the epidemiological and clinical specificities , with more frequent in women and Asian ethnic, and adenocarcinoma predominating. Lung cancer in non-smokers also has properly molecular characteristics such as mutations of EGFR, EML4 ALK-, K-ras, and p53. Finally, non-smokers with lung cancer have a better response to treatment and better survival than smokers.
All these characteristics suggest that the lung cancer in non-smokers is a distinct disease from that of the smokers. We will conduct a literature review on these epidemiological, clinical and therapeutic differences.
KEYWORDS: lung cancer, non-smokers, EGFR, tyrosine kinase inhibitors
RÉSUMÉ
La principale étiologie de cancer bronchique est la consommation de tabac. Cependant, le cancer bronchique du nonfumeur est un problème important de santé publique. Les principales causes de cancer bronchique chez les non-fumeurs sont encore inconnues, mais le tabagisme passif, l’exposition au radon, les expositions professionnelles et environnementales et certains virus peuvent être impliqués.
Le cancer bronchique du non-fumeur a des spécificités épidémiologiques et cliniques, avec plus de femmes, plus d’adénocarcinome et plus d’Asiatiques. Le cancer bronchique du non-fumeur a aussi des caractéristiques moléculaires comme les mutations EGFR, EML4-ALK, K-ras et p53. Enfin, les non-fumeurs atteints de cancer bronchique ont une meilleure réponse aux traitements et une meilleure survie que les fumeurs.
Toutes ces caractéristiques suggèrent que le cancer bronchique du non-fumeur est une pathologie distincte de celle du fumeur. Nous allons effectuer une revue de la littérature sur ces différences épidémiologiques, cliniques et thérapeutiques.
MOTS CLES: cancer bronchique, non-fumeurs, EGFR, inhibiteurs de tyrosine kinases
INTRODUCTION
Le cancer bronchique est la première cause de cancer dans le monde [1, 2]. La consommation de tabac reste le principal facteur de risque. Mais 25 % des cancers bronchiques dans le monde, 15 % des cancers bronchiques chez les hommes et 53 % chez les femmes ne sont pas attribuables au tabac [2-4]. Dans la plupart des études, le terme « non-fumeurs » désigne un patient qui a fumé moins de 100 cigarettes tout au long de sa vie.
Les causes de cancer bronchique chez les nonfumeurs sont toujours mal connues, et des études récentes suggèrent que le cancer bronchique du fumeur et du non-fumeur sont 2 entités distinctes [4, 5]. Des différences cliniques et biologiques ont été identifies entre fumeurs et non-fumeurs, ainsi que les réponses à la chimiothérapie. Les non-fumeurs sont le plus souvent des femmes, asiatiques, avec une histologie de type adénocarcinome et porteurs de mutations EGFR (Epidermal Growth Factor Receptor). Il y a également des différences dans la survie entre fumeurs et non-fumeurs, avec une meilleure survie pour les non-fumeurs dans la plupart des études [6].
EPIDEMIOLOGIE
Certaines études rapportent une incidence augmentée du cancer bronchique chez les non-fumeurs mais ces données sont très difficiles à vérifier [7-10]. L’incidence actuelle du cancer bronchique chez les non-fumeurs est difficile à estimer en raison d’un manque de données concernant le tabagisme dans la plupart des registres. Wakelee et al. ont analysé les données de patients inclus dans 6 études de cohorte (5 américaines et une suédoise) et ont trouvé que les taux d’incidence du cancer bronchique chez les nonfumeurs pour 100 000 personnes-années étaient de 11,2-13,7 pour les hommes et de 15,2-20,8 pour les femmes [11].
Les données de la littérature sur l’incidence globale du cancer bronchique chez les non-fumeurs sont limitées. Une étude européenne ayant inclus une cohorte de travailleurs suédois de sexe masculin dans le secteur du bâtiment a estimé que l’incidence du cancer bronchique chez 143 998 hommes nonfumeurs entre 1971 et 1992 et a analysé les tendances au cours du temps. Les données d’incidence du cancer pour la période 1971-1995 ont été obtenues via le registre national des cancers. Dans cette étude, les taux ont augmenté de 1,5/100 000 en 1976-1980 à 5,4/100 000 en 1991-1995 [12].
Aux Etats-Unis, une étude rétrospective a inclus 11 969 patients (8 762 exfumeurs et fumeurs actifs et 942 non-fumeurs) avec un cancer bronchique non à petites cellules (CBNPC) à partir du programme de surveillance du cancer de 3 comtés de Californie du Sud de 1995 à 2003 et a montré que le taux de carcinome bronchioloalvéolaire (BAC) et de CBNPC chez les non-fumeurs avait augmenté entre la période 1995-1999 (19,4 % pour les BAC, et 8,6 % pour les autres CBNPC) et la période 1999-2003 (26,2 % pour les BAC et 9,4 % pour les autres CBNPC) [13]. Dans cette étude, il y avait une plus grande proportion de non-fumeurs dans le groupe des BAC comparé aux autres CBNPC (23 % vs 9 %, p=0.0001). L’incidence du cancer bronchique chez les non-fumeurs augmente également dans les stades précoces. Yano et al. ont montré que le pourcentage de cancers bronchiques opérables chez les non-fumeurs avait augmenté de 15,9 % à 32,8 % entre 1970 et 2000 [14].
A l’opposé, 2 études de cohorte de l’American Cancer Society Cancer Prevention Study ont mesuré les taux spécifiques de décès par cancer bronchique par âge, sexe et race (pour 100 000 personnes-années) chez plus de 940 000 non-fumeurs entre 1959 et 1979 et entre 1982 et 2000, mais aucune augmentation significative d’incidence du cancer bronchique n’a été retrouvée [15]. Il y avait une légère augmentation de la mortalité ajustée sur l’âge chez les femmes nonfumeuses ayant un cancer bronchique (12,3 à 14,7 pour 100,000), et cette augmentation était significative seulement chez les femmes âgées de 70 à 84 ans. Il n’y avait aucun changement dans les taux de mortalité chez les hommes au cours du temps. En Angleterre, la comparaison de 2 études cas-témoins entre 1950 et 1990 n’a pas montré d’augmentation de l’incidence du cancer bronchique chez les hommes non-fumeurs, mais le pourcentage de non-fumeurs chez les sujets témoins avait augmenté de 4,5% à 19 % [16].
La question de savoir si l’incidence du cancer bronchique chez les non-fumeurs a augmentée ou non reste contre-versée. De plus, toutes ces études ont inclus des patients qui rapportaient eux-mêmes le statut tabagique. Mais, les études ont montré qu’il y avait un faible taux d’erreur de classification des fumeurs et donc le fait de rapporter soi-même son statut tabagique ne doit pas avoir un impact important sur la qualité des informations [17, 18].
FACTEUR DE RISQUE
Les causes de cancer bronchique chez les nonfumeurs restent inconnues, mais l’exposition au tabagisme passif, l’exposition au radon, les expositions professionnelles et environnementales, les facteurs nutritionnels, certains virus, les antécédents de pathologies respiratoires, les facteurs hormonaux et certains facteurs génétiques ont été étudiés comme des causes potentielles.
Facteurs nutritionnels
Les facteurs nutritionnels sont reconnus comme une cause possible de cancer bronchique. La prise de fruits et légumes pourrait être protectrice vis-à-vis du cancer bronchique et la consommation de viande pourrait être un facteur de risque [19-21], mais l’ensemble des données sur ces facteurs reste limité.
Exposition au tabagisme passif
Il existe beaucoup plus de données indiquant que l’exposition au tabagisme est un important facteur de risque chez les non-fumeurs. Certaines études rapportent que 15 à 35 % des cancers bronchiques sont attribuables à l’exposition au tabagisme passif [22-25]. Les premiers rapports d’une possible association entre tabagisme passif et cancer bronchique datent de 1981, avec 2 études [26, 27]. Depuis, plus de 50 études ont confirmé ce lien entre tabagisme passif et cancer bronchique chez les non-fumeurs [28]. Une étude cas-témoins ayant inclus 71 cancers bronchiques et 238 contrôles, tous non-fumeurs, a montré une association significative entre cancer bronchique et exposition au tabagisme passif résidentiel (OR=2,09 [1,02-4,28]) et entre cancer bronchique et exposition au tabagisme passif d’origine professionnelle (OR=1,91 [0,58-6,36]) [29].
Une autre étude cas-témoins a observé la même association entre cancer bronchique chez les non-fumeurs et exposition au tabagisme passif résidentiel (OR=1,2 [0,71,9]), professionnel (OR=1,6 [0,9-2,9]) et résidentiel+professionnel (OR=2,6 [1,0-6,5]) [30], à noter que seule l’association des 2 types de tabagisme passif était significative. Une étude de cohorte asiatique a comparé 504 femmes non-fumeuses avec un cancer bronchique avec 601 femmes non-fumeuses sans maladie, et a trouvé que l’exposition au tabagisme passif résidentiel pouvait être liée au cancer bronchique (OR=1,1 [0,8-1,5]) [31]. Hu et al. [20] ont observé une relation entre le cancer bronchique chez les nonfumeurs et l’intensité de l’exposition résidentielle ou professionnelle au tabagisme passif, avec un risque augmenté si l’intensité augmente (OR=0,7 ; 1,2 et 1,5 pour 1-16 ans, 17-30 ans et plus de 31 ans, respectivement).
Facteurs génétiques
Seuls 10 % à 20 % des fumeurs auront un cancer bronchique, donc les individus ont des susceptibilités différentes. Une étude a inclus 257 non-fumeurs avec un diagnostic de cancer bronchique et âgés de 40 à 84 ans et 277 non-fumeurs témoins entre 1984 et 1987 [32]. Dans cette étude, le cancer bronchique était plus fréquent chez les patients avec une histoire familiale de cancer bronchique (OR=7,2 [0,5-10,3]). Une étude japonaise a inclus 102 255 patients dont 791 cancers bronchiques diagnostiqués et a observé que les antécédents familiaux de cancer bronchique augmentaient le risque de cancer bronchique (HR=1,95), surtout chez les femmes (HR=2,65), surtout chez les non-fumeurs (HR=2,48) et pour les carcinomes épidermoïdes (HR=2,79) [33]. Une autre étude cas-témoins a montré qu’il y avait un excès de risque de cancer bronchique de 25 % chez les parents de premier degrés, en particulier les parents de patients qui développaient un cancer bronchique à un âge plus jeune [34].
Une étude Américaine a enrôlé 806 patients et leurs familles, et a trouvé que le risque de cancer bronchique était augmenté quand il existait une histoire familiale de cancer bronchique (HR=1,85) [35]. Un locus de susceptibilité a été identifié sur le chromosome 6q23-25 [36]. Une étude canadienne a inclus 445 cancers bronchiques et 523 témoins non-fumeurs et a observé un risque augmenté de cancer bronchique chez les non-fumeurs ayant des antécédents familiaux de cancer bronchique (OR=1,8 [1,0-3,2]) [37]. D’autres explications sur un lien génétique du cancer bronchique pourraient être les mutations de la voie de l’EGFR, le polymorphisme des cytochromes p450 (CYP1A1) et des glutathione-S-transférases et la capacité de réparation de l’ADN [4]. Gorlova et al. [38] ont montré dans une étude ayant inclus 219 cancers bronchiques et 309 contrôles que le niveau de réparation de l’ADN était associé au risque de cancer bronchique. Les patients exposés au tabagisme passif et qui ont un niveau plus faible de réparation de l’ADN ont un risque de cancer bronchique 4 fois plus important.
Facteurs hormonaux
Les facteurs hormonaux peuvent influencer les causes de cancer bronchique chez les femmes nonfumeuses. Certains auteurs ont montré qu’une ménopause précoce était associée avec un risque diminué de cancer bronchique [39]. Le risque du traitement hormonal substitutif reste non clarifié avec certaines études rapportant un risque augmenté de cancer bronchique chez les femmes utilisant cette thérapeutique, d’autres études rapportant un risque de cancer bronchique diminué et d’autres études ne retrouvant aucun impact du traitement hormonal substitutif sur le risque de cancer bronchique [40-43].
Expositions professionnelles et environnementales
Les expositions professionnelles et environnementales comme l’amiante, la silice, le radon, l’arsenic, les pesticides et les solvants sont liées au cancer bronchique chez les non-fumeurs [44]. Une étude européenne qui a inclus 650 non-fumeurs avec un cancer bronchique (509 femmes et 141 hommes) et 1 542 contrôles (1 011 femmes et 531 hommes) a observé que 28 % des hommes et 9 % des femmes, étaient exposés à un cancérigène d’origine professionnelle [45].
Les polluants intérieurs sont d’autres causes de cancer bronchique chez les non-fumeurs. Des études asiatiques ont mis en évidence que l’exposition aux vapeurs d’huiles de cuisine et de charbon augmente le risque de cancer bronchique chez les non-fumeurs [46-53]. L’étude de Hu et al. a mis en évidence un risque augmenté de cancer bronchique chez des femmes non-fumeuses porteuses d’un cancer bronchique et exposées aux vapeurs d’huiles de cuisine (OR=2,4 [1,3-4,4]) [20]. Une autre étude asiatique a inclus 224 hommes et 92 femmes en Chine, et a trouvé un risque augmenté de cancer bronchique avec l’exposition aux huiles de cuisine dans les 2 sexes (OR=2,1 [1,2-3,8] pour les hommes et OR=3,6 [1,49,3] pour les femmes) [54].
Pathologies respiratoires associées
Certaines études ont montré un lien entre cancer bronchique et asthme, antécédent d’irradiation, bronchite chronique, fibrose pulmonaire idiopathique et tuberculose [28, 55]. Hinds et al. ont inclus 211 femmes ayant un cancer bronchique et ont trouvé que les femmes non-fumeuses et ayant une tuberculose avaient environ 8 fois plus de risque d’avoir un cancer bronchique [56].
Radon
L’exposition au radon est une autre cause de cancer bronchique chez les non-fumeurs. Lubin et al. dans une cohorte de mineurs d’uranium ont trouvé une relation entre exposition au radon et cancer bronchique [57]. L’exposition au radon d’origine résidentielle peut être associée au cancer bronchique [58], cependant certaines études réfutent cette association [59]. Darby a montré, dans une méta-analyse de 13 études cas-témoins, un risque augmenté de cancer bronchique chez les non-fumeurs de 10,6 % en relation avec une exposition au radon [60]. De même, Krewski et al. ont observé un risque augmenté de cancer bronchique chez les non-fumeurs de 10 % en relation avec une exposition au radon dans une méta-analyse de 7 études cas-témoins [61].
Virus
Le rôle du Human papillomavirus (HPV) dans le cancer bronchique a été explore dans de nombreuses études [62]. Dans une étude à Taiwan, HPV était plus fréquemment identifié chez les patients avec un cancer bronchique par rapport à des contrôles (55 % vs 27 %), en particulier chez les femmes âgées sans histoire de tabagisme [63]. Cependant, une autre étude n’a pas montré cette association.
Lim et al. ont inclus 110 CBNPC et ont essayé d’identifier HPV ou le virus Epstein Barr (EBV) mais sans succès [64]. Un autre virus, le virus Jaasiekte sheep retrovirus (JSRV) provoque une maladie ressemblant à un BAC chez les chèvres. La recherche de ce virus et la relation de celui-ci avec le cancer bronchique chez les humains est en cours d’étude [65].
ASPECTS CLINIQUES ET SURVIE
Aspects cliniques
Le cancer bronchique des non-fumeurs est différent de celui des fumeurs dans de multiples aspects cliniques. Beaucoup d’études ont montré que les nonfumeurs étaient plus jeunes au moment du diagnostic de cancer bronchique [11], même si des cohortes récentes réfutent cette observation [66, 67]. La plupart des études ont trouvé un plus haut taux de femmes parmi les non-fumeurs qui développent un cancer bronchique [2, 4, 11, 68]. L’étiologie de cette observation est inconnue, mais peut-être que les femmes sont plus exposées au tabagisme passif et ont une susceptibilité au cancer bronchique différente de celle des hommes.
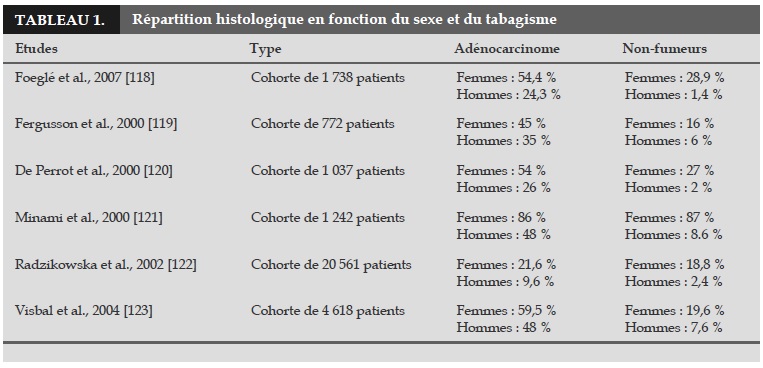
Le cancer bronchique des non-fumeurs est souvent diagnostiqué à un stade plus avancé que chez les fumeurs, mais d’autres études doivent être menées pour le confirmer [4, 68]. L’adénocarcinome est le type histologique le plus fréquent chez les nonfumeurs (Tableau 1) [5, 66, 67, 69], alors que le carcinome épidermoïde et le carcinome à petites cellules sont plus fréquents chez les fumeurs.
Une étude rétrospective de 41 836 femmes en Iowa, âgées de 55 à 69 ans, avec un suivi de 1986 à 1998, a inclus une analyse selon les types histologiques [70] et a montré que l’adénocarcinome était plus souvent associé à l’exposition au tabagisme passif que les carcinomes épidermoïde et à petites cellules (OR=19 pour l’adénocarcinome, OR=3 pour le carcinome épidermoïde et OR=2 pour le carcinome à petites cellules). Une étude menée par Cerfolio et al. a inclus 730 patients (562 fumeurs et 168 non-fumeurs) et a rapporté que les non-fumeurs étaient plus jeunes (p=0.04), plus souvent des femmes (p=0.01), plus symptomatiques au moment du diagnostic (p<0.001) et avaient plus souvent des histologies faiblement différenciées (p=0.04) [71].
Wakelee et al. dans leur étude de 6 cohortes ont observé que les non-fumeurs avec un cancer bronchique étaient plus jeunes que les patients fumeurs avec la même pathologie [11]. Muscat et al. ont analyse les données de patients ayant un cancer bronchique et ont inclus 3 756 hommes (1 461 ex-fumeurs et 113 non-fumeurs) et 2 098 femmes (1 207 exfumeuses et 182 non-fumeuses) et ont montré que pour les femmes, les non-fumeurs étaient plus âgés que les ex-fumeurs (62,2 ans vs 57,6 ans) [72]. Une autre étude a montré les mêmes résultats dans une cohorte de 132 non-fumeurs et 522 fumeurs actifs.
Les non-fumeurs étaient plus âgés (63,5 ans vs 59,5 ans, p=0.0005) et plus souvent des femmes (78 % vs 54 %) [73]. Dans une étude française de 67 nonfumeurs, 635 ex-fumeurs et 791 fumeurs actifs, les non-fumeurs étaient plus âgés, avaient plus souvent un adénocarcinome et étaient plus souvent des femmes (p<0.0001) [66]. Il existe toujours une contreverse, mais le fait que les non-fumeurs qui développent un cancer bronchique soient plus jeunes et plus souvent des femmes est retrouvé dans de nombreuses études.
Le risque de cancer bronchique est différent selon les races et les ethnies. L’extrapolation d’une étude basée sur les données du Surveillance Epidemiology and End Results (SEER) dans les Etats-Unis de l’Ouest a montré un taux plus élevé de cancer bronchique chez les femmes non-fumeuses chinoises et originaires des philippines par rapport aux femmes blanches [74]. Une analyse en Californie du Sud a trouvé que chez les patients atteints de cancer bronchique, le pourcentage de patients développant la maladie qui étaient non-fumeurs variait selon les groupes ethniques et était plus fréquent dans les ethnies asiatique et hispanique [75]. Une autre étude a inclus des femmes non-fumeuses asiatiques (îles pacifiques), hispaniques et blanches non-hispaniques avec un diagnostic de cancer bronchique entre 1998 et 2002 issues du Greater Bay Area Cancer Registry (GBACR) de San Francisco et de Californie du Nord [76]. Dans cette étude, 70 % des femmes asiatiques et 45 % des femmes hispaniques étaient non-fumeuses contre 10 % des femmes blanches non-hispaniques.
Des études japonaises et d’autres pays asiatiques indiquent qu’un pourcentage plus élevé de femmes avec un cancer bronchique sont non-fumeuses, ce qui contraste avec les données d’Europe et des populations caucasiennes [6, 77, 78]. Un travail considérable reste à accomplir pour explorer ces différences ethniques.
Survie
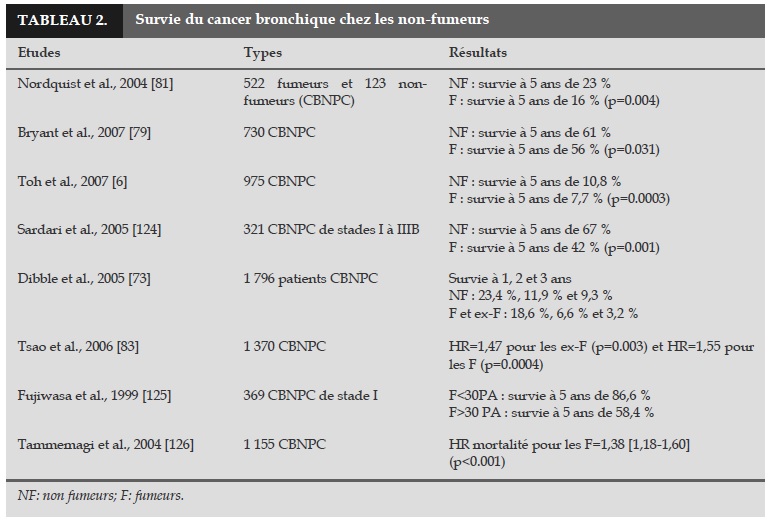
La plupart des études retrouve une meilleure survie pour les non-fumeurs comparés aux fumeurs, indépendamment du stade, du traitement, des comorbidités et d’autres facteurs pronostiques (Tableau 2) [79-81].
Nordquist et al. ont analysé la survie de 654 CBNPC (132 non-fumeurs et 522 fumeurs actifs) et ont mis en évidence une meilleure survie chez les non-fumeurs. La survie à 5 ans était de 16 % pour les fumeurs actifs et de 23 % pour les non-fumeurs (p=0.004) [81]. Dans une autre étude au Japon, les effets de l’histologie, de l’histoire tabagique et de la chimiothérapie sur la survie de patients avec un CBNPC ont été analysés après une 1ière ligne de traitement [80]. La survie à 2 ans était de 17 % pour les fumeurs et 52 % pour les non-fumeurs. Bryant et al. ont inclus 730 patients (562 fumeurs et 168 non-fumeurs) dans une cohorte et ont trouvé des résultats similaires avec un taux de survie à 5 ans plus élevé chez les nonfumeurs par rapport aux fumeurs de stade I (62 % vs 75 %), de stade II (46 % vs 53 %) et de stade III (36 % vs 41 %) [79].
L’étude de Yoshino et al. a inclus 999 CBNPC de stade I et a montré que le statut tabagique et les stades IA ou IB étaient des facteurs pronostiques pour les adénocarcinomes de stade I (HR=1,8 et 2,3, respectivement) [82]. D’autres études ont montré une meilleure survie pour les non-fumeurs avec un cancer bronchique par rapport aux fumeurs [67, 83, 84].
Cependant, Subramanian et al. n’ont pas trouvé de différence significative de survie entre non-fumeurs et fumeurs, avec une survie à 5 ans de 27 % vs 31 %, p=0.73 [85]. Une étude américaine ayant inclus des femmes nonfumeuses en Californie a montré une différence de survie entre les ethnies avec une meilleure survie pour les femmes blanches non-hispaniques par rapport aux femmes asiatiques [86]. Des études complémentaires restent nécessaires pour expliquer ces disparités.
BIOLOGIE MOLECULAIRE
Les explications concernant les différences de survie entre non-fumeurs et fumeurs ne sont pas claires, mais des travaux récents ont identifié des différences moléculaires entre ces 2 populations. Les profils moléculaires du cancer bronchique diffèrent entre nonfumeurs et fumeurs dans de nombreuses voies dont les mutations de l’EGFR, de MET, d’EML4-ALK, de K-ras et de p53 (Tableau 3) [87-90].
Mutations EGFR
L’expression et les mutations d’EGFR sont différentes entre le cancer bronchique des non-fumeurs et celui des fumeurs. Les mutations du gène de l’EGFR sont plus fréquentes chez les non-fumeurs [91-93].
Dans une population asiatique, Pham et al. ont analysé les mutations EGFR chez 265 patients (67 nonfumeurs, 151 ex-fumeurs et 47 fumeurs actifs) et ont trouvé des niveaux plus élevés de mutations EGFR chez les non-fumeurs par rapport aux ex-fumeurs et aux fumeurs actifs (51 % vs 19 % and 4 %, p<0.001) [93]. Les mutations de l’EGFR sont aussi plus fréquentes chez les patients porteurs d’un adénocarcinome, chez les patients de l’Asie de l’Est et chez les femmes [94]. La fréquence des mutations de l’EGFR varie entre pays, avec une fréquence plus élevée au Japon (30.9 %) et à Taiwan (36.1 %) et une fréquence plus basse aux Etats-Unis (9.4 %) et en Australie (11.9 %) [95]. Dans l’étude japonaise de Kosaka et al., 277 patients (159 hommes et 118 femmes, 115 nonfumeurs et 162 ex et fumeurs actifs) ont été inclus. Dans cette étude, les mutations EGFR étaient plus fréquentes chez les femmes (59 % vs 26 %, p<0.001), chez les non-fumeurs (66 % vs 22 %, p<0.001), pour les adénocarcinomes (49 % vs 2 %, p<0.001). Aucune influence du sexe, de l’âge, du TNM n’a été observée sur les mutations EGFR [96]. Une autre étude japonaise a mis en évidence une relation entre exposition au tabagisme passif et existence de mutations d’EGFR [97].
Mutations EMLA-ALK
Récemment, la translocation EML4-ALK a été identifiée potentielle de cancer bronchique [98]. Les mutations EML4-ALK sont plus fréquentes chez les patients jeunes, les hommes, les nonfumeurs ou fumeurs légers et dans les adénocarcinomes. Dans l’étude de Shaw et al., 141 CBNPC ont été analysés [99]. Les patients étaient surtout des femmes, des asiatiques, des non-fumeurs ou fumeurs légers et avaient un diagnostic d’adénocarcinome. Dix-neuf (13 %) tumeurs étaient mutantes pour EML4-ALK, 31 (22 %) étaient mutantes pour EGFR et 91 (65 %) n’avaient aucune de ces 2 mutations. Les patients avec les mutations d’EML4-ALK étaient plus jeunes, des hommes et des non-fumeurs ou fumeurs légers. Parmi les patients métastatiques, les mutations d’EML4-ALK étaient associées avec une résistance aux inhibiteurs de l’EGFR [99].
Mutations K-ras
Les mutations K-ras sont plus fréquentes chez les fumeurs. Tam et al. ont analysé le profil moléculaire des exons 18 à 21 de l’EGFR et les codons 12, 13 et 61 de K-ras chez 215 adénocarcinomes, 15 carcinomes épidermoïdes et 11 tumeurs associées à EBV. Les mutations EGFR étaient plus fréquentes dans les adénocarcinomes (115 de 215) et comme rapporté précédemment, chez les non-fumeurs (p <0.001), les femmes (p<0.001) et pour les histologies bien différenciées (p<0.001). Les mutations K-ras étaient seulement identifiées dans les adénocarcinomes (21 de 215) et étaient associées à une histoire tabagique (p=0.003), un sexe masculin (p=0.009) et des histologies peu différenciées (p=0.037) [100]. Les mutations EGFR et K-ras sont mutuellement exclusives [101, 102]. Riely a analysé les mutations K-ras chez 482 adénocarcinomes (81 non-fumeurs, 316 ex-fumeurs et 85 fumeurs actifs) et a trouvé des mutations K-ras chez 15 % des non-fumeurs, 22 % des ex-fumeurs et 25 % des fumeurs actifs [103].
Mutations MET
Les mutations MET sont également identifiées dans le cancer bronchique. Dans l’étude de Krishnaswamy et al., l’ADN génomique de 141 asiatiques, 76 caucasiens et 66 africains avec un diagnostic de cancer bronchique ont été analysés. La mutation la plus fréquente de MET (MET-N375S) était identifiée chez 13 % des asiatiques par rapport à aucune chez les américains d’origine africaine. La fréquence des mutations de MET était plus élevée chez les hommes fumeurs et les carcinomes épidermoïdes [104]. Les mutations de MET ont un intérêt particulier car la sur-expression de MET est en cause dans la résistance aux inhibiteurs de l’EGFR [105]. Les mutations de MET sont toujours à l’étude mais il semble y avoir des différences selon le statut tabagique.
Autres différences moléculaires
Les mutations de p53 sont identifiées chez les fumeurs et chez les non-fumeurs, mais elles sont plus fréquentes chez les fumeurs [106]. Des types et des spectres différents de mutations de p53 ont été découverts selon le statut tabagique [107, 108]. Les nonfumeurs ont des mutations de p53 qui sont des transitions (purine-purine: AG), alors que les fumeurs ont des transversions (purine-pyrimidine AC) [107]. Le codon où se forment les mutations est aussi différent entre non-fumeurs et fumeurs [107] et les mutations de p53 sont donc très différentes entre non-fumeurs et fumeurs. Des anomalies chromosomiques et des changements par méthylation sur le chromosome p16 sont en cours de recherche [88, 109]. Toutes ces différences moléculaires montrent que les voies de développement du cancer bronchique sont distinctes entre fumeurs et non-fumeurs.
TRAITEMENT
Une meilleure survie chez les non-fumeurs par rapport aux fumeurs, indépendamment du traitement a été observée. L’avantage thérapeutique est particulièrement visible avec les thérapeutiques ciblées vis-à -vis de l’EGFR et plus récemment vis-à-vis d’EML4ALK [99, 110-112]. Dans les études initiales sur erlotinib et d’autres inhibiteurs de l’EGFR, gefitinib, il était noté que certains patients, surtout les nonfumeurs, avaient une meilleure réponse. Dans l’étude pivot BR.19 d’erlotinib versus placebo chez des CBNPC de stade avancé et déjà traités antérieurement, les non-fumeurs avaient une meilleure réponse que les fumeurs (25 % vs 4 %, p<0.001) [113]. Ces observations ont amené à évaluer la cause de cette différence de réponse et les mutations de la protéine EGFR. En 2004, la 1ère publication montrant la réponse aux inhibiteurs de l’EGFR est publiée et est corrélée avec la présence des mutations EGFR [92, 114].
Un travail significatif a découvert que ces mutations EGFR étaient plus fréquentes chez les non-fumeurs [92-95]. Pour explorer les meilleurs traitements chez les patients qui ont les mutations EGFR, nonfumeurs et asiatiques, l’essai IPASS a été ouvert. L’étude IPASS a inclus 1 217 patients de l’Asie de l’Est, tous non-fumeurs ou fumeurs légers [115]. Dans cet essai de phase III, les patients avec un adénocarcinome de stade avancé et non traité ont été inclus et ont reçu du gefitinib ou carboplatine + paclitaxel. La survie sans progression à 12 mois était de 24,9% pour le gefitinib et 6,7% pour carboplatine + paclitaxel, avec un HR de 0,74 [0,65-0,85], p<0.001. Chez les patients avec des mutations EGFR connues (261 patients), la survie sans progression était significativement plus longue dans le groupe recevant du gefitinib (p<0,001), alors que chez les patients sans mutations EGFR (176 patients), la survie sans progression était meilleure dans le groupe recevant carboplatine + paclitaxel (p<0,001). Des essais sont en cours et incluent seulement des patients avec des mutations connues d’EGFR et espèrent confirmer ces résultats. Une de ces études est en cours en France et analyse l’erlotinib comme traitement adjuvant des CBNPC de stade IB-IIIA chirurgicaux avec des mutations EGFR, et un autre essai non-randomisé aux Etats-Unis a une approche similaire.
Pour les patients métastatiques, le Spanish Lung Cancer Group randomise, dans un essai de phase III, des patients connus pour des mutations de l’EGFR pour une 1ière ligne par erlotinib avec un cross-over à la progress i o n [ 1 1 6 ] . Comme la grande major itédespatient save un cancer bronchique et des mutations de l’EGFR sont des non-fumeurs, l’étude des mutations de l’EGFR sont importantes pour comprendre la thérapeutique chez les non-fumeurs. Dans l’essai TRIBUTE, 1 059 CBNPC de stade avancé et non traités ont été randomisés pour recevoir carboplatine + paclitaxel + erlotinib/placebo, les non-fumeurs avaient une survie augmentée dans le groupe sous erlotinib (22,5 mois vs 10,1 mois dans le groupe placebo) [117].
Le Cancer and Leukemia Group B (CALGB) a récemment terminé une étude sur erlotinib +/- chimiothérapie chez des patients porteurs d’un CBNPC de stade avancé et qui étaient non-fumeurs ou fumeurs légers. Cette étude a inclus l’analyse des mutations de l’EGFR, l’expression d’EGFR et les mutations de K-ras. L’Eastern Cooperative Oncology Group (ECOG) développe actuellement un essai pour les CBNPC de stade avancé non-traités chez des patients non-fumeurs ; tous les patients recevront carboplatine + paclitaxel +/- bevacizumab avec une randomisation pour recevoir ou non erlotinib.
Le traitement des patients avec des translocations de la protéine EML4-ALK évolue aussi. Dans un essai de phase I sur des patients sélectionnés pour avoir cette translocation, le taux de contrôle de la maladie à 8 semaines sous un traitement par PF-02341066 était de 87,5 % [111]. Un essai de phase II est actuellement en cours de recrutement et tente de prouver l’utilité de ce composé dans le traitement des CBNPC avec translocations d’EML4-ALK.
CONCLUSIONS
Le cancer bronchique reste la principale cause de mortalité par cancer dans le monde et même si le public pense que les personnes qui ne fument pas ne peuvent avoir cette pathologie, le cancer bronchique chez les non-fumeurs attire de plus en plus l’attention. Le cancer bronchique chez les non-fumeurs est habituellement un adénocarcinome et apparaît plus fréquemment chez les femmes et les patients asiatiques. Les non-fumeurs atteints d’un cancer bronchique ont une meilleure réponse aux inhibiteurs de l’EGFR et une meilleure survie que les patients qui sont fumeurs actifs ou ex-fumeurs. Des études dans le champ de la biologie moléculaire ont identifié de nombreuses différences moléculaires entre nonfumeurs et fumeurs. Toutes ces différences épidémiologiques, cliniques et moléculaires suggèrent que le cancer bronchique des non-fumeurs et des fumeurs sont des pathologies distinctes. Nous devons mieux comprendre la biologie du cancer bronchique chez les non-fumeurs afin de développer des moyens thérapeutiques plus spécifiques et ainsi obtenir une meilleure évolution pour tous les patients atteints de cancer bronchique.
CONFLIT D’INTERETS
Aucun.
REFERENCES
1. Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2009. CA Cancer J Clin 2009;59:225-249.
2. Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002. CA Cancer J Clin 2005;55:74-108.
3. Subramanian A, Govindan R. Lung cancer in never smokers: a unique entity. Oncology 2010;24:29-35.
4. Sun S, Schiller JH, Gazdar AF. Lung cancer in never smokers-a different disease. Nat Rev Canner 2007;7:778-790.
5. Subramanian J, Govindan R. Lung cancer in never smokers: a review. J Clin Oncol 2007;25:561-570.
6. Toh CK, Lim WT. Lung cancer in never-smokers. J Clin Pathol 2007;60:337-340.
7. Morbidity and mortality weekly report. Available at wwwcdcgov/mmwr November 2009.
8. Guerin S, Hill C. [Cancer epidemiology in France in 2010, comparison with the USA]. Bull Canner 2010;97:47-54
9. Scagliotti GV, Longo M, Novello S. Nonsmall cell lung cancer in never smokers. Curr Opin Oncol 2009;21:99-104.
10. Tyczynski JE, Bray F, Parkin DM. Lung cancer in Europe in 2000: epidemiology, prevention, and early detection. Lancet Oncol 2003;4:45-55.
11. Wakelee HA, Chang ET, Gomez SL, et al. Lung cancer incidence in never smokers. J Clin Oncol 2007;25:472478.
12. Boffetta P, Jarvholm B, Brennan P, et al. Incidence of lung cancer in a large cohort of non-smoking men from Sweden. Int J Cancer 2001;94:591-593.
13. Zell JA, Ou SH, Ziogas A, et al. Epidemiology of bronchioloalveolar carcinoma: improvement in survival after release of the 1999 WHO classification of lung tumors. J Clin Oncol 2005;23:8396-8405.
14. Yano T, Miura N, Takenaka T, et al. Never-smoking nonsmall cell lung cancer as a separate entity: clinicopathologic features and survival. Cancer 2008;113:10121018.
15. Thun MJ, Henley SJ, Burns D, et al. Lung cancer death rates in lifelong nonsmokers. J Natl Cancer Inst 2006;98:691-699.
16. Peto R, Darby S, Deo H, et al. Smoking, smoking cessation, and lung cancer in the UK since 1950: combination of national statistics with two case-control studies. BMJ 2000;321:323-329.
17. Nyberg F, Agudo A, Boffetta P, et al. A European validation study of smoking and environmental tobacco smoke exposure in nonsmoking lung cancer cases and controls. Cancer Causes Control 1998;9:173-182.
18. Wells AJ, English PB, Posner SF, et al. Misclassification rates for current smokers misclassified as nonsmokers. Am J Public Health 1998;88:1503-1509.
19. Brennan P, Fortes C, Butler J, et al. A multicenter casecontrol study of diet and lung cancer among nonsmokers. Cancer Causes Control 2000;11:49-58.
20. Hu J, Mao Y, Dryer D, et al. Risk factors for lung cancer among Canadian women who have never smoked. Cancer Detect Prev 2002;26:129-138.
21. Wakai K, Ando M, Ozasa K, et al. Updated information on risk factors for lung cancer: findings from the JACC Study. J Epidemiol 2005;15 Suppl 2:S134-139.
22. Tobacco smoke and involuntary smoking. IARC Monogr Eval Carcinog Risks Hum 2004; 83:1
23. Vineis P, Forastiere F, Hoek G, et al. Outdoor air pollution and lung cancer: recent epidemiologic evidence. Int J Cancer 2004;111:647-652.
24. Vineis P, Hoek G, Krzyzanowski M, et al. Lung cancers attributable to environmental tobacco smoke and air pollution in non-smokers in different European countries: a prospective study. Environ Health 2007;6:7.
25. Wu A. Carcinogenic effects. In: Health Effects of Exposure to Environmental Tobacco Smoke Shopland, DR, Zeise, L, Dunn, A (Eds), National Cancer Institute, Bethesda, MD 1999
26. Hirayama T. Non-smoking wives of heavy smokers have a higher risk of lung cancer: a study from Japan. Br Med J (Clin Res Ed) 1981;282:183-185.
27. Trichopoulos D, Kalandidi A, Sparros L, et al. Lung cancer and passive smoking. Int J Cancer 1981;27:1-4.
28. Samet JM, Avila-Tang E, Boffetta P, et al. Lung cancer in never smokers: clinical epidemiology and environmental risk factors. Clin Cancer Res 2009;15:5626-5645.
29. Jockel KH, Pohlabeln H, Ahrens W, et al. Environmental tobacco smoke and lung cancer. Epidemiology 1998;9:672-675.
30. Nyberg F, Agrenius V, Svartengren K, et al. Environmental tobacco smoker and lung canner in nonsmoker: does time since exposure play a role? Epidemiology 1998;9:301-308.
31. Zhong L, Goldberg MS, Gao YT, et al. A case-control study of lung cancer and environmental tobacco smoke among nonsmoking women living in Shanghai, China. Cancer Causes Control 1999;10:607-616.
32. Schwartz A, Yang P, Swanson G. Familial risk of lung cancer among nonsmokers and their relatives. Am J Epidemiol 1996;144:554-562.
33. Nitadori J, Inoue M, Iwasaki M, et al. Association between lung cancer incidence and family history of lung cancer: data from a large-scale population-based cohort study, the JPHC study. Chest 2006;130:968-975.
34. Gorlova OY, Weng SF, Zhang Y, et al. Aggregation of cancer among relatives of never-smoking lung cancer patients. Int J Cancer 2007;121:111-118.
35. Etzel CJ, Amos CI, Spitz MR. Risk for smoking-related cancer among relatives of lung cancer patients. Cancer Res 2003;63:8531-8535.
36. Bailey-Wilson JE, Amos CI, Pinney SM, et al. A major lung cancer susceptibility locus maps to chromosome 6q23-25. Am J Hum Genet 2004;75:460-474.
37. Brenner DR, Hung RJ, Tsao MS, et al. Lung cancer risk in never-smokers: a population-based case-control study of epidemiologic risk factors. BMC Cancer 2010;10:285.
38. Gorlova OY, Weng SF, Zhang Y, et al. DNA repair capacity and lung cancer risk in never smokers. Cancer Epidemiol Biomarkers Prev 2008;17:1322-1328.
39. Taioli E, Wynder EL. Re: Endocrine factors and adenocarcinoma of the lung in women. J Natl Cancer Inst 1994;86:869-870.
40. Kabat GC, Miller AB, Rohan TE. Reproductive and hormonal factors and risk of lung cancer in women: a prospective cohort study. Int J Canner 2007; 120:2214-2220
41. Kreuzer M, Gerken M, Heinrich J, et al. Hormonal factors and risk of lung cancer among women? Int J Epidemiol 2003;32:263-271.
42. Schwartz AG, Wenzlaff AS, Prysak GM, et al. Reproductive factors, hormone use, estrogen receptor expression and risk of non small-cell lung cancer in women. J Clin Oncol 2007;25:5785-5792.
43. Wu AH, Yu MC, Thomas DC, et al. Personal and family history of lung disease as risk factors for adenocarcinoma of the lung. Cancer Res 1988;48:7279-7284.
44. Neuberger JS, Field RW. Occupation and lung cancer in nonsmokers. Rev Envion Health 2003;18:251-267.
45. Pohlabeln H, Boffetta P, Ahrens W, et al. Occupational risks for lung cancer among nonsmokers. Epidemiology 2000;11:532-538.
46. Cardenas VM, Thun MJ, Austin H, et al. Environmental tobacco smoke and lung cancer mortality in the American Cancer Society's Cancer Prevention Study. II. Cancer Causes Control 1997;8:57-64.
47. Chen Y, Zhi G, Feng Y, et al. Measurements of black and organic carbon emission factors for household coal combustion in china: implication for emission reduction. Environ Sci Technol 2009;43:9495-9500.
48. Ernster VL. Female lung cancer. Annu Rev Public Health 1996;17:97-114.
49. Gao YT, Blot WJ, Zheng W, et al. Lung cancer among Chinese women. Int J Cancer 1987;40:604-609.
50. Shen XB, Wang GX, Huang YZ, et al. Analysis and estimates of attributable risk factors for lung cancer in Nanjing, China. Lung Cancer 1996;14 Suppl 1:S107-112
51. Teixeira E, Conde S, Alves P, et al. [Lung cancer and women]. Rev Port Pneumol 2003;9:225-247.
52. Wang TJ, Zhou BS, Shi JP. Lung cancer in nonsmoking Chinese women: a case-control study. Lung Cancer 1996;14 Suppl 1:S93-98.
53. Zhao Y, Wang S, Aunan K, et al. Air pollution and lung cancer risks in China--a meta-analysis. Sci Total Environ 2006;366:500-513.
54. Liu Q, Sasco AJ, Riboli E, et al. Indoor air pollution and lung cancer in Guangzhou, People's Republic of China. Am J Epidemiol 1993;137:145-154.
55. Gorlova OY, Zhang Y, Schabath MB, et al. Never smokers and lung cancer risk: a case-control study of epidemiological factors. Int J Cancer 2006;118:1798-1804.
56. Hinds MW, Cohen HI, Kolonel LN. Tuberculosis and lung cancer risk in nonsmoking women. Am Rev Respir Dis 1982;125:776-778.
57. Lubin J, Boice JJ, Edling C. A Joint Analysis of 11 Underground Miners Studies. National Institutes of Health, Bethesda, USA, 1994.
58. WHO handbook on indoor radon: a public health perspective. Available at www.WHO.int.
59. Sandler DP, Weinberg CR, Shore DL, et al. Indoor radon and lung cancer risk in connecticut and utah. J Toxicol Environ Health A 2006;69:633-654.
60. Darby S, Hill D, Auvinen A, et al. Radon in homes and risk of lung cancer: collaborative analysis of individual data from 13 European case-control studies. BMJ 2005;330:223.
61. Krewski D, Lubin JH, Zielinski JM, et al. Residential randon and risk of lung cancer: a combined analyris of 7 North American case-control studies. Epidemiology 2005;16:137-145.
62. Chen YC, Chen JH, Richard K, et al. Lung adenocarcinoma and human papillomavirus infection. Cancer 2004;101:1428-1436.
63. Cheng YW, Chiou HL, Sheu GT, et al. The association of human papillomavirus 16/18 infection with lung cancer among nonsmoking Taiwanese women. Cancer Res 2001;61:2799-2803.
64. Lim WT, Chuah KL, Leong SS, et al. Assessment of human papillomavirus and Epstein-Barr virus in lung adenocarcinoma. Oncol Rep 2009;21:971-975.
65. Leroux C, Girard N, Cottin V, et al. Jaagsiekte Sheep Retrovirus (JSRV): from virus to lung cancer in sheep. Vet Res 2007;38:211-228.
66. Clement-Duchene C, Vignaud JM, Stoufflet A, et al. Characteristics of never smoker lung cancer including environmental and occupational risk factors. Lung Cancer 2010;67:144-150.
67. Toh CK, Gao F, Lim WT, et al. Never-smokers with lung cancer: epidemiologic evidence of a distinct disease entity. J Clin Oncol 2006;24:2245-2251.
68. Doran E, Jackman D. Fire Without Smoke: Lung Cancer in Never-Smokers. Oncology 2010;24:488-491.
69. Brownson RC, Loy TS, Ingram E, et al. Lung cancer in nonsmoking women. Histology and survival patterns. Cancer 1995;75:29-33.
70. Yang P, Cerhan JR, Vierkant RA, et al. Adenocarcinoma of the lung is strongly associated with cigarette smoking: further evidence from a prospective study of women. Am J Epidemiol 2002;156:1114-1122.
71. Cerfolio RJ, Bryant AS, Scott E, et al. Women with pathologic stage I, II, and III non-small cell lung cancer have better survival than men. Chest 2006;130:1796-1802
72. Muscat JE, Wynder EL. Lung cancer pathology in smokers, ex-smokers and never smokers. Cancer Lett 1995;88:1-5.
73. Dibble R, Langeburg W, Bair S, et al. Natural history of non-small cell lung cancer in nonsmokers. J Clin Oncol 2005;23:abstract 7252.
74. Epplein M, Schwartz SM, Potter JD, et al. Smokingadjusted lung cancer incidence among AsianAmericans (United States). Cancer Causes Control 2005;16:1085-1090.
75. Ou SH, Ziogas A, Zell J. Epidemiology study of neversmokers with non-small cell lung cancer (NSCLC): High percentages of Asian and Hispanic female neversmokers and the significance of Asian ethnicity. J Clin Oncol 2008;26::abstract 8004.
76. Wakelee H, Chang E, Shema S, et al. Survival after nonsmall cell lung cancer in never-smoking Asian/Pacific Islander and Latina women. Journal of Thoracic Oncology 2009;4:S310 (Abstract: A317.316).
77. Haiman CA, Stram DO, Wilkens LR, et al. Ethnic and racial differences in the smoking-related risk of lung cancer. N Engl J Med 2006;354:333-342.
78. Pinsky PF. Racial and ethnic differences in lung cancer incidence: how much is explained by differences in smoking patterns? (United States). Cancer Causes Control 2006;17:1017-1024.
79. Bryant A, Cerfolio RJ. Differences in epidemiology, histology, and survival between cigarette smokers and never-smokers who develop non-small cell lung cancer. Chest 2007;132:185-192.
80. Itaya T, Yamaoto N, Ando M, et al. Influence of histological type, smoking history and chemotherapy on survival after first-line therapy in patients with advanced non-small cell lung cancer. Cancer Sci 2007;98:226-230.
81. Nordquist LT, Simon GR, Cantor A, et al. Improved survival in never-smokers vs current smokers with primary adenocarcinoma of the lung. Chest 2004;126:347-351.
82. Yoshino I, Kawano D, Oba T, et al. Smoking status as a prognostic factor in patients with stage I pulmonary adenocarcinoma. Ann Thorac Surg 2006;81:1189-1193.
83. Tsao AS, Liu D, Lee JJ, et al. Smoking affects treatment outcome in patients with advanced nonsmall cell lung cancer. Cancer 2006;106:2428-2436.
84. Yano T, Miura N, Takenaka T, et al. Surgical results of non-small cell lung cancer in never-smokers as a separate entity. J Clin Oncol 2008;26 :398s.
85. Subramanian J, Velcheti V, Gao F, et al. Presentation and stage-specific outcomes of lifelong never-smokers with non-small cell lung cancer (NSCLC). J Thorac Oncol 2007;2:827-830.
86. Gomez SL, Chang ET, Shema SJ, et al. Survival following non-small cell lung cancer amaong Asian/Pacific Islander, Latina, and non-Hispanic White women who have never smoked. Cancer Epidemiol Biomarkers Prev 2011.
87. Mounawar M, Mukeria A, Le Calvez F, et al. Patterns of EGFR, HER2, TP53, and KRAS mutations of p14arf expression in non-small cell lung cancers in relation to smoking history. Cancer Res 2007;67:5667-5672.
88. Rudin CM, Avila-Tang E, Harris CC, et al. Lung cancer in never smokers: molecular profiles and therapeutic implications. Clin Cancer Res 2009;15:5646-5661.
89. Schwartz AG, Prysak GM, Block CH, et al. The molecular epidemiology of lung cancer. Carciogernesis 2007;28:507-518
90. LeeJ, LY, Kim JH, Kim SK, et al. Lung cancer in never smokers: Change of a mindset in the molecular era. Lung Cancer 2011.
91. Bell DW, Gore I, Okimoto RA, et al. Inherited susceptibility to lung cancer may be associated with the T790M drug resistance mutation in EGFR. Nat Genet 2005;37:1315-1316.
92. Pao W, Miller V, Zakowski M, et al. EGF receptor gene mutations are common in lung cancers from "never smokers" and are associated with sensitivity of tumors to gefitinib and erlotinib. Proc Natl Acad Sci U S A 2004;101:13306-13311.
93. Pham D, Kris MG, Riely GJ, et al. Use of cigarettesmoking history to estimate the likelihood of mutations in epidermal growth factor receptor gene exons 19 and 21 in lung adenocarcinomas. J Clin Oncol 2006; 24:1700-1704.
94. Sharma SV, Bell DW, Settleman J, et al. Epidermal growth factor receptor mutations in lung cancer. Nat Rev Cancer 2007;7:169-181.
95. Toyooka S, Matsuo K, Shigematsu H, et al. The impact of sex and smoking status on the mutational spectrum of epidermal growth factor receptor gene in non small cell lung cancer. Clin Cancer Res 2007;13:5763-5768.
96. Kosaka T, Yatabe Y, Endoh H, et al. Mutations of the epidermal growth factor receptor gene in lung cancer: biological and clinical implications. Cancer Res 2004;64:8919-8923.
97. Kawaguchi T, Ando M, Takada M, et al. Long exposure of environmental tobacco smoke associated with activating EGFR mutations in never-smokers with nonsmall cell lung cancer. Clin Cancer Res 2011;17:39-45
98. Soda M, Choi YL, Enomoto M, et al. Identification of the transforming EML4-ALK fusion gene in non-smallcell lung cancer. Nature 2007;448:561-566.
99. Shaw AT, Yeap BY, Mino-Kenudson M, et al. Clinical features and outcome of patients with non-small-cell lung cancer who harbor EML4-ALK. J Clin Oncol 2009;27:4247-4253.
100.Tam IY, Chung LP, Suen WS, et al. Distinct epidermal growth factor receptor and KRAS mutation patterns in non-small cell lung cancer patients with different tobacco exposure and clinicopathologic features. Clin Cancer Res 2006;12:1647-1653.
101.Burns T, Rudin C. Lung cancer in never smokers: beyond EGFR mutations and EGFR-TK Inhibitors. Oncology 2010;24:121-131.
102.Shigematsu H, Lin L, Takahashi T, et al. Clinical and biological features associated with epidermal growth factor receptor gene mutations in lung cancers. J Natl Cancer Inst 2005;97:339-346.
103.Riely GJ, Kris MG, Rosenbaum D, et al. Frequency and distinctive spectrum of KRAS mutations in never smokers with lung adenocarcinoma. Clin Cancer Res 2008;14:5731-5734.
104.Krishnaswamy S, Kanteti R, Duke-Cohan JS, et al. Ethnic differences and functional analysis of MET mutations in lung cancer. Clin Cancer Res 2009;15:5714-5723.
105.Engelman JA, Janne PA. Mechanisms of acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in non-small cell lung cancer. Clin Cancer Res 2008;14:2895-2899.
106.Le Calvez F, Mukeria A, Hunt JD, et al. TP53 and KRAS mutation load and types in lung cancers in relation to tobacco smoke: distinct patterns in never, former, and current smokers. Cancer Res 2005;65:5076-83.
107.Gealy R, Zhang L, Siegfried JM, et al. Comparison of mutations in the p53 and K-ras genes in lung carcinomas from smoking and nonsmoking women. Cancer Epidemiol Biomarkers Prev 1999;8:297-302. 108.
108. Toyooka S, Tsuda T, Gazdar AF. The TP53 gene, tobacco exposure, and lung cancer. Hum Mutat 2003;21:229-239.
109.Job B, Bernheim A, Beau-Faller M, et al. Genomic aberrations in lung adenocarcinoma in never smokers. PloS One 2010;5:e15145
110.Shaw A, Costa D, Mino-Kenudson M, et al. Clinicopathologic features of EML4-ALK mutant lung cancer. J Clin Oncol 2009;27:abstract 11021.
111.Shaw AP, Costa D, Lafrate A, et al. Clinical activity of the oral ALK and MET inhibitor PF-02341066 in nonsmall lung cancer (NSCLC) with EML4-ALK translocations. J Thorac Oncol 2009;4:S305-306:abstract A306.304.
112.Tsao MS, Sakurada A, Cutz JC, et al. Erlotinib in lung cancer - molecular and clinical predictors of outcome. N Engl J Med 2005;353:133-144.
113.Shepherd FA, Rodrigues Pereira J, Ciuleanu T, et al. Erlotinib in previously treated non-small-cell lung cancer. N Engl J Med 2005;353:123-132.
114.Lynch TJ, Bell DW, Sordella R, et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. N Engl J Med 2004;350:2129-2139.
115.Mok TS, Wu YL, Thongprasert S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med 2009;361:947-957.
116. NCT00446225. Available at http://clinicaltrials.gov. Last update Jan 23, 2010.
117.Herbst RS, Prager D, Hermann R, et al. TRIBUTE: a phase III trial of erlotinib hydrochloride (OSI-774) combined with carboplatin and paclitaxel chemotherapy in advanced non-small-cell lung cancer. J Clin Oncol 2005;23:5892-5899.
118.Foeglé J, Hedelin G, Lebitasy MP, et al. Specific features of non-small cell lung cancer in women: a retrospective study of 1738 cases diagnosed in Bas-Rhin between 1982 and 1997. J Thorac Oncol 2007;2:466-474.
119. Ferguson MK, Wang J, Hoffman PC, et al. Sexassociated differences in survival of patients undergoing resection for lung cancer. Ann Thorac Surg 2000;69:245-249.
120. de Perrot M, Licker M, Bouchardy C, et al. Sex differences in presentation, management, and prognosis of patients with non-small cell lung carcinoma. J Thorac Cardiovasc Surg 2000;119:21-26.
121. Minami H, Yoshimura M, Miyamoto Y, et al. Lung cancer in women: sex-associated differences in survival of patients undergoing resection for lung cancer. Chest 2000;118:1603-1609.
122. Radzikowska E, Glaz P, Roszkowski K. Lung cancer in women: age, smoking, histology, performance status, stage initial treatment and survival: population base study of 20,561 cases. Ann Oncol 2002;13:1087 -1093.
123.V sbal AL, Williams BA, Nichols FCr, et al. Gender differences in non-small-cell lung cancer survival: an analysis of 4,618 patients diagnosed between 1997 and 2002. Ann Thorac Surg 2004;78:209-215.
124.Sardari Nia P, Weyler J, Colpaert C, et al. Prognostic value of smoking status in operated non-small cell lung cancer. Lung Cancer 2005;47:351-359.
125.Fujisawa T, Lizasa T, Saitoh Y, et al. Smoking before surgery predicts poor long-term survival in patients with stage I non-small-cell lung carcinomas. J Clin Oncol 1999;17:2086-2091.
126.Tammemagi CM, Neslund-Dudas C, Simoff M, et al. Smoking and lung cancer survival: the role of comorbidity and treatment. Chest 2004;125:27-37.
TABLES

REFERENCES
1. Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2009. CA Cancer J Clin 2009;59:225-249.
2. Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002. CA Cancer J Clin 2005;55:74-108.
3. Subramanian A, Govindan R. Lung cancer in never smokers: a unique entity. Oncology 2010;24:29-35.
4. Sun S, Schiller JH, Gazdar AF. Lung cancer in never smokers-a different disease. Nat Rev Canner 2007;7:778-790.
5. Subramanian J, Govindan R. Lung cancer in never smokers: a review. J Clin Oncol 2007;25:561-570.
6. Toh CK, Lim WT. Lung cancer in never-smokers. J Clin Pathol 2007;60:337-340.
7. Morbidity and mortality weekly report. Available at wwwcdcgov/mmwr November 2009.
8. Guerin S, Hill C. [Cancer epidemiology in France in 2010, comparison with the USA]. Bull Canner 2010;97:47-54
9. Scagliotti GV, Longo M, Novello S. Nonsmall cell lung cancer in never smokers. Curr Opin Oncol 2009;21:99-104.
10. Tyczynski JE, Bray F, Parkin DM. Lung cancer in Europe in 2000: epidemiology, prevention, and early detection. Lancet Oncol 2003;4:45-55.
11. Wakelee HA, Chang ET, Gomez SL, et al. Lung cancer incidence in never smokers. J Clin Oncol 2007;25:472478.
12. Boffetta P, Jarvholm B, Brennan P, et al. Incidence of lung cancer in a large cohort of non-smoking men from Sweden. Int J Cancer 2001;94:591-593.
13. Zell JA, Ou SH, Ziogas A, et al. Epidemiology of bronchioloalveolar carcinoma: improvement in survival after release of the 1999 WHO classification of lung tumors. J Clin Oncol 2005;23:8396-8405.
14. Yano T, Miura N, Takenaka T, et al. Never-smoking nonsmall cell lung cancer as a separate entity: clinicopathologic features and survival. Cancer 2008;113:10121018.
15. Thun MJ, Henley SJ, Burns D, et al. Lung cancer death rates in lifelong nonsmokers. J Natl Cancer Inst 2006;98:691-699.
16. Peto R, Darby S, Deo H, et al. Smoking, smoking cessation, and lung cancer in the UK since 1950: combination of national statistics with two case-control studies. BMJ 2000;321:323-329.
17. Nyberg F, Agudo A, Boffetta P, et al. A European validation study of smoking and environmental tobacco smoke exposure in nonsmoking lung cancer cases and controls. Cancer Causes Control 1998;9:173-182.
18. Wells AJ, English PB, Posner SF, et al. Misclassification rates for current smokers misclassified as nonsmokers. Am J Public Health 1998;88:1503-1509.
19. Brennan P, Fortes C, Butler J, et al. A multicenter casecontrol study of diet and lung cancer among nonsmokers. Cancer Causes Control 2000;11:49-58.
20. Hu J, Mao Y, Dryer D, et al. Risk factors for lung cancer among Canadian women who have never smoked. Cancer Detect Prev 2002;26:129-138.
21. Wakai K, Ando M, Ozasa K, et al. Updated information on risk factors for lung cancer: findings from the JACC Study. J Epidemiol 2005;15 Suppl 2:S134-139.
22. Tobacco smoke and involuntary smoking. IARC Monogr Eval Carcinog Risks Hum 2004; 83:1
23. Vineis P, Forastiere F, Hoek G, et al. Outdoor air pollution and lung cancer: recent epidemiologic evidence. Int J Cancer 2004;111:647-652.
24. Vineis P, Hoek G, Krzyzanowski M, et al. Lung cancers attributable to environmental tobacco smoke and air pollution in non-smokers in different European countries: a prospective study. Environ Health 2007;6:7.
25. Wu A. Carcinogenic effects. In: Health Effects of Exposure to Environmental Tobacco Smoke Shopland, DR, Zeise, L, Dunn, A (Eds), National Cancer Institute, Bethesda, MD 1999
26. Hirayama T. Non-smoking wives of heavy smokers have a higher risk of lung cancer: a study from Japan. Br Med J (Clin Res Ed) 1981;282:183-185.
27. Trichopoulos D, Kalandidi A, Sparros L, et al. Lung cancer and passive smoking. Int J Cancer 1981;27:1-4.
28. Samet JM, Avila-Tang E, Boffetta P, et al. Lung cancer in never smokers: clinical epidemiology and environmental risk factors. Clin Cancer Res 2009;15:5626-5645.
29. Jockel KH, Pohlabeln H, Ahrens W, et al. Environmental tobacco smoke and lung cancer. Epidemiology 1998;9:672-675.
30. Nyberg F, Agrenius V, Svartengren K, et al. Environmental tobacco smoker and lung canner in nonsmoker: does time since exposure play a role? Epidemiology 1998;9:301-308.
31. Zhong L, Goldberg MS, Gao YT, et al. A case-control study of lung cancer and environmental tobacco smoke among nonsmoking women living in Shanghai, China. Cancer Causes Control 1999;10:607-616.
32. Schwartz A, Yang P, Swanson G. Familial risk of lung cancer among nonsmokers and their relatives. Am J Epidemiol 1996;144:554-562.
33. Nitadori J, Inoue M, Iwasaki M, et al. Association between lung cancer incidence and family history of lung cancer: data from a large-scale population-based cohort study, the JPHC study. Chest 2006;130:968-975.
34. Gorlova OY, Weng SF, Zhang Y, et al. Aggregation of cancer among relatives of never-smoking lung cancer patients. Int J Cancer 2007;121:111-118.
35. Etzel CJ, Amos CI, Spitz MR. Risk for smoking-related cancer among relatives of lung cancer patients. Cancer Res 2003;63:8531-8535.
36. Bailey-Wilson JE, Amos CI, Pinney SM, et al. A major lung cancer susceptibility locus maps to chromosome 6q23-25. Am J Hum Genet 2004;75:460-474.
37. Brenner DR, Hung RJ, Tsao MS, et al. Lung cancer risk in never-smokers: a population-based case-control study of epidemiologic risk factors. BMC Cancer 2010;10:285.
38. Gorlova OY, Weng SF, Zhang Y, et al. DNA repair capacity and lung cancer risk in never smokers. Cancer Epidemiol Biomarkers Prev 2008;17:1322-1328.
39. Taioli E, Wynder EL. Re: Endocrine factors and adenocarcinoma of the lung in women. J Natl Cancer Inst 1994;86:869-870.
40. Kabat GC, Miller AB, Rohan TE. Reproductive and hormonal factors and risk of lung cancer in women: a prospective cohort study. Int J Canner 2007; 120:2214-2220
41. Kreuzer M, Gerken M, Heinrich J, et al. Hormonal factors and risk of lung cancer among women? Int J Epidemiol 2003;32:263-271.
42. Schwartz AG, Wenzlaff AS, Prysak GM, et al. Reproductive factors, hormone use, estrogen receptor expression and risk of non small-cell lung cancer in women. J Clin Oncol 2007;25:5785-5792.
43. Wu AH, Yu MC, Thomas DC, et al. Personal and family history of lung disease as risk factors for adenocarcinoma of the lung. Cancer Res 1988;48:7279-7284.
44. Neuberger JS, Field RW. Occupation and lung cancer in nonsmokers. Rev Envion Health 2003;18:251-267.
45. Pohlabeln H, Boffetta P, Ahrens W, et al. Occupational risks for lung cancer among nonsmokers. Epidemiology 2000;11:532-538.
46. Cardenas VM, Thun MJ, Austin H, et al. Environmental tobacco smoke and lung cancer mortality in the American Cancer Society's Cancer Prevention Study. II. Cancer Causes Control 1997;8:57-64.
47. Chen Y, Zhi G, Feng Y, et al. Measurements of black and organic carbon emission factors for household coal combustion in china: implication for emission reduction. Environ Sci Technol 2009;43:9495-9500.
48. Ernster VL. Female lung cancer. Annu Rev Public Health 1996;17:97-114.
49. Gao YT, Blot WJ, Zheng W, et al. Lung cancer among Chinese women. Int J Cancer 1987;40:604-609.
50. Shen XB, Wang GX, Huang YZ, et al. Analysis and estimates of attributable risk factors for lung cancer in Nanjing, China. Lung Cancer 1996;14 Suppl 1:S107-112
51. Teixeira E, Conde S, Alves P, et al. [Lung cancer and women]. Rev Port Pneumol 2003;9:225-247.
52. Wang TJ, Zhou BS, Shi JP. Lung cancer in nonsmoking Chinese women: a case-control study. Lung Cancer 1996;14 Suppl 1:S93-98.
53. Zhao Y, Wang S, Aunan K, et al. Air pollution and lung cancer risks in China--a meta-analysis. Sci Total Environ 2006;366:500-513.
54. Liu Q, Sasco AJ, Riboli E, et al. Indoor air pollution and lung cancer in Guangzhou, People's Republic of China. Am J Epidemiol 1993;137:145-154.
55. Gorlova OY, Zhang Y, Schabath MB, et al. Never smokers and lung cancer risk: a case-control study of epidemiological factors. Int J Cancer 2006;118:1798-1804.
56. Hinds MW, Cohen HI, Kolonel LN. Tuberculosis and lung cancer risk in nonsmoking women. Am Rev Respir Dis 1982;125:776-778.
57. Lubin J, Boice JJ, Edling C. A Joint Analysis of 11 Underground Miners Studies. National Institutes of Health, Bethesda, USA, 1994.
58. WHO handbook on indoor radon: a public health perspective. Available at www.WHO.int.
59. Sandler DP, Weinberg CR, Shore DL, et al. Indoor radon and lung cancer risk in connecticut and utah. J Toxicol Environ Health A 2006;69:633-654.
60. Darby S, Hill D, Auvinen A, et al. Radon in homes and risk of lung cancer: collaborative analysis of individual data from 13 European case-control studies. BMJ 2005;330:223.
61. Krewski D, Lubin JH, Zielinski JM, et al. Residential randon and risk of lung cancer: a combined analyris of 7 North American case-control studies. Epidemiology 2005;16:137-145.
62. Chen YC, Chen JH, Richard K, et al. Lung adenocarcinoma and human papillomavirus infection. Cancer 2004;101:1428-1436.
63. Cheng YW, Chiou HL, Sheu GT, et al. The association of human papillomavirus 16/18 infection with lung cancer among nonsmoking Taiwanese women. Cancer Res 2001;61:2799-2803.
64. Lim WT, Chuah KL, Leong SS, et al. Assessment of human papillomavirus and Epstein-Barr virus in lung adenocarcinoma. Oncol Rep 2009;21:971-975.
65. Leroux C, Girard N, Cottin V, et al. Jaagsiekte Sheep Retrovirus (JSRV): from virus to lung cancer in sheep. Vet Res 2007;38:211-228.
66. Clement-Duchene C, Vignaud JM, Stoufflet A, et al. Characteristics of never smoker lung cancer including environmental and occupational risk factors. Lung Cancer 2010;67:144-150.
67. Toh CK, Gao F, Lim WT, et al. Never-smokers with lung cancer: epidemiologic evidence of a distinct disease entity. J Clin Oncol 2006;24:2245-2251.
68. Doran E, Jackman D. Fire Without Smoke: Lung Cancer in Never-Smokers. Oncology 2010;24:488-491.
69. Brownson RC, Loy TS, Ingram E, et al. Lung cancer in nonsmoking women. Histology and survival patterns. Cancer 1995;75:29-33.
70. Yang P, Cerhan JR, Vierkant RA, et al. Adenocarcinoma of the lung is strongly associated with cigarette smoking: further evidence from a prospective study of women. Am J Epidemiol 2002;156:1114-1122.
71. Cerfolio RJ, Bryant AS, Scott E, et al. Women with pathologic stage I, II, and III non-small cell lung cancer have better survival than men. Chest 2006;130:1796-1802
72. Muscat JE, Wynder EL. Lung cancer pathology in smokers, ex-smokers and never smokers. Cancer Lett 1995;88:1-5.
73. Dibble R, Langeburg W, Bair S, et al. Natural history of non-small cell lung cancer in nonsmokers. J Clin Oncol 2005;23:abstract 7252.
74. Epplein M, Schwartz SM, Potter JD, et al. Smokingadjusted lung cancer incidence among AsianAmericans (United States). Cancer Causes Control 2005;16:1085-1090.
75. Ou SH, Ziogas A, Zell J. Epidemiology study of neversmokers with non-small cell lung cancer (NSCLC): High percentages of Asian and Hispanic female neversmokers and the significance of Asian ethnicity. J Clin Oncol 2008;26::abstract 8004.
76. Wakelee H, Chang E, Shema S, et al. Survival after nonsmall cell lung cancer in never-smoking Asian/Pacific Islander and Latina women. Journal of Thoracic Oncology 2009;4:S310 (Abstract: A317.316).
77. Haiman CA, Stram DO, Wilkens LR, et al. Ethnic and racial differences in the smoking-related risk of lung cancer. N Engl J Med 2006;354:333-342.
78. Pinsky PF. Racial and ethnic differences in lung cancer incidence: how much is explained by differences in smoking patterns? (United States). Cancer Causes Control 2006;17:1017-1024.
79. Bryant A, Cerfolio RJ. Differences in epidemiology, histology, and survival between cigarette smokers and never-smokers who develop non-small cell lung cancer. Chest 2007;132:185-192.
80. Itaya T, Yamaoto N, Ando M, et al. Influence of histological type, smoking history and chemotherapy on survival after first-line therapy in patients with advanced non-small cell lung cancer. Cancer Sci 2007;98:226-230.
81. Nordquist LT, Simon GR, Cantor A, et al. Improved survival in never-smokers vs current smokers with primary adenocarcinoma of the lung. Chest 2004;126:347-351.
82. Yoshino I, Kawano D, Oba T, et al. Smoking status as a prognostic factor in patients with stage I pulmonary adenocarcinoma. Ann Thorac Surg 2006;81:1189-1193.
83. Tsao AS, Liu D, Lee JJ, et al. Smoking affects treatment outcome in patients with advanced nonsmall cell lung cancer. Cancer 2006;106:2428-2436.
84. Yano T, Miura N, Takenaka T, et al. Surgical results of non-small cell lung cancer in never-smokers as a separate entity. J Clin Oncol 2008;26 :398s.
85. Subramanian J, Velcheti V, Gao F, et al. Presentation and stage-specific outcomes of lifelong never-smokers with non-small cell lung cancer (NSCLC). J Thorac Oncol 2007;2:827-830.
86. Gomez SL, Chang ET, Shema SJ, et al. Survival following non-small cell lung cancer amaong Asian/Pacific Islander, Latina, and non-Hispanic White women who have never smoked. Cancer Epidemiol Biomarkers Prev 2011.
87. Mounawar M, Mukeria A, Le Calvez F, et al. Patterns of EGFR, HER2, TP53, and KRAS mutations of p14arf expression in non-small cell lung cancers in relation to smoking history. Cancer Res 2007;67:5667-5672.
88. Rudin CM, Avila-Tang E, Harris CC, et al. Lung cancer in never smokers: molecular profiles and therapeutic implications. Clin Cancer Res 2009;15:5646-5661.
89. Schwartz AG, Prysak GM, Block CH, et al. The molecular epidemiology of lung cancer. Carciogernesis 2007;28:507-518
90. LeeJ, LY, Kim JH, Kim SK, et al. Lung cancer in never smokers: Change of a mindset in the molecular era. Lung Cancer 2011.
91. Bell DW, Gore I, Okimoto RA, et al. Inherited susceptibility to lung cancer may be associated with the T790M drug resistance mutation in EGFR. Nat Genet 2005;37:1315-1316.
92. Pao W, Miller V, Zakowski M, et al. EGF receptor gene mutations are common in lung cancers from "never smokers" and are associated with sensitivity of tumors to gefitinib and erlotinib. Proc Natl Acad Sci U S A 2004;101:13306-13311.
93. Pham D, Kris MG, Riely GJ, et al. Use of cigarettesmoking history to estimate the likelihood of mutations in epidermal growth factor receptor gene exons 19 and 21 in lung adenocarcinomas. J Clin Oncol 2006; 24:1700-1704.
94. Sharma SV, Bell DW, Settleman J, et al. Epidermal growth factor receptor mutations in lung cancer. Nat Rev Cancer 2007;7:169-181.
95. Toyooka S, Matsuo K, Shigematsu H, et al. The impact of sex and smoking status on the mutational spectrum of epidermal growth factor receptor gene in non small cell lung cancer. Clin Cancer Res 2007;13:5763-5768.
96. Kosaka T, Yatabe Y, Endoh H, et al. Mutations of the epidermal growth factor receptor gene in lung cancer: biological and clinical implications. Cancer Res 2004;64:8919-8923.
97. Kawaguchi T, Ando M, Takada M, et al. Long exposure of environmental tobacco smoke associated with activating EGFR mutations in never-smokers with nonsmall cell lung cancer. Clin Cancer Res 2011;17:39-45
98. Soda M, Choi YL, Enomoto M, et al. Identification of the transforming EML4-ALK fusion gene in non-smallcell lung cancer. Nature 2007;448:561-566.
99. Shaw AT, Yeap BY, Mino-Kenudson M, et al. Clinical features and outcome of patients with non-small-cell lung cancer who harbor EML4-ALK. J Clin Oncol 2009;27:4247-4253.
100.Tam IY, Chung LP, Suen WS, et al. Distinct epidermal growth factor receptor and KRAS mutation patterns in non-small cell lung cancer patients with different tobacco exposure and clinicopathologic features. Clin Cancer Res 2006;12:1647-1653.
101.Burns T, Rudin C. Lung cancer in never smokers: beyond EGFR mutations and EGFR-TK Inhibitors. Oncology 2010;24:121-131.
102.Shigematsu H, Lin L, Takahashi T, et al. Clinical and biological features associated with epidermal growth factor receptor gene mutations in lung cancers. J Natl Cancer Inst 2005;97:339-346.
103.Riely GJ, Kris MG, Rosenbaum D, et al. Frequency and distinctive spectrum of KRAS mutations in never smokers with lung adenocarcinoma. Clin Cancer Res 2008;14:5731-5734.
104.Krishnaswamy S, Kanteti R, Duke-Cohan JS, et al. Ethnic differences and functional analysis of MET mutations in lung cancer. Clin Cancer Res 2009;15:5714-5723.
105.Engelman JA, Janne PA. Mechanisms of acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in non-small cell lung cancer. Clin Cancer Res 2008;14:2895-2899.
106.Le Calvez F, Mukeria A, Hunt JD, et al. TP53 and KRAS mutation load and types in lung cancers in relation to tobacco smoke: distinct patterns in never, former, and current smokers. Cancer Res 2005;65:5076-83.
107.Gealy R, Zhang L, Siegfried JM, et al. Comparison of mutations in the p53 and K-ras genes in lung carcinomas from smoking and nonsmoking women. Cancer Epidemiol Biomarkers Prev 1999;8:297-302. 108.
108. Toyooka S, Tsuda T, Gazdar AF. The TP53 gene, tobacco exposure, and lung cancer. Hum Mutat 2003;21:229-239.
109.Job B, Bernheim A, Beau-Faller M, et al. Genomic aberrations in lung adenocarcinoma in never smokers. PloS One 2010;5:e15145
110.Shaw A, Costa D, Mino-Kenudson M, et al. Clinicopathologic features of EML4-ALK mutant lung cancer. J Clin Oncol 2009;27:abstract 11021.
111.Shaw AP, Costa D, Lafrate A, et al. Clinical activity of the oral ALK and MET inhibitor PF-02341066 in nonsmall lung cancer (NSCLC) with EML4-ALK translocations. J Thorac Oncol 2009;4:S305-306:abstract A306.304.
112.Tsao MS, Sakurada A, Cutz JC, et al. Erlotinib in lung cancer - molecular and clinical predictors of outcome. N Engl J Med 2005;353:133-144.
113.Shepherd FA, Rodrigues Pereira J, Ciuleanu T, et al. Erlotinib in previously treated non-small-cell lung cancer. N Engl J Med 2005;353:123-132.
114.Lynch TJ, Bell DW, Sordella R, et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. N Engl J Med 2004;350:2129-2139.
115.Mok TS, Wu YL, Thongprasert S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med 2009;361:947-957.
116. NCT00446225. Available at http://clinicaltrials.gov. Last update Jan 23, 2010.
117.Herbst RS, Prager D, Hermann R, et al. TRIBUTE: a phase III trial of erlotinib hydrochloride (OSI-774) combined with carboplatin and paclitaxel chemotherapy in advanced non-small-cell lung cancer. J Clin Oncol 2005;23:5892-5899.
118.Foeglé J, Hedelin G, Lebitasy MP, et al. Specific features of non-small cell lung cancer in women: a retrospective study of 1738 cases diagnosed in Bas-Rhin between 1982 and 1997. J Thorac Oncol 2007;2:466-474.
119. Ferguson MK, Wang J, Hoffman PC, et al. Sexassociated differences in survival of patients undergoing resection for lung cancer. Ann Thorac Surg 2000;69:245-249.
120. de Perrot M, Licker M, Bouchardy C, et al. Sex differences in presentation, management, and prognosis of patients with non-small cell lung carcinoma. J Thorac Cardiovasc Surg 2000;119:21-26.
121. Minami H, Yoshimura M, Miyamoto Y, et al. Lung cancer in women: sex-associated differences in survival of patients undergoing resection for lung cancer. Chest 2000;118:1603-1609.
122. Radzikowska E, Glaz P, Roszkowski K. Lung cancer in women: age, smoking, histology, performance status, stage initial treatment and survival: population base study of 20,561 cases. Ann Oncol 2002;13:1087 -1093.
123.V sbal AL, Williams BA, Nichols FCr, et al. Gender differences in non-small-cell lung cancer survival: an analysis of 4,618 patients diagnosed between 1997 and 2002. Ann Thorac Surg 2004;78:209-215.
124.Sardari Nia P, Weyler J, Colpaert C, et al. Prognostic value of smoking status in operated non-small cell lung cancer. Lung Cancer 2005;47:351-359.
125.Fujisawa T, Lizasa T, Saitoh Y, et al. Smoking before surgery predicts poor long-term survival in patients with stage I non-small-cell lung carcinomas. J Clin Oncol 1999;17:2086-2091.
126.Tammemagi CM, Neslund-Dudas C, Simoff M, et al. Smoking and lung cancer survival: the role of comorbidity and treatment. Chest 2004;125:27-37.