
 English
English
 French
French
Pneumomédiastin au cours d’une dermatomyosite
Pneumomediastinum in dermatomyositis
B. Godbert (1), H. Nguyen Thi Dieu (2), G. Vu Van (2)
1 Service de Pneumologie, Hôpitaux de Brabois, Centre Hospitalier Universitaire de Nancy, France
2 Service de Pneumologie, Hôpital Bach Mai, Ha Noi, Vietnam
Corresponding author
Dr Benoît GODBERT
Service de Pneumologie
Hôpitaux de Brabois
Avenue de Bourgogne
54511 Vandoeuvre-lès-Nancy
Tel : 03.83.15.33.86; Fax : 03.83.15.34.06
Adresse e-mail: b.godbert@chu-nancy.fr
ABSTRACT
Introduction. Dermatomyositis is a rare idiopathic inflammatory disease of the muscles associated with dermatological manifestation. Among the known pulmonary complications, interstitial pneumonia occurs relatively often. Sometime, this interstitial pneumonia takes place into an anti-synthetase syndrome. Other complications such as pneumo-mediastinum and pneumothorax are more rarely.
Case report. We describe a case of dermatomyositis which was probably an anti-synthetase syndrome complicated by a pneumo-mediastinum, with a very extensive subcutaneous emphysema and then a pneumothorax. The evolution of the disease was unfavorable.
Conclusion. In this article we talk about the clinical particularity and the main physiopathological hypothesis of anti-synthetase syndrome.
Key-words: Dermatomyositis, Anti-synthetase, Interstitial pneumonia, Pneumomediastinum, Pneumothorax
RÉSUMÉ
Introduction. La dermatomyosite est une connectivite rare définie par une atteinte musculaire inflammatoire idiopathique, associée à des manifestations cutanées. Parmi les complications pulmonaires décrites les pneumopathies interstitielles sont une complication fréquente, s’inscrivant parfois dans le cadre d’un syndrome des anti-synthétases. D’autres complications sont plus rarement rapportées comme le pneumomédiastin et le pneumothorax.
Observation. Nous décrivons, une observation de dermatomyosite, compliquée d’un pneumomédiastin avec dissection aérique sous-cutanée massive suivi d’un pneumothorax, dont l’évolution a été défavorable.
Conclusion. Cette observation décrit les particularités cliniques et aborde les hypothèses physiopathologiques du syndrome des anti-synthétases.
Mots-clés: Dermatomyosite, Anti-synthétases, Pneumopathie interstitielle, Pneumomédiastin, Pneumothorax
INTRODUCTION
Nous rapportons ici un cas de dermatomyosite compliquée d’une pneumopathie interstitielle, rentrant probablement dans le cadre d’un syndrome des anti-synthétases. L’évolution a été marquée par la survenue d’un pneumomédiastin avec emphysème sous cutané majeur et d’un pneumothorax récidivant.
OBSERVATION
Une patiente âgée de 25 ans, consulte au service de rhumatologie de notre hôpital en avril 2002 pour des polyarthralgies touchant les articulations interphalangiennes des mains et les grosses articulations. Le bilan immunologique initial est négatif et le diagnostic de polyarthrite séro-négative est retenu. La patiente bénéficie d’une corticothérapie à la dose de 20 mg/j.
Au mois de juillet il apparaît des myalgies, une fatigabilité des ceintures musculaires ainsi que des acroparesthésies, un syndrome de Raynaud, des papules de Gottron, et un érythème violacé palpébral en lunettes et péri-unguéal. Le bilan biologique met en évidence une élévation de la vitesse de sédimentation à 50 millimètres à la première heure. Les taux des enzymes musculaires sont normaux, le taux des lactate déshydrogénases sont à 1000 UI/ml (normale < 250 UI/ml).
Le bilan immunologique révèle uniquement la présence d’anticorps antinucléaires à un titre de 1/40. L’antigénémie et les sérologies à cytomégalovirus (CMV) sont positives.
Les explorations fonctionnelles respiratoires mettent en évidence un syndrome restrictif modéré et un abaissement du coefficient de transfert du monoxyde de carbone à 65% de la valeur théorique.
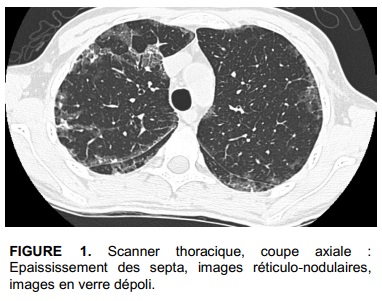
La tomodensitométrie thoracique montre des opacités réticulo-nodulaires périphériques bi-basales et des plages en verre dépoli (Fig.1).
Le lavage broncho-alvéolaire met en évidence une alvéolite lymphocytaire avec recherches bactériologique, mycologique et virologique négatives. L’électromyogramme (réalisé sous corticothérapie) est normal. Les biopsies musculaires et cutanées concluent à une dermatomyosite.
La patiente est placée sous 1 mg/kg/j de prednisolone et ganciclovir pendant 3 semaines.
Devant l’absence d’amélioration, 3 bolus de méthylprednisolone, une première cure de cyclophosphamide puis une cure d’immunoglobulines polyvalentes sont administrées.
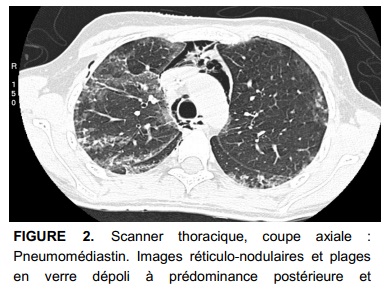
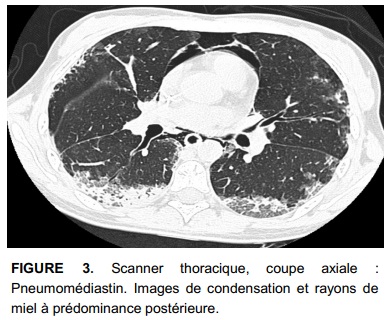
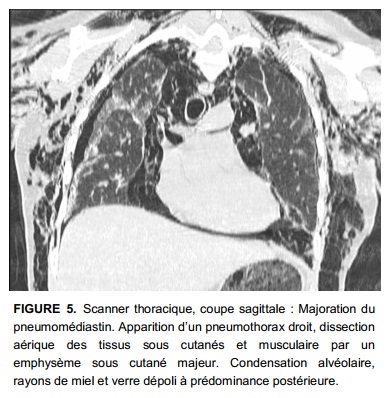
L’évolution est marquée par l’apparition d’un pneumomédiastin et une aggravation des images en rayon de miel, associés à des bronchectasies de traction et quelques kystes sous-pleuraux (Fig. 2 et 3), la patiente est alors adressée au service de pneumologie. Secondairement apparaissent une aggravation du pneumomédiastin et un emphysème sous cutané majeur associés à un pneumothorax droit nécessitant la mise en place d’un drain (Fig. 4 et 5). L’évolution est initialement favorable mais le pneumothorax droit et le pneumomédiastin récidivent début décembre. Une symphyse pleurale et des biopsies pulmonaires chirurgicales sont réalisées concluant à une pneumopathie interstitielle commune (UIP).
L’évolution est marquée par la persistance du pneumothorax et la survenue d’une pneumopathie nosocomiale à staphylococcus aureus méthi-sensible compliquée d’un choc septique. La patiente bénéficie d’une réanimation invasive mais décède le 27 décembre 2002.
DISCUSSION
Des critères communs cernent une définition d’ensemble des dermatomyosites (DMS) et des polymyosites (PMS) [1, 2]. Les critères cliniques sont un déficit musculaire bilatéral et symétrique des ceintures, accompagnés (DMS) ou non (PMS) de signes cutanés. Les manifestations cutanées classiquement décrites sont un érythème violacé péri-orbitaire en lunettes, et un érythème squameux douloureux de la sertissure des ongles ou de la face d’extension des articulations dénommé papule de Gottron.
L’étude anatomopathologique met en évidence un aspect de nécrose des fibres musculaires avec des foyers de régénération, avec ou sans infiltrat inflammatoire et une atrophie périfasciculaire. Une élévation du taux sérique des enzymes musculaires est inconstamment retrouvée. Enfin à l'électromyogramme, il existe une triade caractéristique avec des potentiels d'unité motrice courts et polyphasiques, des fibrillations et des décharges répétées à haute fréquence.
Dans notre observation, il existe d’autres manifestations cliniques, évocatrices d’un syndrome des anti-synthétases (SAS). Le SAS est défini par l’association d’une myosite inflammatoire, d’une pneumopathie interstitielle, d’anomalies cutanées caractéristiques à type de « mains de mécanicien » (kératose fissuraire), d’un syndrome de Raynaud, d’une polyarthrite inflammatoire, et sur le plan biologique d’auto-anticorps antinucléaires appelés anti-synthétase (anti-JO1) [3]. Les anti-JO1 sont présents dans 30 à 60% des cas. Si la sérologie anti-JO1 est négative la recherche d’autres anticorps anti-synthétases doit être effectuée [4]. Il s’agit des anticorps anti-OJ (anti-isoleucine-ARNt synthétase), anti-EJ (anti-glycyl-ARNt synthétase), anti-PL7 (anti-thréonyl-ARNt synthétase), anti-PL12 (anti-alanine-ARNt synthétase) et anti-KS (anti-asparaginyl-ARNt synthétase) [5].
Cette recherche n’a pas pu être réalisée pour notre patiente. Les facteurs suspects d’être incriminés dans la genèse du SAS sont une dysrégulation de l’immunité cellulaire et humorale avec production d’auto-anticorps [4], des facteurs génétiques [5] et des agents infectieux pathogènes notamment viraux [5, 6]. Parmi les auto-anticorps, sont décrit les anticorps dirigés contre les cellules endothéliales [7], des cytokératines, des intégrines ou des métalloprotéases [8, 9].
Des arguments génétiques ont par ailleurs été avancés en raison de la prévalence plus importante de la maladie dans certaines populations (japonais) et d’haplotypes HLA, plus fréquemment atteints [5]. Enfin la responsabilité de micro-organismes infectieux pathogènes, notamment des virus (cytomégaloirus, picornavirus, coxsackie, Epstein Barr virus) est suspectée [5, 6]. Dans notre observation, une infection à CMV a été authentifiée par la présence de l’antigène pp65 dans le sérum de la patiente. Toutefois il est difficile de préciser si cette infection entre dans la genèse de la maladie systémique ou si sa présence est le fait d’une réactivation chez une patiente anciennement infectée sous traitement corticoïde.
CONCLUSION
Parmi les complications pulmonaires des DMS, une pneumopathie interstitielle est rapportée dans 5 à 64% des cas. Cette complication est grave puisqu’elle représente l’une des premières causes de mortalité au cours des myosites. Elle peut s’inscrire dans le cadre d’un SAS (30 à 60% des cas). Sa physiopathologie implique probablement des mécanismes immunologiques, génétiques et peut-être viraux.
REFERENCES
1. Bohan A, Peter JB. Polymyositis and dermatomyositis. N Engl J Med 1975 ; 292 : 403-7.
2. Dalakas MC, Hohlfeld R. Polymyositis and dermatomyositis. Lancet 2003 ; 362 : 971-82.
3. Marie I, Dominique S, Rémy-Jardin M, Hatron PY, Hachulla E. Interstitial lung diseases in polymyositis and dermatomyositis. Rev Med Interne 2001 ; 22 :1083-96.
4. Bergoin C, Bure M, Tavernier JY, Lamblin C, Maurage CA, Remy-Jardin M, Wallaert B. Le syndrome des anti-synthétases. Rev Mal Respir 2002 ;19 : 371-4.
5. Marie I, Hatron PY, Hachulla E, Wallaert B, Michon-pasturelle U, Devulder B. Pulmonary involvement in polymyositis and in dermatomyositis. J Rheumatol 1998 ; 25 : 1336-43.
6. Salmeron G, Greenberg SD, Lidsky MD. Polymyositis and diffuse interstitial lung disease: A review of the histopathologic findings. Arch Intern Med 1981 ; 141 :1005-10.
7. Cervera R, Ramirez G, Fernandez-Sola J, D’Cruz D, Casademont J, Grau JM, Asherson RA, Khamashta MA, Urbano-Marquez A, Hughes GR. Antibodies to endothelial cells in dermatomyositis : association to interstitial lung disease. Br Med J 1991 ; 302 : 880-1.
8. Fujita J, Dobashi N, Tokuda M, Bandoh S, Ohtsuki Y, Yamadori I, Yoshinouchi T, Ueda Y, Takahara J. Elevation of cytokeratine 19 fragment in patients with polymyositis/dermatomyositis. J Rheumatol 1999 ; 26 : 2377-82.
9. Fujita J, Takeuchi T, Dobashi N, Ohtsuki Y, Tokuda M, Takahara J. Detection of anti-ADAM 10 antibody in serum of a patient with pulmonary fibrosis associated with dermatomyositis. Ann Rheum Dis 1999 ; 58 : 770-2.
FIGURES

REFERENCES
1. Bohan A, Peter JB. Polymyositis and dermatomyositis. N Engl J Med 1975 ; 292 : 403-7.
2. Dalakas MC, Hohlfeld R. Polymyositis and dermatomyositis. Lancet 2003 ; 362 : 971-82.
3. Marie I, Dominique S, Rémy-Jardin M, Hatron PY, Hachulla E. Interstitial lung diseases in polymyositis and dermatomyositis. Rev Med Interne 2001 ; 22 :1083-96.
4. Bergoin C, Bure M, Tavernier JY, Lamblin C, Maurage CA, Remy-Jardin M, Wallaert B. Le syndrome des anti-synthétases. Rev Mal Respir 2002 ;19 : 371-4.
5. Marie I, Hatron PY, Hachulla E, Wallaert B, Michon-pasturelle U, Devulder B. Pulmonary involvement in polymyositis and in dermatomyositis. J Rheumatol 1998 ; 25 : 1336-43.
6. Salmeron G, Greenberg SD, Lidsky MD. Polymyositis and diffuse interstitial lung disease: A review of the histopathologic findings. Arch Intern Med 1981 ; 141 :1005-10.
7. Cervera R, Ramirez G, Fernandez-Sola J, D’Cruz D, Casademont J, Grau JM, Asherson RA, Khamashta MA, Urbano-Marquez A, Hughes GR. Antibodies to endothelial cells in dermatomyositis : association to interstitial lung disease. Br Med J 1991 ; 302 : 880-1.
8. Fujita J, Dobashi N, Tokuda M, Bandoh S, Ohtsuki Y, Yamadori I, Yoshinouchi T, Ueda Y, Takahara J. Elevation of cytokeratine 19 fragment in patients with polymyositis/dermatomyositis. J Rheumatol 1999 ; 26 : 2377-82.
9. Fujita J, Takeuchi T, Dobashi N, Ohtsuki Y, Tokuda M, Takahara J. Detection of anti-ADAM 10 antibody in serum of a patient with pulmonary fibrosis associated with dermatomyositis. Ann Rheum Dis 1999 ; 58 : 770-2.
ARTICLE INFO
DOI: 10.12699/jfvp.1.1.2010.83
Conflict of Interest
Non
Date of manuscript receiving
8/4/2010
Date of publication after correction
16/8/2010
Article citation
Godbert B, Nguyen Thi Dieu H, Vu Van G. Pneumomediastinum in dermatomyositis. J Func Vent Pulm 2010;01(01):83-85.