
 English
English
 French
French
Parietal reconstruction: a challenging issue in the management of chest wall tumors.
La reconstruction pariétale: un problème posé au cours de la prise en charge des tumeurs de la paroi thoracique.
S. Rabiou1, B. Efared 2, Y. Hama 3,5, J. Didier 3,5, R. Sani 3,5, S. Sanoussi 4,5, J. Ghalimi1, M. Lakranbi 1, A. Oufkir 6,7, Y. Ouadnouni 1,7, M. Smahi 1,7.
1: Service de Chirurgie Thoracique, CHU Hassan II, Fès, Maroc.
2: Service d’Anatomie et de Cytologie Pathologiques, CHU Hassan II, Fès, Maroc.
3: Service de Chirurgie Générale, HNN, Niamey, Niger.
4: Service de Neurochirurgie, HNN, Niamey, Niger.
5: Faculté des Sciences de la Santé, Université Abdou Moumouni, Niamey, Niger.
6: Service de Chirurgie Plastique et Réparatrice, CHU Hassan II, Fès, Maroc .
7: Faculté de Médecine et de Pharmacie, Université Sidi-Mohamed-Ben-Abdellah, Fès, Maroc.
Corresponding author
Dr. Sani RABIOU
Service de Chirurgie Thoracique C1 – CHU Hassan II, Fès, Maroc.
E-mail: rabiousani2@icloud.com.
ABSTRACT
Chest wall tumors constitute a heterogenous group of diseases sharing in common the critical issue of surgical treatment. The surgery of these tumors has been regarded as heavy for a long time, and most often associated with a very poor prognosis. Progress have been made in the management of chest wall tumors especially the possibility of making wide parietal resections, with better outcome and survival in malignant chest wall tumors. Several surgical methods are available to reconstruct parietectomies according to the size, degree of defect, type and location. Outcomes of these procedures have become satisfactory in terms of morbidity and mortality, and the parietectomy no longer affect the prognosis. The optimal outcome requires thorough preoperative assessement. The surgery should be well scheduled, foreseeing potential complications and try to reconcile the imperative of complete resection with better respiratory function.
KEYWORDS: Chest wall tumors, parietectomy, parietal reconstruction, thoracic flaps.
RÉSUMÉ
Les tumeurs de la paroi thoracique sont un groupe hétérogène de pathologies dont le principal point commun est la perspective d’un traitement chirurgical. Cette chirurgie a longtemps gardé la réputation d’être une chirurgie lourde et souvent associée à un pronostic très péjoratif. La prise en charge de ces tumeurs a connue beaucoup de progrès, notamment dans la possibilité de réaliser des larges résections de la paroi thoracique qui est aujourd’hui considéré comme un facteur augmentant la survie des tumeurs malignes de la paroi thoracique. De nombreuses procédures chirurgicales sont couramment utilisées pour reconstruire les pariétectomies en fonction de la taille, de la perte de substance, de son type ainsi que de sa localisation. Les résultats en termes de morbidité et de mortalité associées à ces procédures sont devenus acceptables, et la pariétectomie n’aggrave plus, en elle-même, le pronostic. L’obtention d’un résultat optimal ne peut être envisagée qu’au prix du respect des principes fondamentaux basés sur un bilan préopératoire spécifique et détaillé. Il s’agit de planifier la chirurgie, d’en prévoir les éventuelles difficultés de façon à pouvoir concilier les impératifs d’une résection complète et ceux du maintien d’une fonction respiratoire acceptable.
MOTS CLÉS: Tumeurs de la paroi thoracique, pariétectomie, reconstruction pariétale, lambeaux thoracique.
INTRODUCTION
Les tumeurs de la paroi thoracique constituent un groupe d’affections hétérogènes ayant comme seul
point commun le fait de se localiser au niveau de la partie osseuse ou molle de la paroi thoracique. Ces
tumeurs sont tantôt bénignes, tantôt malignes et dans ce dernier cas, les lésions sont soit primitives se développant à partir de la paroi thoracique soit secondaires constituées par des métastases des cancers primitifs thoraciques ou extra-thoraciques [1,2].
Dans ce contexte, les investigations complémentaires sont nécessaires pour savoir si la tumeur est purement pariétale ou au contraire une masse endothoracique avec extension pariétale par contiguïté. Nous avons dans le même sens exclu de cet exposé, des tumeurs ayant une spécificité topographique comme les tumeurs du sein et celles de la colonne vertébrale. À l’exception des pseudotumeurs et de certaines tumeurs dites médicales, le traitement commun des tumeurs de la paroi thoracique semble être chirurgical [3,4]. Cette chirurgie a connu beaucoup de progrès dans ce domaine, tout en respectant les principes fondamentaux de la chirurgie pariétale carcinologique conduisant souvent à des larges ré- sections pariétales. Le pronostic est devenu meilleur aujourd’hui grâce à des possibilités de transpositions ostéo-musculo-cutanées, la réalisation des lambeaux vasculaires libres et des prothèses synthétiques.
Nous décrirons ainsi quelques particularités cliniques des tumeurs de la paroi thoracique nécessaires à la compréhension des problèmes posés lors de leur prise en charge.
CLASSIFICATION DES TUMEURS DE LA PAROI THORACIQUE
Les tumeurs de la paroi thoracique peuvent être classées en:
Tumeurs bénignes.
Tumeurs à malignité réduite.
Tumeurs malignes:
- Médicales pures dont la prise en charge exclut toute intervention chirurgicale comme les lymphomes, les plasmocytomes, …etc.
- Chirurgicales pures dont la guérison dépend exclusivement de l’ablation chirurgicale de la tumeur comme les sarcomes de bas grade, les chondrosarcomes, …etc.
- Médico-chirurgicales comme sarcomes de haut grade, sarcome d’Ewing, ostéosarcome,… etc. Pour ces tumeurs la chirurgie vient avant ou après un traitement adjuvant complémentaire.
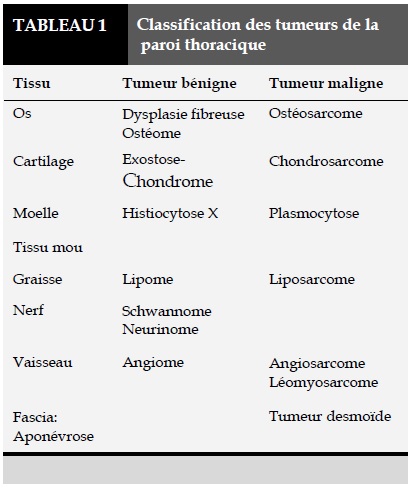
De Monpreville et al. ont établi une classification des tumeurs thoraciques résumée dans le Tableaux 1 [2]. L’examen physique, les clichés radiographiques du thorax avec des incidences de profil sont souvent d’un grand secours. L’apport du scanner thoracique, avec surtout des reconstructions est indispensable pour une bonne délimitation de la tumeur ainsi que ses rapports avec les structures adjacentes. L’imagerie par résonance magnétique nucléaire est très appréciée pour l’analyse précise des lésions des tissus mous. Enfin la biopsie préopératoire est la clé pour juger de la nature maligne ou bénigne, primaire ou métastatique de la tumeur. Mais l’examen histologique de la pièce opératoire reste toujours recommandé [5].
COMMENT MENER A BIEN UNE EXERESE CHIRURGICALE CARCINOLOGIQUE
La voie d’abord doit se faire dans l’axe des côtes ou des muscles concernés, de façon à pouvoir sectionner le ou les muscles en amont et en aval de la tumeur. Dans le cas des sarcomes de la paroi thoracique, l’incision doit être faite dans l’axe des côtes de façon à pouvoir les réséquer si nécessaire. La cicatrice doit pouvoir être reprise facilement en cas de récidive. La résection doit être effectuée en un seul bloc, la tumeur étant entourée de tissu sain d’emblée [6]. Il ne faut pas « disséquer » la tumeur à son contact afin d’éviter le risque de l’ouvrir, car ces lésions souvent nécrotiques peuvent être friables. Il n’est donc pas indiqué de faire des recoupes musculaires (qui sous entendent que l’on a d’abord énucléé la tumeur puis effectué les recoupes pour réséquer la « coque » de la tumeur, ce qui expose en pratique à une contamination du champ opératoire, même si les marges définies sur les recoupes par l’anatomopathologiste sont saines).
Dans les cas d’envahissement musculo-cutané important, il faut prévoir en préopératoire la mise en place d’un lambeau musculo-cutané de couverture.
Le curage ganglionnaire n’est pas systématique.
Les drainages sont placés dans l’axe et à proximité de la cicatrice, afin de pouvoir être repris facilement en cas de récidive.
La pièce d’exérèse est envoyée à l’anatomopathologiste, orientée et fixée sur un liège avec un schéma.
TYPES D’EXERESE CHIRURGICALE
Les différentes modalités d’exérèse sont définies par rapport aux notions anatomiques d’extension tumorale et en fonction de la marge minimale d’exérèse. L’exérèse large est le standard chirurgical [7]. La tumeur est emportée en bloc avec une marge de tissu sain sur toute sa surface. Le caractère « large » de la chirurgie ne dépend pas de ce qu’on enlève, mais de la qualité des marges chirurgicales définie par l’anatomopathologiste sur l’ensemble de la périphérie de la tumeur. Ce n’est donc pas parce que la pièce est volumineuse que l’exérèse est large.
Ainsi, l’exérèse large a une définition clinique et anatomopathologique. Cela consiste à emporter du tissu sain dans tous les plans et/ou une barrière anatomique (par exemple, l’aponévrose). La quantité de tissu sain périphérique nécessaire n’est pas encore clairement déterminée.
PRINCIPES DE RECONSTRUCTION PARIETALE
Les principes sont de reconstituer une rigidité parié-tale dynamique afin de conserver la fonction respiratoire. Il faut donc restaurer une stabilité pariétale suffisante, afin d’éviter l’apparition d’une respiration paradoxale, d’éviter une infection ou une désunion pariétale et enfin d’éviter la constitution d’une hernie pulmonaire [8].
MATÉRIEL DE RECONSTRUCTION
Deux types de matériaux peuvent être utilisés: synthétiques ou biologiques.
Les lambeaux
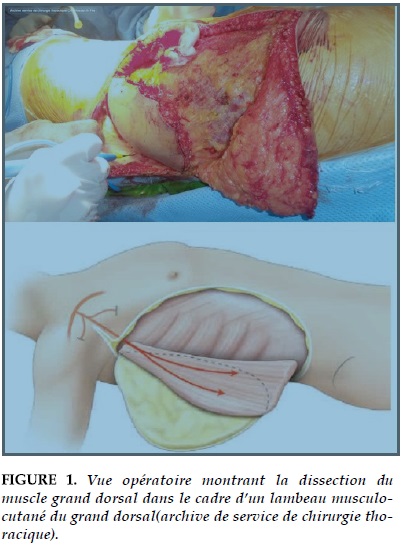
La couverture par lambeau (Figure 1) présente de multiples avantages dans la reconstruction après l’exérèse d’une tumeur pariétale:
Elle autorise l’exérèse de certaines tumeurs agressives qui, sans lambeaux, ne pouvaient pas être opé- rées ;
Elle autorise la chirurgie des récidives voire même des tumeurs en territoire irradié ;
Elle permet de reprendre l’exérèse d’une lésion qui a été biopsiée ou drainée de manière ectopique car, dans ces cas, l’exérèse nécessite d’enlever une zone de peau plus importante que la lésion initiale. Il est essentiel de ne pas faire de reconstruction sur une exérèse non carcinologique sous peine de récidive ou de poursuite évolutive rapide de la lésion, avec « perte » d’une possibilité de reconstruction en cas de reprise. Le lambeau de couverture doit être le plus simple possible techniquement et le plus fiable possible sur le plan vasculaire. Le lambeau pédiculé est techniquement plus facile et s’adapte mieux sur un terrain difficile; l’inconvénient est la mise en communication entre la zone de prélèvement et celle d’exérèse. Néanmoins, cette solution doit être privilégiée. Dans ce cas, il est encore plus fondamental que l’exérèse de la lésion soit carcinologique, sinon le risque de récidive s’étend sur l’ensemble de l’aire opératoire.
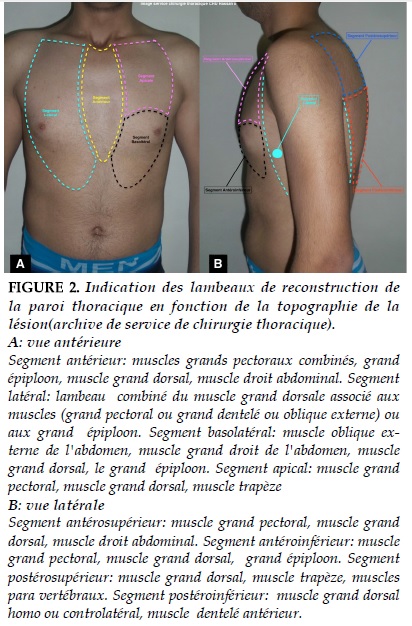
La reconstruction doit tenir compte non seulement des traitements déjà effectués comme la radiothérapie locorégionale, la chimiothérapie néoadjuvante mais aussi des traitements à prévoir après exérèse chirurgicale. La Figure 2 donne un aperçu des indications des lambeaux de reconstruction de la paroi thoracique en fonction de la topographie de la lésion.
L’état général, l’âge du patient et ses antécédents sont à prendre en compte dans le choix du lambeau. Si le lambeau de reconstruction est contre-indiqué, il faudra privilégier d’autres traitements locorégionaux tels que la radiothérapie, car les exérèses incomplètes sont inutiles. Le lambeau libre évite le contact entre site de prélèvement et zone d’exérèse, mais ne doit se faire qu’en cas d’impossibilité du lambeau locoré- gional. L’inconvénient est la nécessité d’avoir une équipe de microchirurgie entraînée et disponible.
Matériaux synthétiques
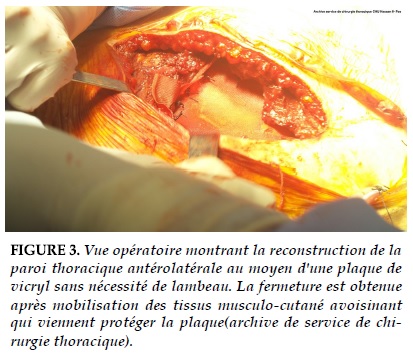
Ce sont les plaques résorbables de polyglactine (Vicryl) (Figure 3), polydioxanone (PDS), les plaques non résorbables de polyéthylène tétraphtalate (Mersilène), de polypropylène (Marlex ou Prolène), les plaques de polytétrafluoroéthylène (Goretex), le ciment synthétique/méthylméthacrylate, et les barres Stratos (adapté pour la reconstruction des côtes et du sternum) [9]. Les matériaux synthétiques ont l’avantage de permettre une réparation rapide, facile et stable d’emblée. La réparation de très larges defects est envisageable. Les réparations pariétales par des matériaux synthétiques répondent à certains impératifs : rigidité, intégration dans les tissus, relative résistance à l’infection, obtention d’une dynamique pariétale lors de la respiration.
Les principaux inconvénients sont l’introduction d’un corps étranger, et donc la sensibilité aux infections. Ainsi, le méthylméthacrylate a été progressivement abandonné en raison des risques d’infection et de toxicité au moment de la pose.
La plupart du temps, le choix du matériau repose sur les préférences du chirurgien. Des études ont
montré l’absence de différence significative entre les différents matériaux dans les suites opératoires et les éventuelles complications [10].
INDICATIONS DE LA RECONSTRUCTION PARIETALE [11-13]
La réparation pariétale n’est pas obligatoire en cas de defect pariétal de moins de 5 cm de diamètre ou limité à une ou deux côtes adjacentes, surtout s’il s’agit des arcs postérieurs des côtes. Elle n’est pas non plus indiquée en cas de localisation apicale ou sousscapulaire de moins de 7 cm et au-dessus du 4ième espace intercostal dans la portion latérale ou posté- rieure. Dans ces cas, une fermeture primaire par rapprochement des côtes adjacentes est en général suffisante. Une plaque résorbable peut parfois être mise en place car elle n’augmente pas le risque d’infection.
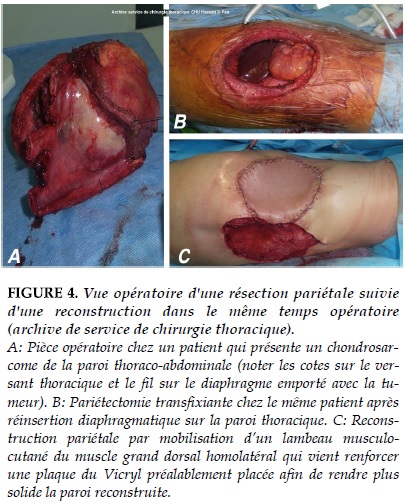
La réparation pariétale est indispensable dans tous les autres cas, en particulier lors des larges pariétectomies antérieures et antérolatérales (Figure 3 et 4), où la stabilité pariétale est particulièrement compromise, mais également lorsque le defect est localisé sous la pointe de l’omoplate car il existe des risques d’incarcération de l’omoplate dans le thorax lors des mouvements du bras, ce qui peut devenir particuliè- rement douloureux. Si les voies d’abord et les techniques de résection sont très codifiées, les techniques de réparation sont plus fonction de l’appréciation de chaque opérateur. En pratique, à partir du moment où les grands principes de réparation sont respectés, toutes les techniques de réparation sont envisageables.
CONCLUSION
La chirurgie constitue la meilleure option thérapeutique dans la majorité des cas de tumeurs de la paroi thoracique en offrant la possibilité d’un traitement curatif de la maladie ainsi que celui de la douleur qu’elle engendre. Avant toute décision opératoire, un bilan pré-opératoire est essentiel pour éliminer non seulement une contre indication, mais entrevoir les éventuelles difficultés peropératoires dans le cadre d’une reconstruction pariétale. La sélection raisonnée des matériaux prothétiques et des lambeaux de couverture, effectuée en fonction des caractéristiques du terrain, du site récepteur et de la localisation exacte de la tumeur sur le segment de la paroi thoracique sont aussi des éléments déterminants. Enfin, nous recommandons un suivi postopératoire à court et à long terme avec une réhabilitation ventilatoire adaptée aux différents types de reconstruction parié- tale afin d’optimiser la survie des patients.
CONFLIT D’INTÉRÊT
Aucun.
RÉFÉRENCES
1. Chapelier AR, Bacha EA, De Montpréville V, et al. Radical resection of radiation-induced sarcoma of the chest wall: Report of 15 cases. Ann Thorac Surg 1997; 63:214.
2. De Monpreville V, Zemoura L, Dumet E. Classification des tumeurs primitives de la paroi thoracique. Service d’anatomie pathologique. Centre chirurgical marie Lannelongue 2002. http:// www.thorax.org/ journee2002/Classifictumeurparoie.htm
3. Ozulu BA, Genc O, Gurkok S, et al. Chest Wall Tumors . Asian Cardiovasc Thorac Ann 1998; 6(3): 212-5.
4. Yamuzaki K, Kyobu G. Surgical management of chest wall tumours. The Japanese Journal of thoracic Surgery 1999; 52: 392-4.
5. Etienne Odimba F K, Bernard K. Les problèmes posés au cours de la prise en charge des tumeurs de la paroi thoracique dans les centres médicaux peu nantis. emémoires de l'Académie Nationale de Chirurgie 2011; 10 (1): 097-101
6. Stojadinovic A, Leung DH, Hoos A, et al. Analysis of the prognostic significance of microscopic margins in 2,084 localized primary adult soft tissue sarcomas. Ann Surg 2002; 235 (3) : 424-34.
7. Clark MA, Fisher C, Judson I, et al. Soft-tissue sarcomas in adults. N Engl J Med 2005; 353 (7): 701-11.
8. Deschamps C, Tirnaksiz BM, Darbandi R et al. Early and long-term results of prosthetic chest wall reconstruction. J Thor Cardiovasc Sur 1999; 117: 588-91.
9. Hamad AM, Marulli G, Bulf R, Rea F. Titanium plates support for chest wall reconstruction with Gore-Tex dual mesh after sternochondral resection. Eur J Cardiothorac Surg 2009; 36: 779-80.
10. Deschamps C, Tirnaksiz BM, Darbandi R et al. Early and long-term results of prosthetic chest wall reconstruction. J Thor Cardiovasc Sur 1999; 117: 588-91.
11. Incarbone M, Nava M, Lequaglie C, et al. Sternal resection for primary or secondary tumors. J Thorac Cardiovasc Surg 1997; 114: 93-9.
12. Chapelier AR, Missana MC, Couturaud B et al. Sternal resection and reconstruction for primary malignant tumors. Ann Thorac Surg 2004; 77: 1001-6.
13. Liao HT, Cheng MH, Ulusal BG, et al. Deep inferior epigastric perforator flap for successful simultaneous breast and chest wall reconstruction in a Poland anomaly patient. Ann Plastic Surg 2005; 55: 422-6.
FIGURES AND TABLES
REFERENCES
1. Chapelier AR, Bacha EA, De Montpréville V, et al. Radical resection of radiation-induced sarcoma of the chest wall: Report of 15 cases. Ann Thorac Surg 1997; 63:214.
2. De Monpreville V, Zemoura L, Dumet E. Classification des tumeurs primitives de la paroi thoracique. Service d’anatomie pathologique. Centre chirurgical marie Lannelongue 2002. http:// www.thorax.org/ journee2002/Classifictumeurparoie.htm
3. Ozulu BA, Genc O, Gurkok S, et al. Chest Wall Tumors . Asian Cardiovasc Thorac Ann 1998; 6(3): 212-5.
4. Yamuzaki K, Kyobu G. Surgical management of chest wall tumours. The Japanese Journal of thoracic Surgery 1999; 52: 392-4.
5. Etienne Odimba F K, Bernard K. Les problèmes posés au cours de la prise en charge des tumeurs de la paroi thoracique dans les centres médicaux peu nantis. emémoires de l'Académie Nationale de Chirurgie 2011; 10 (1): 097-101
6. Stojadinovic A, Leung DH, Hoos A, et al. Analysis of the prognostic significance of microscopic margins in 2,084 localized primary adult soft tissue sarcomas. Ann Surg 2002; 235 (3) : 424-34.
7. Clark MA, Fisher C, Judson I, et al. Soft-tissue sarcomas in adults. N Engl J Med 2005; 353 (7): 701-11.
8. Deschamps C, Tirnaksiz BM, Darbandi R et al. Early and long-term results of prosthetic chest wall reconstruction. J Thor Cardiovasc Sur 1999; 117: 588-91.
9. Hamad AM, Marulli G, Bulf R, Rea F. Titanium plates support for chest wall reconstruction with Gore-Tex dual mesh after sternochondral resection. Eur J Cardiothorac Surg 2009; 36: 779-80.
10. Deschamps C, Tirnaksiz BM, Darbandi R et al. Early and long-term results of prosthetic chest wall reconstruction. J Thor Cardiovasc Sur 1999; 117: 588-91.
11. Incarbone M, Nava M, Lequaglie C, et al. Sternal resection for primary or secondary tumors. J Thorac Cardiovasc Surg 1997; 114: 93-9.
12. Chapelier AR, Missana MC, Couturaud B et al. Sternal resection and reconstruction for primary malignant tumors. Ann Thorac Surg 2004; 77: 1001-6.
13. Liao HT, Cheng MH, Ulusal BG, et al. Deep inferior epigastric perforator flap for successful simultaneous breast and chest wall reconstruction in a Poland anomaly patient. Ann Plastic Surg 2005; 55: 422-6.
ARTICLE INFO
DOI: 10.12699/jfvp.7.21.2016.2
Conflict of Interest
Non
Date of manuscript receiving
22/3/2016
Date of publication after correction
15/7/2016
Article citation
Rabiou S, Efared B, Hama Y, Didier J, Sani R, Sanoussi S, Ghalimi J, Lakranbi M, Oufkir A, Ouadnouni Y, Smahi M. Parietal reconstruction: a challenging issue in the management of chest wall tumors. J Func Vent Pulm 2016;21(7):2-6.