
 English
English
 French
French
Current chalenge in lung transplantation
Les défis actuels en transplantation pulmonaire
Carine Ngo
Institut Curie. Paris
Université Paris Descartes. France
Corresponding author
Dr. NGO Carine
Institut Curie. Université Paris Descartes. France
E-mail: carine.ngo@curie.fr
ABSTRACT
Lung transplantation is now the ultimate effective treatment for terminal respiratory failure. Lung transplantation has made considerable progress over the past 20 years internationally in number and quality with continuous and significant improvement in results over the years.
Despite considerable progress in lung transplantation, it remains burdened with high mortality in the long term due to chronic graft dysfunction whose BOS (bronchiolitis obliterant syndrome) is the main event. The vast majority of patients with acute cellular rejection, initially recognized as the predominant form of acute rejection and a major risk factor for bronchiolitis obliterant syndrome, can now be successfully treated by intensifying conventional immunosuppressive therapy.
However, there is a growing recognition, since ten years, the major role of antibody-mediated rejection (antibody-mediated rejection, or AMR) or humoral rejection (HR), not only in the acute graft dysfunction, but also in late graft loss, including kidney and heart transplantation.
In lung transplantation, the present classification of pulmonary rejection does not yet reflect the humoral rejection even if circumstantial evidence of the role of humoral alloimmunization in the lung graft dysfunction emerge and multiply. The diagnosis of humoral rejection in lung transplantation remains a challenge, the criteria are less well defined and more controversial in kidney and heart transplant.
KEYWORDS: Lung transplantation pulmonaire, obliterant bronchiolitis, humoral rejection, graft dysfonction
RÉSUMÉ
La transplantation pulmonaire constitue aujourd’hui l’ultime traitement efficace de l’insuffisance respiratoire terminale. La transplantation pulmonaire a connu des progrès considérables au cours des 20 dernières années au niveau international en nombre et qualité avec une amélioration continue et significative des résultats au fil des ans.
Malgré des progrès considérables en transplantation pulmonaire, celle-ci reste grevée d’une mortalité élevée à long terme, due à la dysfonction chronique du greffon dont le BOS (syndrome de bronchiolite oblitérante) est la principale manifestation. La vaste majorité des patients présentant un rejet aigu cellulaire, reconnue initialement comme la forme prédominante du rejet aigu et un facteur de risque majeur du syndrome de bronchiolite oblitérante, peuvent aujourd’hui être traités avec succès par une intensification du traitement immunosuppresseur conventionnel.
Cependant, il existe une reconnaissance accrue, depuis une dizaine d’années, du rôle majeur du rejet médié par les anticorps (antibody-mediated rejection ou AMR) ou rejet humoral (RH), non seulement dans la dysfonction aigue du greffon, mais aussi dans la perte tardive du greffon, notamment en transplantation rénale et cardiaque.
En transplantation pulmonaire, la classification actualisée du rejet pulmonaire ne prend pas encore en compte le rejet humoral même si des preuves circonstancielles du rôle de l’allo-immunisation humorale dans la dysfonction du greffon pulmonaire émergent et se multiplient. Le diagnostic de rejet humoral en transplantation pulmonaire demeure un défi, les critères étant moins bien définis et plus controversés qu’en transplantation rénale et cardiaque.
MOTS CLÉS: Transplantation pulmonaire, bronchiolite oblitérante, rejet humoral, dysfonction du greffon
INTRODUCTION
L’étude des données épidémiologiques permet de mieux comprendre les particularités du rejet en transplantation pulmonaire. L’identification des principaux obstacles à la survie des greffés pulmonaires et de leurs facteurs prédictifs constitue un des challenges de ces dernières décennies.
ÉPIDÉMIOLOGIE
La transplantation pulmonaire constitue aujourd’hui l’ultime traitement efficace de l’insuffisance respiratoire terminale.
La transplantation pulmonaire a connu des progrès considérables au cours des 20 dernières années au niveau international en nombre et qualité avec une amélioration continue et significative des résultats au fil des ans.
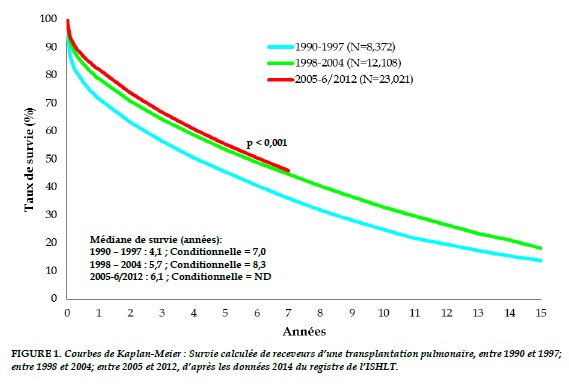
Le nombre de greffes pulmonaires n’a cessé d’augmenter, passant de plus de 1000 en 1993 à plus de 3800 greffes pulmonaires réalisées dans le monde en 2012, selon les données du registre de l’International Society of Heart and Lung Transplantation (ISHLT) [1]. La survie médiane est passée de 4,1 ans à 6,1 ans pour les patients transplantés respectivement pendant les périodes 1990–1997 et 2005–2012 (Figure 1).
La médiane de survie de la greffe et la médiane de survie conditionnelle (temps de survie de 50% pour les receveurs vivants 1 an post-transplantation) sont présentées selon la période de la greffe.
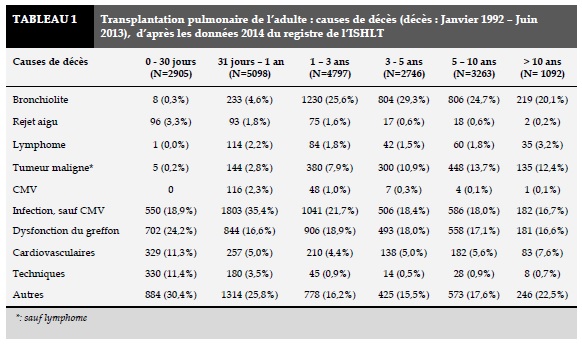
Cependant, ces améliorations remarquables ne doivent pas occulter les obstacles persistants qui sont à l’origine d’une survie à long terme des greffés pulmonaires inférieure à celle de patients ayant bénéficié d’autres types de transplantation d’organe solide. La survie globale à 10 ans est de seulement 28% pour les transplantés pulmonaires, contre 54% pour le cœur, 60% pour le foie et 61% pour le rein [2].
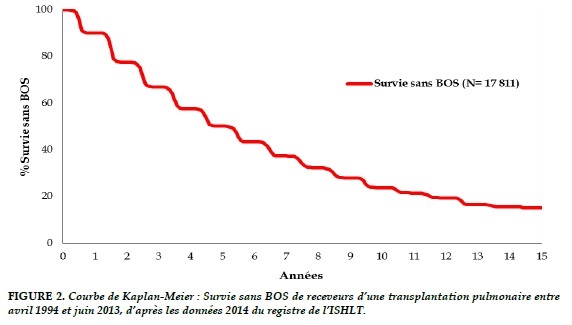
Une grande partie des décès précoces (<1 an) sont dus à la dysfonction primaire du greffon, aux problèmes techniques (réintervention chirurgicale, anomalies au niveau des anastomoses bronchiques et vasculaires) et aux infections (Figure 2). Bien que l’incidence du rejet aigu est élevée pendant la 1ère année post-opératoire (entre 40 et 50%), elle cause peu de décès [1,3]. Mais le principal obstacle à la survie à long terme après transplantation pulmonaire demeure le rejet chronique d’allogreffe qui se traduit par une dysfonction chronique du greffon, avec l’apparition d’une bronchiolite oblitérante (BO). L’incidence du syndrome de bronchiolite oblitérante (BOS) est approximativement de 50% dans les 5 ans suivant la transplantation (Figure 3). (Tableau 1)
LA CLASSIFICATION INTERNATIONALE DU REJET EN TRANSPLANTATION PULMONAIRE
L’ISHLT a publié une mise à jour de la classification du rejet pulmonaire en 2007 [4].
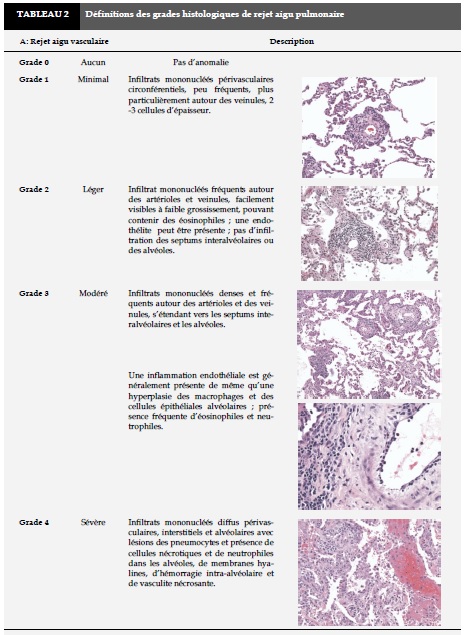
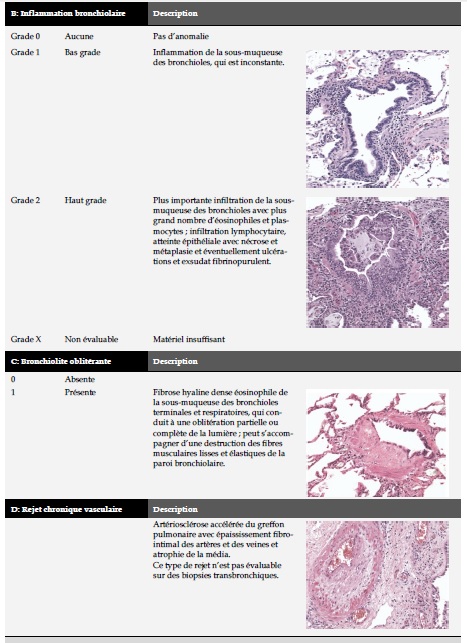
Le diagnostic de rejet aigu cellulaire et chronique du greffon pulmonaire repose sur l’histologie, à partir de prélèvements de parenchyme pulmonaire obtenus lors des biopsies transbronchiques (BTB).
La particularité de l’histologie du rejet pulmonaire aigu et chronique par rapport aux autres organes réside dans une atteinte à la fois des vaisseaux et des voies aériennes.
La classification histologique du rejet pulmonaire est résumée dans le Tableau 2A - 2B
LE SYNDROME DE BRONCHIOLITE OBLITERANTE (BOS): LE TALON D’ACHILLE DE LA TRANSPLANTATION PULMONAIRE
La dysfonction chronique du greffon, encore appelée CLAD (chronic lung allograft dysfunction), considérée comme une forme de rejet chronique, constitue à ce jour l’obstacle majeur de la survie à long terme des transplantés pulmonaires [5]. Elle a été initialement associée à la bronchiolite oblitérante (BO).
Sur le plan anatomo-pathologique, la BO se caractérise par une oblitération plus ou moins complète des bronchioles terminales et respiratoires par un processus inflammatoire et fibroprolifératif. Les BTB ayant une mauvaise sensibilité pour la détection de ces lésions, l’ISHLT a proposé le terme de « syndrome de bronchiolite oblitérante » (BOS) pour identifier, sur le plan clinique, les patients développant une BO.
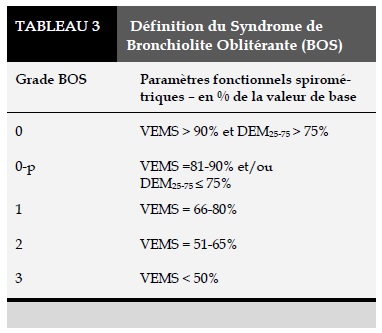
Le BOS se traduit cliniquement par un déclin du volume expiratoire maximal par seconde (VEMS) persistant par rapport à sa valeur de base (ou valeur prédite) et/ou du débit expiratoire maximal médian (DEM25-75), avec 4 stades de gravité croissante en fonction de l’extension du processus obstructif. La classification de BOS établie en 1993 et modifiée en 2002 est présentée dans le tableau 2 [6]. Le stade 0-p (potential BOS) identifie les patients potentiellement atteints de BO.
La physiopathologie de la BO est complexe et ses mécanismes sont encore mal connus. Les théories actuelles retiennent des facteurs de risque d’origine allo-immune mais aussi non immunologique.
Sur le plan thérapeutique, diverses options ont été proposées mais aucun n’a fait preuve d’une réelle efficacité [7]. (Tableau 3)
FACTEURS DE RISQUE DE BOS
Facteurs allo-dépendants
La réponse immune induite par l’allogénicité dirigée contre les cellules endothéliales et épithéliales bronchiques du greffon est reconnue comme étant fortement impliquée dans l’induction du rejet chronique.
L’allo-immunisation T occupe une place majeure dans le développement de la BO. La fréquence et la sévérité des épisodes de rejet aigu cellulaire (rejet aigu vasculaire et inflammation bronchiolaire) sont associées à une augmentation très significative de BOS [8,9].
Facteurs allo-indépendants
L’influence de la réponse immunitaire innée et de la réponse inflammatoire secondaire aux agressions extérieures est aujourd’hui reconnue dans le développement du BOS (10). Des événements non allodépendants tels que les infections virales (en particulier le CMV), bactériennes ou fongiques, les lésions d’ischémie-perfusion dont résulte la dysfonction primaire du greffon, le reflux gastro-oesophagien sont autant de facteurs pouvant contribuer au développement ultérieur de la BO.
Auto-immunité
Sumpter et col. ont développé le concept de rejet en deux phases: une 1ère phase d’agression tissulaire et une 2nde phase représentée par l’autoimmunité [11]. L’agression tissulaire (d’origine immune ou non immune) conduit à l’exposition d’antigènes du soi qui étaient normalement séquestrés. Le relargage de ces auto-antigènes cryptiques déclenche la prolifération de cellules T auto-réactives et la production d’auto-anticorps. Le collagène de type 5, constituant de la membrane basale de l’endothélium et de l’épithélium bronchiolaire, a été le premier auto-antigène décrit [12].
Burlingham et col. ont montré que le risque de BOS était 5 à 10 fois plus élevé chez les patients ayant des réponses cellulaires élevées dirigées contre le col (V) et que celles-ci étaient médiées par les cellules TH17 [13].
CONCLUSION
Malgré des progrès considérables en transplantation pulmonaire, celle-ci reste grevée d’une mortalité élevée à long terme, due au rejet chronique.
En transplantation rénale et cardiaque, il existe une reconnaissance accrue, depuis une dizaine d’années, du rôle majeur du rejet humoral, non seulement dans la dysfonction aigue du greffon, mais aussi dans la perte tardive du greffon.
CONFLIT D’INTÉRÊTS
Aucun.
REFERENCES
1. Yusen RD, Edwards LB, Kucheryavaya AY, Benden C, Dipchand AI, et al. The registry of the International Society for Heart and Lung Transplantation: thirty-first adult lung and heart-lung transplant report--2014; focus theme: retransplantation. J Heart Lung Transplant Off Publ Int Soc Heart Transplant. 2014;33(10):1009‑24.
2. Agence de la biomédecine - rapport médical et scientifique [Internet]. [cité 30 juill 2015]. Disponible sur: about:reader?url=http%3A%2F%2Fwww.agence-biomedecine.fr%2Fannexes%2Fbilan2012%2Fdonnees%2Forganes%2F04-coeur-poumon%2Fsynthese.htm
3. Yusen RD. Technology and outcomes assessment in lung transplantation. Proc Am Thorac Soc. 2009;6(1):128-36.
4. Knoop C, Estenne M. Acute and chronic rejection after lung transplantation. Semin Respir Crit Care Med. 2006;27(5):521-33.
5. Weigt SS, DerHovanessian A, Wallace WD, Lynch JP, Belperio JA. Bronchiolitis obliterans syndrome: the Achilles’ heel of lung transplantation. Semin Respir Crit Care Med. 2013;34(3):336 51.
6. Hopkins PM, Aboyoun CL, Chhajed PN, Malouf MA, Plit ML, Rainer SP, et al. Prospective analysis of 1,235 transbronchial lung biopsies in lung transplant recipients. J Heart Lung Transplant OffPubl Int Soc Heart Transplant. 2002;21(10):1062 7.
7. Christie JD, Edwards LB, Kucheryavaya AY, Benden C, Dobbels F, Kirk R, et al. The Registry of the International Society for Heart and Lung Transplantation: Twenty-eighth Adult Lung and Heart-Lung Transplant Report--2011. J Heart Lung Transplant Off PublInt Soc Heart Transplant. 2011;30(10):1104 22
8. Trulock EP, Christie JD, Edwards LB, Boucek MM, Aurora P, Taylor DO, et al. Registry of the International Society for Heart and Lung Transplantation: twenty-fourth official adult lung and heart-lung transplantation report-2007. J Heart Lung Transplant Off Publ Int Soc Heart Transplant. 2007;26(8):782 95.
9. Patel JK, Kittleson M, Kobashigawa JA. Cardiac allograft rejection. Surg J R Coll Surg Edinb Irel. 2011;9(3):160‑7.
10. Perkins D, Verma M, Park KJ. Advances of genomic science and systems biology in renal transplantation: a review. Semin Immunopathol. 2011;33(2):211.8.
11. Stewart S, Fishbein MC, Snell GI, Berry GJ, Boehler A, Burke MM, et al. Revision of the 1996 working formulation for the standardization of nomenclature in the diagnosis of lung rejection. J Heart Lung Transplant Off Publ Int Soc Heart Transplant. 2007;26(12):1229.42.
12. Yousem SA, Berry GJ, Cagle PT, Chamberlain D, Husain AN, Hruban RH, et al. Revision of the 1990 working formulation for the classification of pulmonary allograft rejection: Lung Rejection Study Group. J Heart Lung Transplant Off Publ Int Soc Heart Transplant. janv 1996;15(1 Pt 1):1.15.
13. Arcasoy SM, Berry G, Marboe CC, Tazelaar HD, Zamora MR, Wolters HJ, et al. Pathologic interpretation of transbronchial biopsy for acute rejection of lung allograft is highly variable. Am J Transplant Off J Am Soc Transplant Am Soc Transpl Surg. 2011;11(2):320.8.
FIGURES/TABLES
REFERENCES
1. Yusen RD, Edwards LB, Kucheryavaya AY, Benden C, Dipchand AI, et al. The registry of the International Society for Heart and Lung Transplantation: thirty-first adult lung and heart-lung transplant report--2014; focus theme: retransplantation. J Heart Lung Transplant Off Publ Int Soc Heart Transplant. 2014;33(10):1009‑24.
2. Agence de la biomédecine - rapport médical et scientifique [Internet]. [cité 30 juill 2015]. Disponible sur: about:reader?url=http%3A%2F%2Fwww.agence-biomedecine.fr%2Fannexes%2Fbilan2012%2Fdonnees%2Forganes%2F04-coeur-poumon%2Fsynthese.htm
3. Yusen RD. Technology and outcomes assessment in lung transplantation. Proc Am Thorac Soc. 2009;6(1):128-36.
4. Knoop C, Estenne M. Acute and chronic rejection after lung transplantation. Semin Respir Crit Care Med. 2006;27(5):521-33.
5. Weigt SS, DerHovanessian A, Wallace WD, Lynch JP, Belperio JA. Bronchiolitis obliterans syndrome: the Achilles’ heel of lung transplantation. Semin Respir Crit Care Med. 2013;34(3):336 51.
6. Hopkins PM, Aboyoun CL, Chhajed PN, Malouf MA, Plit ML, Rainer SP, et al. Prospective analysis of 1,235 transbronchial lung biopsies in lung transplant recipients. J Heart Lung Transplant OffPubl Int Soc Heart Transplant. 2002;21(10):1062 7.
7. Christie JD, Edwards LB, Kucheryavaya AY, Benden C, Dobbels F, Kirk R, et al. The Registry of the International Society for Heart and Lung Transplantation: Twenty-eighth Adult Lung and Heart-Lung Transplant Report--2011. J Heart Lung Transplant Off PublInt Soc Heart Transplant. 2011;30(10):1104 22
8. Trulock EP, Christie JD, Edwards LB, Boucek MM, Aurora P, Taylor DO, et al. Registry of the International Society for Heart and Lung Transplantation: twenty-fourth official adult lung and heart-lung transplantation report-2007. J Heart Lung Transplant Off Publ Int Soc Heart Transplant. 2007;26(8):782 95.
9. Patel JK, Kittleson M, Kobashigawa JA. Cardiac allograft rejection. Surg J R Coll Surg Edinb Irel. 2011;9(3):160‑7.
10. Perkins D, Verma M, Park KJ. Advances of genomic science and systems biology in renal transplantation: a review. Semin Immunopathol. 2011;33(2):211.8.
11. Stewart S, Fishbein MC, Snell GI, Berry GJ, Boehler A, Burke MM, et al. Revision of the 1996 working formulation for the standardization of nomenclature in the diagnosis of lung rejection. J Heart Lung Transplant Off Publ Int Soc Heart Transplant. 2007;26(12):1229.42.
12. Yousem SA, Berry GJ, Cagle PT, Chamberlain D, Husain AN, Hruban RH, et al. Revision of the 1990 working formulation for the classification of pulmonary allograft rejection: Lung Rejection Study Group. J Heart Lung Transplant Off Publ Int Soc Heart Transplant. janv 1996;15(1 Pt 1):1.15.
13. Arcasoy SM, Berry G, Marboe CC, Tazelaar HD, Zamora MR, Wolters HJ, et al. Pathologic interpretation of transbronchial biopsy for acute rejection of lung allograft is highly variable. Am J Transplant Off J Am Soc Transplant Am Soc Transpl Surg. 2011;11(2):320.8.
ARTICLE INFO
DOI: 10.12699/jfvp.6.18.2015.2
Conflict of Interest
Non
Date of manuscript receiving
22/1/2015
Date of publication after correction
15/6/2015
Article citation
Carine Ngo. Current chalenge in lung transplantation. J Func Vent Pulm 2015;18(6):2-8