
 English
English
 French
French
Study of exhaled NO in subjects without apneas during sleep
Étude du NO exhalé chez les sujets non-apnéiques au cours du sommeil
K. Dang Thi Mai1, Y. Nguyen Hoang2, B. Nguyen Quoc3, K. Le Quang3, D. Tran Thanh3, N. Doan Thi Quynh3, S. Duong-Quy3,4
1: Service de Pneumologie. Hôpital Cho Ray. Ho Chi Minh Ville
2: Hôpital Général de Phu Tho. Phu Tho Province
3: Collège de Médecine de Lam Dong
4: Université Paris Descartes - Sorbonnes Cité. Paris
Corresponding author
Pr. Sy DUONG-QUY
Collège de Médecine de Lam Dong
Hôpital Cochin Université Paris Descartes
E-mail: sduongquy.jfvp@gmail.com
ABSTRACT
Introduction. In patients with Obstructive Sleep Apnea Syndrome (OSAS), the alveolar concentration of nitric oxide (CANO) might be increased on waking up. However, the concentration of exhaled NO in subjects without OSAS should be studied to provide reference values for Vietnamese people.
Aims of study. This study was designed to study exhaled NO in healthy subjects and its correlations with anthropometric characteristics and sleep parameters.
Subjects and Method. Subjects without OSAS were included in this study. All anthropometric characteristics, exhaled NO (FENO-50/100/150/350, CANO, JawNO) and polysomnography parameters were measured to analysis. Exhaled NO was measured by Hypair NO+ (Medisoft, USA) and polysomnography was measured by Alice 6 (Philippes, USA).
Results. 26 healthy subjects (14 men/12 women) with a mean age of 48 ± 9 years were enrolled in this study. Mean BMI was 21 ± 3 kg/m2. Neck and abdomen circumferences were 32 ± 3 cm and 77 ± 8 cm, respectively. Mean Epworth score was 9 ± 4. Apnea-hypopnea index was 3 ± 1/hour. FENO-50/100/150/350, CANO, and JawNO were significantly increased on waking up (P <0,001). Mean SpO2 was 92 ± 2%; Nadir SpO2 was 90 ± 2%. There were not any correlations between CANO and anthropometric characteristics and polysomnography parameters.
Conclusion. Exhaled NO has a circadian rhythm during sleep in subjects without OSAS. The concentration of exhaled NO in the airways is non-pathologically increased on waking up. It is also independent of clinical and functional parameters.
KEYWORDS: Sleep apnea, NO, Epworth, FENO, CANO, J’awNO
RÉSUMÉ
Introduction. Chez les patients atteints du syndrome des apnées obstructives du sommeil (SAOS), la concentration du NO exhalé pourrait être augmentée au réveil. Cependant, la concentration du NO exhalé chez les sujets vietnamiens qui n’ont pas de SAOS doit être étudiée pour avoir les valeurs de référence.
Objectif. Cette étude a été planifiée pour étudier le NO exhalé chez les sujets sains et la corrélation entre le NO exhalé avec les paramètres anthropométriques.
Sujets et méthode. Les sujets sains qui n’ont pas eu de SAOS ont été inclus dans cette étude. Tous les paramètres anthropométriques, la mesure du NO exhalé (FENO-50/100/150/350, CANO, JawNO) et les paramètres polysomnographiques ont été enregistrés pour analyser. Le NO exhalé a été mesuré par l’appareil Hypair NO+ (Medisoft, USA) et la polysomnographie a été mesurée par l’appareil Alice 6 (Philippes, USA).
Résultat. 26 sujets sains (14 hommes/12 femmes) avec l’âge moyen de 48 ± 9 ans ont été inclus dans cette étude. L’IMC moyen était de 21 ± 3 kg/m2. Les circonférences du cou et de l’abdomen étaient de 32 ± 3 cm et de 77 ± 8 cm, respectivement. Le score d’Epworth moyen était de 9 ± 4. L’index d’apnées-hyponées était de 3 ± 1/heure. Les FENO-50/100/150/350, la CANO, et le J’awNO ont été significativement augmentés au réveil (P <0,001). La SpO2 moyenne était de 92 ± 2%; la SpO2 minimale moyenne était de 90 ± 2%. Il n’y a pas eu de corrération entre la concentration du NO exhalé et les paramètres anthropométriques et polysomnographiques.
Conclusions. Le NO exhalé a le rythme circadien chez les sujets n’ayant pas de SAOS. Chez les sujets sains, la concentration du NO exhalé s’augmente au réveil et est indépendamment aux paramètres cliniques et fonctionnels.
MOTS CLÉS: Apnées du sommeil, NO, Epworth, FENO, CANO, J’awNO
INTRODUCTION
Le syndrome d’apnées obstructives du sommeil (SAOS) est caractérisé par des courts épisodes apnéiques de répétition pendant le sommeil. Chaque épisode apnéique se termine habituellement par un réveil s’associant à une désaturation. Selon le résultat des études précédentes, la prévalence du SAOS était environ 4% chez l’homme et 2% chez la femme [1-5]. Il est démontré que le SAOS est un facteur de risque des maladies cardiovasculaires [6-7]. La désaturation nocturne pendant le sommeil dû à l’obstruction de la voie aérienne supérieure est à l’origine de la production du stress oxydatif et des cytokines préinflammatoires [8]. Ce phénomène provoque aussi le dysfonctionnement endothélial qui s’aggrave des problèmes cardiovasculaires [9-10]. Donc, la mesure des bio-marqueurs inflammatoires serait utile dans le dépistage et dans le diagnostic de la sévérité du SAOS [11-13].
Dans le système cardiovasculaire, le monoxyde d’azote (NO) a un rôle important dans la modulation du tonus vasculaire. Cependant, dans les pathologies respiratoires, le NO exhalé est un bon marqueur inflammatoire, lié à éosinophiles, des voies aériennes retrouvé dans certaines maladies allergiques telles que la rhinite, l’asthme et la pneumopathie interstitielle diffuse [12]. Grâce au progrès technique, le NO exhalé peut être mesuré facilement dans l’air expiré des patients atteints de pathologie respiratoire [11]. La concentration totale du NO exhalé (FENO) est définie comme la production du NO dans la surface des voies aériennes. Elle pourrait être variée chez les patients atteints de SAOS [13]. Chez ces patients, la concentration alvéolaire du NO (CANO) reflète indirectement la production du NO dans les cellules épithéliales alvéolaires et dans les cellules inflammatoires existent dans l’espace interstitielle pulmonaire [14, 15, 16].
Le résultat des études récentes a montré que chez les patients atteints de SAOS, la CANO a été significativement augmentée au réveil par rapport aux sujets sains [13, 17 :Thong]. Les auteurs ont clues que la mesure de la CANO au réveil permet donc de dépister les sujets atteints de SAOS. Le seuil pathologique du NO exhalé est actuellement défini par les recommandations internationales [18]. Cependant, le seuil du NO exhalé chez les vietnamiens sains et son rythme circadien n’ont pas encore été démontrés. Le but de cette étude est de déterminer la concentration du NO exhalé diurne et au réveil chez les sujets sains et sa corrélation avec les facteurs anthropologiques et polysomnographiques.
MATÉRIELS ET MÉTHODE
Sujets
Les adultes sains sans l’antécédent des maladies respiratoires ont été inclus dans cette étude. Ils ont été recrutés en consultation à l’Unité de Recherche Clinique du Collège de Médecine de Lam Dong (Dalat – Vietnam). Ils devaient être capables de réaliser correctement des examens demandés selon le protocole de l’étude. Ceux qui avaient l’antécédent des maladies chroniques, des infections aigue ou sous le traitement par corticostéroïdes inhalées ou systémiques ont été exclus de cette étude. Les sujets qui avaient le SAOS conformé par l’index d’apnées-hyponées (IAH) ≥ 5/heure ont été aussi éliminés.
Méthode
Il s’agit d’une étude prospective et descriptive qui a été réalisée pendant 6 mois: du 01 juin au 01 décembre 2014. Tous les paramètres concernant les données anthropologiques, les questionnaires du sommeil, le score d’Epthworth (0-24), la polysomnographie ont été enregistrés pour analyser. La polysomnographie a été réalisé pendant la nuit à l’Unité de Recherche Clinique (URC). La mesure du NO exhalé a été réalisée avant et après chaque polysomnographie.
La mesure du NO exhalé
L’appareil d’Hypair FENO+ (MS Medisoft, USA) a été utilisé pour mesurer le NO exhalé en respectant strictement le protocole du fournisseur. Il s’agit d’un système de débit multiple permettant de mesurer le NO exhalé à 50/100/150/350 ml/s. Les paramètres mesurés ont été traités par le logiciel EXPAIR. La concentration du NO bronchique (FENO), la concentration du NO alvéolaire (CANO) et le débit du NO dans les voies aériennes (JawNO) ont été enregistrés pour analyser statistique.
La mesure de la polysomnographie
Tous les participants ont bénéficié la polysomnographie (PSG) pendant la nuit au URC du Collège de Médecine de Lam Dong. L’appareil Alice 6 (Philippes, USA) a été utilisé pour cette étude. Les paramètres obtenus des PSG ont été analysés par le logiciel Alice Sleepware (Philippes, USA).
La durée d’enregistrement minimale était de 6 heures avec la durée du sommeil minimale était de 3 heures. Les paramètres enregistrés étaient l’électroencéphalogramme (EEG) avec les électrodes au niveau de C4–A1, C3–A2, O2–A1 và O1–A2; l’électromyogramme (EMG), l’électrocardiogramme (ECG), le débit nasal et buccal, les mouvements thoraco-abdominaux, la position corporelle au cours du sommeil, l’index d’apnées-hyponées (IAH), la saturation d’oxygène, le micro éveil, et le ronflement.
Analyse statistique
Le logiciel SPSS - version 22.0 (Chicago - Illinois, USA) a été utilisé pour analyser le résultat. Tous les paramètres sont présentés sous forme de moyenne ± SD. Le test Student a été utilisé pour comparer les données paramétriques. La corrélation entre le NO exhalé et les paramètres anthropométriques et polysomnographiques a été évaluée par le coefficient R2. La valeur de P <0,5 a été utilisée pour constater des différences significatives.
RÉSULTATS
Caractéristiques anthropométriques des participants
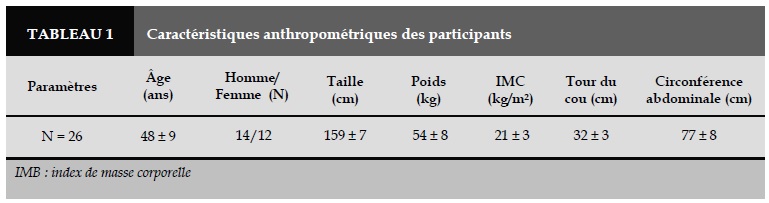
Entre juin et décembre 2014, il y avait 58 sujets vivant à Dalat ont participé à cette étude. 32 sujets ayant l’IAH ≥ 5/heure ont été exclus de cette étude. Toutes les caractéristiques anthropométriques des sujets inclus sont présentées dans le Tableau 1. L’âge moyen des participants était de 54 ± 14 ans. Il y avait 14 hommes et 12 femmes (Tableau 1).
Le score d’Epworth et les paramètres de la PSG
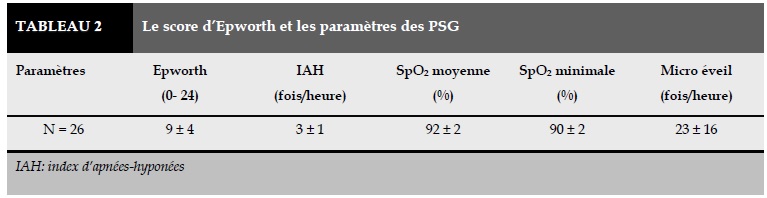
Le résultat du score d’Epworth et des paramètres des PSG sont présentés dans le Tableau 2. Le score d’Epworth moyen était de 9 ± 4. L’index d’apnées-hyponées (IHA) était de 3 ± 1/heur. La saturation moyenne était de 93 ± 2%. L’index de micro éveil était de 23 ± 16 /heure (Tableau 2).
La concentration du NO exhalé (FENO, CANO, J’awNO)
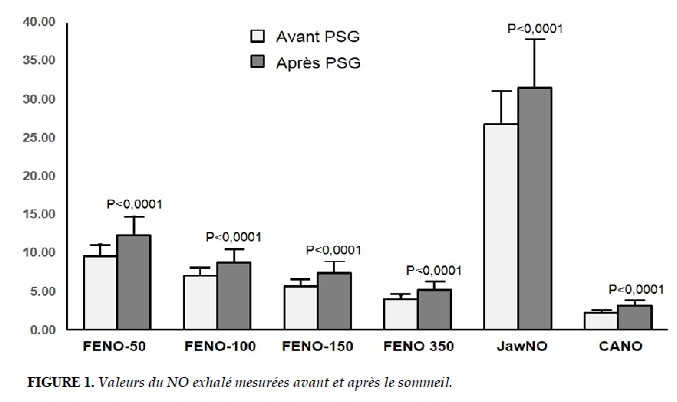
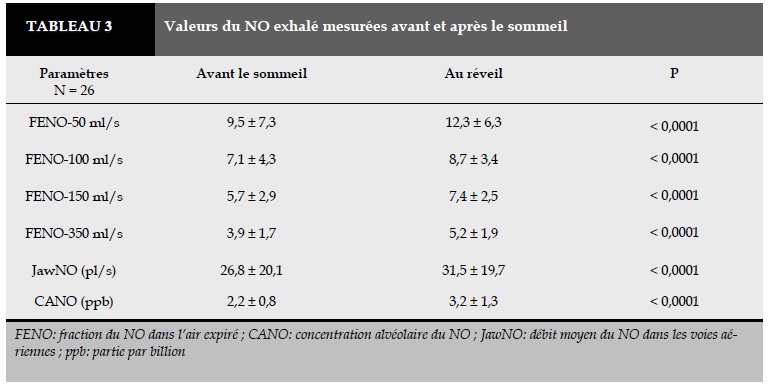
Le résultat de la mesure du NO exhalé (FENO, CANO, J’awNO) avant et après le sommeil est figuré au Tableau 3 et dans la Figure 1. La FENO-50, FENO-100, FENO-150, FENO350, le JawNO, et la CANO mesurées au réveil étaient significativement plus élevées que la veille (P < 0,0001).
La corrélation entre le NO exhalé, les paramètres anthropométriques, et la PSG
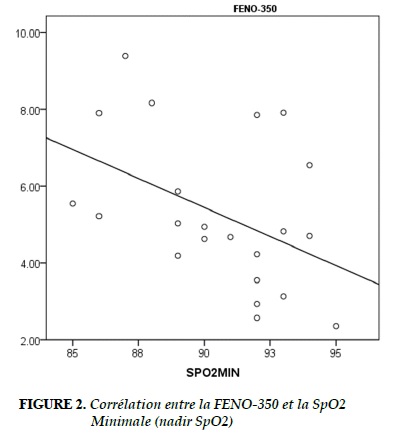
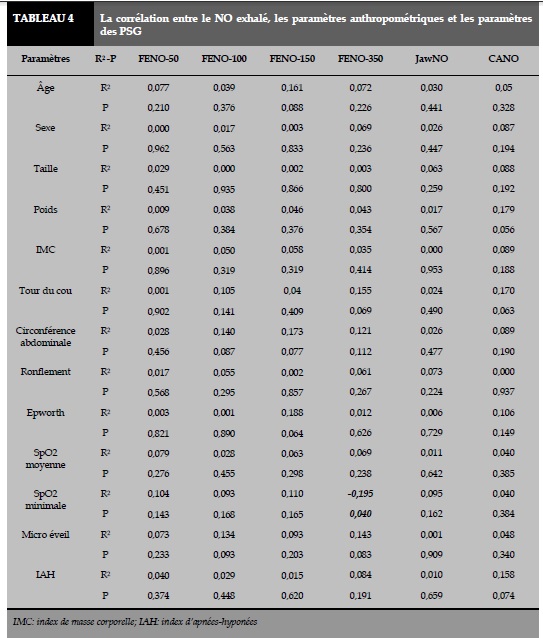
La corrélation entre le NO exhalé à différents débits (FENO-50/100/150/350 ml/s, CANO, JawNO), les paramètres anthropométriques, et les PSG est figurée au Tableau 4. Il n’y a pas de corrélation significative entre le NO exhalé avec l’âge, le sexe, la taille, le poids, l’IMC, le tour du cou, et la circonférence abdominale (P >0,05 ; Tableau 4). Il y a une très faible et corrélation inverse entre la FENO-350 et la SpO2 minimale (R2 =0,195; P =0,040; Tableau 4, Figure 2).
DISCUSSION
La mesure du NO exhalé a été considérée comme la méthode d’exploration non invasive et utile de l’inflammation du système respiratoire [11]. L’augmentation du NO exhalé pourrait être liée directement au stress oxydatif ou par l’intermédiaire des médiateurs inflammatoires La mesure du NO exhalé dans les voies aériennes distales (CANO) a été aussi étudiée récemment dans le SAOS [17].
Le résultat de notre étude a montré que: 1) Chez les sujets sains, la concentration et le débit du NO exhalé augment significativement au réveil; 2) L’augmentation de la concentration du NO exhalé dans les voies aériennes (FENO, CANO) au réveil reste dans le seuil des limites de la normale; 3) Il n’y a pas de corrélation significative entre le NO exhalé et les paramètres anthropométriques et polysomnographiques chez les sujets étudiés.
Dans cette étude, les participants n’avaient pas de facteurs de risque anthropométrique en faveur du SAOS (Tableau 1) par rapport aux sujets atteints de SAOS démontrés par des études précédentes [1, 3, 4]. Il s’agit des sujets sains qui avaient l’IMC, le tour du cou et la circonférence abdominale dans les normes de la normale (Tableau 1). Ils n’avaient pas d’autres pathologies associées favorisant le SAOS telles que l’hypertension artérielle, le diabète et la BPCO. Chez ces sujets, le score d’Epworth moyen était inférieur à 10, suggérant l’absence de somnolence diurne liée au SAOS (Tableau 2). Cependant, le score d’Epworth a eté jugé comme le paramètre non pertinent dans le diagnostic du SAOS.
Le résultat concernant la PSG montre que l’IAH était inférieur à 5/heure (3 ± 1/heure) reconfirmant l’absence de SAOS chez les sujets étudiés (Tableau 2). L’IAH est utilisé comme le seul critère diagnostique du SAOS [19 : ref : american society of physiologie 2013]. Le résultat de notre étude montrait aussi que la saturation moyenne et la saturation minimale au cours du sommeil étaient dans les limites de la normale (Tableau 2). La désaturation nocturne a été utilisé aussi comme le signe indirect du SAOS [20].
Les études récentes ont montré que la mesure du NO exhalé, en particulier celui au niveau alvéolaire (CANO) aiderait à dépister les sujets à risque du SAOS [13, 17, 21]. La CANO est un paramètre le plus pertinent car elle est indépendant aux paramètres anthropométriques par rapport à la FENO qui est variée selon l’âge et la taille [17]. Actuellement, le seuil normal de la FENO chez les enfants est inférieure à 20 ppb et à 25 ppb chez les adultes [18, 22]. Le seuil de la CANO a été proposé à inférieur à 5 ppb. La CANO est calculée grâce à la mesure de la FENO à débit multiple (50-350 ml/s). Le JawNO n’est pas souvent utilisé comme le critère diagnostique des pathologies respiratoires parcequ’il réflète la concentration totale du NO des voies aériennes.
Le résultat de notre étude a montré que la concentrations du NO exhalé bronchique et alvéolaire (FENO et CANO) et le débit moyen du NO (JawNO) avant et après le sommeil étaient dans les limites de la normale (FENO <25 ppb, CANO <5 ppb et JawNO <100 nl/min; Tableau 3). Malgré l’augmentation significative de la concentration du NO exhalé au réveil, le seuil du NO exhalé était inférieur à la limite pathologique (Figure 2 et Tableau 3). Cette augmentation pourrait être liée au rythme circadien du NO dans les voies aériennes [12, 23]. L’augmentation pathologique du NO exhalé, en particulier la CANO, au réveil chez les sujets atteints de SAOS a été rapportée par notre équipe [17]. Selon certains auteurs, l’augmentation de la CANO au réveil chez les sujets atteints de SAOS pourrait être liée au stress oxidatif produit par l’hypoxie intermittante [14, 17, 21, 24]. Le stress oxidatif augmente l’activité de la NOS inductible (iNOS) dans la production du NO des cellules épithéliales.
La CANO a été utilisée actuellement dans les études cliniques pour le dépistage des sujets à risque du SAOS. La mesure du NO exhalée est un examen non invasif et peu cher. En particulier, la CANO n’est pas influencée par des facteurs anthropométriques (âge, sexe, taille, poids, IMC, tour du cou, et circonférence abdominale). Le résultat de notre étude a montré que le NO exhalé mesuré à débits multiples n’a pas eu de corrélation avec les paramètres anthropométriques (Tableau 4). De plus, chez les sujets sains, il n’y a pas de corrélation significative entre le NO exhalé et les paramètres polysomnographiques (ronflement, SpO2 minimale, IHA, micro éveils). Le résultat de notre étude a montré qu’il y a une très faible corrélation entre la FENO-350 et la SpO2 minimale (Figure 2 et Tableau 4). Cependant, selon les recommandations des sociétés savantes, il y a seulement le FENO et la CANO ont été utilisées dans la prise en charge des patients atteints de maladies respiratoires [ref]. Alors, l’utilisation du NO exhalé (FENO, CANO) serait un exmen utile dans le dépistage des patients atteints de SAOS.
CONCLUSION
Le SAOS est une comorbi-mortalité des maladies cardiovasculaires. Le diagnostic précoce du SAOS chez les patients atteints des maladies cardiovasculaires sont nécessaires. Chez les sujets sains, en dehors de son rythme circadien, la concentration du NO exhalé est un paramètre indépendant. La mesure du NO exhalé pourrait être utilisable dans le dépistage du SAOS car il s’agit d’un examen non invasif et peu couteux.
CONFLIT D’INTÉRÊTS
Aucun.
RÉFÉRENCES
1. Young T, Palta M, Dempsey J, Peppard PE, Nieto FJ, Hla KM. Burden of sleep apnea: rationale, design, and major findings of the Wisconsin Sleep Cohort study. WMJ 2009; 108(5):246-9.
2. Baldwin CM, Griffith KA, Nieto FJ, et al. The association of sleep-disordered breathing and sleep symptoms with quality of life in the Sleep Heart Health Study. Sleep2001;24:96–105.
3. Duran J, Esnaola S, Rubio R, et al. Obstructive sleep apnea-hypopnea and related clinical features in a population-based sample of subjects aged 30 to 70 yr.Am J Respir Crit Care Med. 2001;163:685–9
4. Kripke DF, Ancoli-Israel S, Klauber MR, et al. Prevalence of sleep-disordered breathing in ages 40-64 years: a population-based survey. Sleep 1997;20:65–76
5. Ong KC, Clerk AA. Comparison of the severity of sleep-disordered breathing in Asian and Caucasian patients seen at a sleep disorders center. Respir Med.1998; 92:843–8.
6. Shepard JW., Jr. Hypertension, cardiac arrhythmias, myocardial infarction, and stroke in relation to obstructive sleep apnea. Clin Chest Med.1992;13:437–58.
7. W.T. McNicholas, M.R. Bonsigore, Management Committee of EU COST ACTION B26. Sleep apnoea as an independent risk factor for cardiovascular disease: current evidence, basic mechanisms and research priorities. Eur Respir J. 2007; 29:156–178.
8. P. Lévy, J.L. Pépin, C. Arnaud, R. Tamisier, J.C. Borel, M. Dematteis, et al., Intermittent hypoxia and sleep-disordered breathing: current concepts and perspectives. Eur. Respir. J 2008; 32: 1082–1095.
9. L. Lavie, P. Lavie, Molecular mechanisms of cardiovascular disease in OSAHS: the oxidative stress link. Eur. Respir. J 2009; 33:1467–1484.
10. S Duong-Quy. Endothelial Dysfunction in Patients with Obstructive Sleep Apnea (OSA). Journal of Vascular Medicine & Surgery 2015; 3 (1): 1-2.
11. Carpagnano GE, Lacedonia D, Foschino-Barbaro MP. Non-invasive study of airways inflammation in sleep apnea patients. Sleep Med Rev 2011; 15: 317-26.
12. Barnes PJ, Dweik RA, et al,. Exhaled nitric oxide in pulmonary diseases: a comprehensive review, Chest 2010; 138: 682–92.
13. Depalo A, Carpagnano GE, Spanevello A, et al. Exhaled NO and iNOS expression in sputum cells of healthy, obese and OSA subjects. J Intern Med 2008; 263: 70–8.
14. Fortuna AM, Miralda R, Calaf N, et al. Airway and alveolar nitric oxide measurements in obstructive sleep apnea syndrome. Respir Med 2011; 105: 630-6.
15. K.P. Tiev, N.N. Le-Dong, S. Duong-Quy, T. Hua-Huy, J. Cabane, A.T. Dinh-Xuan. Exhaled nitric oxide, but not serum nitrite and nitrate, is a marker of interstitial lung disease in systemic sclerosis. Nitric Oxide 2009; (20): 200–206.
16. K.P. Tiev, T. Hua-Huy, A. Kettaneh, Y. Allanore, N.N. Le-Dong, S. Duong-Quy, et al., Alveolar concentration of nitric oxide predicts pulmonary function deterioration in scleroderma. Thorax 2012; 67: 157–163.
17. T Hua-Huy, NN Le-Dong, S Duong-Quy, L Luchon, S Rouhani, AT Dinh-Xuan. Increased alveolar nitric oxide concentration is related to nocturnal oxygen desaturation in obstructive sleep apnoea. Nitric Oxide 2015; 45, 27-34S.
18. American Thoracic Society, European Respiratory Society, ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide. Am. J. Respir. Crit. Care Med. 2005; 171: 912–930.
19. Amir Qaseem, Jon-Erik C. Holty, Douglas K. Owens, Paul Dallas, Melissa Starkey, Paul Shekelle, and Clinical Guidelines Committee of the American College of Physicians. Management of Obstructive Sleep Apnea in Adults: A Clinical Practice Guideline From the American College of Physicians. Ann Intern Med. 2013; 159(7):471-483.
20. Ryan S, Taylor CT, McNicholas WT. Selective activation of inflammatory pathways by intermittent hypoxia in obstructive sleep apnea syndrome. Circulation 2005; 112: 2660–7
21. Petrosyan M, Perraki E, Simoes D, et al. Exhaled breath markers in patients with obstructive sleep apnoea. Sleep Breath 2008; 12: 207–15.
22. Raed A. Dweik, Peter B. Boggs, Serpil C. Erzurum, Charles G. Irvin, Margaret W. Leigh, Jon O. Lundberg, Anna-Carin Olin, Alan L. Plummer, D. Robin Taylor, on behalf of the American Thoracic Society Committee on Interpretation of Exhaled Nitric Oxide Levels (FENO) for Clinical Applications. Interpretation of Exhaled Nitric Oxide Levels (FENO) for Clinical Applications. Am J Respir Crit Care Med 2011; 184: 602–615.
23. F.L. Ricciardolo, P.J. Sterk, B. Gaston, G. Folkerts, Nitric oxide in health and disease of the respiratory system, Physiol. Rev.2004; 84: 731–765.
24. Carpagnano GE, Kharitonov SA, Resta O, et al. 8-Isoprostane, a marker of oxidative stress, is increased in exhaled breath condensate of patients with obstructive sleep apnea after night and is reduced by continuous positive airway pressure therapy. Chest 2003; 124: 1386-92.
FIGURES/TABLES
REFERENCES
1. Young T, Palta M, Dempsey J, Peppard PE, Nieto FJ, Hla KM. Burden of sleep apnea: rationale, design, and major findings of the Wisconsin Sleep Cohort study. WMJ 2009; 108(5):246-9.
2. Baldwin CM, Griffith KA, Nieto FJ, et al. The association of sleep-disordered breathing and sleep symptoms with quality of life in the Sleep Heart Health Study. Sleep2001;24:96–105.
3. Duran J, Esnaola S, Rubio R, et al. Obstructive sleep apnea-hypopnea and related clinical features in a population-based sample of subjects aged 30 to 70 yr.Am J Respir Crit Care Med. 2001;163:685–9
4. Kripke DF, Ancoli-Israel S, Klauber MR, et al. Prevalence of sleep-disordered breathing in ages 40-64 years: a population-based survey. Sleep 1997;20:65–76
5. Ong KC, Clerk AA. Comparison of the severity of sleep-disordered breathing in Asian and Caucasian patients seen at a sleep disorders center. Respir Med.1998; 92:843–8.
6. Shepard JW., Jr. Hypertension, cardiac arrhythmias, myocardial infarction, and stroke in relation to obstructive sleep apnea. Clin Chest Med.1992;13:437–58.
7. W.T. McNicholas, M.R. Bonsigore, Management Committee of EU COST ACTION B26. Sleep apnoea as an independent risk factor for cardiovascular disease: current evidence, basic mechanisms and research priorities. Eur Respir J. 2007; 29:156–178.
8. P. Lévy, J.L. Pépin, C. Arnaud, R. Tamisier, J.C. Borel, M. Dematteis, et al., Intermittent hypoxia and sleep-disordered breathing: current concepts and perspectives. Eur. Respir. J 2008; 32: 1082–1095.
9. L. Lavie, P. Lavie, Molecular mechanisms of cardiovascular disease in OSAHS: the oxidative stress link. Eur. Respir. J 2009; 33:1467–1484.
10. S Duong-Quy. Endothelial Dysfunction in Patients with Obstructive Sleep Apnea (OSA). Journal of Vascular Medicine & Surgery 2015; 3 (1): 1-2.
11. Carpagnano GE, Lacedonia D, Foschino-Barbaro MP. Non-invasive study of airways inflammation in sleep apnea patients. Sleep Med Rev 2011; 15: 317-26.
12. Barnes PJ, Dweik RA, et al,. Exhaled nitric oxide in pulmonary diseases: a comprehensive review, Chest 2010; 138: 682–92.
13. Depalo A, Carpagnano GE, Spanevello A, et al. Exhaled NO and iNOS expression in sputum cells of healthy, obese and OSA subjects. J Intern Med 2008; 263: 70–8.
14. Fortuna AM, Miralda R, Calaf N, et al. Airway and alveolar nitric oxide measurements in obstructive sleep apnea syndrome. Respir Med 2011; 105: 630-6.
15. K.P. Tiev, N.N. Le-Dong, S. Duong-Quy, T. Hua-Huy, J. Cabane, A.T. Dinh-Xuan. Exhaled nitric oxide, but not serum nitrite and nitrate, is a marker of interstitial lung disease in systemic sclerosis. Nitric Oxide 2009; (20): 200–206.
16. K.P. Tiev, T. Hua-Huy, A. Kettaneh, Y. Allanore, N.N. Le-Dong, S. Duong-Quy, et al., Alveolar concentration of nitric oxide predicts pulmonary function deterioration in scleroderma. Thorax 2012; 67: 157–163.
17. T Hua-Huy, NN Le-Dong, S Duong-Quy, L Luchon, S Rouhani, AT Dinh-Xuan. Increased alveolar nitric oxide concentration is related to nocturnal oxygen desaturation in obstructive sleep apnoea. Nitric Oxide 2015; 45, 27-34S.
18. American Thoracic Society, European Respiratory Society, ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide. Am. J. Respir. Crit. Care Med. 2005; 171: 912–930.
19. Amir Qaseem, Jon-Erik C. Holty, Douglas K. Owens, Paul Dallas, Melissa Starkey, Paul Shekelle, and Clinical Guidelines Committee of the American College of Physicians. Management of Obstructive Sleep Apnea in Adults: A Clinical Practice Guideline From the American College of Physicians. Ann Intern Med. 2013; 159(7):471-483.
20. Ryan S, Taylor CT, McNicholas WT. Selective activation of inflammatory pathways by intermittent hypoxia in obstructive sleep apnea syndrome. Circulation 2005; 112: 2660–7
21. Petrosyan M, Perraki E, Simoes D, et al. Exhaled breath markers in patients with obstructive sleep apnoea. Sleep Breath 2008; 12: 207–15.
22. Raed A. Dweik, Peter B. Boggs, Serpil C. Erzurum, Charles G. Irvin, Margaret W. Leigh, Jon O. Lundberg, Anna-Carin Olin, Alan L. Plummer, D. Robin Taylor, on behalf of the American Thoracic Society Committee on Interpretation of Exhaled Nitric Oxide Levels (FENO) for Clinical Applications. Interpretation of Exhaled Nitric Oxide Levels (FENO) for Clinical Applications. Am J Respir Crit Care Med 2011; 184: 602–615.
23. F.L. Ricciardolo, P.J. Sterk, B. Gaston, G. Folkerts, Nitric oxide in health and disease of the respiratory system, Physiol. Rev.2004; 84: 731–765.
24. Carpagnano GE, Kharitonov SA, Resta O, et al. 8-Isoprostane, a marker of oxidative stress, is increased in exhaled breath condensate of patients with obstructive sleep apnea after night and is reduced by continuous positive airway pressure therapy. Chest 2003; 124: 1386-92.
ARTICLE INFO
DOI: 10.12699/jfvp.6.17.2015.36
Conflict of Interest
Non
Date of manuscript receiving
Date of publication after correction
Article citation
Dang Thi Mai K, Nguyen Hoang Y, Nguyen Quoc B, Le Quang K, Tran Thanh D, Doan Thi Quynh N, Duong-Quy S. Study of exhaled NO in subjects without apneas during sleep. J Func Vent Pulm 2015;17(6):36-42.