
 English
English
 French
French
Giant lung hamartoma: about one observation
Géant hamartome pulmonaire: a propos d’une observation
N.N.M. Razafimanjato1, F. Randrianambinina1, S. Rabesalama2, A.F. Rakototiana2, F.A. Hunald3, A.J.C. Rakotoarisoa1, H.J.L. Rakotovao1
1: Service de Chirurgie Thoracique. CHU/JRA BP: 4150 CP: 101 Antananarivo. Madagascar
2: Service de Chirurgie Viscérale. CHU/JR BP 4150 CP: 101 Antananarivo. Madagascar
3: Service de Chirurgie Pédiatrique. CHU/JRA BP: 4150 CP: 101 Antananarivo. Madagascar
Corresponding author
Dr. Narindra Njarasoa Mihaja RAZAFIMANJATO
Service de Chirurgie Thoracique. CHU/JRA BP: 4150 CP: 101 Antananarivo. Madagascar
E-mail: razafesteban@yahoo.fr
ABSTRACT
We report a case of pulmonary hamartoma observed in a 41 years old patient with acute dyspnea and whose chest radiograph and CT pulmonary visualized a right mass pulmonary, look pejorative who required transthoracic biopsy to acquire histological evidence.
Giant hamartoma is uncommon benign bronchopulmonary tumor. Imaging can suggest the diagnosis.
Conservative surgery is generally possible. Prognosis is favorable
KEYWORDS: Pulmonary hamartoma, neoplasms, benign tumor
RÉSUMÉ
Les auteurs rapportent un cas d’hamartome pulmonaire chez une patiente de 41 ans, présentant une dyspnée aigue et dont la radiographie thoracique et la TDM objectivaient une masse pulmonaire droite, d’allure péjoratif, ayant nécessité une ponction biopsie transthoracique pour acquérir la preuve histologique.
Un géant hamartome pulmonaire est moins fréquente. L’imagerie permet d’évoquer le diagnostic.
Son traitement chirurgical est le plus souvent conservateur. Son pronostic est généralement favorable.
MOTS CLÉS: Hamartome pulmonaire, néoplasie, tumeur bénigne
INTRODUCTION
L’hamartome est défini par Albrecht en 1904 comme étant un assemblage désordonné de tissus identiques à ceux de l’organe ou du territoire où ils se rencontrent, avec excès éventuel de l’un ou de plusieurs d’entre eux [1]. L’hamartome pulmonaire occupe la troisième place des tumeurs pulmonaires après les carcinomes et les granulomes [2].
Notre objectif est de décrire la particularité de cette affection sur le plan clinique et sur le plan histopathologique par la prédominance de sa composante fibroléiomyomateuse.
OBSERVATION
Il s’agissait d’une patiente de 41 ans en bon état général qui consultait pour une dyspnée aigue d’apparition récente. Dans ses antécédents, elle ne présentait pas de facteurs de risque ni de pathologie respiratoire quelconque.
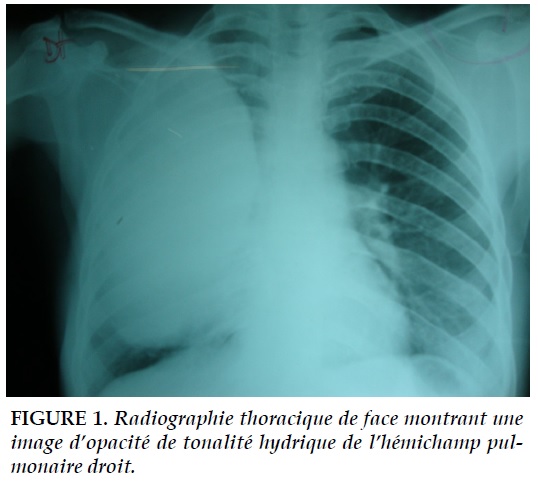
La dyspnée ne répondait pas au bronchodilatateur et à la corticothérapie inhalée. La radiographie montrait une image d’opacité de tonalité hydrique occupant le poumon droit (Figure 1).
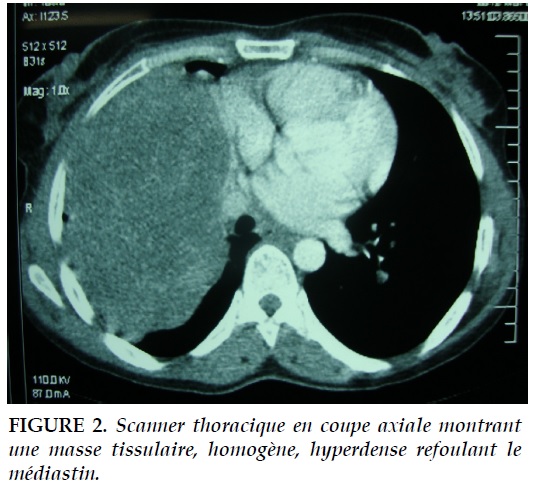
La tomodensitométrie (TDM) montrait une volumineuse image d’opacité correspond à une masse tissulaire située à droite sous la bifurcation trachéale et dans le hile du poumon (Figure 2). Cette infiltration tissulaire respectait les bronches et les vaisseaux qui n’étaient pas refoulés. L’examen du liquide de lavage broncho-alvéolaire n’a pas été contributif. La fonction respiratoire était normale.
L’examen anatomopathologique de la tumeur par ponction biopsique transpariétale révélait un hamartome fibroléiomyomateux.
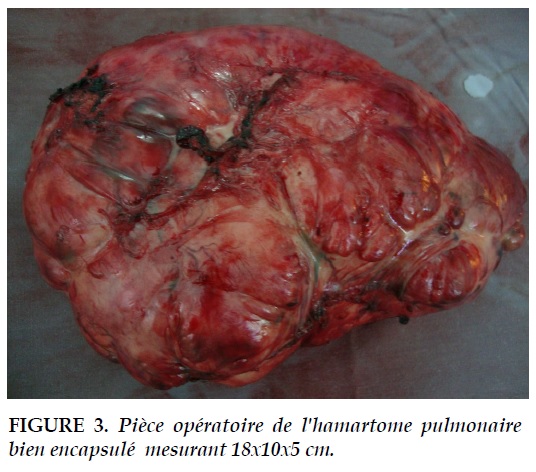
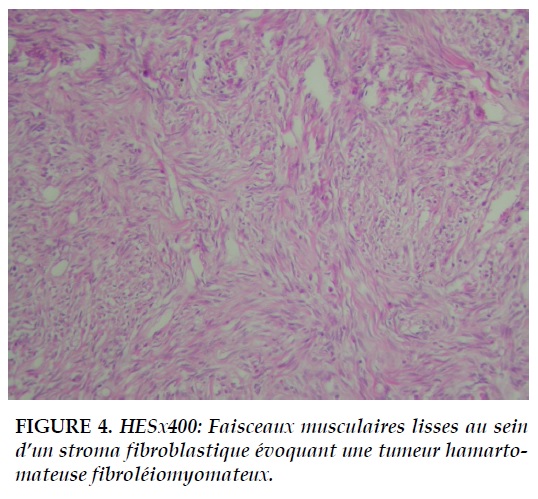
L’intervention par sterno-thoracotomie antérieure (hémi-clamshell) montrait une grosse formation tissulaire indépendante du parenchyme pulmonaire mesurant 18x10x5 cm. Il n’y avait pas d’artère systémique anormale en rapport avec la lésion ni de connexion particulière du tissu tumoral avec les bronches. La pièce opératoire était entièrement examinée (Figure 3). Les formations tissulaires correspondaient à des faisceaux musculaires lisses au sein d’un stroma fibroblastique évoquant une tumeur hamartomateuse fibroleiomyomateux (Figure 4).
Les suites opératoires immédiates étaient simples. La patiente était revue en consultation. La dyspnée avait disparu. Par contre, la spirométrie de contrôle montrait une discrète diminution des constantes probablement en rapport avec les séquelles la sterno-thoracotomie.
DISCUSSION
L’incidence de l’hamartome pulmonaire dans la population générale est de 0,25% et représente 7 à 14% des lésions pulmonaires [3]. C’est la plus fréquente des tumeurs bénignes broncho-pulmonaires [4]. Le pic de fréquence de cette tumeur se situe chez l’adulte dans la sixième décennie de vie. De rares cas ont été décrits chez l’enfant, illustrant sa faible fréquence dans la population pédiatrique [2, 5]. Sa pathogénie réside sur l’identification des réarrangements chromosomiques (6p21 et 12q14-15) favorisant sa croissance tumorale [6].
L’hamartome est une tumeur bénigne, dérivée du tissu mésenchymateux péribronchique [3, 5]. Le tissu cartilagineux est généralement le composant mésenchymateux principal, mais d’autres tissus sont souvent présents: tissu conjonctif fibreux, muscle lisse, graisse, tissu épithélial. Pour notre patiente, les faisceaux léiomyomateux étaient les principaux composants de la tumeur [1, 2].
Ces tumeurs dépassent rarement 4 cm de diamètre à la différence de notre observation qu’on qualifie de géant hamartome pulmonaire. Ils sont le plus souvent asymptomatiques et de découverte fortuite à la radiographie thoracique ou en post-mortem [1, 3, 7].
La clinique est dominée par une symptomatologie respiratoire: toux, douleur thoracique, expectoration, dyspnée, hémoptysie [7, 8]. Ce fut le cas de notre patiente qui a présenté une dyspnée aigue asthmatiforme identique à celui rapporté par Personne C [9].
Radiologiquement, il réalise une opacité arrondie de petite taille, en général inférieure à 2,5 cm. La taille de ces lésions varie de 1 à 8 cm, et il n'y a eu que deux rapports publiés d'un hamartome plus de trois fois la taille des données publiées antérieurement [10, 11].
Dans moins de 20 % des cas, il existe des calcifications, parfois centrales et concentriques. Elles sont beaucoup plus spécifiques quand elles sont dessinées en « pop corn » ou en « polynucléaires » ou encore « réniformes » [1, 5].
Pour Siegelman et al., les critères tomodensitométriques qui permettent de poser le diagnostic d'hamartome bénin sont: la taille inférieure à 2,5 cm, la limite nette et lisse, la présence de calcifications et surtout la présence de zones graisseuses dont environ 30 % des hamartomes en sont dépourvus. Ces critères permettent, lorsqu'ils sont présents, de porter le diagnostic avec certitude [2]. Quant à la PET FDG, certains rapports sur les hamartomes décrivent la difficulté à les différencier des tumeurs malignes par son caractère accumulatif anormalement de FDG [12].
Le diagnostic est apporté par ponction-biopsie percutanée. Son rendement est de 60 à 70 % sous réserve de multiples prises biopsiques. Lors de la ponction, la sensation de masse dure difficile à pénétrer, fuyant sous l'aiguille, est évocatrice [13].
Dans notre observation, la ponction biopsie trans-thoracique sous écho-guidée nous a permis de poser le diagnostic d’hamartome pulmonaire et ainsi de décider une intervention chirurgicale d’emblée malgré la dimension de la tumeur et son aspect péjoratif sur l’imagerie.
La chirurgie est représentée soit par la weedge-résection ou l'énucléation, car il n'y a classiquement pas de récurrence tumorale, excepté quelques cas anecdotiques de récidive et de transformation maligne [14]. Dans notre cas, une énucléation tumorale nous a permis d’éviter une résection parenchymateuse et respecter les gros vaisseaux intra-hilaires.
CONCLUSION
L’hamartome pulmonaire à composante fibroléiomyomateuse est une tumeur bénigne rare et particulière. Il est le plus souvent asymptomatique et de découverte fortuite.
Certains critères tomodensitométriques font évoquer le diagnostic mais seul l’examen anatomopathologique pourra apporter sa confirmation. Son traitement chirurgical est le plus souvent conservateur avec un bon pronostic.
CONFLIT D’INTÉRÊTS
Les auteurs déclarent ne pas avoir de conflit d'intérêts.
REFERENCES
1. Ramirez-Chavez G, Celard P, Gamondes JP, Loire R, Cordier JF, Brune J. Les hamartomes pulmonaires. A propos de 49 cas opérés. Semaine des Hôpitaux 1984;60: 1181-4.
2. Sieglman SS, Khouri NF, Scott WW, Leo FP, Hamper UM, Fishman EK, et al. Pulmonary hamartoma: CT findings. Radiology 1986; 160: 313-7.
3. Kiryu T, Kawaguchi S, Matsui E, Hoshi H, Kokubo M, Shimokawa K. Multiple chondromatous hamartomas of the lung. A case report and review of the literature with special reference to carney syndrome. Cancer 1999; 85: 2557-61.
4. Wislez M, Cadranel J. Opacités rondes intrapulmonaires uniques ou multiples. Rev Prat 1999;49: 1125-32.
5. Bosson N, Ducou-Le Pointe H, Boccon-Gibod L, Ait Bella S, Gruner M, Montagne JPH. Un cas d’hamartome mésenchymateux pulmonaire chez un enfant de 9 ans. J Radiol 1997;78:227-9.
6. Ebru Çakir, Funda Demirağ, Sadi Kaya, Hakan Ertürk. Giant Pulmonary Hamartoma-Case report and review of the literature. Solunum Hastalıkları 2007; 18: 162-166.
7. Yang C, Zhao H, Yin H. Diagnosis and treatment of pulmonary hamartoma. Zhonghua Jie He He Hu Xi Za Zhi 1999; 22: 399- 400.
8. Ge F, Tong F, Li Z. Diagnosis and treatment of pulmonary hamartoma. Clin Med Sci J 1998; 13: 61-2.
9. Personne C, Toty L, Colchen A, Hertzog P. Asphyxie aiguë par tumeur bénigne des bronches. Ann Chir 1979; 33: 551-552.
10. Ganti S, Milton R, Davidson L, Anikin V. Giant pulmonary hamartoma. J Cardiothorac Surg 2006; 1:19.
11. Heman M. N. Joshi, MBChB BSc (Hons), MRCS (Eng) and Richard D. Giant Pulmonary Hamartoma Causing Acute Right Heart Failure. Ann Thorac Surg 2014; 97: e21-2.
12. Masamichi Itoga, Yoshiki Kobayashi, Masahide Takeda, YukiMoritoki et al. A Case of pulmonary hamartoma showing rapid growth. Case Reports in Medicine. Volume 2013, Article ID 231652, 3 pages. http://dx.doi.org/10.1155/2013/231652.
13. Zarbo RJ, Fenoglio-Preiser CM. Interinstitutional database for comparison of performance in lung fine-needle aspiration cytology. A College of American Pathologists Q-Probe Study of 5 264 cases with histologic correlation. Arch Pathol Lab Med 1992; 116:463-70.
14. Laroche CM, Stewart S, Wells F, Shneerson J. Multiple recurrent intrapulmonary and endobronchial mesenchymomas (hamartomas). Thorax 1993; 48: 572-573.
FIGURES
REFERENCES
1. Ramirez-Chavez G, Celard P, Gamondes JP, Loire R, Cordier JF, Brune J. Les hamartomes pulmonaires. A propos de 49 cas opérés. Semaine des Hôpitaux 1984;60: 1181-4.
2. Sieglman SS, Khouri NF, Scott WW, Leo FP, Hamper UM, Fishman EK, et al. Pulmonary hamartoma: CT findings. Radiology 1986; 160: 313-7.
3. Kiryu T, Kawaguchi S, Matsui E, Hoshi H, Kokubo M, Shimokawa K. Multiple chondromatous hamartomas of the lung. A case report and review of the literature with special reference to carney syndrome. Cancer 1999; 85: 2557-61.
4. Wislez M, Cadranel J. Opacités rondes intrapulmonaires uniques ou multiples. Rev Prat 1999;49: 1125-32.
5. Bosson N, Ducou-Le Pointe H, Boccon-Gibod L, Ait Bella S, Gruner M, Montagne JPH. Un cas d’hamartome mésenchymateux pulmonaire chez un enfant de 9 ans. J Radiol 1997;78:227-9.
6. Ebru Çakir, Funda Demirağ, Sadi Kaya, Hakan Ertürk. Giant Pulmonary Hamartoma-Case report and review of the literature. Solunum Hastalıkları 2007; 18: 162-166.
7. Yang C, Zhao H, Yin H. Diagnosis and treatment of pulmonary hamartoma. Zhonghua Jie He He Hu Xi Za Zhi 1999; 22: 399- 400.
8. Ge F, Tong F, Li Z. Diagnosis and treatment of pulmonary hamartoma. Clin Med Sci J 1998; 13: 61-2.
9. Personne C, Toty L, Colchen A, Hertzog P. Asphyxie aiguë par tumeur bénigne des bronches. Ann Chir 1979; 33: 551-552.
10. Ganti S, Milton R, Davidson L, Anikin V. Giant pulmonary hamartoma. J Cardiothorac Surg 2006; 1:19.
11. Heman M. N. Joshi, MBChB BSc (Hons), MRCS (Eng) and Richard D. Giant Pulmonary Hamartoma Causing Acute Right Heart Failure. Ann Thorac Surg 2014; 97: e21-2.
12. Masamichi Itoga, Yoshiki Kobayashi, Masahide Takeda, YukiMoritoki et al. A Case of pulmonary hamartoma showing rapid growth. Case Reports in Medicine. Volume 2013, Article ID 231652, 3 pages. http://dx.doi.org/10.1155/2013/231652.
13. Zarbo RJ, Fenoglio-Preiser CM. Interinstitutional database for comparison of performance in lung fine-needle aspiration cytology. A College of American Pathologists Q-Probe Study of 5 264 cases with histologic correlation. Arch Pathol Lab Med 1992; 116:463-70.
14. Laroche CM, Stewart S, Wells F, Shneerson J. Multiple recurrent intrapulmonary and endobronchial mesenchymomas (hamartomas). Thorax 1993; 48: 572-573.
ARTICLE INFO
DOI: 10.12699/jfvp.6.17.2015.50
Conflict of Interest
Non
Date of manuscript receiving
27/12/2014
Date of publication after correction
23/02/2015
Article citation
Razafimanjato N.N.M, Randrianambinina F, Rabesalama S, Rakototiana A.F, Hunald F.A, Rakotoarisoa A.J.C, Rakotovao H.J.L. Giant lung hamartoma: about one observation. J Func Vent Pulm 2015;17(6):50-53.