
 English
English
 French
French
Vitamin D and repiratory diseases
Vitamine D et pathologies respiratoires
R. Bouchentouf
Service de pneumologie, Hôpital Militaire Avicenne. Marrakech
Laboratoire PCIM, FMPM, Université Cadi Ayyad. Marrakech - Maroc
Corresponding author
Pr. Bouchentouf Rachid
Service de Pneumologie.Hôpital Militaire Avicenne Marrakech. Maroc
Email : bouchentouf_rachid@yahoo.fr
ABSTRACT
Vitamin D is a vitamin with a large potential, its involvement in many physiological processes. Several studies have shown that a low levels of vitamin D are associated with the susceptibility of many respiratory diseases.
More than its classic effect on the phosphocalcique metabolism, it has been proved that vitamin D have effect immunomodulary effect.
The improvement in vitamin D status vitamin will be a reasonable strategy to prevent and reduce the risk of respiratory effects of vitamin D deficiency.
KEYWORDS: Vitamin D, lung, effects
RÉSUMÉ
La vitamine D est une vitamine aux multiples potentialités, étant impliquée dans de nombreux processus physiologiques. De nombreuses études observationnelles ont montré une association entre le déficit en vitamine D d’une part et la susceptibilité à certaines affections respiratoires.
A côté de son effet classique sur le métabolisme phosphocalcique, la vitamine D possède un effet immuno-modulateur pouvant expliquer les effets non classiques de la vitamine D.
Enfin l’amélioration du statut vitaminique représente une stratégie raisonnable pour la prévention et la réduction des effets respiratoires du déficit en vitamine D.
MOTS CLÉS: Vitamine D, poumon, effets
INTRODUCTION
A côté du rôle essentiel de la vitamine D dans le métabolisme phosphocalcique et la formation de l’os, il parait qu’elle a d’autres fonctions bénéfiques ce qui explique le regain d’intérêt pour cette vitamine.
ll est établi son rôle protecteur vis-à-vis de certaines pathologies néoplasiques, auto-immunes et infectieuses. Le déficit et l’insuffisance en vitamine D prédispose à la survenue de certaines pathologies notamment respiratoires.
STRUCTURE CHIMIQUE ET METABOLISME
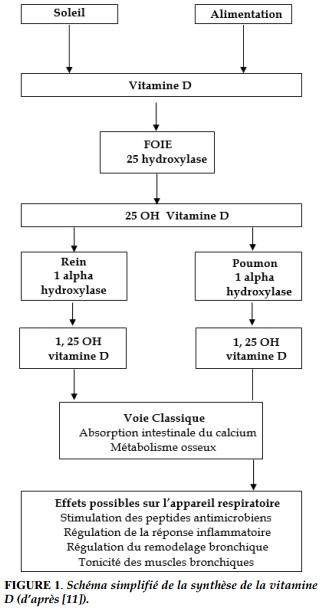
La vitamine D est désormais considérée comme une hormone avec plus d’une trentaine de tissus cibles, et son rôle semble plus étendu que celui déjà connu sur le système squelettique. Le terme « vitamine D » correspond à deux composés: l’ergocalciférol (vitamine D2), présent dans un nombre très faible d’aliments d’origine végétale, et le cholécalciférol (vitamine D3), produit dans la peau sous l’effet des rayons ultraviolets B et apporté par quelques aliments d’origine animale.
Après son absorption intestinale la vitamine D est hydroxylée dans le foie en 25 hydroxyvitamine D, 25 (OH) D, la principale forme de réserve, puis dans le rein en 1,25 (OH) vitamine D2 ou calcitriol, la forme hormonale, sous l’action de la 1 alpha hydroxylase (Figure 1). Le métabolite actif de la vitamine D, le 1,25(OH) 2D va passer dans le sang et aller agir sur des tissus cibles où elle se lie au récepteur de la vitamine D (Vitamin D Receptor [VDR]) situé dans le cytosol de ces cellules.
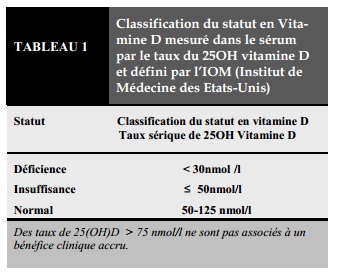
Le déficit et l’insuffisance en vitamine D sont définis respectivement par des concentrations sériques de 25 hydroxyvitamine D inférieures à 30 nmol /l et entre 30 à 50 nmol /l (Tableau1). Le déficit en vitamine D est très fréquent au sein de la population générale; et sa prévalence en Europe a augmenté au cours des dernières décennies, dans les 2 sexes, dans toutes les tranches d’âge, quelle que soit la catégorie ethnique.
Le statut vitaminique D diffère d’un pays à un autre, en France les études épidémiologiques montrent que 43 à 50% de la population sont déficients en vitamine et environ 80% ont une insuffisance en vitamine D [1].
Il est important de souligner qu’un excès de vitamine D est potentiellement toxique, et que c’est une situation rare et se voit en cas surconsommation de la vitamine D ou dans pathologies caractérisées par une hypersensibilité à la vitamine D comme les granulomatoses.
VITAMINE D ET ATOPIE ET ASTHME BRONCHIQUE
Plusieurs études surtout transversales et observationnelles ont montré l’existence d’une relation entre le déficit en vitamine D et l’existence de symptômes d’atopie (rhinite, asthme, dermatite atopique, allergies alimentaires).
Bener et al ont montré que les enfants ayant un déficit en vitamine D avaient un risque élevé d’avoir un asthme [2]. L’influence du statut vitaminique D de la femme enceinte sur le développement ultérieur de maladies allergique chez leurs enfants est un élément supplémentaire à l’appui des relations entre vitamine D et atopie.
La vitamine D en ce qui concerne plus spécifiquement les maladies allergiques, diminue la production des Ig E et réduit l’inflammation en augmentant la production d’IL 10 [3].
Le rôle le plus séduisant de la vitamine D dans la physiopathologie de la maladie asthmatique repose sur sa capacité à moduler la réponse T régulatrice [4].
La vitamine D module les actions des lymphocytes T (Th1 et Th2), elle diminue la libération des cytokines pro-inflammatoires par les cellules mononuclées du sang périphérique et par les cellules T. L’efficacité de la corticothérapie dans la maladie asthmatique repose en partie sur sa modulation de la réponse T régulatrice et l’augmentation de la sécrétion d’IL10 [4, 5].
Plusieurs études très récemment publiées suggèrent un impact de l’insuffisance en vitamine D sur la sévérité et le niveau de contrôle de l’asthme aussi bien chez l’enfant que chez l’adulte [6, 7].
VITAMINE D ET BPCO
La prévalence de la carence en vitamine D chez les BPCO est importante, pouvant expliquer une partie du retentissement osseux de cette pathologie.
Dans une étude récente, 70 % des BPCO avaient un déficit en vitamine D et ce déficit en vitamine D était associé à la sévérité de la BPCO et à la fonction respiratoire [8].
Une analyse cohorte du National Health And Nutrition Examination Survey (NHANES) a suggéré le rôle dans la vitamine D dans l’aggravation de la fonction respiratoire en montrant une corrélation positive entre la fonction pulmonaire et le taux sérique de la vitamine D dans la population générale [9]. Les fumeurs afro-américains développaient rapidement l’obstruction bronchique par rapport aux caucasiens du fait de la prévalence du déficit en vitamine D chez les afro-américains [10]. Également un polymorphisme de la vitamin D- binding protein a été associé au risque de BPCO.
Le déficit en vitamine D chez les BPCO pourrait être attribué à une diminution de synthèse cutanée liée au vieillissement de la peau induit par le tabagisme et une diminution de l’exposition solaire [11]. Ce déficit a un effet délétère sur la BPCO puisque les fractures costales et les tassements vertébraux retentissent sur la fonction respiratoire.
La supplémentation en vitamine D renforce chez le sujet âgé la force musculaire et l’équilibre et réduit le risque de chute, d’où l’intérêt d’un taux optimal de cette vitamine chez les patients BPCO [10].
VITAMINE D ET INFECTIONS RESPIRATOIRES
Le déficit en vitamine D a été associé, par des études épidémiologiques, à la survenue ou à l’évolution péjorative un certain nombre de maladies infectieuses telle la tuberculose et les infections respiratoires hautes et basses [12].
La vitamine D est un immunomodulateur, en effet elle inhibe l’immunité acquise et stimule l’immunité innée. Cette inhibition de l’immunité acquise par la 1,25(OH) 2D semble bénéfique dans un certain nombre de pathologies auto-immunes, alors que la modulation de l’immunité innée suggère des propriétés anti-infectieuses de la vitamine D [13].
Le rôle de la vitamine D dans la régulation de la réponse anti-infectieuse est double d’une part il inhibe la réponse immune inflammatoire type 1, diminue l’expression des Toll-like récepteurs TLR 2 et 4 à la surface des monocytes-macrophages, et d’autre part il stimule la synthèse par les monocytes-macrophages, les neutrophiles et les cellules épithéliales de peptides antimicrobiens dont le plus étudié est cathélicidine (IL37).
In vitro l’induction de la cathélicidine par la vitamine D augmente la capacité bactéricide des cellules phagocytaires vis-à-vis des agents pathogènes respiratoires tels le mycobacterium tuberculosis. Plusieurs études ont associé la susceptibilité à la tuberculose avec le déficit en vitamine D ou avec certains polymorphismes du gène du VDR [14].
Une étude randomisée, menée en double insu contre placebo dans la tuberculose pulmonaire bacillifère, a montré que la supplémentation en vitamine D à forte dose, ajoutée au traitement antituberculeux, raccourcissait le délai de négativation des expectorations chez les sujets présentant un certain polymorphisme du VDR connu pour influencer positivement la phagocytose [15].
Pour les infections respiratoires hautes et basses l’association entre un déficit de la vitamine D et le risque de développement de pneumopathies sévères a été observée aussi bien chez l’adulte que chez l’enfant. [16] Mais contrairement à la tuberculose la supplémentation en vitamine D ne semble pas apporter de bénéfice pour les infections respiratoires hautes ou basses [17].
VITAMINE D ET CANCER BRONCHIQUE
On constate que les cancers sont plus fréquents dans les pays du Nord que dans les pays du Sud. Des taux plasmatiques bas de la vitamine D ont été corrélés à un risque accru de cancer [18]. Les études épidémiologiques montrent un rôle protecteur de la vitamine D par rapport au cancer colique cancers, et peut-être au cancer du sein.
La vitamine D pourrait faciliter la différenciation cellulaire, avoir un effet anti-inflammatoire, anti-angiogénique et pro-apoptotique.
En ce qui concerne le cancer bronchique les données sont rares et contradictoires ; dans l’étude NHANES, aucune corrélation n’a été mise en évidence initialement, avec davantage de recul, on a noté une mortalité accrue par cancer du poumon chez les hommes qui avaient initialement un fort taux de vitamine D.
Une récente étude cas-témoins aux États-Unis n’a retrouvé aucune association chez des hommes fumeurs, sauf peut-être chez ceux ayant été prélevés en hiver au moment où la biosynthèse de la vitamine D est réduite [19].
VITAMINE D ET AUTRES PATHOLOGIES RESPIRATOIRES
Il a été décrit la présence du déficit en vitamine dans les pneumopathies infiltrantes diffuses notamment celles associées aux connectivites. Le déclin de la fonction respiratoire au cours de ces maladies suggère la possibilité d’un rôle de la vitamine dans la pathogénie des pneumopathies infiltrantes diffuses [20].
Dans le cas de la sarcoïdose on retrouve une hypersensibilité à la vitamine D en rapport avec la production extrarénale de 1,25-(OH) 2D par les macrophages. La vitamine D et ses métabolites sont responsables d’une hypercalciurie, avec un risque de lithiase urinaire, et d’une hypercalcémie qui peut nécessiter un traitement immunosuppresseur [21].
Chez les transplantés pulmonaire divers études observationnelles ont montré la fréquence élevée de déficit de la vitamine D et ont rappelé que cette association est corrélée avec une évolution défavorable avec altération de la fonction respiratoire et risque infectieux et du rejet du greffon [22, 23].
CONCLUSION
Depuis quelques années, la vitamine D est devenue une véritable vedette. Initialement réputée pour son rôle dans le métabolisme osseux et son action essentielle dans l’homéostasie phosphocalcique, elle apparaît désormais être un élément clé dans de nombreuses pathologies notamment respiratoires. Des études d’intervention sont maintenant nécessaires pour démontrer que la restauration des taux circulants de 25(OH) D corrige ou prévient les anomalies décrites en lien avec ce déficit.
REFERENCES
1. Souberbielle JC. Épidémiologie du déficit en vitamine D. Cahiers de nutrition et de diététique 2014; 49 : 252-9.
2. Bener A , Ehlayel MS, Tulic MK , Hamid Q. Vitamin D deficiency as a strong predictor of asthma in children. Int Arch Allergy Immunol 2012; 157: 168-75.
3. Dutau G, Lavaud F. Vitamine D, immunité, asthme et symptômes d’atopie. Revue Française d’Allergologie 2012; 52: S10-S18.
3. Dimeloe S, Nanzer A, Ryanna K, Hawrylowicz C: Regulatory T cells, inflammation and the allergic response: The role of glucocorticoids and vitamin D. J Steroid Biochem Mol Biol 2010; 120: 86-95.
4. Xystrakis E, Kusumakar S, Boswell S, Peek E, et al. Reversing the defective induction of IL10 secreting regulatory T cells in glucocorticoid - resistant asthma patients. J Clin Invest 2006; 116: 146 - 55.
6. Brehm JM, Acosta-Perez E, Klei L, Roeder K, Barmada M. et al. Vitamin D insufficiency and severe asthma exacerbations in Puerto Rican children. Am. J. Respir Crit Care Med 2012; 186:140-6.
7. Staple LE, Teach SJ. Evidence for the role of inadequate vitamin D in asthma severity among children. J Investig Med, 2011; 59: 1086-8.
8. Romme EA, Rutten EP, Smeenk FW, et al. Vitamin D status is associated with bone mineral density and functional exercise capacity in patients with chronic obstructive pulmonary disease. Ann Med 2013; 45(1): 91-6.
9. Black PN, Scragg R. Relationship between serum 25-hydroxyvitamin D and pulmonary function in the third National Health and Nutrition Examination Survey. Chest 2005; 128: 3792-8.
10. Janssens W, Lehouck A , Carremans C, Bouillon R, Mathieu C, Decramer M. Vitamin D beyond bones in chronic obstructive pulmonary disease time to act. Am J Respir Crit Care Med 2009; 179: 630-6.
11. Finklea JD, Grossmann RE, Tangpricha V. Vitamin D and chronic lung disease: a review of molecular mechanisms and clinical studies. Adv Nutr 2011; 2: 244-53.
12. Ghosn J, Viard JP. Vitamine D et infection. Presse Med. 2013, 42 ; 1371-6.
13. Viard JP. Vitamine D et pathologie infectieuse : un rôle dans les infections de la mère et de l’enfant ? La Lettre du Gynécologue 2012; 375: 35-8.
14. Wilkinson RJ, Llwelyn M, Toossi Z, Patel P, Pavsol G, Lalvani A, et al. Influence of vitamin D deficiency and Vitamin D receptor polymorphisms on tuberculosis among Gujarati Asians in west London: a case-control study. Lancet 2000 ; 355:618-21
15. Martineau AR, Timms PM, Bothamley GH et al. High-dose vitamin D3 during intensive phase antimicrobial treatment of pulmonary tuberculosis: a double-blind randomized controlled trial. Lancet 2011; 377:242-50.
16. Ginde AA, Mansbach JM , Camargo CA Jr. Association between serum 25-Hydroxyvitamin D level and upper respiratory tract infection in the Third National Health and Nutrition Examination Survey. Arch Intern Med 2009; 169: 384-90.
17. Murdoch DR, Slow S, Chambers ST, Jennings LC, Stewart AW, Priest PC, et al. Effect of Vitamin D3 supplementation on upper respiratory tract infection in healthy adults: the VIDARIS randomized controlled trial. JAMA 2012; 308: 1333-9.
18. Espié M, Wassermann J, De Kermadec E, Lalloum M, Coussy F. Vitamine D et cancers. Presse Med 2013 ; 42 :1405-11.
19. Weinstein S. Serum - hydroxyvitamin D and risk of lung cancer in male smokers: a nested case-control study. PLoS One 2011; 6(6): e 20796.
20. Hagaman JT, Panos RJ, McCormack FX , Thakar CV, Wikenheiser- Brokamp KA, Shipley RT, et al. Vitamin D deficiency and reduced lung function in connective tissue-associated interstitial lung diseases. Chest 2011; 139: 353-60.
21. Kavathia D, Buckley JD, Rao D, Rybicki B, Burke R. Elevated 1,25 dihydroxyvitamin D levels are associated with protracted treatment in sarcoidosis. Respir Med 2010; 104: 564-70.
22. Verleden SE, Vos R, Geenens R, Ruttens D, Vaneylen A, Dupont LJ, et al. Vitamin D deficiency in lung transplant patients: is it important. Transplantation 2012; 93: 224-9.
23. Lowery EM, Bemiss B, Cascino T, Durazo-Arvizu RA, Forsythe SM, Alex C , et al. Low vitamin D levels are associated with increased rejection and infections after lung transplantation. Heart Lung Transplant 2012; 31:700-7.
FIGURE/TABLE
REFERENCES
1. Souberbielle JC. Épidémiologie du déficit en vitamine D. Cahiers de nutrition et de diététique 2014; 49 : 252-9.
2. Bener A , Ehlayel MS, Tulic MK , Hamid Q. Vitamin D deficiency as a strong predictor of asthma in children. Int Arch Allergy Immunol 2012; 157: 168-75.
3. Dutau G, Lavaud F. Vitamine D, immunité, asthme et symptômes d’atopie. Revue Française d’Allergologie 2012; 52: S10-S18.
3. Dimeloe S, Nanzer A, Ryanna K, Hawrylowicz C: Regulatory T cells, inflammation and the allergic response: The role of glucocorticoids and vitamin D. J Steroid Biochem Mol Biol 2010; 120: 86-95.
4. Xystrakis E, Kusumakar S, Boswell S, Peek E, et al. Reversing the defective induction of IL10 secreting regulatory T cells in glucocorticoid - resistant asthma patients. J Clin Invest 2006; 116: 146 - 55.
6. Brehm JM, Acosta-Perez E, Klei L, Roeder K, Barmada M. et al. Vitamin D insufficiency and severe asthma exacerbations in Puerto Rican children. Am. J. Respir Crit Care Med 2012; 186:140-6.
7. Staple LE, Teach SJ. Evidence for the role of inadequate vitamin D in asthma severity among children. J Investig Med, 2011; 59: 1086-8.
8. Romme EA, Rutten EP, Smeenk FW, et al. Vitamin D status is associated with bone mineral density and functional exercise capacity in patients with chronic obstructive pulmonary disease. Ann Med 2013; 45(1): 91-6.
9. Black PN, Scragg R. Relationship between serum 25-hydroxyvitamin D and pulmonary function in the third National Health and Nutrition Examination Survey. Chest 2005; 128: 3792-8.
10. Janssens W, Lehouck A , Carremans C, Bouillon R, Mathieu C, Decramer M. Vitamin D beyond bones in chronic obstructive pulmonary disease time to act. Am J Respir Crit Care Med 2009; 179: 630-6.
11. Finklea JD, Grossmann RE, Tangpricha V. Vitamin D and chronic lung disease: a review of molecular mechanisms and clinical studies. Adv Nutr 2011; 2: 244-53.
12. Ghosn J, Viard JP. Vitamine D et infection. Presse Med. 2013, 42 ; 1371-6.
13. Viard JP. Vitamine D et pathologie infectieuse : un rôle dans les infections de la mère et de l’enfant ? La Lettre du Gynécologue 2012; 375: 35-8.
14. Wilkinson RJ, Llwelyn M, Toossi Z, Patel P, Pavsol G, Lalvani A, et al. Influence of vitamin D deficiency and Vitamin D receptor polymorphisms on tuberculosis among Gujarati Asians in west London: a case-control study. Lancet 2000 ; 355:618-21
15. Martineau AR, Timms PM, Bothamley GH et al. High-dose vitamin D3 during intensive phase antimicrobial treatment of pulmonary tuberculosis: a double-blind randomized controlled trial. Lancet 2011; 377:242-50.
16. Ginde AA, Mansbach JM , Camargo CA Jr. Association between serum 25-Hydroxyvitamin D level and upper respiratory tract infection in the Third National Health and Nutrition Examination Survey. Arch Intern Med 2009; 169: 384-90.
17. Murdoch DR, Slow S, Chambers ST, Jennings LC, Stewart AW, Priest PC, et al. Effect of Vitamin D3 supplementation on upper respiratory tract infection in healthy adults: the VIDARIS randomized controlled trial. JAMA 2012; 308: 1333-9.
18. Espié M, Wassermann J, De Kermadec E, Lalloum M, Coussy F. Vitamine D et cancers. Presse Med 2013 ; 42 :1405-11.
19. Weinstein S. Serum - hydroxyvitamin D and risk of lung cancer in male smokers: a nested case-control study. PLoS One 2011; 6(6): e 20796.
20. Hagaman JT, Panos RJ, McCormack FX , Thakar CV, Wikenheiser- Brokamp KA, Shipley RT, et al. Vitamin D deficiency and reduced lung function in connective tissue-associated interstitial lung diseases. Chest 2011; 139: 353-60.
21. Kavathia D, Buckley JD, Rao D, Rybicki B, Burke R. Elevated 1,25 dihydroxyvitamin D levels are associated with protracted treatment in sarcoidosis. Respir Med 2010; 104: 564-70.
22. Verleden SE, Vos R, Geenens R, Ruttens D, Vaneylen A, Dupont LJ, et al. Vitamin D deficiency in lung transplant patients: is it important. Transplantation 2012; 93: 224-9.
23. Lowery EM, Bemiss B, Cascino T, Durazo-Arvizu RA, Forsythe SM, Alex C , et al. Low vitamin D levels are associated with increased rejection and infections after lung transplantation. Heart Lung Transplant 2012; 31:700-7.
ARTICLE INFO
DOI: 10.12699/jfvp.6.17.2015.10
Conflict of Interest
Non
Date of manuscript receiving
25/12/2014
Date of publication after correction
07/02/2015
Article citation
Bouchentouf R. Vitamin D and repiratory diseases. J Func Vent Pulm 2015;17(6):10-14.