
 English
English
 French
French
Phenotype mixte BPCO-Asthme
COPD-Asthma overlap syndrome
M.S. Nguyen1, R. Louis2, J.L. Corhay2
1: Service de Pneumo-Allergologie. Hôpital HUU NGHI, Hanoi - Vietnam
2: Service de Pneumo-Allergologie. CHU de Liège - Belgique
Corresponding author
Dr. NGUYEN Minh-Sang
Service de Pneumo-Allergologie. Hôpital Huu Nghi. Hanoi - Vietnam
E-mail: sangmedi@gmail.com
ABSTRACT
In the recent years, the COPD-Asthma overlap syndrome is the object of a growing interest by the scientific community. It is indeed an important phenotype because patients need a specific therapeutic approach, especially the treatment by inhaled corticosteroids. In addition, patients with this overlap syndrome are more symptomatic and have more exacerbations than patients with COPD or asthma. Moreover the burdens linked with medical treatment and mortality are more important in this phenotype. For these reasons, we decided to draw the attention of the practitioners by this review on the COPD-Asthma overlap syndrome, by hoping to update their knowledge, and in other hand to help them in the management and treatment of these patients.
KEYWORDS: Asthma, COPD, COPD-Asthma overlap syndrome
RÉSUMÉ
Ces dernières années, le phénotype mixte BPCO-Asthme est l’objet d’un intérêt croissant par la part de la communauté scientifique. Il s’agit en effet d’un phénotype important, car il engendre une prise en charge thérapeutique spécifique - à savoir l’utilisation de corticostéroïdes inhalés. Les patients qui en sont atteints présentent plus de symptômes et plus d’exacerbations que les patients asthmatiques ou BPCO purs. De plus le fardeau lié aux traitements médicaux et la mortalité sont plus importants dans ce phénotype. Pour ces raisons, nous avons décidé rédiger cette revue afin d’attirer l’attention des praticiens sur ce phénotype mixte BPCO-Asthme, en espérant d’une part d’actualiser leurs connaissances sur ce phénotype, et, d’autre part les aider dans la prise en charge de ces patients en optimalisant.
MOTS CLES: Asthme, BPCO, phénotype mixte BPCO-Asthme
INTRODUCTION
En 1960, le néerlandais Orie NGM et ses collègues ont proposé pour la première fois le chevauchement entre l’asthme et la broncho-pneumopathie chronique obstructive (BPCO). Selon Orie NGM, les diverses formes d'obstruction des voies aériennes telles que l'asthme, la bronchite chronique et l'emphysème ne doivent finalement pas être considérées comme des maladies distinctes, mais plutôt comme des expressions différentes d'une même entité, une maladie pulmonaire chronique non spécifique[1].
Dans le troisième Symposium international sur la bronchite chronique aux Pays-Bas en septembre 1969, Fletcher et ses collègues ont aussi suggéré le terme de « hypothèse néerlandaise ». Au début hyperréactivité bronchique a été utilisée pour diagnostiquer l’asthme [2], cependant dans les dernières années on a aussi observé une hyperréactivité bronchique chez les patients souffrant de BPCO [3]. Par exemple, le tabagisme est peut-être associé à un risque d’hyperréactivité bronchique [4]. D’autre part, l’absence de réversibilité bronchique n’est pas seulement présente dans la BPCO, mais aussi dans l’asthme [5]. Donc, à côté de la BPCO et de l’asthme pur, il existe une BPCO avec des traits asthmatiques et un asthme avec des traits de BPCO. Pour cette raison, le « Global Initiative for Asthma » (GINA) et le « Global Initiative for Chronic Obstructive Lung Disease » (GOLD), au mois de mai cette année, ont publié la première fois une recommandation concernant ce phénotype mixte [6].
SIMILITUDES ET DIFFERENCES ENTRE LA BPCO ET L’ASTHME
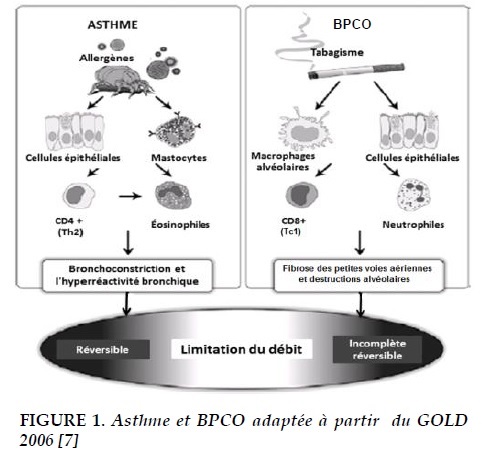
Les deux maladies se caractérisent par une limitation des débits aériens et par des symptômes communs incluant la difficulté respiratoire à l’effort, le manque de souffle ou les sibilantes à l’auscultation.Bien qu’elles conduisent toutes deux à la limitation des débits aériens, ces deux pathologies sont différentes du point de vue étiologique, pathogénique et épidémiologique. Le pronostic et le traitement sont également différents. Selon le GOLD 2006, les différences pathologiques sont résumées dans la Figure 1 [7]. Dans l’asthme, les allergènes représentent un facteur de risque important, alors que c’est le tabagisme qui est principalement incriminé dans la BPCO. Les cellules immunologiques qui jouent le rôle le plus important dans la BPCO sont les neutrophiles, les lymphocytes T-CD8+ et les cytokines suivantes IL-8, IL-6, IL-1β. Par contre, dans l’asthme, ce sont les éosinophiles, les lymphocytes T-CD4+ et les cytokines suivantes IL-4, IL-5, IL-13 qui jouent un rôle prépondérant [8].
L’asthme se caractérise par une bronchoconstriction et une l’hyperréactivité bronchique, mais l’impact sur le remaniement des voies aériennes et des alvéoles reste relativement limité. À l’opposé, la BPCO se caractérise par la fibrose des petites bronchioles et par la destruction des alvéoles.
Dans l’asthme, le trouble ventilatoire obstructif est complètement réversible (spontanément ou sous l’effet du traitement), tandis que la BPCO est précisément caractérisée par son caractère irréversible.
La BPCO commence en général après l’âge de 40 ans et est souvent associée au tabagisme, tandis que l’asthme apparaît souvent chez des personnes plus jeunes et n’est pas associé au tabac. Cependant, les réalités cliniques sont souvent plus complexes et nous amènent à rencontrer des cas de chevauchement ou ‘‘overlap’’ qui nous conduisent à remettre en cause notre diagnostic et le traitement. Par exemple, certains asthmatiques fumeurs présentent aussi des caractéristiques de BPCO (signes cliniques, épreuves fonctionnelles respiratoires et examens de laboratoire). De plus, chez certains patients BPCO, il existe des sujets aux antécédents asthmatiques qui présentent des expectorations éosinophiliques ou bien une réversibilité significative après l’utilisation d’aérosols bronchodilatateurs.
PHENOTYPE MIXTE ASTHME - BPCO
Définition Le premier signe de l’existence d’un phénotype mixte est le degré de réversibilité du trouble ventilatoire obstructif.
L’échelle de réversibilité varie de la réversibilité complète dans l’asthme à l’absence de réversibilité dans la BPCO. Entre les deux états, c’est la réversibilité incomplète [8]. Donc, chez les patients qui ont une réversibilité incomplète, la BPCO et l’asthme coexistent en même temps. C’est le phénotype mixte BPCO-Asthme ou syndrome de chevauchement asthme-BPCO. Le syndrome mixte BPCO-Asthme a aussi été défini par des symptômes d’augmentation de variabilité du débit aérien et une réversibilité incomplète de l’obstruction ventilatoire [9].
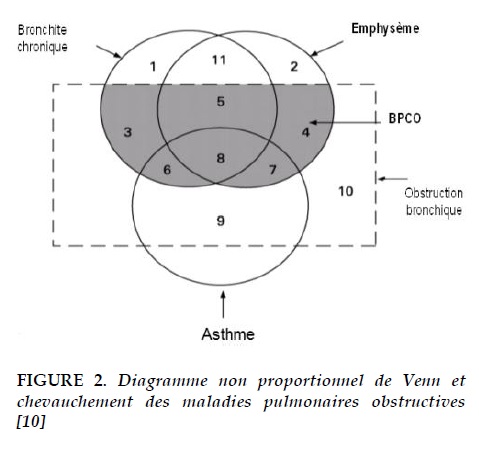
La BPCO n’est pas une maladie homogène, elle inclut des phénotypes différents [10]. Parmi ces phénotypes, il existe le phénotype mixte BPCO-asthme. En 1995, l’ATS (Amercican Thoracic Society) a adopté le diagramme non proportionnel de Venn [11] (Figure 2) suivant pour exprimer la diversité des présentations cliniques de la BPCO. On peut remarquer dans les zones 7, 8 et 9 que la BPCO et l’asthme coexistent.
Dans leurs nouvelles directives communes publiées en mai 2014, le GINA et le GOLD ont défini le syndrome de chevauchement asthme-BPCO ou phénotype mixte BPCO-asthme comme suit: présence d’une obstruction persistante des voies aériennes, avec quelques traits asthmatiques et quelques traits de BPCO [6].
Épidémiologie En 1995, une étude sur 30 patients BPCO a montré que 25% des patients ont une réversibilité significative et une bonne réponse clinique aux corticostéroïdes inhalés[12]. Dans une autre étude publiée en 2003, Soriano JB. et coll. ont montré que 17% à 19% des patients atteints d’une maladie pulmonaire obstructive ont au minimum les 2 affections et que cette prévalence augmente avec l’âge [13].
Parmi les syndromes de chevauchement des maladies pulmonaires obstructives, le chevauchement (« Overlap » en anglais) entre l’asthme et la BPCO est le plus fréquent [14].
Dans une étude publiée en 2011, Hardin M., et coll. ont montré que 13% des patients souffrant de BPCO avaient déjà des antécédents d’asthme avant l’âge de 40 ans [15]. Miravitlles M, et ses collègues ont montré que 17,4% des patients BPCO ont un phénotype mixte BPCO-asthme [16]. Cependant, ces 2 études ont défini le phénotype mixte sur base d’un seul critère: diagnostic d’asthme avant l’âge de 40 ans. Ce critère est imparfait, car il existe des patients asthmatiques sous-diagnostiqués [17]. De plus, il existe des patients qui commencent à présenter de l’asthme quand ils sont plus âgés [17, 18]. Jusqu'à présent, la prévalence précise du syndrome mixte BPCOAsthme demeure inconnue.
En général, les patients atteints du syndrome mixte sont plus âgés que les patients asthmatiques purs, mais un peu plus jeunes que les patients BPCO. Selon Hardin., et coll., l’âge moyen des patients présentant le syndrome mixte était dans son étude de 61,3 ans, ils étaient donc plus jeunes que les patients atteints de BPCO dont l’âge moyen était de 64,7 ans (p=0,0001) [15]. Les données du NHANES III (US National Health and Nutrition Examination Survey III) ont montré que l’âge moyen des asthmatiques purs est de 28,8 ans, celui de l’asthme avec bronchite chronique est de 38,2 ans et celui de la bronchite chronique pure est de 42,8 ans. Dans l’asthme avec bronchite chronique et emphysème, l’âge moyen est de 61,4 ans contre 68,4 ans dans la bronchite chronique avec emphysème [13]. D’autre part, de façon intéressante, on constate quand on considère isolément le phénotype mixte que sa prévalence augmente avec l’âge. Marco et coll. ont montré dans une nouvelle étude publiée en 2013 que la prévalence du phénotype mixte BPCO-asthme dans la population générale est de 1,6%, 2,1% et 4,5% respectivement dans les groupes d’âge de 20-44, 45-64, 65-84 ans [ 19].
En ce qui concerne la race et le sexe, les données sont moins claires. Dans la même étude, Hardin M., et coll. ont montré que plus d’Afro-Américains ont déclaré avoir des antécédents d'asthme (33,6% vs 15,6%, p <0,0001) [15].
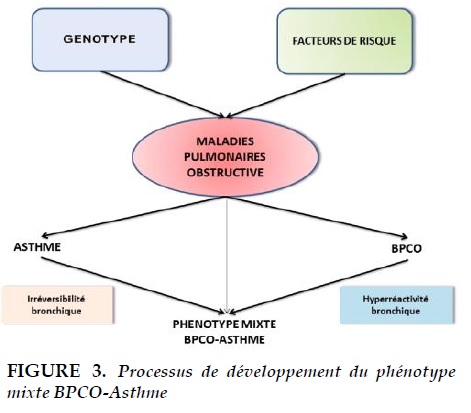
Pathogénie Nous pouvons distinguer deux processus de développement du syndrome mixte. Le premier processus est le syndrome mixte chez les patients asthmatiques qui subissent des remaniements bronchiques conduisant à une réversibilité incomplète des voies respiratoires après broncho-dilatation.
Chez les asthmatiques, la capacité de réversibilité des bronches diminue avec l’âge, surtout dans les dernières décades de la vie, augmentant ainsi le nombre de sujets souffrant de BPCO dans cette population. Cependant, parmi les patients asthmatiques fumeurs, la prévalence de la BPCO est plus élevée que chez les non-fumeurs, et la fonction respiratoire est également vouée à un déclin plus rapide chez les asthmatiques fumeurs [20]. Les facteurs de risque qui provoquent l’apparition d’une irréversibilité bronchique sont résumés dans la Tableau 1 [5].
Des gènes peuvent ainsi affecter le développement du poumon dans l'utérus et la croissance de poumon dans l’enfance. Ils peuvent aussi en association avec des facteurs de risques environnementaux, tels que le tabagisme et la pollution de l'air, contribuer au développement de l'asthme dans l'enfance et de la BPCO à la suite [21]. En outre, Hardin M et ses collègues ont montré que les polymorphismes nucléotidiques simples (SNP-single nucleotide polymorphisms) dans les gènes CSMD1 (rs11779254, p=1,57×10-6) et SOX5 (rs59569785, p=1.61×10-6) chez les non-Hispaniques blancs, et le gène GPR65 (rs6574978, p=1.18×10-7) qui apparait dans les groupes non-Hispaniques blancs et les Afro-Américains, sont associés au syndrome de chevauchement de la BPCO et de l'asthme [22].
Le deuxième processus est le syndrome mixte chez les patients BPCO chez qui l’on voit apparaître des traits asthmatiques alors qu’ils ne présentaient aucun symptôme d’asthme auparavant (asthme d'apparition tardive). Le mécanisme de l’apparition de l’asthme chez les personnes âgées n’est pas encore très clair. Cependant, dans une étude publiée en 2002, Hizawa N et coll. ont montré que l'allèle du promoteur SNP (rs2280788: -28C> G) dans le gène ligand des chimiokines 5 (CCL5) est associé à l'asthme d'apparition tardive [23].
La CCL5 pourrait être impliquée dans la pathogenèse du remodelage épithélial et de l’hyperréactivité bronchique chronique en réponse à des infections virales [24, 25]. De plus, le tabagisme est peut-être associé à un risque d’hyperréactivité bronchique [4]. Après des années, le fumeur développe une BPCO et en même temps une maladie asthmatique caractérisée par une hyperréactivité bronchique, conduisant ainsi au phénotype mixte BPCO-Asthme [26]. Rappelons encore que les facteurs favorisant l’apparition d’une hyperréactivité bronchique sont l’obstruction bronchique, l'atopie (IgE, Prick tests positifs..), l’inflammation éosinophique, le sexe féminin et enfin le tabagisme [3]. Le résumé du processus de développement de ce phénotype mixte est décrit dans la Figure 3.
Diagnostic
En 2012, une étude menée en Espagne sur le phénotype mixte BPCO-asthme a permis de proposer les critères diagnostiques suivants [27].
Critères majeurs
Réversibilité positive accrue (≥ 15% et ≥ 400ml), éosinophilie dans les expectorations ≥ 3%, antécédents personnels d’asthme.
Critères mineurs
IgE totales élevées, antécédents personnels d’atopie, réversibilité positive (≥ 12% et ≥ 200ml) à au moins deux reprises. Le diagnostic ne peut être posé que si le patient présente au moins 2 critères majeurs, ou un critère majeur et 2 critères mineurs.
Si les critères espagnols sont très spécifiques, ils sont cependant moins sensibles. De plus, la fraction expirée du monoxyde d'azote (FeNO) et les IgE spécifiques n’ont pas été repris dans les critères diagnostiques.
Ainsi, jusqu’à ce jour, nous n’avons pas encore de critères unanimes précis pour porter un diagnostic de phénotype mixte BPCO-asthme, chaque auteur a ses critères basés sur les antécédents médicaux et les examens paracliniques. Par contre, il revient au clinicien de:
1) Confirmer le diagnostic de la BPCO par un examen spirométrique, le VEMS/CVF doit être inférieur à 70% après bronchodilatation par un bronchodilatateur à courte durée d’action.
2) Confirmer le diagnostic d’asthme en prenant en compte les éléments suivants: i) antécédent d’asthme avant l’âge de 40 ans, ii) terrain atopique, tests cutanés positifs, rhinite allergique, symptômes respiratoires variables au cours du temps, iii) examens spirométriques: test de réversibilité positif, iv) paramètres inflammatoires plaidant en faveur d’un asthme éosinophilique: 3% d’éosinophiles dans le sputum, éosinophilie élevée dans le sang (> 400/mm3), FeNO élevé (≥ 45 ppb -particules par milliard), paramètres systémiques spécifiques: élévation des IgE totales, élévation des IgE spécifiques.
Parmi tous ces éléments, l’inflammation éosinophilique des voies aériennes est le facteur le plus important. Elle reflète le mécanisme biologique de l’asthme et joue un rôle important dans le cadre de nouvelles études menées dans l’asthme et la BPCO.
Conséquences cliniques et pronostics du syndrome mixte
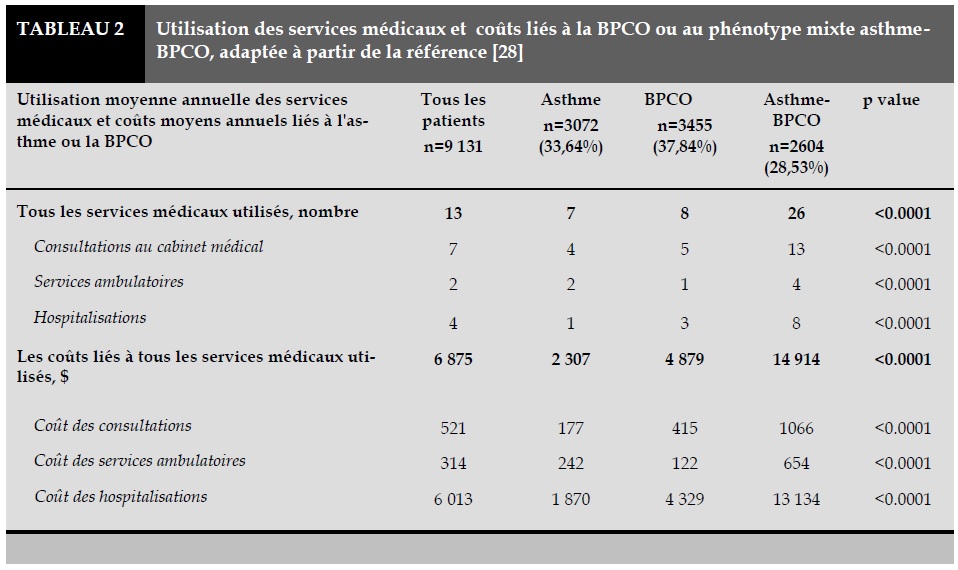
Les patients atteints du phénotype mixte BPCO- Asthme ont plus recours aux services médicaux (comme des consultations chez un généraliste ou des hospitalisations) et besoin de plus de traitements médicamenteux que les patients atteints de BPCO ou les asthmatiques purs. Ce phénotype engendre donc des coûts généraux sont plus élevés (Tableau 2) [28].
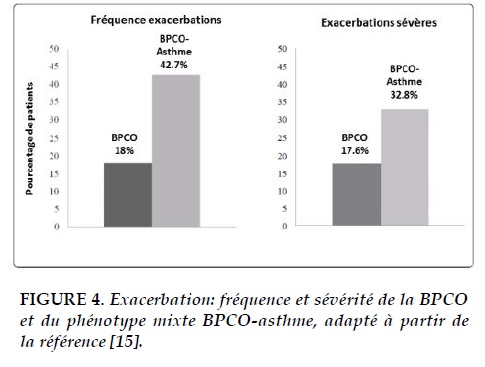
Les patients atteints du phénotype mixte présentent aussi plus d’exacerbations que les patients atteints de BPCO isolée [15, 29]. Selon le GOLD, les patients symptomatiques avec au moins 2 exacerbations au cours des 12 derniers mois sont classés dans le groupe D (le groupe à plus haut risque). Cependant, les patients atteints du phénotype mixte ont des exacerbations plus fréquentes et plus sévères que les autres maladies pulmonaires obstructives (Figure 4) [15].
Parmi les conséquences des exacerbations, nous pouvons relever un déclin plus rapide de la fonction respiratoire, une détérioration de la qualité de vie et du bien-être des patients, et une augmentation de la morbidité et de la mortalité dans la BPCO.
Dans une étude de population (NHANES III aux États-Unis) reprenant les données du suivi longitudinal de 15203 sujets, Enrique Diaz-Guzman et coll. ont montré que sujets chez qui coexistait un asthme et une BPCO avaient un risque de décès plus élevé au cours du suivi (Figure 5) [30].
Thérapeutique L’intérêt de distinguer le phénotype mixte BPCOasthme de la BPCO et de l’asthme est de permettre une approche thérapeutique plus ciblée chez les patients qui sont atteints de ce phénotype mixte [31].
En général, la pierre angulaire du traitement d’asthme est la prise de corticostéroïdes inhalés. Par contre, le traitement de la BPCO repose principalement sur les bronchodilatateurs à longue durée d’action, on n’ajoute en effet des corticostéroïdes inhalés que lorsque la BPCO est sévère (ou très sévère) et si le patient présente des exacerbations fréquentes [32, 33].
Les corticostéroïdes inhalés sont moins efficaces chez les patients BPCO et provoquent potentiellement des effets secondaires comme
la candidose orale, la diminution de la densité osseuse ou encore les altérations de la peau. De plus, de nouvelles études ont montré le haut risque de pneumonie liée à l’utilisation des corticostéroïdes inhalés chez les patients BPCO stables [34]. Dans le phénotype mixte, les corticostéroïdes inhalés sont indiqués à n’importe quel niveau d’obstruction bronchique [31, 35, 36]. Finalement, une bonne indication de l’usage des corticostéroïdes inhalés dans la BPCO devrait permettre d’une part d’éviter des effets secondaires inutiles et d’autre part de réduire le coût lié au traitement médicamenteux de la BPCO.
Dans ce phénotype mixte BPCO-Asthme, des études sont en cours afin de voir si un traitement par anticorps monoclonaux dirigés contre l’IL-5 (mépolizumab) pourrait être utile, par exemple chez les sujets présentant une inflammation éosinophilique persistante malgré un traitement par hautes doses de corticostéroïdes [37].
La thermoplastie, en cours de validation dans l’asthme sévère, pourrait aussi devenir un domaine d’investigation prometteur dans ce phénotype mixte [38, 39].
Ces thérapeutiques ciblées pour ce phénotype n’excluent pas l’application des recommandations du GOLD dans le traitement de fond de la BPCO tels que l’arrêt du facteur tabagique, l’oxygénothérapie en cas d’insuffisance respiratoire, la revalidation pulmonaire, et les mesures préventives des infections des voies respiratoires (vaccin antigrippal et antipneumococcique).
CONCLUSION
La distinction entre l’asthme et la BPCO n’est pas toujours possible, Il existe donc un syndrome de chevauchement important entre la BPCO et l’asthme, ce dernier correspond à un phénotype important dont la prévalence n’est pas encore bien connue. Son diagnostic ne doit pas seulement être basé sur les tests de fonction respiratoire et en particulier le test de réversibilité bronchique, mais il faut aussi tenir compte d’autres informations ou résultats d’examens paracliniques tels que les antécédents d’atopie, l’inflammation éosinophilique, la mesure du NO exhalé, etc. Par ailleurs, les patients qui en sont atteints présentent plus de symptômes et plus d’exacerbations que les patients asthmatiques ou BPCO purs. De plus, le fardeau lié aux traitements médicaux et la mortalité sont plus importants dans ce phénotype. Il nécessite aussi une prise en charge thérapeutique plus spécifique - à savoir l’utilisation de corticostéroïdes inhalés.
CONFLITS D’INTÉRÊTS
Aucun.
REFERENCES
1. Orie NGM, Sluiter H – Bronchitis: an international symposium, 27-29 April 1960, University of Groningen, the Netherlands - CC Thomas, 1961.
2. Benson MK. – Bronchial hyperreactivity. British Journal of Diseases of the Chest 1975; 69: 227-239.
3. Grootendorst DC, Rabe KF. – Mechanisms of Bronchial Hyperreactivity in Asthma and Chronic Obstructive Pulmonary Disease. Proceedings of the American Thoracic Society 2004; 1: 77-87.
4. Chinn S, Jarvis D, Luczynska CM, AckermannLiebrich U, Anto JM, et al. – An increase in bronchial responsiveness is associated with continuing or restarting smoking. Am J Respir Crit Care Med 2005; 172: 956-961.
5. Boulet LP. – Irreversible airway obstruction in asthma. Curr Allergy Asthma Rep 2009; 9: 168-173.
6. Diagnosis of Diseases of Chronic Airflow Limitation: Asthma, COPD and Asthma-COPD Overlap Syndrome (ACOS). GLOBAL INITIATIVE FOR ASTHMA ; GLOBAL INITIATIVE FOR CHRONIC OBSTRUCTIVE LUNG DISEASE 2014.
7. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease (2006). GLOBAL INITIATIVE FOR CHRONIC OBSTRUCTIVE LUNG DISEASE 2006.
8. Buist AS - Chapter 1 - Definitions In Asthma and COPD (Second Edition). Academic Press,Oxford 2009, 1-7.
9. Gibson PG, Simpson JL. – The overlap syndrome of asthma and COPD: what are its features and how important is it? Thorax 2009; 64: 728-735.
10. Corhay JL, Schleich F, Louis R. – Phenotypes in chronic obstructive Pulmonary disease. Rev Med Liège 2014; 69: 415-421.
11. – Standards for the diagnosis and care of patients with chronic obstructive pulmonary disease. American Thoracic Society. Am J Respir Crit Care Med 1995; 152: S77121.
12. Weiner P, Weiner M, Azgad Y, Zamir D. – Inhaled budesonide therapy for patients with stable COPD. Chest 1995; 108: 1568-1571.
13. Soriano JB, Davis KJ, Coleman B, Visick G, Mannino D, et al. – The proportional Venn diagram of obstructive lung disease: two approximations from the United States and the United Kingdom. Chest 2003; 124: 474-481.
14. Marsh SE, Travers J, Weatherall M, Williams MV, Aldington S, et al. – Proportional classifications of COPD phenotypes. Thorax 2008; 63: 761-767.
15. Hardin M, Silverman EK, Barr RG, Hansel NN, Schroeder JD, et al. – The clinical features of the overlap between COPD and asthma. Respir Res 2011; 12: 127.
16. Miravitlles M, Soriano JB, Ancochea J, Munoz L, Duran-Tauleria E, et al. – Characterisation of the overlap COPD-asthma phenotype. Focus on physical activity and health status. Respir Med 2013; 107: 1053-1060.
17. Enright PL, McClelland RL, Newman AB, Gottlieb DJ, Lebowitz MD. – Underdiagnosis and undertreatment of asthma in the elderly. Cardiovascular Health Study Research Group. Chest 1999; 116: 603-613.
18. Hanania NA, King MJ, Braman SS, Saltoun C, Wise RA, et al. – Asthma in the elderly: Current understanding and future research needs--a report of a National Institute on Aging (NIA) workshop. J Allergy Clin Immunol 2011; 128: S4-24.
19. de Marco R, Pesce G, Marcon A, Accordini S, Antonicelli L, et al. – The coexistence of asthma and chronic obstructive pulmonary disease (COPD): prevalence and risk factors in young, middle-aged and elderly people from the general population. PLoS One 2013; 8: e62985.
20. Lange P, Parner J, Vestbo J, Schnohr P, Jensen G. – A 15-year follow-up study of ventilatory function in adults with asthma. N Engl J Med 1998; 339: 1194-1200.
21. Postma DS, Kerkhof M, Boezen HM, Koppelman GH. – Asthma and chronic obstructive pulmonary disease: common genes, common environments? Am J Respir Crit Care Med 2011; 183: 1588-1594.
22. Hardin M, Cho M, McDonald ML, Beaty T, Ramsdell J, et al. – The clinical and genetic features of COPD-asthma overlap syndrome. Eur Respir J 2014; 44: 341-350.
23. Hizawa N, Yamaguchi E, Konno S, Tanino Y, Jinushi E, et al. – A functional polymorphism in the RANTES gene promoter is associated with the development of late-onset asthma. Am J Respir Crit Care Med 2002; 166: 686-690.
24. Zhu J, Qiu YS, Majumdar S, Gamble E, Matin D, et al. – Exacerbations of Bronchitis: bronchial eosinophilia and gene expression for interleukin-4, interleukin-5, and eosinophil chemoattractants. Am J Respir Crit Care Med 2001; 164: 109-116.
25. Matsukura S, Kokubu F, Kubo H, Tomita T, Tokunaga H, et al. – Expression of RANTES by normal airway epithelial cells after influenza virus A infection. Am J Respir Cell Mol Biol 1998; 18: 255-264.
26. Jindal SK. – Dutch hypothesis: revisited? Chest 2004; 126: 329-331.
27. Soler-Cataluna JJ, Cosio B, Izquierdo JL, LopezCampos JL, Marin JM, et al. – Consensus document on the overlap phenotype COPD-asthma in COPD. Arch Bronconeumol 2012; 48: 331-337.
28. Shaya FT, Dongyi D, Akazawa MO, Blanchette CM, Wang J, et al. – Burden of concomitant asthma and COPD in a Medicaid population. Chest 2008; 134: 14-19.
29. Menezes AM, Montes de Oca M, Perez-Padilla R, Nadeau G, Wehrmeister FC, et al. – Increased risk of exacerbation and hospitalization in subjects with an overlap phenotype: COPD-asthma. Chest 2014; 145: 297-304.
30. Diaz-Guzman E, Khosravi M, Mannino DM. – Asthma, chronic obstructive pulmonary disease, and mortality in the U.S. population. Copd 2011; 8: 400-407.
31. Louie S, Zeki AA, Schivo M, Chan AL, Yoneda KY, et al. – The asthma-chronic obstructive pulmonary disease overlap syndrome: pharmacotherapeutic considerations. Expert Rev Clin Pharmacol 2013; 6: 197-219.
32. Rabe KF, Hurd S, Anzueto A, Barnes PJ, Buist SA, et al. – Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. American journal of respiratory and critical care medicine 2007; 176: 532-555.
33. Vestbo J, Hurd SS, Agusti AG, Jones PW, Vogelmeier C, et al. – Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. Am J Respir Crit Care Med 2013; 187: 347-365.
34. Drummond MB, Dasenbrook EC, Pitz MW, Murphy DJ, Fan E. – Inhaled corticosteroids in patients with stable chronic obstructive pulmonary disease: a systematic review and meta-analysis. JAMA 2008; 300: 2407-2416.
35. Miravitlles M, Soler-Cataluna JJ, Calle M, Soriano JB. – Treatment of COPD by clinical phenotypes: putting old evidence into clinical practice. Eur Respir J 2013; 41: 1252-1256.
36. Miravitlles M. – The overlap syndrome between asthma and COPD: implications for management. Hot Topics Respir Med 2011; 16: 15-20.
37. Haldar P, Brightling CE, Hargadon B, Gupta S, Monteiro W, et al. – Mepolizumab and exacerbations of refractory eosinophilic asthma. N Engl J Med 2009; 360: 973-984.
38. Wechsler ME, Laviolette M, Rubin AS, Fiterman J, Lapa e Silva JR, et al. – Bronchial thermoplasty: Longterm safety and effectiveness in patients with severe persistent asthma. J Allergy Clin Immunol 2013; 132: 1295-1302.
39. Doeing DC, Mahajan AK, White SR, Naureckas ET, Krishnan JA, et al. – Safety and feasibility of bronchial thermoplasty in asthma patients with very severe fixed airflow obstruction: a case series. J Asthma 2013; 50: 215-218.
FIGURES / TABLES

REFERENCES
1. Orie NGM, Sluiter H – Bronchitis: an international symposium, 27-29 April 1960, University of Groningen, the Netherlands - CC Thomas, 1961.
2. Benson MK. – Bronchial hyperreactivity. British Journal of Diseases of the Chest 1975; 69: 227-239.
3. Grootendorst DC, Rabe KF. – Mechanisms of Bronchial Hyperreactivity in Asthma and Chronic Obstructive Pulmonary Disease. Proceedings of the American Thoracic Society 2004; 1: 77-87.
4. Chinn S, Jarvis D, Luczynska CM, AckermannLiebrich U, Anto JM, et al. – An increase in bronchial responsiveness is associated with continuing or restarting smoking. Am J Respir Crit Care Med 2005; 172: 956-961.
5. Boulet LP. – Irreversible airway obstruction in asthma. Curr Allergy Asthma Rep 2009; 9: 168-173.
6. Diagnosis of Diseases of Chronic Airflow Limitation: Asthma, COPD and Asthma-COPD Overlap Syndrome (ACOS). GLOBAL INITIATIVE FOR ASTHMA ; GLOBAL INITIATIVE FOR CHRONIC OBSTRUCTIVE LUNG DISEASE 2014.
7. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease (2006). GLOBAL INITIATIVE FOR CHRONIC OBSTRUCTIVE LUNG DISEASE 2006.
8. Buist AS - Chapter 1 - Definitions In Asthma and COPD (Second Edition). Academic Press,Oxford 2009, 1-7.
9. Gibson PG, Simpson JL. – The overlap syndrome of asthma and COPD: what are its features and how important is it? Thorax 2009; 64: 728-735.
10. Corhay JL, Schleich F, Louis R. – Phenotypes in chronic obstructive Pulmonary disease. Rev Med Liège 2014; 69: 415-421.
11. – Standards for the diagnosis and care of patients with chronic obstructive pulmonary disease. American Thoracic Society. Am J Respir Crit Care Med 1995; 152: S77121.
12. Weiner P, Weiner M, Azgad Y, Zamir D. – Inhaled budesonide therapy for patients with stable COPD. Chest 1995; 108: 1568-1571.
13. Soriano JB, Davis KJ, Coleman B, Visick G, Mannino D, et al. – The proportional Venn diagram of obstructive lung disease: two approximations from the United States and the United Kingdom. Chest 2003; 124: 474-481.
14. Marsh SE, Travers J, Weatherall M, Williams MV, Aldington S, et al. – Proportional classifications of COPD phenotypes. Thorax 2008; 63: 761-767.
15. Hardin M, Silverman EK, Barr RG, Hansel NN, Schroeder JD, et al. – The clinical features of the overlap between COPD and asthma. Respir Res 2011; 12: 127.
16. Miravitlles M, Soriano JB, Ancochea J, Munoz L, Duran-Tauleria E, et al. – Characterisation of the overlap COPD-asthma phenotype. Focus on physical activity and health status. Respir Med 2013; 107: 1053-1060.
17. Enright PL, McClelland RL, Newman AB, Gottlieb DJ, Lebowitz MD. – Underdiagnosis and undertreatment of asthma in the elderly. Cardiovascular Health Study Research Group. Chest 1999; 116: 603-613.
18. Hanania NA, King MJ, Braman SS, Saltoun C, Wise RA, et al. – Asthma in the elderly: Current understanding and future research needs--a report of a National Institute on Aging (NIA) workshop. J Allergy Clin Immunol 2011; 128: S4-24.
19. de Marco R, Pesce G, Marcon A, Accordini S, Antonicelli L, et al. – The coexistence of asthma and chronic obstructive pulmonary disease (COPD): prevalence and risk factors in young, middle-aged and elderly people from the general population. PLoS One 2013; 8: e62985.
20. Lange P, Parner J, Vestbo J, Schnohr P, Jensen G. – A 15-year follow-up study of ventilatory function in adults with asthma. N Engl J Med 1998; 339: 1194-1200.
21. Postma DS, Kerkhof M, Boezen HM, Koppelman GH. – Asthma and chronic obstructive pulmonary disease: common genes, common environments? Am J Respir Crit Care Med 2011; 183: 1588-1594.
22. Hardin M, Cho M, McDonald ML, Beaty T, Ramsdell J, et al. – The clinical and genetic features of COPD-asthma overlap syndrome. Eur Respir J 2014; 44: 341-350.
23. Hizawa N, Yamaguchi E, Konno S, Tanino Y, Jinushi E, et al. – A functional polymorphism in the RANTES gene promoter is associated with the development of late-onset asthma. Am J Respir Crit Care Med 2002; 166: 686-690.
24. Zhu J, Qiu YS, Majumdar S, Gamble E, Matin D, et al. – Exacerbations of Bronchitis: bronchial eosinophilia and gene expression for interleukin-4, interleukin-5, and eosinophil chemoattractants. Am J Respir Crit Care Med 2001; 164: 109-116.
25. Matsukura S, Kokubu F, Kubo H, Tomita T, Tokunaga H, et al. – Expression of RANTES by normal airway epithelial cells after influenza virus A infection. Am J Respir Cell Mol Biol 1998; 18: 255-264.
26. Jindal SK. – Dutch hypothesis: revisited? Chest 2004; 126: 329-331.
27. Soler-Cataluna JJ, Cosio B, Izquierdo JL, LopezCampos JL, Marin JM, et al. – Consensus document on the overlap phenotype COPD-asthma in COPD. Arch Bronconeumol 2012; 48: 331-337.
28. Shaya FT, Dongyi D, Akazawa MO, Blanchette CM, Wang J, et al. – Burden of concomitant asthma and COPD in a Medicaid population. Chest 2008; 134: 14-19.
29. Menezes AM, Montes de Oca M, Perez-Padilla R, Nadeau G, Wehrmeister FC, et al. – Increased risk of exacerbation and hospitalization in subjects with an overlap phenotype: COPD-asthma. Chest 2014; 145: 297-304.
30. Diaz-Guzman E, Khosravi M, Mannino DM. – Asthma, chronic obstructive pulmonary disease, and mortality in the U.S. population. Copd 2011; 8: 400-407.
31. Louie S, Zeki AA, Schivo M, Chan AL, Yoneda KY, et al. – The asthma-chronic obstructive pulmonary disease overlap syndrome: pharmacotherapeutic considerations. Expert Rev Clin Pharmacol 2013; 6: 197-219.
32. Rabe KF, Hurd S, Anzueto A, Barnes PJ, Buist SA, et al. – Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. American journal of respiratory and critical care medicine 2007; 176: 532-555.
33. Vestbo J, Hurd SS, Agusti AG, Jones PW, Vogelmeier C, et al. – Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. Am J Respir Crit Care Med 2013; 187: 347-365.
34. Drummond MB, Dasenbrook EC, Pitz MW, Murphy DJ, Fan E. – Inhaled corticosteroids in patients with stable chronic obstructive pulmonary disease: a systematic review and meta-analysis. JAMA 2008; 300: 2407-2416.
35. Miravitlles M, Soler-Cataluna JJ, Calle M, Soriano JB. – Treatment of COPD by clinical phenotypes: putting old evidence into clinical practice. Eur Respir J 2013; 41: 1252-1256.
36. Miravitlles M. – The overlap syndrome between asthma and COPD: implications for management. Hot Topics Respir Med 2011; 16: 15-20.
37. Haldar P, Brightling CE, Hargadon B, Gupta S, Monteiro W, et al. – Mepolizumab and exacerbations of refractory eosinophilic asthma. N Engl J Med 2009; 360: 973-984.
38. Wechsler ME, Laviolette M, Rubin AS, Fiterman J, Lapa e Silva JR, et al. – Bronchial thermoplasty: Longterm safety and effectiveness in patients with severe persistent asthma. J Allergy Clin Immunol 2013; 132: 1295-1302.
39. Doeing DC, Mahajan AK, White SR, Naureckas ET, Krishnan JA, et al. – Safety and feasibility of bronchial thermoplasty in asthma patients with very severe fixed airflow obstruction: a case series. J Asthma 2013; 50: 215-218.
ARTICLE INFO
DOI: 10.12699/jfvp.5.15.2014.3
Conflict of Interest
Non
Date of manuscript receiving
22/4/2014
Date of publication after correction
15/8/2014
Article citation
NGUYEN M.S , LOUIS R, CORHAY J.L. Phenotype mixte BPCO-Asthme. J Func Vent Pulm 2014;05(15):3-10.