
 English
English
 French
French
Pemphigoïde bulleuse révélant un carcinome bronchique
Bullous pemphigoid revealing a bronchial carcinoma
H. Janah, H. Souhi, A. Zegmout, H. Naji-Amrani, M. Raoufi, H. Elouazzani, I.A. Rhorfi, A. Abid
Service de Pneumo-Phtisiologie
Hôpital Militaire d’Instruction Mohammed V, Rabat - Maroc
Corresponding author
Dr. Hicham JANAH
Service de Pneumo-Phtisiologie.
Hôpital Militaire d’Instruction Mohammed V. Rabat - Maroc
E-mail: janah14@live.fr
ABSTRACT
Introduction. Bullous pemphigoid (BP) is the most common autoimmune bullous dermatosis, preferably touching the age of about 70 years.
The paraneoplasic origin of PB is rarely reported. This injury can appear synchronously or sometimes be a manifestation indicative of the tumor.
Observation. We report the case of a young patient with metastatic bronchial cancer revealed by BP.
Conclusion. In the subject young smoker, any bullous pemphigoid justifies the search of neoplasia.
KEYWORDS: Bullous pemphigoid, bullous dermatosis, paraneoplasia, lung cancer
RÉSUMÉ
Introduction. La pemphigoïde bulleuse (PB) est la plus fréquente des dermatoses bulleuses auto-immunes, touchants pré- férentiellement le sujet âgé de plus de 70 ans.
L’origine paranéoplasique de la PB est rarement rapportée. Cette lésion peut apparaitre de manière synchrone ou parfois être une manifestation révélatrice de la tumeur.
Observation. Nous rapportons l’observation d’un jeune patient présentant un cancer bronchique métastatique révélé par une PB.
Conclusion. Chez le sujet jeune fumeur, toute pemphigoïde bulleuse justifie la recherche d’une néoplasie.
MOTS CLES: Pemphigoïde bulleuse, dermatose bulleuse, paranéoplasie, cancer bronchopulmonaire
INTRODUCTION
La pemphigoïde bulleuse (PB) est la plus fréquente des dermatoses bulleuses auto-immunes. L’origine paranéoplasique de la pemphigoïde bulleuse est rarement rapportée.
Nous rapportons l’observation d’un jeune patient présentant un cancer bronchique révélé par une PB.
OBSERVATION
Nous rapportons le cas d’un patient âgé de 52 ans, tabagique chronique à raison de 40 paquets-année, qui présentait depuis 3 mois des douleurs thoraciques gauches, des hémoptysies de faibles abondances évoluant dans un contexte de fléchissement de l’état général avec apparition récente des lésions dermatologiques prurigineuses.
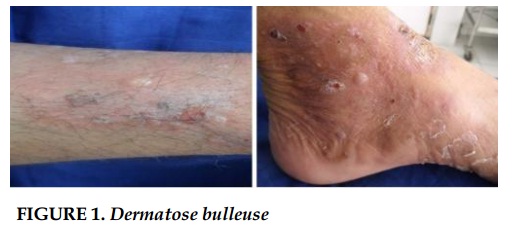
L’examen clinique pleuropulmonaire objectivait un syndrome de condensation au niveau de l’hemithorax gauche, l’examen cutané montrait une dermatose bulleuse prurigineuse à contour clair reposant sur des plaques erythémateuse avec un signe de Nikolsky négatif, laissant place à des lésions érosives sans atteinte de la muqueuse buccale ni génitale (Figure 1), intéressant de façon symétrique le tronc et les membres inferieurs faisant évoquer une pemphigoï- de bulleuse associée à un cancer bronchique.
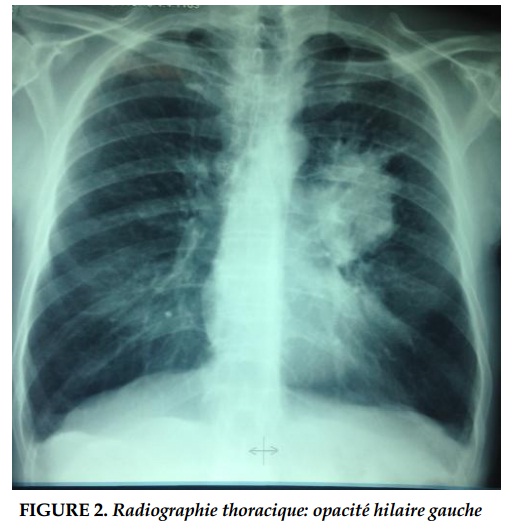
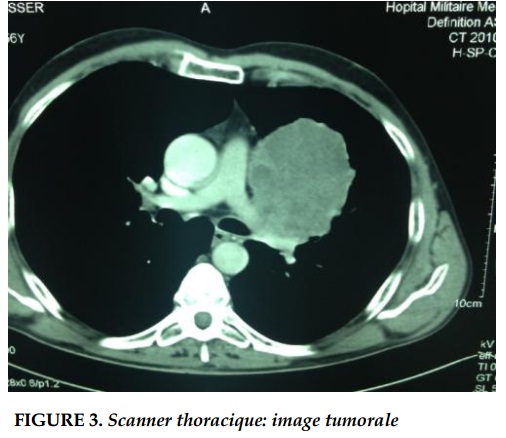
La radiographie thoracique de face montrait une opacité hilaire gauche, le scanner thoracique objectivait un processus tissulaire nécrotique hilaire gauche, réalisant un contact intime avec l’artère pulmonaire gauche (Figure 2 et 3).
La fibroscopie bronchique objectivait un bourgeon tumoral blanchâtre obstruant l’orifice du culmen et l’étude anatomopathologique des biopsies revenaient en faveur d’un carcinome épidermoïde moyennement différencié et infiltrant. La biopsie cutanée montrait un décollement sous épidermique
avec dépôts de C3 et IgG à l’immunofluorescence directe compatible avec une pemphigoïde bulleuse.
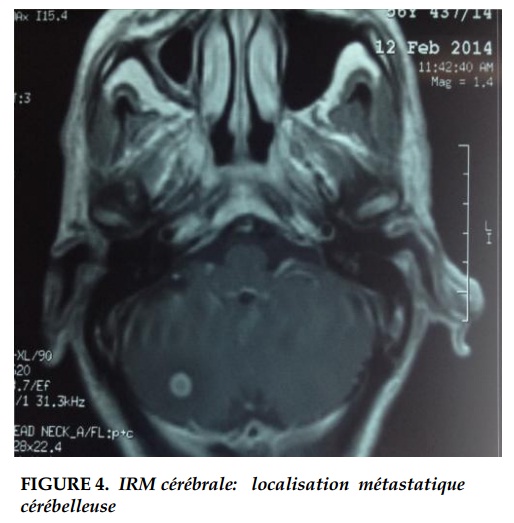
Le bilan d’extension du cancer bronchique mettait en évidence une localisation métastatique cérébelleuse (Figure 4). L’hémogramme montrait une éosinophilie modérée. La spirométrie montrait des troubles ventilatoires obstructifs avec un VEMS à 40%.
La décision thérapeutique était de commencer une chimiothérapie à base de cisplatine et navelbine, associée à une radiothérapie thoracique et cérébelleuse et corticothérapie locale.
L’évolution a été marquée par la régression des lé- sions bulleuses amélioration clinique et stabilisation du processus pulmonaire sur un recul de 8 mois.
DISCUSSION
Les syndromes paranéoplasiques les plus fréquents dans le cancer bronchique sont d’abord l’hippocratisme digital (dans sa forme isolée ou associée à une ostéo-arthropathie hypertrophiante), puis les manifestations endocriniennes et neurologiques.
Les syndromes paranéoplasiques cutanés sont beaucoup plus rares et regroupent l’acanthosis nigricans, l’acrokératose de Bazex, la dermatomyosite et les dermatoses bulleuses [1]. Les manifestations paranéoplasiques cutanées représentent 7 à 15% des syndromes paranéoplasiques rapportés au cours de l’é- volution des cancers [2]. Ces dermatoses paranéoplasiques représentent un groupe hétérogène d’affections qui ne résultent pas de l’extension directe du cancer ou d’une diffusion métastatique. Les manifestations cutanées peuvent précéder, coïncider ou suivre le diagnostic du cancer. L’évolution de la dermatose paranéoplasique accompagne étroitement celle favorable ou non du cancer.
La physiopathologie des dermatoses paranéoplasiques est mal connue: production par la tumeur d’hormones, de cytokines, de facteurs de croissance ou de diverses autres substances encore inconnues; mécanismes immunologiques mettant en jeu des interactions antigènes - anticorps [3]. La pemphigoï-de bulleuse (PB) est la plus fréquente des dermatoses bulleuses auto-immunes. Elle représente 70 % des dermatoses bulleuses auto-immunes sous- épidermiques avec une incidence annuelle de plus de 400 nouveaux cas par an en France [4].
Elle touche avec prédilection le sujet âgé (âge moyen en France autour de 80 ans). Par ailleurs notre patient était relativement jeune. Elle se caractérise cliniquement dans sa forme classique par une dermatose bulleuse, prurigineuse, faite de bulles tendues sur plaques érythémateuses, symétriques (faces de flexion des membres, face antérointerne des cuisses, abdomen), sans atteinte muqueuse ni cicatrice atrophique, sans signe de Nikolsky [5].
L’hémogramme montre fréquemment une hyperéosinophilie sanguine, parfois très importante. Notre patient avait une hyperéosinophilie modérée.
Le diagnostic est affirmé sur la biopsie cutanée avec mise en évidence d’une bulle sous-épidermique à toit respecté en coloration standard, et sur la présence d’anticorps de classe IgG fixés de façon linéaire sur la jonction dermo-épidermique révélés par une technique d’immunofluorescence directe.
L’association d’une pemphigoïde bulleuse et d’une maladie cancéreuse fait toujours l’objet de controverse ; il existe des rapports faisant état d’améliorations de lésions bulleuses par un traitement anti-tumoral, ce qui pourrait évoquer une relation causale [6].
Dans notre observation, la régression de la dermatose au début de chimiothérapie plaide en faveur du caractère paranéoplasique.
Dans le contexte d’une altération de l’état général, la recherche d’une tumeur solide est légitime car l’association avec une pemphigoïde bulleuse n’est pas fortuite, notamment dans les carcinomes pulmonaires et hématologiques [7].
CONCLUSION
La pemphigoïde bulleuse paranéoplasique est rare, mais très évocatrice d’une tumeur profonde qu’il faudra rechercher de principe, Son traitement repose essentiellement sur celui de la néoplasie sous jacente.
CONFLITS D’INTÉRÊTS
Aucun.
REFERENCES
1. Lomholt H, Thestrup-Pedersen K. Paraneoplastic skin mani-festations of lung cancer. Acta Derm Venereol 2000; 80: 200-2.
2. Kurzsock R, Cohen PR. Cutaneous paraneoplastic syndromes insolid tumors. Am J Med 1995; 99: 662-71.
3. Hall TC. Paraneoplastic syndromes: mechanisms. Semin Oncol 1997; 24: 269-76.
4. Bernard P, Vaillant L, Labeille B, Bedane C, Arbeille B, Denoeux JP, et al. Incidence and distribution of subepidermal autoimmune bullous skin diseases in three French regions. Arch Dermatol 1995; 131: 48-52.
5. Doffoel-Hantz V, Cogné M, Drouet M, Sparsa A, Bonnetblanc JM, Bédane C. Physiopathologie de la pemphigoïde bulleuse: Annales de dermatologie et de vénéréologie 2009; 136: 740-747.
6. Andriamanantena D, Boye T, Gervaise A, et al. Une manifestation paranéoplasique inhabituelledans le cancer bronchique: l’érythrodermie hyperéosinophilique. Rev Pneumol Clin 2009; 65: 32-5.
7. Vaillant L, Bernard P, Joly P, Prost C, Labeille B, et al. Evaluation of clinical criteria for diagnosis of bullous pemphigoid. Arch Dermatol 1998; 134: 1075-80.
FIGURES
REFERENCES
1. Lomholt H, Thestrup-Pedersen K. Paraneoplastic skin mani-festations of lung cancer. Acta Derm Venereol 2000; 80: 200-2.
2. Kurzsock R, Cohen PR. Cutaneous paraneoplastic syndromes insolid tumors. Am J Med 1995; 99: 662-71.
3. Hall TC. Paraneoplastic syndromes: mechanisms. Semin Oncol 1997; 24: 269-76.
4. Bernard P, Vaillant L, Labeille B, Bedane C, Arbeille B, Denoeux JP, et al. Incidence and distribution of subepidermal autoimmune bullous skin diseases in three French regions. Arch Dermatol 1995; 131: 48-52.
5. Doffoel-Hantz V, Cogné M, Drouet M, Sparsa A, Bonnetblanc JM, Bédane C. Physiopathologie de la pemphigoïde bulleuse: Annales de dermatologie et de vénéréologie 2009; 136: 740-747.
6. Andriamanantena D, Boye T, Gervaise A, et al. Une manifestation paranéoplasique inhabituelledans le cancer bronchique: l’érythrodermie hyperéosinophilique. Rev Pneumol Clin 2009; 65: 32-5.
7. Vaillant L, Bernard P, Joly P, Prost C, Labeille B, et al. Evaluation of clinical criteria for diagnosis of bullous pemphigoid. Arch Dermatol 1998; 134: 1075-80.
ARTICLE INFO
DOI: 10.12699/jfvp.5.15.2014.42
Conflict of Interest
Non
Date of manuscript receiving
14/02/2014
Date of publication after correction
17/8/2014
Article citation
Janah H, Souhi H,Zegmout A, Naji-Amrani H , Raoufi M, Elouazzani H, Rhorfi I.A, Abid A. Bullous pemphigoid revealing a bronchial carcinoma. J Func Vent Pulm 2014;05(15):42-45.