
 English
English
 French
French
Rôle des cytokines dans l’asthme
Role of cytokines in asthma
H. Le Thi Thu 1, A. Nguyen Thi Van 1, H. Thuc Thanh 1, T. Nguyen Thi Dieu 1,2, H. Le Thi Minh 1
1: Service d’Immuno-Allergologie et Rhumatologie
Hôpital Pédiatrique National. Ha Noi, Viet Nam
2: Département de Pédiatrie
Université de Médecine de Ha Noi, Viet Nam
Corresponding author
Dr. LE THI THU Huong
Service d’Immuno-Allergologie et Rhumatologie Hôpital Pédiatrique National. Ha Noi - Viet Nam
E-mail: lehuong199@yahoo.com
ABSTRACT
Asthma is a chronic disease of the respiratory airways whose physiopathology is complex and the etiology remains unknown. One of progresses of recent decades is the discovery of cytokines that play a major role in the maintenance and amplification of the inflammatory response in asthma.
There are several cytokines and chemokines that are involved in the pathophysiology of asthma. In asthmatic patients, the increase of Th2 cells is observed. In current classification, cytokines include: interferons (IFN), interleukins (IL), chemokines, tumor necrosis factor (TNF), colony stimulating factors (CSF), transforming growth factors (TGF). Cytokines bind to specific membrane receptors on their target cells ; they trigger signal transduction pathways that alter the gene expression of their target cells. The sensitivity of a target cell to a particular cytokine is determined by the presence of specific membrane receptors.
Determining the specific role of these cytokines in asthma helps to classify the biological phenotypes of asthma. They constitute, in the future, therapeutic targets by using specific anti-cytokines or inhibiting their receptors in severe asthma and steroid-resistant asthma.
KEYWORDS: Asthma, severe asthma, steroid-resistant, cytokine
RÉSUMÉ
L’asthme est une maladie chronique des voies aériennes respiratoires dont la physiopathologie est complexe et l’étiologie demeure mal connue. Un des progrès de ces dernières décennies est la découverte des cytokines qui jouent un rôle majeur dans le maintien et l’amplification de la réponse inflammatoire dans l’asthme.
Il existe plusieurs cytokines et chémokines qui sont impliquées dans la physiopathologie de l’asthme. Chez les patients asthmatiques, l’augmentation du nombre de cellules Th2 est observée. Selon la classification actuelle, les cytokines comprennent: les interférons (IFN), les interleukines (IL), les chémokines, les tumor necrosis factor (TNF), les colony stimulating factors (CSF ), les transforming growth factors (TGF). Les cytokines se lient à des récepteurs membranaires spécifiques de leurs cellules cibles ; elles déclenchent des voies de transduction du signal qui modifient l’expression des gènes de leurs cellules cibles. La sensibilité d’une cellule cible à une cytokine particulière est déterminée par la présence de récepteurs membranaires spécifiques.
La détermination du rôle spécifique de ces cytokines dans l’asthme aide à classifier les phénotypes biologiques de l’asthme. Elles constituent, dans l’avenir, des cibles thérapeutiques en utilisant des anti-cytokines spécifiques ou en inhibant leurs récepteurs dans l’asthme sévère et l’asthme résistant aux corticostéroïdes.
MOTS CLES: Asthme, asthme sévère, corticostéroïde résistante, cytokine
INTRODUCTION
Les cytokines sont des protéines solubles de faible poids moléculaire qui sont produites par de très nombreux types cellulaires en réponse aux allergènes. Elles ont une fonction de transmetteur pour moduler la réponse inflammatoire et immunitaire (innée et spécifique). De plus, elles permettent un dialogue entre cellules, pour la régulation des fonctions biologiques extrêmement variées telles que l’hématopoïèse, la prolifération, la différenciation, l’activation, la survie et la mort cellulaire.
Depuis ces dernières années, le rôle des cytokines dans l’asthme, en particulier dans la physiopathologie de l’asthme sévère a été mis en évidence dans les études de Desai, Levine et al. [1, 2]. Récemment, le rôle des cytokines produites par les cellules Th1 et Th2 dans l’asthme réfractaire a été démontré [3].
CLASSIFICATION DES CYTOKINES
Selon la classification actuelle, les cytokines comprennent: les interférons (IFN), les interleukines (IL), les chémokines, les tumor necrosis factor (TNF), les colony stimulating factors (CSF ), les transforming growth factors (TGF). Les interleukines sont produites par toutes les cellules de l’organisme et le préfixe IL- est utilisé pour toutes les différentes interleukines. Actuellement, 37 cytokines aux rôles divers ont été découvertes chez l’homme et numérotées de l’IL-1 à l’IL-37. On distingue 3 groupes d'interleukines: celles qui dérivent surtout des cellules présentatrices d'antigènes (CPA) (cellules dendritiques, macrophages...) ou des lymphocytes T qui ont une double fonction de générer une réponse immunitaire innée et d'envoyer des signaux contribuant à l'initiation et la polarisation de la réponse immune adaptative (TNF, IL-1, IL-6, IL-8, IL-12, IL-15, IL-18, IL-23, IL-27, IL-32) ; celles qui sont surtout des médiateurs de l'immunité cytotoxique (anti-virale, anti-cancéreuse), humorale, à médiation cellulaire (Th1 ; Th17) ou allergique (Th2) ; celles qui sont immunosuppressives (Treg).
On trouve aussi parmi cette famille, les molécules de type IFN et TNF. On les confond parfois avec les facteurs de croissance hématopoïétiques, car elles ont de nombreuses activités communes. Il reste les chimiokines qui ont un rôle dans le recrutement des effecteurs immunologiques. Mais il existe des molécules qui sont considérées comme des cytokines comme l’IL‐8 et qui sont chimiotactiques comme les chémokines. Dans la réponse immunitaire, les cytokines sont divisées en lymphokines (les cytokines qui sont produites par les cellules T et régulent la réponse immuni --taire), en cytokines pro-inflammatoires (les cytokines qui amplifient et entretiennent l’inflammation), et en cytokines anti-inflammatoires (les cytokines impliqués dans la régulation négative de la réponse inflammatoire).
PROPRIETES GENERALES DES CYTOKINES
Les cytokines sont synthétisées par une cellule activée et se lient à des récepteurs membranaires spécifiques. Quelque soit leur origine, les cytokines ont trois caractéristiques communes:
Redondance: un même effet peut être obtenu par différentes cytokines se fixant chacune sur leur récepteur spécifique.
Pléiotropie: une même cytokine peut avoir plusieurs effets. Multi-orientations: une seule cytokine peut activer plusieurs cellules.
Activité en cascade: la plupart des cytokines entrainent des réactions en cascade en induisant la production d’une autre cytokine par les cellules cibles.
Il existe quelques propriétés communes aux cytokines: faible poids moléculaire (10 – 25 kD), peu d’homologie de séquence entre elles (maximum 30% d’homologie), activation à de très faible concentration, et réaction synergique.
Les cytokines se lient à des récepteurs membranaires spécifiques de leurs cellules cibles ; elles déclenchent des voies de transduction du signal qui modifient l’expression des gènes de leurs cellules cibles. La sensibilité d’une cellule cible à une cytokine particulière est déterminée par la présence de récepteurs membranaires spécifiques. En général, les cytokines et leurs récepteurs présentent une très forte affinité l’un pour l’autre, avec des constantes de dissociation allant de 10-10 à 10-12 M. Ce sont des molécules qui agissent localement: elles ont une action qui pourrait ressembler à celle d’un médiateur, c'est-à-dire qu’elles agissent soit de façon autocrine (une cellule secrète une cytokine qui agit sur la même cellule), soit paracrine (sur une autre cellule mais à une très faible distance). Beaucoup plus rarement, elles peuvent avoir une action endocrine (qui emploie la circulation générale) comme l’IL-6 et le TNF par exemple.
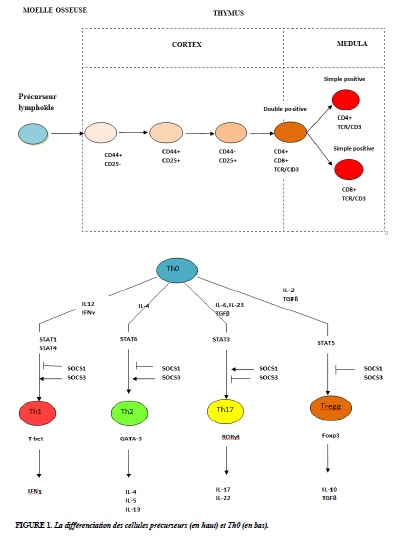
Les cellules précurseurs se différencient et deviennent les cellules T pré-lymphopoïétiques, puis elles se différencient encore en 4 stades consécutifs en double négativité (pas de marqueurs CD4, CD8), puis en double positivité (avec les marqueurs CD4, CD8), et finalement en simple positivité (portant seulement le marqueur CD4 ou CD8) pour devenir un lymphocyte T CD4 (T helper) ou CD8 (T cytotoxique) (Figure 1).
Les cellules CD4 (Th0) sont différenciées en Th1 ou Th2 selon les différents facteurs. L’IL-12 (produit par les macrophages) et l’IFN-γ (produit par les cellules NK) provoquent la transformation des Th0 en Th1, et les Th1 peuvent produire IL-2, TNF-α, IFNγ, CD40, TGF-β, qui augmentent la réponse inflammatoire cellulaire (infection). Les protéines antigéniques capturées par les CPA sont présentées aux CD4 grâce à l’IL-4 qui permet la différenciation Th0 en Th2. Le Th2 sécrète l’IL-4, l’IL-13, l’IL-9, l’IL -5, qui favorisent la réponse inflammatoire (allergie). Le Th0 peut également se différencier en Th17 et Treg (T régulateur). Le Treg module l’effet des cellules Th et sécrète l’IL-10 qui inhibe le Th1.
LE RÔLE DES CYTOKINES DANS L’ASTHME
L’asthme est une maladie chronique des voies aériennes respiratoires dont la physiopathologie est complexe et l’étiologie demeure mal connue. Un des progrès de ces dernières décennies est la découverte des cytokines qui jouent un rôle majeur dans le maintien et l’amplification de la réponse inflammatoire dans l’asthme. Il existe plusieurs cytokines et chémokines qui sont impliquées dans la physiopathologie de l’asthme. Les cytokines comme l’IL-1, le TNF-α, l’IL-6 sont liées à plusieurs maladies inflammatoires. D’autres cytokines comme l’IL-4, IL-5, IL-9 et IL-13 sont sécrétées par les cellules Th2, cependant elles peuvent être produites par d’autres cellules. La réponse Th2 induit la sécrétion des cytokines IL-4, IL-5, IL-9 et IL-13. Chez les patients asthmatiques, l’augmentation du nombre de cellules Th2 est observée.
Interleukine-4 (IL-4)
L’IL-4 a un rôle majeur dans la différenciation des Th0 en Th2. Il peut être implqué dans la sensibilisation aux allergènes. Son rôle est nécessaire dans la transformation des cellules B qui produisent des IgG en celles qui produisent des IgE.
Chez les patients asthmatiques sévères, le nombre de cellules qui ont été colorées positivement à l’IL-4 est plus élevé que celui chez les sujets de contrôle. En particulier, il est très élevé chez les patients asthmatiques sévères et réfractaires. Ainsi, le traitement par corticostéroïdes ne diminue l’expression de l’IL-4 que chez les patients asthmatiques sévères répondant aux corticostéroïdes [4].
Interleukine-5
L’IL-5 joue un rôle dans l’inflammation indirecte induite par les éosinophiles, lié principalement à la différenciation des cellules précurseurs de la moelle osseuse ainsi qu’à la prolongation de la survie des éosinophiles.
L’utilisation de l’IL-5 par voie locale ou générale chez les patients asthmatiques résulte d’une augmentation des éosinophiles et pro-éosinophiles CD34 dans le sang périphérique. Dans une étude expérimentale sur des animaux, la suppression des anticorps spécifiques de l’IL-5 ont diminué le nombre des éosinophiles et inhibé la réponse immunologique aux allergènes. Chez les patients asthmatiques, les anticorps inhibiteurs spécifiques de l’IL-5 (mepolizumab) peuvent réduire significativement le nombre des éosinophiles dans le sang et les crachats mais n’ont pas d’efficacité dans la réponse immunoallergique ou l’hyperréactivité bronchique.
Chez les patients asthmatiques réfractaires, la concentration d’IL-5 dans les crachats peut être réduite sous corticostéroïdes par voie générale (prednisone) [5]. De plus, il existe une corrélation significative entre la concentration d’IL-5 dans les crachats et la fréquence annuelle des exacerbations chez ces patients. Ainsi, l’IL-5 est considérée comme un biomarqueur dans la prédiction des exacerbations chez les patients asthmatiques.
Interleukine-9
Chez les souris, l’IL-9 provoque l’inflammation indirecte par l’intermédiaire des éosinophiles, l’hypersécrétion muqueuse, l’hyperréactivité des voies aériennes, et l’augmentation des autres manifestations des cytokines Th2 et IgE. La suppression de l’IL-9 peut inhiber les éosinophiles localisés dans le poumon, la sécrétion muqueuse, et l’hyperréactivité des voies aériennes chez les souris ayant une sensibilisation allergénique. Chez les souris, certains effets de l’IL-9 (l’inflammation induite par les éosinophiles et l’hypersécrétion muqueuse) sont médiés indirectement par la sécrétion d’IL-13. Cependant, l’effet de l’IL-9 sur les mastocytes et les lymphocytes B est direct [6]. L’IL-9 a un rôle important dans la différenciation et la prolifération des mastocytes ainsi que dans l’interaction synergique avec la SCF.
Interleukine-12
L’IL-12 a un rôle important dans la différentiation et l’activation des Th1, des macrophages, des cellules dendritiques, et des cellules épithéliales des voies aériennes. L’IL-12 stimule les cellules T qui libèrent l’IFN-γ qui régule l’activation de l’IL-12Rβ2 et maintient la différenciation des cellules Th1. Contrairement à l’IL-12, l’IL-4 inhibe l’activité de l’IL-12Rβ2 et donc empêche la différentiation des Th1.
Chez les patients asthmatiques, l’IL-12 est libérée par les cellules hématologiques à une faible concentration. Chez les patients asthmatiques légers, l’IL-12 diminue le nombre des éosinophiles dans la circulation sanguine mais ne diminue pas la réponse allergique ou l’hyperréactivité bronchique [7].
Interleukine-13
Comme l’IL-4, l’IL-13 peut stimuler la transformation des mastocytes en produisant les IgE et en modifiant la structure des voies aériennes sans avoir de rôle dans la différenciation des Th2. Le rôle de l’IL-13, en particulier dans l’asthme sévère a été confirmé. Sur les prélèvements biopsiques bronchiques des patients asthmatiques sévères, Naseer et al. [8] ont noté qu’il existe un grand nombre de cellules inflammatoires avec une augmentation de l’expression des ARNm codant l’IL -13. Cette hyper-expression a été réduite sous corticostéroïdes chez les patients répondeurs. Récemment, l’augmentation de l’expression protéique de l’IL-13 a également été retrouvée chez les patients asthmatiques réfractaires.
Interleukine 16 (IL-16)
L’IL-6 est présente dans le lavage broncho-alvéolaire chez les sujets ayant bénéficié du test de provocation bronchique à l’histamine et aux allergènes. Dans l’asthme, l’IL-16 a pour effet la diminution de l’hyperréactivité bronchique des patients en associant avec le CD4 sur la région de stimulation des lymphocytes T en réponse à la réaction dépendante à l’inflammation.
Interleukine-17 (IL-17)
L’IL-17 est produite par les cellules T helper (Th)-17, sous-groupe des cellules T qui produisent l’IL-23. L’IL-23 est produite par les cellules dendritiques et les macrophages en réponse à la stimulation due aux bactéries via les Toll Like Recepteurs. C'est un promoteur de la production d'IL-17. L’IL-17 comprend plusieurs membres, appelés IL-17A, B, C, D, E, F.
L’IL-17 a un rôle important dans les maladies inflammatoires. Elle est régulée par le facteur de transformation ROR-gt (retinoic acid orphan receptor-gt). Les autres interleukines telles que l’IL6, l’IL-1b, le TGF-b, et l’IL-23 sont impliquées dans la différenciation de Th17 chez l’homme. Le rôle de l’IL -17 dans l’asthme est encore peu connu. L’expression de l’IL-17 est augmentée dans les crachats et la muqueuse bronchique des patients asthmatiques. L’IL-17A et l’IL-17F sont impliquées dans l’inflammation médiée par les neutrophiles grâce à la libération des chémokines comme CXCL1, CXCL6 et CXCL8. Ces dernières sont exprimées dans l’épithélium bronchique et dans les cellules musculaires lisses des voies aériennes et jouent un rôle dans l’inflammation liée aux neutrophiles chez les patients asthmatiques sévères.
Bullens et al. [9] ont montré qu’il y a une augmentation de l’expression des ARNm codant l’IL-17A dans les cellules isolées de crachats des patients asthmatiques modérés et sévères. De plus, chez ces patients, l’expression protéique de l’IL-17 sur les biopsies bronchiques était plus élevée que celle chez les patients asthmatiques légers et les sujets sains.
Interleukine 33 (IL-33)
Les résultats des études récentes ont montré que l’expression de l’IL-33 était augmentée sur les prélèvements biopsiques bronchiques des patients asthmatiques par rapport aux sujets sains. En particulier, l’augmentation de l’expression de l’IL-13 était plus importante chez les patients asthmatiques sévères. De plus, l’augmentation de l’expression de l’IL-33 était également retrouvée dans les cellules musculaires lisses chez les patients ayant un asthme modéré et sévère.
Interférons (IFN)
Les IFN sont produits par les lymphocytes CD4+ et CD8+ sous l’effet de l’IL-12, l’IL-18, et des endotoxines. La production des IFN est inhibée par l’IL-10. Les IFN, représentant des cytokines Th1, sont des cytokines pro-inflammatoires qui stimulent les leucocytes et les cellules endothéliales qui produisent les molécules adhérentes, l’IL-1, l’ IL-12 et les TNFa. On distingue plusieurs groupes d’IFN: les IFN de type I comprenant l’IFN-α et l’IFN-β, les IFN de type II représentés principalement par l’IFNγ, les IFN de type III comprenant essentiellement l’IFN-λ.
L’IFN de type I (IFN-α et β) et l’IFN de type III (IFNl) jouent un rôle important dans l’immunité innée pour lutter contre les virus. L’expression de l’IFN-β et l’IFN-l était diminuée dans les cellules épithéliales des voies aériennes chez les patients asthmatiques et corrélée à la transcription des rhinovirus. Cette diminution était retrouvée principalement dans l’asthme ayant pour facteur déclenchant un virus. La diminution de l’expression de l’IFN-α est aussi un marqueur biologique de l’asthme réfractaire à la corticothérapie. Cependant, le mécanisme de ce phénomène n’a pas encore été élucidé.
TNF-α
Le TNF-α est produit par plusieurs types de cellules, y compris les macrophages, les mastocytes, les lymphocytes T, les cellules épithéliales, et les cellules musculaires lisses des voies aériennes. Chez les sujets sains, l’inhalation du TNF-α déclenche l’hyperréactivité bronchique et l’inflammation des voies aériennes induite par l’augmentation des neutrophiles.
Le TNF-α réagit directement sur les cellules musculaires lisses et provoque la contraction des voies aériennes, ce qui explique son rôle dans l’hyperréactivité bronchique chez les sujets asthmatiques. Le TNF- est présent dans les différentes cellules des voies aériennes, en particulier dans les mastocytes et a un rôle primordial dans l’amplification de la cascade inflammatoire par l’activation de la NF-kB. La suppression du TNF- par l’Etanercept diminuait l’hyperréactivité bronchique et améliorait la fonction respiratoire dans quelques études sur de petits groupes de patients asthmatiques réfractaires aux traitements. De plus, la suppression du TNF- par l’Infliximab peut diminuer la crise d’asthme chez les patients ayant un asthme léger.
TGF-β1
Des études récentes ont montré que le niveau d’expression de l’ARNm de TGF-β1 était augmenté sur les prélèvements biopsiques bronchiques des patients asthmatiques modérés et sévères. En particulier, chez ces patients, la corticothérapie par voie orale n’a pas diminué l’expression de TGF-β1. L’hyper expression du TGF-β1 pourrait ainsi être considérée comme un marqueur de la résistance à la corticothérapie. En particulier, chez ces patients, la corticothérapie par voie orale n’a pas diminué l’expression de TGF-β1. L’hyper expression du TGF-β1 pourrait ainsi être considérée comme un marqueur de la résistance à la corticothérapie. De plus, l’augmentation de l’expression de TGF-β1 était également retrouvée dans les crachats et dans le liquide de lavage broncho-alvéolaire chez les patients asthmatiques. Abdulamir et al. [10] ont confirmé qu’il existait une corrélation entre le degré d’expression de NF-kB dans les lymphocytes dans le liquide de lavage broncho-alvéolaire, et l’expression de TGF-β1extracellulaire chez les patients asthmatiques sévères par rapport aux patients asthmatiques légers et aux sujets sains. Actuellement, le TGF-β1 avec ses variantes génétiques sont considérés comme un des facteurs favorisant l’asthme sévère par le mécanisme de modification structurale des voies aériennes (remodelage).
Rôle des cytokines dans la prise en charge des patients asthmatiques
Considéré comme le modèle le plus remarquable dans la physiopathologie de l’asthme allergique des années 1980, le lymphocyte CD4 de type 2 (Th2) joue un rôle primordial. Ce rôle était basé sur les observations confirmant la présence des sous-groupes Th2 dans l’asthme. Il a été largement étudié pendant plus de 30 ans. Actuellement, dans sa physiopathologie, l’asthme est défini comme une maladie très variable et hétérogène, impliquant les cellules Th1 et Th2 ainsi que les Th17 et T régulateurs dont le rôle a été récemment démontré. Comme les cytokines sont produites par les lymphocytes T, les cellules immunitaires innées et les cellules structurales, le traitement spécifique de l’asthme vise à inhiber ces cytokines. Ce traitement semble être efficace dans quelques sous-groupes de patients, mais parfois inefficace chez d’autres patients. Ainsi, il faut différencier les sous-groupes de patients selon la physiopathologie et l’atteinte des voies aériennes de l’asthme. De plus, la suppression de l’expression et de l’activité des cytokines est toujours recherchée pour le bénéfice thérapeutique des patients. Les cellules CD4 de type 2 (Th2) et leurs cytokines sont prédominantes dans l’asthme allergique léger et modéré. Tandis que dans l’asthme sévère réfractaire aux corticostéroïdes, le phénotype mixte Th2/Th1 etTh17 est prédominant. Les autres cellules immunitaires, en particulier les neutrophiles, les macrophages, les cellules dendritiques ainsi que les cellules épithéliales et les cellules musculaires lisses sont aussi impliquées dans la pathogenèse de l’asthme due à cytokines. L’asthme léger et modéré sont caractérisés par des poussées aigues sur une base d’inflammation chronique des voies aériennes, infiltrées par les lymphocytes T, les éosinophiles qui sont impliquées dans la production des IgE, dans l’hyperplasie et la dysplasie des cellules sécrétoires, le remodelage et l’hyperréactivité bronchique. Ces caractéristiques physiopathologiques expliquent les signes cliniques des patients asthmatiques se traduisant par l’obstruction bronchique, la toux, les sifflements et la dyspnée. En particulier, la production des cytokines IL-3, IL-4, IL5, IL-9, IL-13, GM-CSF, et TSLP par les lymphocytes Th2 contribue à la modification de la physiopathologie de l’asthme. Le mécanisme qui induit l’augmentation des Th2 dans les voies aériennes n’a pas encore été clarifié. Elle pourrait être liée à la diminution de la fonction modulatrice des lymphocytes Th1 (IFNγ) ou des cellules T régulatrices (IL-10).
Les caractéristiques pathologiques de l’asthme sévère sont différentes de celle de l’asthme léger ou modéré car elles sont marquées par le phénotype mixte des Th1/Th2 impliquant par le rôle des Th17. L’augmentation de TNFα, IFNγ, IL-17 et IL-27 peut induire l’augmentation des neutrophiles (plutôt que des éosinophiles) ou des granulocytes mixtes infiltrant les voies aériennes. De plus, les patients ayant ce phénotype sont souvent réfractaires au traitement par corticostéroïdes. Sur le plan clinique, la crise d’asthme survient lors d’une obstruction bronchique importante, se manifestant par une toux, dyspnée et des sifflements. Les crises d’asthme sévère avec une hyperéosinophilie sont plus fréquentes que celles avec une hyperneutrophilie. Elles sont aggravées par l’implication des différentes cytokines telles que le TNFa, l’IL-8, le GM-CSF conduisant aux crises d’asthme sévères et réfractaires. Parmi ces cytokines, le TNFa joue un rôle prépondérant. Cependant, les crises d’asthme induites par l’infection pourraient être liées à la diminution de l’IFN de type 1.
Le traitement associant les corticostéroïdes et les b mimétiques de longue durée d’action est le traitement clé dans l’asthme. Il est efficace dans l’inhibition de l’expression des cytokines et des signes inflammatoires aigus. Cependant cette thérapie ne peut pas prévenir et traiter les étiologies de l’asthme. Ainsi, il est nécessaire de trouver de nouveaux traitements plus efficaces ciblant les cytokines. Cette approche thérapeutique deviendra un traitement potentiel des patients asthmatiques.
Applications dans le traitement
Malgré des essais dans l’inhibition des cytokines dans l’asthme par les anticorps, les résultats sont encore limités par la multiplicité des cytokines impliquées dans la pathogénèse de l’asthme et leur interaction. L’inhibition des cytokines a pour but de réduire la cascade inflammatoire dans l’asthme. Cela peut inhiber également plusieurs autres cytokines. Dans l’asthme léger, l’inhalation d’antisens oligonucleotides associés à CCR3 bloquant et la chaîne b de GM-CSF, IL-3, IL-5 peut diminuer l’expression génique de ces cytokines dans les cellules des voies aériennes après contact avec un allergène. Elle diminue significativement le nombre des éosinophiles dans les expectorations à la phrase précoce de la réaction inflammatoire. L’efficacité du traitement est encore plus significative si elle inhibe aussi les cytokines et leurs récepteurs spécifiques plutôt que de diminuer seulement la production des cytokines.
Corticostéroïdes
Jusqu’à présent, l’efficacité de la corticothérapie a été confirmée dans la prise en charge de l’asthme. Les corticostéroïdes inhibent la transcription des gènes codant pour les cytokines inflammatoires. Cependant, elles ne sont pas efficaces dans l’asthme résistant.
Anti-cytokines
L’anti IL-4/IL-4-Rα (pascolizumad) et l’anti IL-5 (mepolizumad) sont en cours d’évaluation dans les essais cliniques. L’efficacité du brodalumab, anticorps monoclonal anti-récepteur IL-17, chez les patients asthmatiques a été démontrée. Il est efficace dans l’asthme réversible aux bronchodilatateurs. Cependant, son efficacité n’a pas été démontrée dans l'asthme modéré à sévère traité par corticoïdes inhalées. Les anti- IL-9, IL-13, IL-17, IL-25, IL-33 et les anti- TSLP et GM-CSF seront de nouvelles cibles thérapeutiques dans l’avenir.
CONCLUSION
Les cytokines sont impliquées dans la physiopathologie de l’asthme, en particulier chez les asthmatiques sévères. Plusieurs cytokines ont des rôles différents et interagissent entre elles. La détermination du rôle spécifique de ces cytokines dans l’asthme aide à classifier les phénotypes biologiques de l’asthme. Elles constituent, dans l’avenir, des cibles thérapeutiques en utilisant des anti-cytokines spécifiques ou en inhibant leurs récepteurs dans l’asthme sévère et l’asthme résistant aux corticostéroïdes. Des essais cliniques utilisant des anticorps monoclonaux sélectifs des cytokines et leurs récepteurs sont en cours.
Remerciements
Les auteurs remercient la Fondation Nationale du Développement Scientifique et Technologique pour sa subvention dans la réalisation de ce travail (NAFOCTED - N° 5629).
CONFLIT D’INTERÊT
Aucun.
REFERENCES
1. Desai D, Brightling C. Cytokine and anti-cytokine therapy in asthma: ready for the clinic? Clin Exp Immunol 2009; 158(1): 10-9.
2. Levine SJ, Wenzel SE. Narrative review: the role of Th2 immune pathway modulation in the treatment of severe asthma and its phenotypes. Ann Intern Med 2010; 152(4): 232-7.
3. Shannon J, Ernst P, Yamauchi Y, et al. Differences in airway cytokine profile in severe asthma compared to moderate asthma. Chest 2008;1 33(2): 420-6.
4. Leung DY, Martin RJ, Szefler SJ, Sher ER, Ying S, Kay AB, Hamid Q. Dysregulation of interleukin 4, interleukin 5, and interferon gamma gene expression in steroid-resistant asthma. J Exp Med 1995; 181(1): 33-40.
5. Dente FL, Bacci E, Bartoli ML, et al. Effects of oral prednisone on sputum eosinophils and cytokines in patients with severe refractory asthma. Ann Allergy Asthma Immunol 2010; 104(6): 464-70.
6. Zhou Y, McLane M, Levitt RC. Th2 cytokines and asthma. Interleukin-9 as a therapeutic target for asthma. Respir Res 2001; 2(2): 80-4.
7. Trinchieri G, Pflanz S, Kastelein RA.The IL-12 family of heterodimeric cytokines: new players in the regulation of T cell responses. Immunity 2003; 19(5): 641-4.
8. Naseer T, Minshall EM, Leung DY, Laberge S, Ernst P, Martin RJ, Hamid Q. Expression of IL-12 and IL-13 mRNA in asthma and their modulation in response to steroid therapy. Am J Respir Crit Care Med 1997; 155(3): 845-51.
9. Bullens DM, Truyen E, Coteur L, et al. IL-17 mRNA in sputum of asthmatic patients: linking T cell driven inflammation and granulocytic influx? Respir Res 2006; 7: 135.
10. Abdulamir AS, Hafidh RR, Abubakar F. Different inflammatory mechanisms in lungs of severe and mild asthma: crosstalk of NF-kappa-B, TGFbeta1, Bax, Bcl-2, IL-4 and IgE. Scand J Clin Lab Invest 2009; 69(4): 487-95.
FIGURE
REFERENCES
1. Desai D, Brightling C. Cytokine and anti-cytokine therapy in asthma: ready for the clinic? Clin Exp Immunol 2009; 158(1): 10-9.
2. Levine SJ, Wenzel SE. Narrative review: the role of Th2 immune pathway modulation in the treatment of severe asthma and its phenotypes. Ann Intern Med 2010; 152(4): 232-7.
3. Shannon J, Ernst P, Yamauchi Y, et al. Differences in airway cytokine profile in severe asthma compared to moderate asthma. Chest 2008;1 33(2): 420-6.
4. Leung DY, Martin RJ, Szefler SJ, Sher ER, Ying S, Kay AB, Hamid Q. Dysregulation of interleukin 4, interleukin 5, and interferon gamma gene expression in steroid-resistant asthma. J Exp Med 1995; 181(1): 33-40.
5. Dente FL, Bacci E, Bartoli ML, et al. Effects of oral prednisone on sputum eosinophils and cytokines in patients with severe refractory asthma. Ann Allergy Asthma Immunol 2010; 104(6): 464-70.
6. Zhou Y, McLane M, Levitt RC. Th2 cytokines and asthma. Interleukin-9 as a therapeutic target for asthma. Respir Res 2001; 2(2): 80-4.
7. Trinchieri G, Pflanz S, Kastelein RA.The IL-12 family of heterodimeric cytokines: new players in the regulation of T cell responses. Immunity 2003; 19(5): 641-4.
8. Naseer T, Minshall EM, Leung DY, Laberge S, Ernst P, Martin RJ, Hamid Q. Expression of IL-12 and IL-13 mRNA in asthma and their modulation in response to steroid therapy. Am J Respir Crit Care Med 1997; 155(3): 845-51.
9. Bullens DM, Truyen E, Coteur L, et al. IL-17 mRNA in sputum of asthmatic patients: linking T cell driven inflammation and granulocytic influx? Respir Res 2006; 7: 135.
10. Abdulamir AS, Hafidh RR, Abubakar F. Different inflammatory mechanisms in lungs of severe and mild asthma: crosstalk of NF-kappa-B, TGFbeta1, Bax, Bcl-2, IL-4 and IgE. Scand J Clin Lab Invest 2009; 69(4): 487-95.
ARTICLE INFO
DOI: 10.12699/jfvp.5.14.2014.25
Conflict of Interest
Non
Date of manuscript receiving
12/11/2013
Date of publication after correction
15/4/2014
Article citation
Le Thi Thu H, Nguyen Thi Van A, Thuc Thanh H, Nguyen Thi Dieu T , Le Thi Minh H. Role of cytokines in asthma. J Func Vent Pulm 2014;05(14):25-32.