
 English
English
 French
French
Aspects chirurgicaux des complications des tuberculoses pulmonaire et pleurale de l’enfant
Surgical aspects of pulmonary and pleural tuberculosis in children
F. Randrianambinina1, H. Randrianambinina2, N.N. Razafimanjato Narindra1, J.C. Rakotoarisoa Andriamihaja 1, J.L. Rakotovao Hanitrala1
1: Service de Chirurgie Thoracique du Centre Hospitalier Universitaire Joseph Ravoahangy Andrianavalona (CHUJRA) Antananarivo Madagascar. BP 4150
2: Service de Réanimation Chirurgicale du Centre Hospitalier Universitaire Joseph Ravoahangy Andrianavalona (CHU -JRA) Antananarivo Madagascar. BP 4150
Corresponding author
Dr. Fanomezantsoa RANDRIANAMBININA
Service de Chirurgie Thoracique du Centre Hospitalier Universitaire Joseph Ravoahangy Andrianavalona (CHU-JRA) Antananarivo Madagascar
E-mail: fanomez_r@yahoo.fr
ABSTRACT
Introduction. Tuberculosis (TB) in childhood remains a major problem for public health. The aim of our study was to describe surgical complications of children with pulmonary and pleural tuberculosis to determine the factors favoring these complications.
Method. This is a retrospective and descriptive study realized in the Department of Thoracic Surgery at the University Hospital-JRA Antananarivo Madagascar during a period of five years from January 1st 2009 to December 31 2013.
Results. We collected 47 children with complications of pulmonary and pleural tuberculosis among which 31 boys (65.94%) and 16 girls (34.06%). The median age is 6 years with extremes of 2 and 15 years. The clinical and radiological manifestations are dominated by purulent pleuritis in 59.57% of cases. The diagnosis of tuberculosis is given by the pediatric score in 44.68% of cases. The chest tube is made of 93.62% and 34.04% of children have benefited from pleuropulmonary decortication.
Conclusion. The low socioeconomic level, non-specific clinic, the difficulty of diagnostic confirmation are the factors that favor the appearance of complications of pulmonary tuberculosis and pleural or in children, requiring surgery.
KEYWORDS: Tobacco smoking, prevalence, knowledge, attitude, pupils, Togo
RÉSUMÉ
Introduction. La tuberculose chez l’enfant demeure un problème majeur de santé publique. Le but de notre étude est de décrire les complications chirurgicales des tuberculoses pulmonaire et pleurale de l’enfant afin de déterminer les facteurs favorisant ces complications.
Méthode. Il s’agit d’une étude rétrospective descriptive réalisée dans le Service de Chirurgie Thoracique au CHU-JRA Antananarivo Madagascar sur une période de cinq ans allant du 1er Janvier 2009 au 31 Décembre 2013.
Résultats. Nous avons colligé 47 enfants présentant des complications de la tuberculose pulmonaire et ou pleurale dont 31 garçons (65,94%) et 16 filles (34,06%). L’âge médian est de 6 ans avec des extrêmes de 2 ans et 15 ans. Les manifestations clinico-radiologiques sont dominées par les pleurésies purulentes dans 59,57% des cas. Le diagnostic de la tuberculose est donné par le score pédiatrique dans 44,68% des cas. Le drainage thoracique est réalisé dans 93,62% des cas et 34,04% des enfants ont bénéficié d’une décortication pleuropulmonaire.
Conclusion. Le bas niveau socio-économique, la clinique non spécifique, la difficulté de la confirmation diagnostique constituent les facteurs qui favorisent l’apparition des complications de la tuberculose pulmonaire et ou pleurale chez l’enfant, nécessitant la chirurgie.
MOTS CLES: Enfant, chirurgie, complications, pleurésies purulentes, tuberculose
INTRODUCTION
La tuberculose est une maladie contagieuse, endémo -épidémique, à transmission essentiellement interhumaine due au complexe Mycobacterium tuberculosis [1]. Elle reste un grand problème de santé dans le monde entier et les pays en voie de développement portent le plus lourd fardeau de cette épidémie parce qu’ils totalisent 95% des cas mondiaux [2]. Sa forme pédiatrique est rare, mais elle demeure un problème majeur de santé publique puisqu’elle constitue le reflet direct de l’importance de l’endémie tuberculeuse et un indicateur de l’efficacité de la lutte antituberculeuse dans un pays [3].
Cependant, le diagnostic de la tuberculose de l’enfant est difficile et repose le plus souvent sur des arguments présomptifs [4], pouvant être à l’origine d’un retard diagnostique et thérapeutique. Ce retard explique la gravité de la maladie au moment du diagnostic où la poly chimiothérapie n’est plus suffisante pour le traitement faisant ainsi recours aux moyens chirurgicaux.
L’objectif de notre étude est ainsi de décrire les complications chirurgicales des tuberculoses pulmonaire et pleurale de l’enfant dans le Service de Chirurgie Thoracique au Centre Hospitalier Universitaire Joseph Ravoahangy Andrianavalona (CHU-JRA) Antananarivo Madagascar afin de déterminer les facteurs favorisant ces complications.
MATÉRIELS ET MÉTHODE
Il s’agit d’une étude rétrospective et descriptive réalisée dans le service de Chirurgie Thoracique au CHU-JRA Antananarivo sur une période de cinq ans, allant du 1er Janvier 2009 au 31 Décembre 2013.
Nous avons colligé 47 enfants pendant notre période d’étude, obtenus par dépouillement des dossiers médicaux. Nous avons inclus tous les patients âgés de 15 ans et moins, présentant une complication d’ordre chirurgicale de la tuberculose pulmonaire et ou pleurale, diagnostiquée bactériologiquement ou par le score pédiatrique établi par l’OMS, ayant un dossier médical complet, c’est-à-dire, comportant au moins une radiographie pulmonaire et un examen de recherche des bacilles tuberculeux, et ayant été suivis régulièrement à la consultation de contrôle dans les premiers mois post-opératoires.
Ne sont pas inclus dans notre étude, les patients dont leurs dossiers médicaux sont incomplets, tous les patients présentant une miliaire tuberculeuse qui est une complication de la tuberculose pulmonaire mais dont le traitement est seulement médical et ceux qui sont perdus de vue. Nous avons observé de nombreux paramètres tels que: la prévalence, l’âge et le sexe, les antécédents personnels et familiaux constitués par la vaccination, la notion de contage tuberculeux et les niveaux socio-économiques des parents qui sont définis par leur niveau de scolarisation, la valeur de leurs revenus mensuels et leurs logements; les types de complications, les examens para cliniques, les traitements chirurgicaux préconisés et l’évolution dans les premiers mois post-opératoires. La limite de notre travail est représentée par la taille de l’échantillon insuffisante.
RÉSULTATS
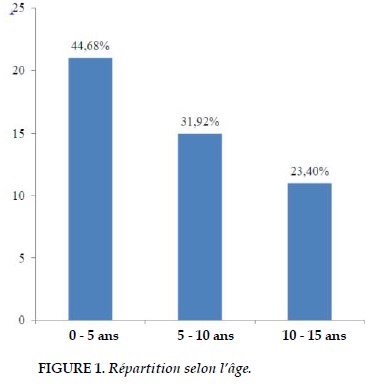
Pendant cette période de cinq ans, 2 278 patients sont hospitalisés dans le service de Chirurgie Thoracique dont 281 sont des enfants âgés de 15 ans et moins. Parmi ces enfants, 47 patients présentent une tuberculose pulmonaire ou pleurale compliquée, qui représentent ainsi 16,73% des enfants hospitalisés dans ce service. Nous avons colligé 31 garçons qui représentent 65,94% des cas et 16 filles constituant 34,04% des cas. Le sexe ratio est de 1,94. L’âge médian est de 6 ans et les âges extrêmes sont de 2 ans et 15 ans. Nous avons un pic de fréquence dans la tranche d’âge de 0 à 5 ans (Figure 1).
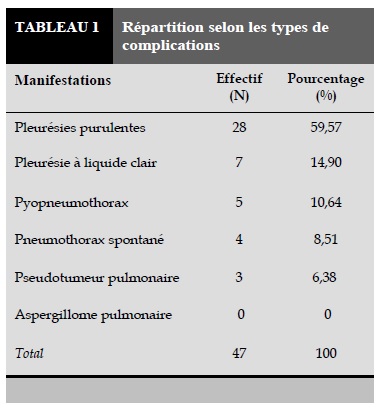
Presque tous les enfants c’est-à-dire les 91,49% des cas ont reçu une vaccination BCG et seulement 08,51% des enfants ne sont pas vaccinés. Concernant l’existence d’un contage tuberculeux, 61,70% des cas ont eu un contact avec une personne tuberculeuse dans la famille ou dans le voisinage tandis que 38,30% des enfants n’ont pas eu cette notion de contage dans l’interrogatoire. Le niveau socioéconomique des parents est bas dans 70,21% des cas, moyen dans 17,02% des cas et haut dans 12,77% des cas. Parmi nos 47 patients, 11 enfants (23,40% des cas) sont des tuberculeux connus et déjà mis sous traitement antituberculeux avant leur hospitalisation dans notre service de Chirurgie Thoracique et 36 enfants (76,60% des cas) sont révélés tuberculeux lors des explorations effectuées durant leur séjour dans le Service de Chirurgie Thoracique. Les manifestations cliniques sont dominées par des signes de pleurésies purulentes dans 59,57% des cas (Tableau 1).
Tous les patients ont bénéficié d’une radiographie pulmonaire et seulement 6 patients (12,77%) ont eu un scanner thoracique, qui sont les deux enfants présentant une pseudotumeur et 4 enfants ayant un pneumothorax. Les images radiologiques retrouvées sont des images d’épanchements pleuraux liquidiens ou gazeux, associées des images de polyadénopathie médiastinale dans 17,02% des cas et des cavernes tuberculeuses dans 6,38% des cas.
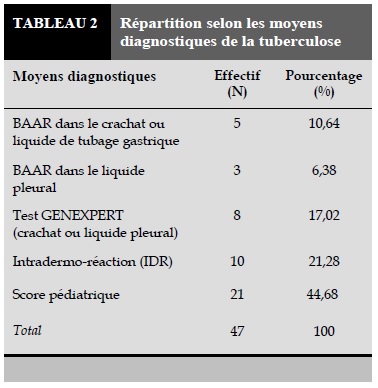
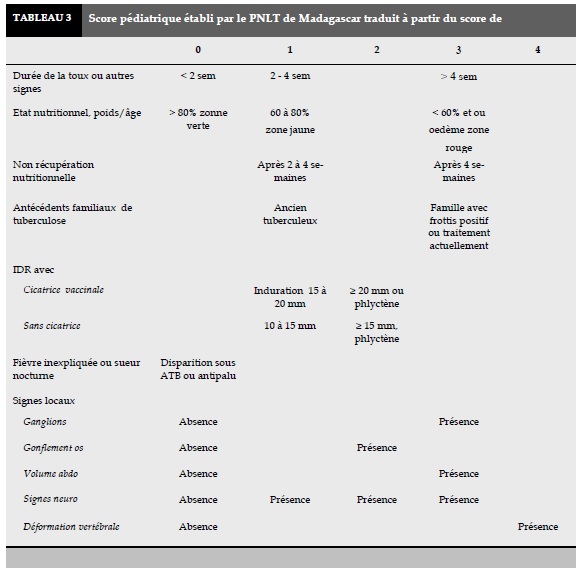
La confirmation diagnostique (Tableau 2) est donnée, dans la majorité des cas (44,68%), par le score pédiatrique établi par l’OMS appliqué dans notre Programme National de Lutte contre la Tuberculose (PNLT) (Tableau 3). Le test gene Xpert est réalisé chez 12 enfants et 8 tests (66,67% de tests effectués) sont revenus positifs.
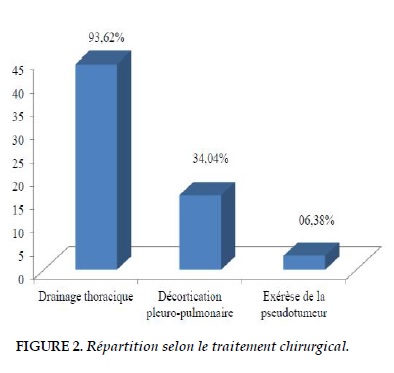
Le traitement est à la fois médical et chirurgical. Le traitement médical étant établi selon la recommandation dans notre PNLT, associé à des antibiothérapies adaptées pour les cas de surinfections bactériennes. Concernant les traitements chirurgicaux, tous les épanchements pleuraux sont drainés dans le premier temps, puis si on n’obtient pas un bon résultat après deux semaines de drainage thoracique, une thoracotomie pour décortication pleuropulmonaire est indiquée (Figure 2).
Les suites opératoires sont simples dans 82,98% des cas. Cependant, nous avons rencontré des infections du site opératoire dans 12,77% des cas, un échec de drainage thoracique dans 34,04% des cas justifiant ainsi les mini-thoracotomies pour décortication pleuropulmonaire, et 2 décès (4,25%) suite à un choc septique.
DISCUSSION
La tuberculose de l’enfant est encore fréquente dans les zones d’endémie tuberculeuse surtout dans les pays Africains. Dans notre série, 16,14% des enfants hospitalisés dans notre service de Chirurgie Thoracique sont tuberculeux. Elle constituait 20,6% d’admission en 2000 au Congo et 13,7% des tuberculeux sont des enfants âgés de moins de 13 ans à Cape Town en Afrique du Sud [5,6]. À l’opposé, les pays développés ont une faible incidence. En France en 2004, il y avait 5 512 cas dont 452 cas sont des enfants moins de 15 ans et la localisation pulmonaire constitue 75% des cas [7]. Aux Etats-Unis, 6% des tuberculeux sont des enfants [8]. Mais de nombreux auteurs ont démontré qu’on observe actuellement une augmentation de la proportion de la tuberculose pédiatrique dans les pays développés due à l’élévation du taux d’immigration, à l’infection au VIH et à la prise de la drogue chez les adolescents [8]. Nous avons une prédominance masculine (65,94%) dans notre série ce qui correspond au résultat de la série de 465 enfants au Maroc où les garçons représentent 54,2% des cas [9]. Mais nombreux auteurs rapportent un sex ratio égal à 1 [3, 10]. Nous avons retrouvé un pic de fréquence dans la tranche d’âge de 0 à 5 ans. Il y a une forte proportion des enfants tuberculeux âgés de moins de 5 ans en chirurgie thoracique car les enfants de bas âge développent rapidement une tuberculose maladie et évolue facilement vers les complications [11]. Dans une étude faite à Maroc, 69,9% des enfants sont âgés de moins de 05 ans [9]. Dans une série de 214 enfants réalisés à Madagascar, 72% ont moins de 05 ans [12]. L’âge inférieur à 5 ans joue ainsi un rôle important dans l’apparition des complications de la tuberculose pulmonaire et ou pleurale [13].
Nous avons constaté que parmi les enfants présentant une tuberculose compliquée dans notre travail, 91,49% sont vaccinés contre la tuberculose. On retrouve cette même constatation dans une étude réalisée par l’Institut Pasteur de Madagascar; où, bien que 56% des enfants tuberculeux aient été vaccinés par le BCG, il n’y a pas eu sur le plan pronostic, de différence statistiquement significative entre les vaccinés et les non-vaccinés (χ2 calculé inférieur au χ2 seuil de 5%) [12]. La protection conférée par la vaccination BCG est ainsi dépassée dans les pays à forte prévalence de la tuberculose car les enfants sont en contact massif et répété avec les bacilles tuberculeux. Cette même hypothèse justifie également l’absence de notion de contage tuberculeux dans la famille ou dans l’entourage pour certains enfants alors qu’ils sont infectés.
Concernant le niveau socio-économique des parents, 70,21% ont un bas ou faible niveau. Notre résultat correspond aux données de la littérature car nombreuses d’entre elles rapportent cette fréquence élevée de la tuberculose chez l’enfant en milieu défavorisé [9,12]. Il est démontré que la malnutrition entraîne une diminution immunitaire par médiation cellulaire et favorise la survenue de la tuberculose [9]. Dans le milieu défavorisé, la malnutrition ne constitue pas le seul facteur de risque de la tuberculose, mais il y a également la promiscuité, la pollution, l’insalubrité dans le foyer, la négligence et l’ignorance des parents [14].
Le plus souvent, la tuberculose pulmonaire de l’enfant n’est vue qu’au stade de complications car les manifestations cliniques au début de la maladie ne sont pas spécifiques ou même, l’enfant reste longtemps asymptomatique entraînant ainsi un retard diagnostique [11]. Les manifestations de ces complications sont dominées par les épanchements pleuraux dans notre série dont, 59,57% des cas sont constitués par les pleurésies purulentes. Chez les enfants plus jeunes, l'épanchement fait partie des complications de la maladie pulmonaire [15]. La proportion de la tuberculose pulmonaire de l’enfant qui se complique par des pleurésies varie de 2 à 38% [16]. Mais l’épanchement peut être également dû à la localisation pleurale de la tuberculose qui tient la deuxième place de la forme extra-pulmonaire avec
une incidence de 4,9% et touche surtout les adolescents [17]. La surinfection par les germes banaux est possible. Sur 28 cas de pyothorax tuberculeux colligés par Hassine et al, 9 patients (32,14% des cas) avaient un pneumothorax associé. Cette association était en rapport avec une fistule broncho-pleurale [18].
Comme la clinique est difficile et non spécifique dans la tuberculose de l’enfant, il faut demander des examens para cliniques pour pouvoir confirmer le diagnostic. L’idéal, c’est d’avoir une confirmation bactériologique c’est-à-dire la mise en évidence du Mycobacterium tuberculosis. Cependant, cette preuve bactériologique est rare chez l’enfant [19].
On peut chercher les bacilles tuberculeux dans le crachat sur trois prélèvements pendant trois jours successifs, produit par expectoration spontanée ou par expectoration induite en utilisant un aérosol d’eau salée hypertonique (3%) pendant 10 mn [20]. Pourtant, cet examen n’est souvent pas possible chez l’enfant en raison de la faible charge bacillaire et de sa difficulté à expectorer et l’enfant est souvent non coopérant [13]. Même, pratiqué dans des meilleures conditions, l’examen microscopique de crachat a également une faible sensibilité inférieure à 15% dans le diagnostic de la tuberculose pulmonaire chez l’enfant [21]. Par contre l’aspiration du suc gastrique tôt le matin trois jours de suite permet un diagnostic bactériologique chez 30–50% des enfants et jusqu’à 70% des nourrissons avec une tuberculose active [13].
On peut rechercher également les bacilles tuberculeux dans le liquide de lavage broncho-alvéolaire à l’aide d’une bronchoscopie. C’est une nouvelle technique dans le diagnostic de la tuberculose pulmonaire chez l’enfant et c’est une technique très spécialisée dont nombreux pays endémiques n’ont pas son accès [22]. En plus, les prélèvements bronchiques pour une recherche bactériologique de bacilles tuberculeux n'ont pas permis un meilleur rendement que les tubages gastriques [23].
Pour la tuberculose pleurale, le diagnostic bactériologique est également difficile et repose le plus souvent sur l’examen de biopsies pleurales, ou des marqueurs de la tuberculose dans le liquide pleural [24]. La découverte des bacilles tuberculeux ou BAAR (Bacilles Acido-Alcoolo-Résistants) dans le liquide pleural est inférieure à 20% et la culture est positive dans 18 à 38% des cas [19]. La confirmation diagnostique par culture du Mycobacterium tuberculosis à partir des prélèvements de crachat ou du liquide gastrique ou du liquide de lavage broncho-alvéolaire ou du liquide pleural, n’excède donc pas 30 à 40% de sensibilité chez l’enfant, alors qu’elle constitue le gold standard dans le diagnostic de la tuberculose pulmonaire et ou pleurale chez l’adulte [25].
La difficulté d’établir le diagnostic, notamment bactériologique, justifie la place de la radiographie du thorax dans la prise en charge de la tuberculose pulmonaire chez l’enfant dans les pays en développement. Son intérêt est double : diagnostic et dépistage autour d’un cas avéré [2]. Mais, la tomodensitométrie thoracique est réservée aux quelques formes complexes de tuberculose pulmonaire dont l’image ne peut être correctement interprétée sur les clichés standards [26]. Chez nous, le scanner est très coûteux pour les patients et nous ne le demandons pas systématiquement qu’en cas des épanchements récidivants et des images difficilement interprétables à la radiographie thoracique standard. La radiologie seule ne peut pas donner le diagnostic de la tuberculose pulmonaire et ou pleurale de l’enfant d’où la nécessité de faire d’autres examens qui confirment la présence de l’infection tuberculeuse.
Il y a l’intradermo réaction (IDR) à la tuberculine ou le test tuberculinique de Mantoux. Mais l’interprétation du résultat doit se faire selon le contexte individuel de la personne examinée. Un test de 05 mm est actuellement considéré en Suisse comme positif chez les enfants non vaccinés par le BCG [13]. Dans notre étude, l’IDR est positive dans 21,28% des cas. Ce résultat correspond à celui retrouvé dans l’étude de Mohammod Jobayer Chisti et al où le test cutané à la tuberculine est positif dans 22% des cas [27]. Mais d’autres auteurs rapportent une proportion élevée de test positif (65,19% dont 42,48% ont un diamètre ≥ 10 mm) [9]. Mais, une IDR négative n’exclue pas une infection à Mycobacterium tuberculosis car il peut y avoir des faux négatifs comme dans le cas de miliaires tuberculeuses ou tuberculose maladie, d’une infection VIH ou d’autres infections virales comme la rougeole ou la varicelle, d’une prise des médicaments immunosuppresseurs comme une corticothérapie à forte dose ou des anticancéreux, de malnutrition sévère, d’infection tuberculeuse récente [28]. 10
Nous avons également utilisé le test geneXpert chez 12 enfants, pour poser le diagnostic de la tuberculose dont 8 tests sont positifs représentant 66,67% des tests geneXpert effectués mais 17,02% de tous les enfants diagnostiqués. Dans l’étude de Mohammod Jobayer Chisti, comparant le geneXpert avec la culture des bacilles tuberculeux, le geneXpert a une sensibilité à 67% (95% CI: 24–94) et une spécificité à 92% (95% CI: 87–95) [27]. La positivité de ce test varie selon les prélèvements utilisés [27]. Le geneXpert est une nouvelle technique dans le diagnostic rapide de la tuberculose chez l’enfant qui consiste à faire un test par PCR (Polymerase Chain Reaction) en temps réel. Il permet de diminuer le risque de faux positif par contamination croisée et de détecter à la fois le Mycobacterium tuberculosis et son éventuelle résistance à la rifampicine [29]. Nombreuses études américaines récentes ont rapporté une sensibilité et spécificité élevées de ce test dans les prélèvements respiratoires chez les patients vivants dans des pays à forte ou à faible prévalence tuberculeuse [30,31]. Mais il y a peu d’études africaines concernant ce test. Ceci est dû au manque de matériels pour faire ce test dans les pays Africains. C’est le cas de Madagascar où on doit importer ces matériels et il y a très souvent une rupture de stock dans nos centres de diagnostic.
Il y a d’autres examens biologiques qui permet de poser le diagnostic de la tuberculose chez l’enfant mais qui ne sont pas encore totalement accessible pour tout le monde chez nous à Madagascar. Ce sont les tests sanguins de détermination d’interferon gamma (IGRAs: Interferon Gamma Release Assays) tels que le T-SPOT.TB® et le QuantiFERON-TB® [32]. Ils sont nettement plus chers et exigent une prise de sang qui n’est pas simple chez le petit enfant. Chez les patients immunodéficients et les enfants ayant une tuberculose extrapulmonaire ainsi que chez les petits enfants, les tests IFN-γ n’ont pas encore été suffisamment évalués et donnent parfois des résultats douteux [33].
Comme il n’y a pas d’examen qui peut donner spécifiquement le diagnostic de la tuberculose pulmonaire ou de la tuberculose pleurale chez l’enfant; en pratique, la confirmation diagnostique est obtenue à partir d’un faisceau d’arguments qui oriente vers l’infection tuberculeuse. L’OMS a établi un score diagnostic qui est formé par l’ensemble des signes en faveur de la tuberculose chez l’enfant, c’est le score de Keith Edwards. Dans une étude cas-témoins de Sarkar et al concernant ce score de Keith Edwards, ils ont trouvé une sensibilité à 84,9%, une spécificité à 78% et une valeur prédictive positive à 80,36% [34]. Dans une étude prospective de L. Mbala et al, la sensibilité du score est de 85 %, sa spécificité est de 67,2 %, sa valeur prédictive positive est de 80,9 % et sa valeur prédictive négative est de 73,2 % [35]. Comme, la sensibilité de ce score est très élevée, alors, il est préférable d’utiliser ce score dans la pratique quotidienne pour éviter le retard diagnostique et l’évolution vers les complications.
Concernant le traitement, il est avant tout, un traitement médical associant de nombreux antibiotiques antituberculeux selon le protocole établi par notre programme national. En revanche, les complications requièrent une prise en charge chirurgicale. Dans notre étude, nous avons utilisé le drainage thoracique dans 93,62% des cas et une décortication pleuropulmonaire par une mini thoracotomie dans 34,04% des cas car nous n’avons pas encore de la thoracoscopie. Chez l’enfant, le traitement chirurgical de première intention d’une pleurésie purulente est le drainage thoracique. Dans un algorithme préconisé par Ala Eldin H. Ahmed et al et Prema Menon, l’indication chirurgicale varie selon le stade de la maladie. Il faut mettre, dans un premier temps c’est-à-dire au stade 1 ou phase exsudative, un drain thoracique percutané associé à une antibiothérapie par voie intraveineuse. Quand la pleurésie est cloisonnée ou quand le pus est devenu très épais, c’est-à -dire, au stade 2 ou fibrinopurulent, il faut administrer de fibrinolytique comme de l’urokinase ou streptokinase, à travers le drain thoracique. Mais quand on n’obtient pas un bon résultat après quelques jours de drainage avec utilisation de fibrinolytique, c’est-àdire, un passage au stade 3 ou stade d’organisation, une décortication pleuropulmonaire par VATS (Video Assisted Thoracoscopic Surgery) ou par mini thoracotomie est indiquée [36,37].
Deux études randomisées comparant la décortication thoracoscopique et le drainage thoracique avec des fibrinolytiques ont démontré qu’il n’y a pas de différence significative entre les deux techniques concernant la durée d’hospitalisation et les suites postopératoires. Par contre, le coût de traitement est significativement très bas avec le drainage avec fibrinolytique qu’avec la décortication par VATS [38].
Pour l’évolution après traitement, dans une étude multicentrique de Samir S. Shah et al, une réintervention ou utilisation d’autre technique complémentaire est retrouvée dans 23,1% des cas après drainage thoracique sans fibrinolytique, dans 19,8% des cas après drainage thoracique avec fibrinolytique, dans 24,7% après thoracotomie et dans 10,8% des cas après VATS, P-value étant < 0,001 [39].
CONCLUSION
La prévalence de la tuberculose pulmonaire ou pleurale de l’enfant est encore importante dans les pays en voie de développement comme Madagascar. Les complications sont fréquentes dues au retard de diagnostic et nombreux facteurs sont en cause tels que, le bas niveau socio-économique, la non spécificité des manifestations cliniques chez l’enfant, la difficulté de confirmation bactériologique et la non accessibilité de certains examens para cliniques. Ces complications requièrent un traitement chirurgical dont le coût est souvent assez cher pour la plupart de nos patients.
Ainsi, il est nécessaire d’intégrer cette prise en charge chirurgicale dans notre programme national de lutte contre la tuberculose afin d’obtenir une réduction de la morbidité et de la mortalité liées à cette maladie.
CONFLIT D”INTÉRÊTS
Aucun.
RÉFÉRENCES
1. Anane R. La tuberculose de l’enfant en Afrique. Aspects épidémiologiques, cliniques et thérapeutiques. Med Trop 2003; 63: 473-80.
2. Mabiala Babela JR, Makosso E, Senga P. Aspects radiographiques de la tuberculose pulmonaire chez l’enfant congolais : influence de l’infection à VIH. Med Trop 2006; 66: 255-9.
3. Pefura Yone EW, Evouna Mbarga A, Kuaban C. Impact de l’infection à VIH sur la tuberculose de l’enfant à Yaoundé, Cameroun. RMR 2012; 29: 1095-103.
4. Adonis-Koffy L, Kouassi F, Timité-Konan AM. Analyse des critères diagnostiques de la tuberculose de l’enfant en milieu ivoirien hospitalier. Bull Soc Pathol Exot 2004; 97(2): 127-8.
5. Wouter A O. Diagnostic et traitement de la tuberculose - Manuel pratique. Recommandations destinées au corps médical. FARES asbl, Septembre 2010.
6. Marais BJ, Hesseling AC, Gie RP, Schaaf HS, Beyers N. The burden of childhood tuberculosis and the accuracy of routine surveillance data in a high-burden setting. Int J Tuberc Lung Dis 2006; 10: 259–63.
7. Guide - Affection de longue durée. Tuberculose active. Saint-Denis La Plaine: Haute Autorité de Santé (HAS) 2007.
8. Schneider E, Castro KG. Tuberculosis trends in the United States, 1992–2001. Tuberculosis Edinb 2003; 83:21–9.
9. El Harim RL, El Matar JAM, El Malki TA. Aspects de la tuberculose de l’enfant à propos de 465 cas. Maroc Médical 2007; 29(4): 1-14.
10. Sun Kim W, Choi JI, Cheon JE, Kim IO, Yeon KM, Lee HJ. Pulmonary Tuberculosis in Infants: Radiographic and CT Findings. AJR 2006; 187:1024–33.
11. Zellweger JP, Barben J, Hammer J. Diagnostic et traitement de la tuberculose chez l’enfant. Paediatrica 2007 ; 18(4) : 22-4.
12. Rasamoelisoa JM, Tovone XG, Razoeliarinoro HV, Rakotoarimanana DR. Evaluation de la prise en charge de la tuberculose infantile à Madagascar. Résultats d'une étude multicentrique. Arch Inst Pasteur Madagascar 1999; 65(2): 82-5.
13. Barben J, Hammer J, Zellweger JP. Diagnostic et traitement de la tuberculose de l’enfant. Forum Med Suisse 2009; 9(32): 543-7.
14. Goussard P, Gie RP, Kling S. The outcome of infants younger than 6 months requiring ventilation for pneumonia caused by Mycobacterium tuberculosis. Pediatr Pulmonol 2008; 43:505–10.
15. Gie R. Atlas diagnostic de la tuberculose intrathoracique chez l’Enfant. Guide pour les pays à faibles revenus 2003. Union Internationale contre la Tuberculose et les Maladies Respiratoires 68 Boulevard Saint-Michel, 75006 Paris, France, 2003.
16. Gupta BK, Bharat V, Bandyopadhyay D. Role of Adenosine Deaminase Estimation in Differentiation of Tuberculous and Nontuberculous Exudative Pleural Effusions. J Clin Med Res 2010; 2(2): 79-84.
17. Mishra OP, Kumar R, Ali Z, Prasad R, Nath G. Evaluation of polymerase chain reaction and adenosine deaminase assay for the diagnosis of tuberculous effusions in children. Arch Dis Child 2006; 91: 985–9.
18. Hassine E, Marniche K, Bousnina S. Le pyothorax tuberculeux. Press Med 2002; 31: 921-8.
19. Marais BJ, Gie RP, Schaaf HS, Hesseling AC, Obihara CC, Starke JJ et al. The natural history of childhood intra-thoracic tuberculosis: a critical review of literature from the pre-chemotherapy era. Int J Tuberc Lung Dis 2004; 8(4): 392-402.
20. Commission nationale de lutte antituberculeuse. Guide de prise en charge de la tuberculose PNLT. République Tunisienne 2011.
21. Lo´pez A´VGG, PradoMontes de Oca E. Classic and New Diagnostic Approaches to Childhood Tuberculosis. JTM 2012: 1-12.
22. Marais BJ, Gie RP, Schaaf HS, Beyers N, Donald PR, Starke JR. Childhood Pulmonary Tuberculosis. Old Wisdom and New Challenges. Am J Respir Crit Care Med 2006; 173: 1078–90.
23. Benhalla-Djadoun KN, Smati-Bourtel L, Redjala O, Boufersaoui A, Douiri D, Boukari R, Baghriche M. L'endoscopie bronchique : une aide au diagnostic de tuberculose respiratoire chez l'enfant? Revue française d’allergologie et d’immunologie clinique 2005;45:571– 5.
24. Hasaneen NA, Zaki ME, Shalaby HM, El Morsi AS. Polymerase chain reaction of pleural biopsy is a rapid and sensitive method for the diagnosis of tuberculous pleural effusion. Chest 2003; 124(6):2105–11.
25. Nicol MP, Pienaar D, Wood K. Enzyme-linked immunospot assay responses to early secretory antigenic target 6, culture filtrate protein 10, and purified protein derivative among children with tuberculosis: implications for diagnosis and monitoring of therapy. Clinical Infectious Diseases 2005; 40(9): 1301–8.
26. Thumerelle C, Pouessel G, Errera S. Imagerie de la tuberculose pulmonaire. Arch Pediatr 2005; 12: S132- 6.
27. Chisti MJ, Graham SM, Duke T, Ahmed T, Ashraf H, Faruque ASG, La Vincente S, Banu S, Raqib R, Salam MA. A Prospective Study of the Prevalence of Tuberculosis and Bacteraemia in Bangladeshi Children with Severe Malnutrition and Pneumonia Including an Evaluation of Xpert MTB/RIF Assay. PLoS ONE 9(4): 1-9.
28. Moore DP, Schaaf HS, Nuttall J, Marais BJ. Childhood tuberculosis guidelines of the Southern African Society for Paediatric Infectious Diseases. South Afr J Epidemiol Infect 2009; 24(3): 57-68.
29. Blakemore R, Story E, Helb D, Kop J, Banada JP. Evaluation of the analytical performance of the Xpert MTB/RIF assay. J Clin Microbiol 2010; 48: 2495–2501.
30. Marlowe EM, Novak-Weekley SMN, Cumpio J, Sharp SE, Momeny MA. Evaluation of the Cepheid Xpert MTB/RIF assay for direct detection of Mycobacterium tuberculosis complex in respiratory specimens. J. Clin. Microbiol 2011; 49: 1621–1623.
31. Boehme CC, Nabeta P, Hillemann D, Nicol MP, Shenai S. Rapid molecular detection of tuberculosis and rifampin resistance. N Engl J Med 2010; 363: 1005-15.
32. Pai M, Riley LW, Colford JJM. Interferon-gamma assays in the immunodiagnosis of tuberculosis: a systematic review. Lancet Infec Dis 2004; 4: 761–76.
33. Pai M, Dheda K, Cunningham J, Scano F, O’Brien R. Tcell assays for the diagnosis of latent tuberculosis infection: moving the research agenda forward. Lancet Infect Dis 2007; 7: 428–38.
34. Sarkar S, Paul DK, Chakrabarti S, Mandal NK, Ghoshal AG. The Keith Edward scoring system: A case control study. Lung India 2009; 26(2): 35–7.
35. Mbala,LN, Nsibu,K, Mpingiyabo. Validité du score de Keith Edwards dans le diagnostic de la tuberculose pulmonaire chez l’enfant. Arch Pediatr 2014 21: 13-9.
36. Ahmed AEH, Yacoub TE. Empyema Thoracis. Clinical Medicine Insights: Circulatory, Respiratory and Pulmonary Medicine 2010: 4 1–8.
37. Menon P, Kanojia RP, Rao KLN. Empyema thoracis: Surgical management in children. J Indian Assoc Pediatr Surg 2009; 14(3): 85–93.
38. St. Peter SD. Harrison CTK. Thoracoscopic decortication vs. tube thoracostomy with fibrinolysis for empyema in children: a prospective, randomized trial. J Pediatr Surg 2009; 44: 106–11.
39. Shah SS, Hall M, Newland JG, Brogan TV. Comparative Effectiveness of Pleural Drainage Procedures for the Treatment of Complicated Pneumonia in Childhood. J Hosp Med 2011; 6 (5): 25663.
FIGURES/TABLES
RÉFÉRENCES
1. Anane R. La tuberculose de l’enfant en Afrique. Aspects épidémiologiques, cliniques et thérapeutiques. Med Trop 2003; 63: 473-80.
2. Mabiala Babela JR, Makosso E, Senga P. Aspects radiographiques de la tuberculose pulmonaire chez l’enfant congolais : influence de l’infection à VIH. Med Trop 2006; 66: 255-9.
3. Pefura Yone EW, Evouna Mbarga A, Kuaban C. Impact de l’infection à VIH sur la tuberculose de l’enfant à Yaoundé, Cameroun. RMR 2012; 29: 1095-103.
4. Adonis-Koffy L, Kouassi F, Timité-Konan AM. Analyse des critères diagnostiques de la tuberculose de l’enfant en milieu ivoirien hospitalier. Bull Soc Pathol Exot 2004; 97(2): 127-8.
5. Wouter A O. Diagnostic et traitement de la tuberculose - Manuel pratique. Recommandations destinées au corps médical. FARES asbl, Septembre 2010.
6. Marais BJ, Hesseling AC, Gie RP, Schaaf HS, Beyers N. The burden of childhood tuberculosis and the accuracy of routine surveillance data in a high-burden setting. Int J Tuberc Lung Dis 2006; 10: 259–63.
7. Guide - Affection de longue durée. Tuberculose active. Saint-Denis La Plaine: Haute Autorité de Santé (HAS) 2007.
8. Schneider E, Castro KG. Tuberculosis trends in the United States, 1992–2001. Tuberculosis Edinb 2003; 83:21–9.
9. El Harim RL, El Matar JAM, El Malki TA. Aspects de la tuberculose de l’enfant à propos de 465 cas. Maroc Médical 2007; 29(4): 1-14.
10. Sun Kim W, Choi JI, Cheon JE, Kim IO, Yeon KM, Lee HJ. Pulmonary Tuberculosis in Infants: Radiographic and CT Findings. AJR 2006; 187:1024–33.
11. Zellweger JP, Barben J, Hammer J. Diagnostic et traitement de la tuberculose chez l’enfant. Paediatrica 2007 ; 18(4) : 22-4.
12. Rasamoelisoa JM, Tovone XG, Razoeliarinoro HV, Rakotoarimanana DR. Evaluation de la prise en charge de la tuberculose infantile à Madagascar. Résultats d'une étude multicentrique. Arch Inst Pasteur Madagascar 1999; 65(2): 82-5.
13. Barben J, Hammer J, Zellweger JP. Diagnostic et traitement de la tuberculose de l’enfant. Forum Med Suisse 2009; 9(32): 543-7.
14. Goussard P, Gie RP, Kling S. The outcome of infants younger than 6 months requiring ventilation for pneumonia caused by Mycobacterium tuberculosis. Pediatr Pulmonol 2008; 43:505–10.
15. Gie R. Atlas diagnostic de la tuberculose intrathoracique chez l’Enfant. Guide pour les pays à faibles revenus 2003. Union Internationale contre la Tuberculose et les Maladies Respiratoires 68 Boulevard Saint-Michel, 75006 Paris, France, 2003.
16. Gupta BK, Bharat V, Bandyopadhyay D. Role of Adenosine Deaminase Estimation in Differentiation of Tuberculous and Nontuberculous Exudative Pleural Effusions. J Clin Med Res 2010; 2(2): 79-84.
17. Mishra OP, Kumar R, Ali Z, Prasad R, Nath G. Evaluation of polymerase chain reaction and adenosine deaminase assay for the diagnosis of tuberculous effusions in children. Arch Dis Child 2006; 91: 985–9.
18. Hassine E, Marniche K, Bousnina S. Le pyothorax tuberculeux. Press Med 2002; 31: 921-8.
19. Marais BJ, Gie RP, Schaaf HS, Hesseling AC, Obihara CC, Starke JJ et al. The natural history of childhood intra-thoracic tuberculosis: a critical review of literature from the pre-chemotherapy era. Int J Tuberc Lung Dis 2004; 8(4): 392-402.
20. Commission nationale de lutte antituberculeuse. Guide de prise en charge de la tuberculose PNLT. République Tunisienne 2011.
21. Lo´pez A´VGG, PradoMontes de Oca E. Classic and New Diagnostic Approaches to Childhood Tuberculosis. JTM 2012: 1-12.
22. Marais BJ, Gie RP, Schaaf HS, Beyers N, Donald PR, Starke JR. Childhood Pulmonary Tuberculosis. Old Wisdom and New Challenges. Am J Respir Crit Care Med 2006; 173: 1078–90.
23. Benhalla-Djadoun KN, Smati-Bourtel L, Redjala O, Boufersaoui A, Douiri D, Boukari R, Baghriche M. L'endoscopie bronchique : une aide au diagnostic de tuberculose respiratoire chez l'enfant? Revue française d’allergologie et d’immunologie clinique 2005;45:571– 5.
24. Hasaneen NA, Zaki ME, Shalaby HM, El Morsi AS. Polymerase chain reaction of pleural biopsy is a rapid and sensitive method for the diagnosis of tuberculous pleural effusion. Chest 2003; 124(6):2105–11.
25. Nicol MP, Pienaar D, Wood K. Enzyme-linked immunospot assay responses to early secretory antigenic target 6, culture filtrate protein 10, and purified protein derivative among children with tuberculosis: implications for diagnosis and monitoring of therapy. Clinical Infectious Diseases 2005; 40(9): 1301–8.
26. Thumerelle C, Pouessel G, Errera S. Imagerie de la tuberculose pulmonaire. Arch Pediatr 2005; 12: S132- 6.
27. Chisti MJ, Graham SM, Duke T, Ahmed T, Ashraf H, Faruque ASG, La Vincente S, Banu S, Raqib R, Salam MA. A Prospective Study of the Prevalence of Tuberculosis and Bacteraemia in Bangladeshi Children with Severe Malnutrition and Pneumonia Including an Evaluation of Xpert MTB/RIF Assay. PLoS ONE 9(4): 1-9.
28. Moore DP, Schaaf HS, Nuttall J, Marais BJ. Childhood tuberculosis guidelines of the Southern African Society for Paediatric Infectious Diseases. South Afr J Epidemiol Infect 2009; 24(3): 57-68.
29. Blakemore R, Story E, Helb D, Kop J, Banada JP. Evaluation of the analytical performance of the Xpert MTB/RIF assay. J Clin Microbiol 2010; 48: 2495–2501.
30. Marlowe EM, Novak-Weekley SMN, Cumpio J, Sharp SE, Momeny MA. Evaluation of the Cepheid Xpert MTB/RIF assay for direct detection of Mycobacterium tuberculosis complex in respiratory specimens. J. Clin. Microbiol 2011; 49: 1621–1623.
31. Boehme CC, Nabeta P, Hillemann D, Nicol MP, Shenai S. Rapid molecular detection of tuberculosis and rifampin resistance. N Engl J Med 2010; 363: 1005-15.
32. Pai M, Riley LW, Colford JJM. Interferon-gamma assays in the immunodiagnosis of tuberculosis: a systematic review. Lancet Infec Dis 2004; 4: 761–76.
33. Pai M, Dheda K, Cunningham J, Scano F, O’Brien R. Tcell assays for the diagnosis of latent tuberculosis infection: moving the research agenda forward. Lancet Infect Dis 2007; 7: 428–38.
34. Sarkar S, Paul DK, Chakrabarti S, Mandal NK, Ghoshal AG. The Keith Edward scoring system: A case control study. Lung India 2009; 26(2): 35–7.
35. Mbala,LN, Nsibu,K, Mpingiyabo. Validité du score de Keith Edwards dans le diagnostic de la tuberculose pulmonaire chez l’enfant. Arch Pediatr 2014 21: 13-9.
36. Ahmed AEH, Yacoub TE. Empyema Thoracis. Clinical Medicine Insights: Circulatory, Respiratory and Pulmonary Medicine 2010: 4 1–8.
37. Menon P, Kanojia RP, Rao KLN. Empyema thoracis: Surgical management in children. J Indian Assoc Pediatr Surg 2009; 14(3): 85–93.
38. St. Peter SD. Harrison CTK. Thoracoscopic decortication vs. tube thoracostomy with fibrinolysis for empyema in children: a prospective, randomized trial. J Pediatr Surg 2009; 44: 106–11.
39. Shah SS, Hall M, Newland JG, Brogan TV. Comparative Effectiveness of Pleural Drainage Procedures for the Treatment of Complicated Pneumonia in Childhood. J Hosp Med 2011; 6 (5): 25663.
ARTICLE INFO
DOI: 10.12699/jfvp.6.19.2015.31
Conflict of Interest
Non
Date of manuscript receiving
13/2/2015
Date of publication after correction
15/10/2015
Article citation
Randrianambinina F, Randrianambinina H, Razafimanjato Narindra N.N, Rakotoarisoa Andriamihaja J.C, Rakotovao Hanitrala J.L. Surgical aspects of pulmonary and pleural tuberculosis in children. J Func Vent Pulm 2015;19(6):31-38.