
 English
English
 French
French
Traitement multimodal des tumeurs épithéliales thymiques
Multimodal treatment of thymic epithelial tumors
A. Ouabdelmoumen¹, A. Sbai¹, F. Naciri¹, Z. Dehbi¹, Z. Bourhaleb², M. Elhfid³, L. Mezouar¹
1: Service de Radiothérapie, CHU Mohamed VI, Oujda. Maroc
2: Service de Radiothérapie, CHU Ibn Rochd, Casablanca. Maroc
3: Service de Radiothérapie, Centre Régional d'Oncologie, Tanger. Maroc
Corresponding author
Dr. Asmae OUABDELMOUMEN
Service de Radiothérapie du CHU Mohamed VI, Oujda. Maroc
E-mail: moumen.asmae@gmail.com
ABSTRACT
Introduction. The epithelial thymic tumors (ETT), including thymomes and thymic carcinoma, are rare. The treatment of invasive forms is multimodal.
Method. We report our experience of seven patients affected by thymic carcinoma or invasive thymome treated in our institution from January 2007 to December 2013.
Results. According to the classification of Masoaka, 6 patients were classified in stage III, only 1 patient in stage II. The anatomopathologique study after immuno marking concluded in 5 cases with typical thymome B3 and in 2 cases with thymic carcinoma C. 4 patients were additionally operated, and 3 patients received a chemotherapy of induction with protocol CAP (cyclophosphamide, adriamycine, cisplatine). A radiotherapy (until 66 Gy) was delivered by adjuvating of curative surgery or a supplement of chemotherapy (unoperable disease). In the last date of follow-up, all the patients were alive. A lung metastasis was developed in a patient who presents a thymic carcinoma, without local recurrence, after a extension time of 24 months. 3 patients presenting a thymome B3, had a pleurale relapse, with an average extension time of 19 months.
Conclusion. In our series, the phenotype and invasive character appeared to be the prognostic factors the most pejorative.
KEYWORDS: Epithelial tumor, thymome, surgery, radiotherapy, chimiotherapy
RÉSUMÉ
Introduction. Les tumeurs épithéliales thymiques (TET), regroupant les thymomes et les carcinomes thymiques, sont rares. Le traitement des formes invasives est multimodal.
Méthode. Nous rapportons notre expérience de sept patients atteints d'un carcinome thymique ou thymome invasifs traités dans notre institution de Janvier 2007 à Décembre 2013.
Résultats. Selon la classification de Masoaka, 6 patients ont été classés en stade III, un seul patient en stade II. L’étude anatomopathologique après immuno-marquage a conclu dans 5 cas à un thymome type B3 et dans 2 cas à un carcinome thymique C. 4 patients ont été opérés d'emblé, et 3 patients ont reçu une chimiothérapie d'induction à base de protocole CAP (cyclophosphamide, adriamycine, cisplatine). Une radiothérapie (jusqu'à 66 Gy) était délivrée en adjuvant d'une chirurgie curative ou en complément d'une chimiothérapie (maladie non résécable). A la dernière date de suivi, tous les patients étaient en vie. Une métastase pulmonaire a été développée chez un patient qui présente un carcinome thymique, sans récidive locale, après un délai de 24 mois. 3 patients présentant un thymome B3, ont eu une rechute pleurale, avec un délai moyen de 19 mois.
Conclusion. Dans notre série, le sous type histologique et le caractère invasif paraissaient être les facteurs pronostiques les plus péjoratifs.
MOTS CLÉS: Tumeur épithéliale, thymome, chirurgie, radiothérapie, chimiothérapie
INTRODUCTION
Les tumeurs épithéliales thymiques (TET), regroupant les thymomes et les carcinomes thymiques, sont rares, de croissance le plus souvent lente, se développant dans le médiastin antérieur. Le traitement des formes invasives reste essentiellement chirurgical, suivi d'une radiothérapie adjuvante. Dans les lésions d’emblée inopérables, la chimiothérapie néoadjuvante à base de cisplatine a toute sa place, suivie d’une chirurgie maximaliste et d’une radiothérapie postopératoire.
Cette étude tentera à travers sept cas de tracer les caractéristiques de ces tumeurs dans leurs aspects thérapeutiques et évolutifs.
MATÉRIELS ET MÉTHODES
Nous rapportons une série de sept cas de TET, répertoriés au service de radiothérapie, au CHU Mohammed VI d'Oujda.
Données cliniques
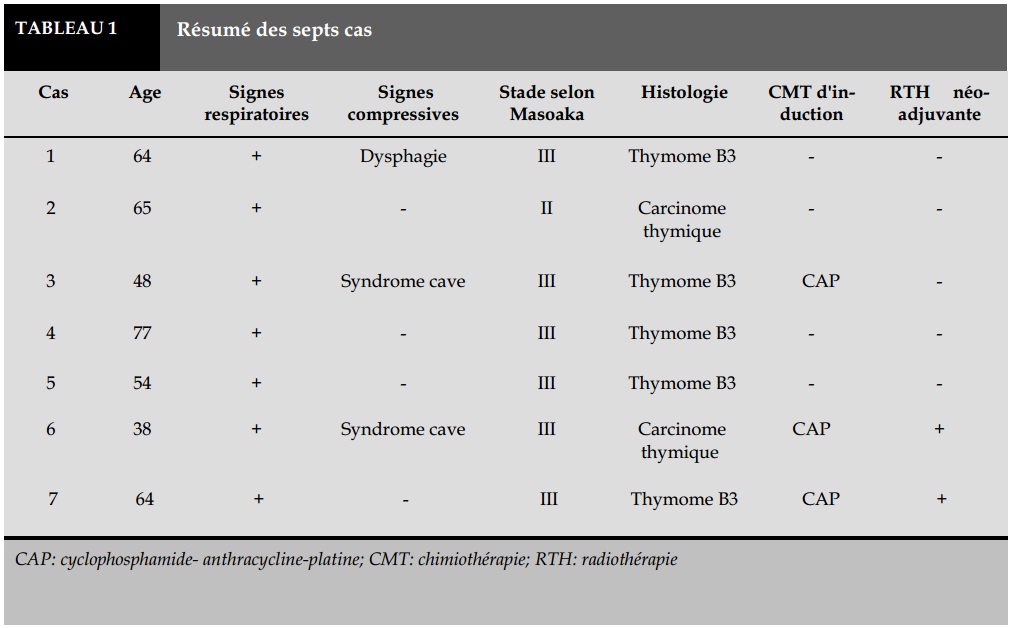
De Janvier 2007 à Décembre 2013, sept patients présentant un thymome non métastatique ont été colligés au service de radiothérapie, au CHU Mohammed VI d'Oujda. L'âge médian était de 54 ans (38-77 ans) et le sexe ratio femme/homme de 1,3. Le délai moyen de consultation était de 6 mois.
Cliniquement, tous nos patients ont présenté des signes respiratoires. Une compression cave supérieure a révélé la maladie dans deux cas. Les signes généraux ont été présents chez trois patients. On note l'absence d'une myasthénie associée ou d'un autre syndrome paranéoplasique.
Anatomopathologie et stadification
Le diagnostic histologique a été obtenu dans 4 cas par ponction biopsie transpariétale, dans un cas par biopsie chirurgicale et dans 2 cas par biopsie exérèse de la masse thymique. Selon la classification de l'OMS 2004 [1], L’étude anatomopathologique après immuno-marquage a conclu dans 5 cas à un thymome type B3 et dans 2 cas à un carcinome thymique C.
Selon la classification de Masoaka [2], 6 patients ont été classés en stade III, et un seul patient en stade II, en se basant sur les comptes rendu opératoires et anatomopathologiques.
Protocoles thérapeutiques
Quatre patients ont reçu une chirurgie d'emblé suivie d'une radiothérapie post opératoire, dont un avec chimiothérapie concomitante (cisplatine).
En raison d’un envahissement massif du médiastin et de la veine cave supérieur, trois patients (stade III) ont reçu une chimiothérapie d'induction faite de protocole CAP (cyclophosphamide, adriamycine, cisplatine). Un patient a bénéficié d'une chirurgie suivie d'une radiothérapie adjuvante, les deux autres ont eu une radio-chimiothérapie concomitante, dont un a été opéré et a reçu un complément d'irradiation du lit opératoire.
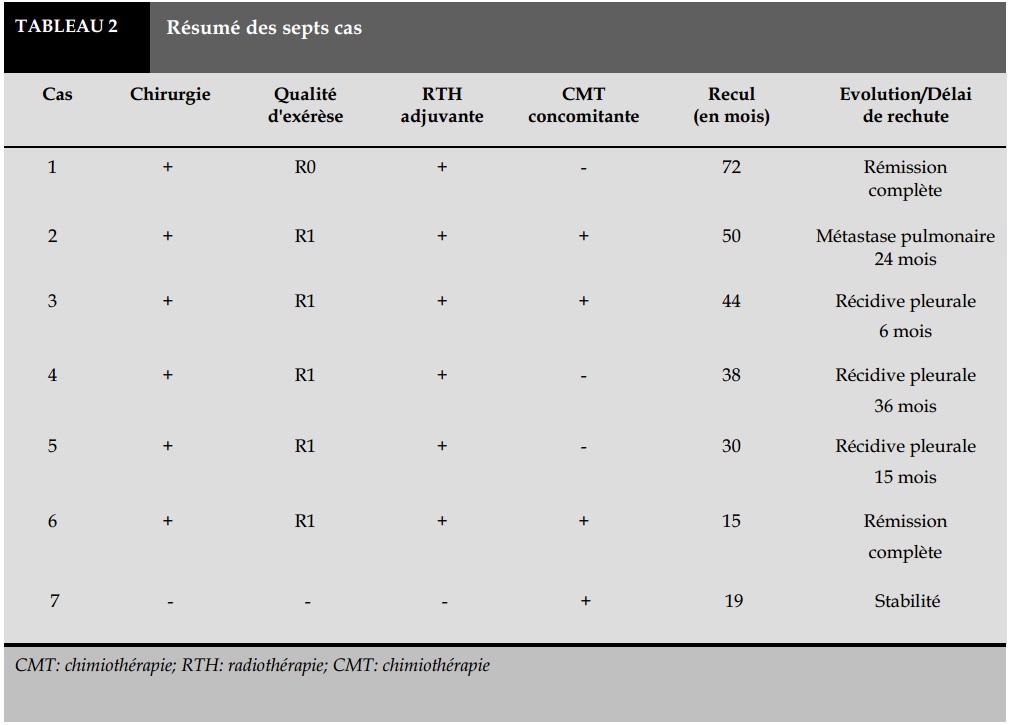
Dans les six cas opérés: cinq patients ont eu une exérèse microscopiquement incomplète (R1), un patient a eu une exérèse microscopiquement complète (R0). La dose moyenne de radiothérapie était de 62 Gy (56 - 66 Gy).
RÉSULTATS
A la dernière date de suivi, tous les patients étaient en vie. Deux patients étaient en rémission complète: un patient après un recul de 72 mois (thymome B3, stade III), et une patiente après un recul de 15 mois (carcinome thymique C, stade III).
Une métastase pulmonaire a été développée chez un patient qui présente un carcinome thymique, sans récidive locale, après un délai de 24 mois. Trois patients présentant le thymome B3, ont eu une rechute pleurale, avec un délai moyen de 19 mois.
Le résumé des sept observations est présenté dans le Tableau 1-2.
DISCUSSION
Les TET sont rares, cependant, elles représentent l’étiologie la plus fréquente de tumeurs du médiastin antérieur de l’adulte [3]. Les TET sont subdivisées en thymomes et carcinomes thymiques [4]. Les signes d’appel cliniques sont variés [5], principalement respiratoires (gêne respiratoire, toux, dyspnée, douleurs thoraciques, atteinte du nerf phrénique) ou compressifs (syndrome cave supérieur). Les thymomes sont fréquemment découverts dans le cadre du bilan d’un syndrome paranéoplasique, au premier plan desquels figure la myasthenie [6,7].
Le scanner permet de visualiser un processus tumoral de densité tissulaire centré sur la région thymique, d’apprécier son extension locorégionale, de rechercher des signes radiologiques de malignité, tels un envahissement vasculaire et de rechercher une dissémination métastatique [3]. Le diagnostic anatomopathologique de certitude est le plus souvent chirurgical, il peut être parfois fourni par simple ponction percutanée [3].
Le système de stadification tumorale des TET est typiquement postopératoire, intégrant à la fois des données anatomiques macroscopiques et histopathologiques microscopiques. Pour les thymomes, la classification la plus communément utilisée est celle de Masaoka, revue par Koga [1] (Tableau 3).
Le traitement de référence des TET est chirurgical. Une résection macroscopiquement et microscopiquement complète est de règle chaque fois qu'elle est possible [8]. La qualité de la résection dépend intimement du degré d’invasion tumorale. Si les tumeurs de stade I- II ne requièrent qu’une thymectomie totale emportant la graisse périthymique, les tumeurs de stade III et IV nécessitent quant à elles une résection en bloc de la tumeur et des structures adjacentes envahies (plèvre, péricarde, gros vaisseaux) [1].
La qualité de résection représente, après le stade tumoral, le facteur pronostique le plus significatif sur la survie globale et la survie sans récidive [9,10]. Pour les TET localement avancées, la séquence chimiothérapie puis chirurgie permet des résections complètes dans une proportion que ne permettait pas la chirurgie première [11]. Les taux de réponse des carcinomes thymiques à la chimiothérapie sont en général inférieurs à ceux observés dans les thymomes [12].
Une radiothérapie préopératoire peut être proposée afin de faciliter la chirurgie d’exérèse [13]. Actuellement, elle est plutôt proposée après un relatif échec d’une chimiothérapie néoadjuvante. La dose préconisée ne dépasse pas 40 Gy et le plus souvent un complément d’irradiation du lit opératoire est proposé après l’opération [14].
Dans les trois formes inopérables de notre série, ces deux options ont permis une résection quasi complète chez deux patients. Un patient a été récusé chirurgicalement après une chimiothérapie d'induction suivie d'une radiochimiothérapie concomitante.
La radiothérapie adjuvante des TET est justifiée dès l’observation d’un envahissement capsulaire, soit à partir du stade II de la classification [15], en fait, le taux de récidives sur le site opératoire des stades II et III en résection complète passe de 28 % à 5 % en cas de radiothérapie thoracique adjuvante [16]. En cas de chirurgie incomplète, le taux de risque de rechute locale est plus élevé, pouvant atteindre 50 % en territoire irradié [14].
L’évolution des thymomes (type B) est essentiellement locorégionale, avec le plus souvent des rechutes à type de masses pleurales, les métastases à distance sont exceptionnelles [17]. Le taux de rechute sous forme de greffes pleurales, surtout dans les tumeurs de stade III, varie selon les séries de 5 à 40%. Ces rechutes peuvent survenir tardivement [14]. Dans notre série, trois patients (sur cinq) présentant le thymome B3, ont eu une rechute pleurale, avec un délai moyen de 19 mois.
Les carcinomes thymiques ont un pronostic globalement plus péjoratif par rapport aux thymomes, avec une fréquence plus élevée des récidives et des métastases [18]. Dans notre série, un seul patient présentant le carcinome thymique, a développé une métastase pulmonaire unique qui a été reséqué, et après une période de stabilité de plus d'un an, il a présenté trois nouvelles métastases pulmonaires qui ont disparu complètement sous chimiothérapie.
CONCLUSION
Les TET sont rares, leurs prise en charge relève d'un traitement multimodal, où la chirurgie représente le gold standard.
Le sous type histologique et le caractère invasif paraissaient être les facteurs pronostiques les plus péjoratifs.
CONFLIT D”INTÉRÊTS
Aucun.
RÉFÉRENCES
1. Besse B, Girard N. Les tumeurs du thymus. Revue des Maladies Respiratoires Actualités 2013; 5, 452-460.
2. Travis WB, Brambilla A, Muller-Hermelinck HK, Harris CC.World Health Organization Classification of Tumours. Pathology and genetics of tumours of the lung, pleura, thymus and heart. Lyon: IARC Press; 2004.
3. Jacot W, Quantin X, Pujo JL. Traitement des tumeurs épithéliales thymiques Vers une prise en charge pluridisciplinaire. Rev Mal Respir 2006; 23 : 3S35-3S46.
4. V. Thomas De Montpréville. Thymomes et carcinomes thymique. Rev Mal Respir 2010; 27, 1281- 1287.
5. Wang LS, Huang MH, Lin TS, Huang BS, Chien KY. Malignant thymoma. Cancer 1992; 70: 443- 50.
6. Thomas CR, Wright CD, Loehrer PJ. Thymoma: State of the art. J Clin Oncol 1999; 17: 2280-9.
7. Levasseur P, Menestrier M, Gaud C, Dartevelle P, Julia P, Rojas- Miranda A, Navajas M, Le Brigand H, Merlier M: Thymomes et maladies associées. À propos de 255 thymomes opérés. Rev Mal Respir 1988; 5: 173-8.
8. Perrotin C, Régnard JF. Tumeurs du thymus. EMCPneumologie 2005; 2: 33- 48.
9. Huang J, Detterbeck FC, Wang Z, Loehrer PJ Sr. Standard outcome measures for thymic malignancies. J Thorac Oncol 2001; 6: S1691-7.
10. Kondo K, Monden Y. Therapy for thymic epithelial tumors: a clinical study of 1,320 patients from Japan. Ann Thorac Surg 2003;76: 878-84.
11. Mackintosh JF, Hawson GA, Matar KS, Johnston NG. Initial chemotherapy followed by surgery in malignant thymoma. Aust N Z J Med 1989; 19: 362-4.
12. Eng TY, Fuller CD, Jagirdar J, Bains Y, Thomas CR. Thymic carcinoma: state of the art review. Int J Radiat Oncol Phys 2004; 59: 654–64.
13. Akaogi E, Ohara K, Mitsui K, Onizuka M, Ishikawa S, Mitsui T, et al. Preoperative radiotherapy and surgery for advanced thymoma with invasion to the great vessels. J Surg Oncol 1996; 63: 17–22.
14. Le Péchoux C, Mahé M, Bretel JJ, Roberti E, Ruffié P. Tumeurs épithéliales thymiques. Cancer/ Radiothérapie 2005; 9: 351–357.
15. Ruffie P, Gory-Delabaere G, Fervers B, Lehmann M, Regnard JF, Resbeut M : Standards, options et recommandations pour la prise en charge des patients atteints de tumeurs épithéliales du thymus. Groupe de travail SOR. Bull Cancer 1999 ; 86: 365-84.
16. Curran WJ Jr, Kornstein MJ, Brooks JJ, Turrisi AT 3rd. Invasive thymoma: The role of mediastinal irradiation following complete or incomplete surgical resection. J Clin Oncol 1988; 6: 1722-7.
17. Morère JF, Mornex F, Soulières D. Thérapeutique du cancer. Spinger 2ème Edition 2011.
18. Ayadi-Kaddoura A, Bacha D, Smati B, Kilani T, El Mezni F. Carcinomes thymiques primitifs: à propos de trois cas avec revue de la littérature. Revue de Pneumologie clinique 2009; 65,113- 117.
TABLES

RÉFÉRENCES
1. Besse B, Girard N. Les tumeurs du thymus. Revue des Maladies Respiratoires Actualités 2013; 5, 452-460.
2. Travis WB, Brambilla A, Muller-Hermelinck HK, Harris CC.World Health Organization Classification of Tumours. Pathology and genetics of tumours of the lung, pleura, thymus and heart. Lyon: IARC Press; 2004.
3. Jacot W, Quantin X, Pujo JL. Traitement des tumeurs épithéliales thymiques Vers une prise en charge pluridisciplinaire. Rev Mal Respir 2006; 23 : 3S35-3S46.
4. V. Thomas De Montpréville. Thymomes et carcinomes thymique. Rev Mal Respir 2010; 27, 1281- 1287.
5. Wang LS, Huang MH, Lin TS, Huang BS, Chien KY. Malignant thymoma. Cancer 1992; 70: 443- 50.
6. Thomas CR, Wright CD, Loehrer PJ. Thymoma: State of the art. J Clin Oncol 1999; 17: 2280-9.
7. Levasseur P, Menestrier M, Gaud C, Dartevelle P, Julia P, Rojas- Miranda A, Navajas M, Le Brigand H, Merlier M: Thymomes et maladies associées. À propos de 255 thymomes opérés. Rev Mal Respir 1988; 5: 173-8.
8. Perrotin C, Régnard JF. Tumeurs du thymus. EMCPneumologie 2005; 2: 33- 48.
9. Huang J, Detterbeck FC, Wang Z, Loehrer PJ Sr. Standard outcome measures for thymic malignancies. J Thorac Oncol 2001; 6: S1691-7.
10. Kondo K, Monden Y. Therapy for thymic epithelial tumors: a clinical study of 1,320 patients from Japan. Ann Thorac Surg 2003;76: 878-84.
11. Mackintosh JF, Hawson GA, Matar KS, Johnston NG. Initial chemotherapy followed by surgery in malignant thymoma. Aust N Z J Med 1989; 19: 362-4.
12. Eng TY, Fuller CD, Jagirdar J, Bains Y, Thomas CR. Thymic carcinoma: state of the art review. Int J Radiat Oncol Phys 2004; 59: 654–64.
13. Akaogi E, Ohara K, Mitsui K, Onizuka M, Ishikawa S, Mitsui T, et al. Preoperative radiotherapy and surgery for advanced thymoma with invasion to the great vessels. J Surg Oncol 1996; 63: 17–22.
14. Le Péchoux C, Mahé M, Bretel JJ, Roberti E, Ruffié P. Tumeurs épithéliales thymiques. Cancer/ Radiothérapie 2005; 9: 351–357.
15. Ruffie P, Gory-Delabaere G, Fervers B, Lehmann M, Regnard JF, Resbeut M : Standards, options et recommandations pour la prise en charge des patients atteints de tumeurs épithéliales du thymus. Groupe de travail SOR. Bull Cancer 1999 ; 86: 365-84.
16. Curran WJ Jr, Kornstein MJ, Brooks JJ, Turrisi AT 3rd. Invasive thymoma: The role of mediastinal irradiation following complete or incomplete surgical resection. J Clin Oncol 1988; 6: 1722-7.
17. Morère JF, Mornex F, Soulières D. Thérapeutique du cancer. Spinger 2ème Edition 2011.
18. Ayadi-Kaddoura A, Bacha D, Smati B, Kilani T, El Mezni F. Carcinomes thymiques primitifs: à propos de trois cas avec revue de la littérature. Revue de Pneumologie clinique 2009; 65,113- 117.
ARTICLE INFO
DOI: 10.12699/jfvp.6.19.2015.39
Conflict of Interest
Non
Date of manuscript receiving
24/2/2015
Date of publication after correction
16/10/2015
Article citation
Ouabdelmoumen A, Sbai A, Naciri F, Dehbi Z, Bourhaleb Z, Elhfid M, Mezouar L. Multimodal treatment of thymic epithelial tumors. J Func Vent Pulm 2015;19(6):39-43 .