
 English
English
 French
French
Profil épidémiologique et pronostic de la pleurésie purulente chez l'enfant
Epidemiological profile and prognosis of empyema in children
M. Garba1, S. Rabiou2, M. Kamaye1, A. Soumaila1, S. Alido3
1: Service de Pédiatrie B. Hôpital National de Niamey, Niamey. Niger
2: Service de Chirurgie Thoracique. CHU Hassan II, Fès. Maroc
3: Service de Pédiatrie. Hôpital National Lamordé, Niamey, Niger
Corresponding author
Dr. Moumouni GARBA
Service de Pédiatrie B. Hôpital National de Niamey, Niamey. Niger
E-mail: djadomoumouni@gmail.com
ABSTRACT
Introduction. The incidence of empyema is increasing in the world. In addition, the prognosis of the disease is still a chalenge. The main objective of our study is to analyze the epidemiological characteristics and prognosis of empyema in children.
Methods. We conducted a prospective study from January 2012 to June 2014 by identifying cases of empyema in children aged from 0 to 15 years.
Results. The empyema represents 1.04% of childhood illness. The mean age was 5.77±4.43 years with a sex ration was 1. The newborns were the most affected (36%). 70% of the patients were from rural areas. The average duration of symptoms before hospitalization was 21.02 ± 18.24 days. Respiratory distress was a common reason for consultation (52%); 78% of patients had an abundance of effusion. Pneumococcus was the most relevant germ (46%). The pleural thickening was the most common complication (8%). The average length of hospital stay was 22.67±10.97 days. Mortality was zero.
Conclusions. Pneumococcus is still the main germ of empyema in the children. Despite the exclusive use of chest drainage associated with antibiotic therapy, the prognosis of our patients is satisfactory.
KEYWORDS: Empyema, pronostic, children, Niamey
RÉSUMÉ
Introduction. L’incidence de la pleurésie purulente est en augmentation dans le monde. En plus le pronostic de la maladie reste toujours un chalenge. L’objectif principal de notre étude est d’analyser les caractéristiques épidémiologiques et le pronostic de la pleurésie purulente de l’enfant.
Méthodes. Nous avons mené une étude prospective de janvier 2012 à juin 2014 recensant les cas de pleurésie purulente chez les enfants de 0 à 15 ans.
Résultats. La pleurésie purulente représente 1,04% des maladies de l’enfant. L’âge moyen était 5,77±4,43 ans avec un sex ration à 1. Les nourrissons étaient les plus affectés (36%). 70% des patients provenaient des zones rurales. La durée moyenne des symptômes avant hospitalisation était de 21,02±18,24 jours. La détresse respiratoire était le motif fréquent de consultation (52%); 78% des patients avaient un épanchement de grande abondance. Le pneumocoque était le germe le plus en cause (46%). La pachypleurite était la complication la plus fréquente (8%). La durée moyenne de séjour hospitalier était de 22,67±10,97 jours. La mortalité était nulle.
Conclusions. Le pneumocoque reste le principal germe de la pleurésie purulente de l’enfant. Malgré l’utilisation exclusive du drainage thoracique associé à l’antibiothérapie, le pronostic de nos patients est satisfaisant.
MOTS CLES: Pleurésie purulente, pronostic, enfant, Niamey
INTRODUCTION
L’incidence de la pleurésie purulente ne cesse d’augmenter à travers le monde. Selon une étude menée en Ecosse l’incidence de la pleurésie est passée de 1/100000 en 1998 à 3,7/100000 en 2005 [1]. Cette recrudescence serait due non seulement à la résistance des germes vis-à-vis des antibiotiques mais aussi à des facteurs intrinsèques à l’hôte comme la malnutrition, l’immunodépression et le jeune âge [2]. Cependant, il faut bien admettre que malgré le grand nombre de publications sur le sujet, elles sont loin d’apporter les réponses aux questions des cliniciens.
En effet, les conduites à tenir divergent sur le choix de l’antibiothérapie et les gestes chirurgicaux adaptés. Nonobstant cela, la prise en charge des pleurésies purulentes a beaucoup bénéficié de nouvelles thérapeutiques, des avancées de la chirurgie et du drainage radioguidée. En dépit de ce progrès le pronostic des pleurésies purulentes reste encore sombre notamment dans les pays pauvres aux plateaux techniques obsolètes.
Dans le but d’analyser le profil épidémiologique, bactériologique, et le pronostic des pleurésies purulentes en milieu pédiatrique, les auteurs rapportent une série de 50 patients.
MATÉRIELS ET MÉTHODES
Il s’agit d’une étude prospective menée au niveau des services de Pédiatrie A et B de l’Hôpital National de Niamey de Janvier 2012 à Juin 2014. Nous avons inclus dans l’étude tous les patients admis aux services pour prise en charge d’une pleurésie dont la ponction pleurale a ramené un liquide purulent. Le cas de pleurésie hématique, tuberculeuse et les hydrothorax ont été exclus.
Pour chaque malade nous avons recueilli l’âge, le sexe, la provenance, l’automédication, la durée des symptômes, l’état nutritionnel, le bilan radiologique, les paramètres biologiques, l’analyse du liquide pleural, la prise en charge médicale et chirurgicale ainsi que l’évolution. L’ensemble de ces données ont été saisies puis analysées à l’aide du logiciel IBM SPSS statistics 20. Le seuil de significativité pour l’ensemble des tests était P <0,05.
RESULTATS
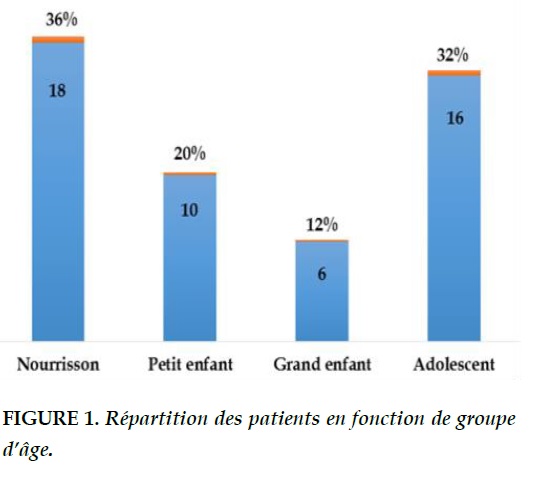
Sur 4 780 enfants hospitalisés pendant la période de l’étude 50 étaient admis pour pleurésie purulente soit une fréquence de 1,04%. Il y’avait autant de filles que de garçons. L’âge moyen était de 5,77±4,43 ans avec des extrêmes variant entre 2 mois et 13 ans. Les nourrissons étaient les plus touchés (36%) (Figure 1).
Environ 70% (N=36) des malades provenaient des zones rurales. Les motifs d’hospitalisation étaient dominés par la détresse respiratoire plus douleur thoracique (52%), suivies de la toux dans 24%. La durée moyenne d’évolution des symptômes avant l’hospitalisation était de 21,02±18,24 jours. Avant l’admission 22% des patients étaient déjà sous antibiothérapie, 14% avaient pris d’autres médicaments dont la nature n’a pas été précisée. Plus de la moitié (54%) des cas de pleurésies purulentes sont survenues pendant la saison froide (janvier, février et mars).
La température moyenne des patients à l’admission est de 38,19±1,09 °C. Les principaux signes à l’admission sont la toux 98% et le syndrome de détresse respiratoire 68%. Sur le plan nutritionnel, 34% des enfants souffrent de malnutrition, dont 16% cas de malnutrition aigüe sévère et 18% cas de malnutrition aigüe modérée. Sur le plan radiologique, le côté gauche était concerné dans 52% des cas et 78% des patients avaient un épanchement de grande abondance.
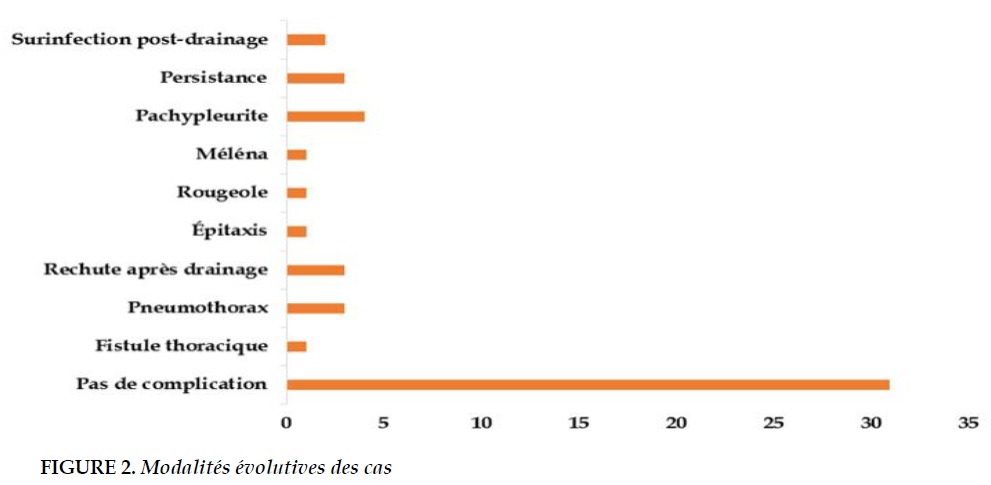
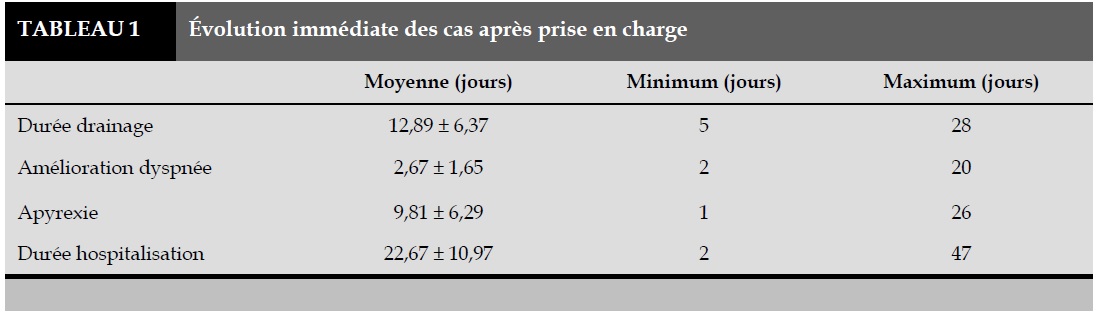
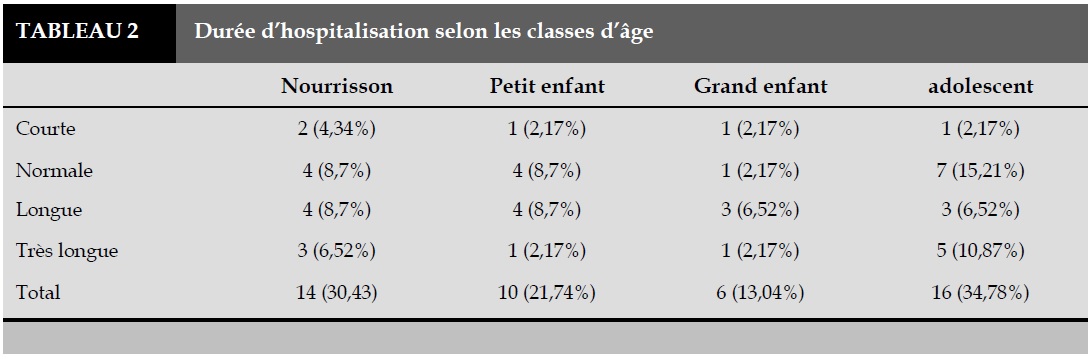
La numération formule sanguine montrait une hyperleucocytose chez tous les patients avec un taux moyen de leucocytes de 11262/ml. La VS moyenne à l’admission était de 84,27 mm à la première heure et une anémie avec un taux d’hémoglobine moyen de 8,70 Hb/dl était associée, dont 18,20% avaient une anémie modérée. La culture du pus était stérile chez tous les malades et le test au latex était positif à streptococus pneumoniae chez 46% des malades et au staphylocoque auréus chez 4%. La prise en charge consistait en une bi-antibiothérapie probabiliste à large spectre couvrant les germes anaérobie et aérobie, instaurée avant même le résultat de la culture du pus puis adaptée en fonction du résultat de l’antibiogramme. Un drainage chirurgical était nécessaire chez 90% des patients parmi lesquels 8% étaient exclus faute de moyens financiers. Le Tableau 1 résume l’évolution immédiate après la prise en charge. Chez 52% de nos patients un tarissement de l’épanchement pleural à la radiographie de contrôle a été constaté après le premier drainage. Chez 22% des malades la pleurésie a persisté après 20 jours de drainage, ce qui avait nécessité un repositionnement du drain thoracique. Le Tableau 2 nous donne la durée d’hospitalisation en fonction de la tranche d’âge. Le profil évolutif ainsi que les différentes complications sont résumés dans la Figure 2. La durée moyenne d’hospitalisation était de 22,67±10,97 jours. Seulement 20% des patients étaient suivis après l’hospitalisation, pendant une période moyenne de 43,2±10,7 jours. Tous étaient radiologiquement guéris. Le croisement de la durée d’hospitalisation selon la provenance avait montré que les enfants provenant de zone rurale avaient une durée d’hospitalisation plus longue (20,45%) par rapport aux enfants originaires des zones urbaines (13,63%). Aucune mortalité hospitalière n’a été constatée dans notre étude.
DISCUSSION
Nous avons trouvé une fréquence de 1,04%. L’incidence de la pleurésie purulente est en constante augmentation dans les pays du Nord et du Sud comme l’ont soussigné des auteurs [2-5]. Cette progression de l’incidence a été constatée même dans les régions où la vaccination anti-pneumococcique est instaurée depuis les années 2000 (Amérique et Europe) [6,7]. Selon une étude menée en Ecosse par Roxburgh et Al [4] la progression de l’incidence n’est pas due à une augmentation des cas de pneumonie bactérienne, ni au changement d’antibiotiques, et à la virulence des microbes. Des études supplémentaires doivent être menées pour tenter d’expliquer la recrudescence de la maladie.
L’âge moyen de nos patients était de 5,77±4,43 ans. C’est la même tendance rapportée par plusieurs auteurs comme Koueta [8] (5,24 ans) et Joon-ho [6] (5,75 ans). En revanche selon Roxanne et al [9] la vaccination contre le pneumocoque semble diminuer l’âge moyen de survenue de la maladie (2,1 ans). Nous avons constaté que les nourrissons étaient les plus affectés par la pleurésie. Ce constat a été corroboré par les résultats de plusieurs auteurs [8]. Plusieurs études rapportent l’influence des saisons sur la survenue de la maladie comme Baranwal, Rashna et Koueta [5,8,10]. Dans notre étude la recrudescence se passe pendant la période froide qui est favorable à la propagation des maladies respiratoires. Par contre dans des études indiennes [5,10] le nombre important de cas se rencontrent en période chaude et humide de juillet, aout et septembre. Cette différence de saisonnalité est-elle due à une différence d’écosystème bactérien ? La majorité de nos patients (70%) proviennent des zones rurales. S’agit-il d’un biais de sélection ou c’est parce que les maladies respiratoires en zone rurale sont mal prises en charge et évoluent vers la pleurésie ?
La durée moyenne d’évolution de la maladie avant l’hospitalisation est de 21,02±18,24 jours. Elle est nettement supérieure aux 9 jours en moyenne et 7 jours respectivement des auteurs occidentaux comme Kyrie et Elizabeth [11,12]. Mais elle est proche des 15 jours d’une série africaine [8]. Ce retard de consultation pourrait s’expliquer par le problème d’accessibilité géographique et financière des hôpitaux, l’automédication très répandue et souvent le recours aux guérisseurs traditionnels. La toux (98%), la fièvre (82%) et la détresse respiratoire (68%) étaient les principaux motifs de consultations. Ils ont été rapportés à des fréquences similaires par Weil-Olivier et al [13]. Plus de 2/3 de nos patients avaient un épanchement de grande abondance plus les 45% rapportés par Koueta [8]; probablement dû au long délai de consultation.
La culture du liquide pleurale était négative chez tous nos patients, et seulement 6% des malades ont une hémoculture positive. La faible positivité des cultures a été rapportée certains auteurs du sud [5] (5%) et [8] (7%). Cela est dû probablement à l’antibiothérapie probabiliste reçu avant les prélèvements et aux performances limitées de nos laboratoires. La recherche d’antigène soluble au latex était positive à 46% aux streptococcus pneumonies et 4% staphylococcus auréus chez nos patients. La prédominance du pneumocoque dans la pleurésie de l’enfant a été rapportée par plusieurs séries [15] (58%), [16] (82,9%), [17] (75%). Par contre Baranwal et al [10] rapportent en Inde une prédominance du staphylocoque à 62%.
La prise en charge de la pleurésie purulente de l’enfant continue toujours de susciter un grand débat. Certaines équipes occidentaux [11,17,18] ont proposé des algorithmes pour faciliter le traitement. Nous avons procédé à une double antibiothérapie probabiliste première à base de ceftriaxone-gentamycine dans 78% des cas et un drainage thoracique chez 82% des patients. Dans notre série et dans celle de Barnes et al [19], il a été observé un long délai entre la date d’admission et la réalisation du drainage thoracique d’environ 6 jours versus un jour pour Michelle et al [3]. Ce long délai est lié à l’indisponibilité du matériel dans les services. L’utilisation des fibrinolytique dans la prise en charge de la pleurésie purulente n’est pas encore entrée dans notre pratique thérapeutique à cause de son prix inaccessible pour la majorité de nos patients. Mais plusieurs auteurs [20,21] ont rapporté son efficacité par le raccourcissement du temps d’hospitalisation et la diminution du recourt à la chirurgie.
La durée moyenne d’apyrexie de nos patients est 9,8±6,29 jours, cette durée s’approche d’une étude indienne [5] qui a obtenu 10,52±4,12 jours; par contre elle est loin de 2 jours pour Carey [22]. L’utilisation de la thoracotomie directe pratiquée par Carey et al raccourcirait ce délai. La durée moyenne du drainage de nos patients était de 12,89 jours. Elle est en moyenne de 5 jours chez les équipes associant en plus les fibrinolytiques et la thoracotomie vidéo assistée [7,23]. La durée moyenne d’hospitalisation de nos patients est de 22,67±10,97 jours ce qu’on peut considérer comme longue par rapport aux 7 jours de Carey [22]. Il faut noter que ces équipes procèdent à la thoracotomie vidéo assistée et l’utilisation de fibrinolytiques dans la prise en charge de leurs patients.
Malgré le manque de certains moyens techniques la mortalité est nulle dans notre étude; certains auteurs [5,8] ont rapporté respectivement des taux de mortalité de 3,3% et 8,6%. S’agit-il d’un fait du hasard ou de la petitesse de la taille de notre échantillon ?
La complication la plus rapportée dans la littérature est la pachypleurite [3, 18]. Elle est de 8% dans notre étude. Dans une série rapportée par Rashna et Al [5] en Inde elle est de 16.7%. Cette complication est probablement sous-évaluée dans notre étude en raison de la non-accessibilité du scanner thoracique à tous les patients.
CONCLUSION
Les infections respiratoires aigües en général, et les pleurésies purulentes en particulier demeurent relativement fréquentes dans le contexte de sous-développement socio-économique. Elles surviennent en grande majorité dans la période froide et sèche. Le diagnostic bactériologique n’est pas aisé, car la sensibilité des différents examens paracliniques disponibles n’est pas satisfaisante. Le pneumocoque reste toujours le germe responsable dans notre contexte. Compte tenu de la gravité immédiate de la maladie et de ses nombreuses séquelles, parfois handicapantes. Il est souhaitable d’avoir un algorithme simple de prise en charge, qui tient compte de nos conditions d’exercice et des progrès thérapeutiques en la matière disponibles.
CONFLIT D”INTÉRÊTS
Aucun.
RÉFÉRENCES
1.Joaquin B, Vicenç F, Albert P. The increasing incidence of empyema. Curr Op in Pulm Med 2013; 4 (19):350–356
2. Carrie L, Kent K, Andrew P et Al. Impact of pneumococcal conjugate vaccine on pneumococcal parapneumonic empyema. Pediatr Infect Dis J 2006; 25:250 –254.
3. Michelle M, Kristin A, Bruce Edmonson M. Treatement trends and outcomes in US hospital stays of children with empyema. Pediatr Infect Dis J 2014; 33:431–436.
4. Roxburgh CSD, Youngson GG, Townend JA, Turner SW. Trends in pneumonia and empyema in Scottish children in the past 25 years. Arch Dis Child 2008; 93:316–318.
5. Rashna D et Al. Empyema Thoracis: Analysis of 150 Cases from a Tertiary Care Centre in North East India. Indian J Pediatr 2011 Nov; 78 (11):1371–1377.
6. Joon-Ho L, So HK, Jina L, Eun HC, Hoan JL. Diagnosis of pneumococcal empyema using immunochromatographic test on pleural fluid and serotype distribution in Korean children. Diagn Microbiol Infect Dis 2012; 72 :119–124.
7. Ampofo K, Andrew T, Chris R, Anne J. Evolution of the epidemiology of pneumococcal disease among Utah children through the vaccine era. Pediatr Infect Dis J 2011; 30 (12):1100-1103.
8. Koueta F. Pleurésie chez L’enfant : Aspects Epidémiologiques, Cliniques, Paracliniques, Thérapeutiques et Evolutifs au Centre Hospitalier Universitaire Pédiatrique Charles de Gaulle de Ouagadougou (Burkina Faso). Clinics in Mother and Child Health 2011; 8:16-21
9. Roxanne E, Anita C, Gwendolyn L, Tanya G et Al. Bacterial Causes of Empyema in Children, Australia, 2007–2009. Emerg Infect Dis 2011 Oct; 17 (10):1839-1845
10. Baranwal AK, Singh M, Marwaha RK, Kumar L. Empyema thoracis: a 10-year comparative review of hospitalized children from south Asia. Arch Dis Child 2003; 88:1009–1014.
11. Kyrie L, Tim W, Charles R. Impact of an Evidence-Based Algorithm on Quality of Care in Pediatric Parapneumonic Effusion and Empyema. Pediatr Pulmonol 2011; 46:722–728.
12. Elizabeth K, Joanna M, Alex B, Mike S, Sonia S. Impact of the seven-valent pneumococcal conjugate vaccination (PCV7) programme on childhood hospital admissions for bacterial pneumonia and empyema in England: national time-trends study, 1997-2008. Thorax 2010; 65:770-774
13. Weil-Olivier C, Levy C, Marguet C, Sardet A, De La Rocque F. Enquête rétrospective multicentrique sur les pleuropneumopathies infectieuses de l’enfant en France. Arch Pediatr 2005; 12:823–826.
14. Mohammad V, Ommolbanin A. Management of Thoracic Empyema: Review of 112 Cases. Acta Med Iran 2012; 50(3):203-207.
15. Tzou-Yien L, Kao P, Ching-Chuan L, Ching-Yuang L et Al. Etiology of empyema thoracis and parapneumonic pleural effusion in Taiwanese children and adolescents younger than 18 years of age. Pediatr Infect Dis J 2013; 32 (4):419-421
16. Hernandez-Bou S, Juan J, Cristina E, Amadeu G et Al. Pediatric Parapneumonic Pleural Effusion: Epidemiology, Clinical Characteristics, and Microbiological Diagnosis. Pediatr Pulmonol 2009; 44:1192–1200.
17. Edward C, John W, Weiya Z, Lucas H, Gregory R. Management of Children With Empyema: Pleural Drainage Is Not Always Necessary. Pediatr Pulmonol 2010; 45:475–480
18. Adam J, Ian M. Management of empyema in children. Pediatr Pulmonol. 2005; 40:148–156
19. Barnes NP, Hull J, Thomson AH. Medical management of parapneumonic pleural disease. Pediatr pulmonol 2005; 39:27–134
20. Rahul B, Nick AM. Treatment of Complicated Pleural Effusions in 2013. Clin Chest Med
21. Fernando M, Diovanni DG, Antonio N, Stefania T, Francesca R, Angelo L. Treatment of Complicated Pleural Effusion With Intra cavitary Urokinase in Children. Pediatr Pulmonol 2000; 29:438–442
22. Carey JA, Hamilton JR, Spencer DA, Gould K, Hasan A. Empyema thoracis: a role for open thoracotomy and decortication. Arch Dis Child1998; 79:510–513.
23. Gibelin A, Bernard A, Migueres M, Jaillard S. Décortication : techniques, indications, résultats ? Rev Mal Respir 2013; 5:127-130.
FIGURES/TABLES
RÉFÉRENCES
1.Joaquin B, Vicenç F, Albert P. The increasing incidence of empyema. Curr Op in Pulm Med 2013; 4 (19):350–356
2. Carrie L, Kent K, Andrew P et Al. Impact of pneumococcal conjugate vaccine on pneumococcal parapneumonic empyema. Pediatr Infect Dis J 2006; 25:250 –254.
3. Michelle M, Kristin A, Bruce Edmonson M. Treatement trends and outcomes in US hospital stays of children with empyema. Pediatr Infect Dis J 2014; 33:431–436.
4. Roxburgh CSD, Youngson GG, Townend JA, Turner SW. Trends in pneumonia and empyema in Scottish children in the past 25 years. Arch Dis Child 2008; 93:316–318.
5. Rashna D et Al. Empyema Thoracis: Analysis of 150 Cases from a Tertiary Care Centre in North East India. Indian J Pediatr 2011 Nov; 78 (11):1371–1377.
6. Joon-Ho L, So HK, Jina L, Eun HC, Hoan JL. Diagnosis of pneumococcal empyema using immunochromatographic test on pleural fluid and serotype distribution in Korean children. Diagn Microbiol Infect Dis 2012; 72 :119–124.
7. Ampofo K, Andrew T, Chris R, Anne J. Evolution of the epidemiology of pneumococcal disease among Utah children through the vaccine era. Pediatr Infect Dis J 2011; 30 (12):1100-1103.
8. Koueta F. Pleurésie chez L’enfant : Aspects Epidémiologiques, Cliniques, Paracliniques, Thérapeutiques et Evolutifs au Centre Hospitalier Universitaire Pédiatrique Charles de Gaulle de Ouagadougou (Burkina Faso). Clinics in Mother and Child Health 2011; 8:16-21
9. Roxanne E, Anita C, Gwendolyn L, Tanya G et Al. Bacterial Causes of Empyema in Children, Australia, 2007–2009. Emerg Infect Dis 2011 Oct; 17 (10):1839-1845
10. Baranwal AK, Singh M, Marwaha RK, Kumar L. Empyema thoracis: a 10-year comparative review of hospitalized children from south Asia. Arch Dis Child 2003; 88:1009–1014.
11. Kyrie L, Tim W, Charles R. Impact of an Evidence-Based Algorithm on Quality of Care in Pediatric Parapneumonic Effusion and Empyema. Pediatr Pulmonol 2011; 46:722–728.
12. Elizabeth K, Joanna M, Alex B, Mike S, Sonia S. Impact of the seven-valent pneumococcal conjugate vaccination (PCV7) programme on childhood hospital admissions for bacterial pneumonia and empyema in England: national time-trends study, 1997-2008. Thorax 2010; 65:770-774
13. Weil-Olivier C, Levy C, Marguet C, Sardet A, De La Rocque F. Enquête rétrospective multicentrique sur les pleuropneumopathies infectieuses de l’enfant en France. Arch Pediatr 2005; 12:823–826.
14. Mohammad V, Ommolbanin A. Management of Thoracic Empyema: Review of 112 Cases. Acta Med Iran 2012; 50(3):203-207.
15. Tzou-Yien L, Kao P, Ching-Chuan L, Ching-Yuang L et Al. Etiology of empyema thoracis and parapneumonic pleural effusion in Taiwanese children and adolescents younger than 18 years of age. Pediatr Infect Dis J 2013; 32 (4):419-421
16. Hernandez-Bou S, Juan J, Cristina E, Amadeu G et Al. Pediatric Parapneumonic Pleural Effusion: Epidemiology, Clinical Characteristics, and Microbiological Diagnosis. Pediatr Pulmonol 2009; 44:1192–1200.
17. Edward C, John W, Weiya Z, Lucas H, Gregory R. Management of Children With Empyema: Pleural Drainage Is Not Always Necessary. Pediatr Pulmonol 2010; 45:475–480
18. Adam J, Ian M. Management of empyema in children. Pediatr Pulmonol. 2005; 40:148–156
19. Barnes NP, Hull J, Thomson AH. Medical management of parapneumonic pleural disease. Pediatr pulmonol 2005; 39:27–134
20. Rahul B, Nick AM. Treatment of Complicated Pleural Effusions in 2013. Clin Chest Med
21. Fernando M, Diovanni DG, Antonio N, Stefania T, Francesca R, Angelo L. Treatment of Complicated Pleural Effusion With Intra cavitary Urokinase in Children. Pediatr Pulmonol 2000; 29:438–442
22. Carey JA, Hamilton JR, Spencer DA, Gould K, Hasan A. Empyema thoracis: a role for open thoracotomy and decortication. Arch Dis Child1998; 79:510–513.
23. Gibelin A, Bernard A, Migueres M, Jaillard S. Décortication : techniques, indications, résultats ? Rev Mal Respir 2013; 5:127-130.
ARTICLE INFO
DOI: 10.12699/jfvp.6.19.2015.49
Conflict of Interest
Non
Date of manuscript receiving
Date of publication after correction
Article citation
Garba M, Rabiou S, Kamaye M, Soumaila A, Alido S. Epidemiological profile and prognosis of empyema in children. J Func Vent Pulm 2015;19(6):49-54.