
 English
English
 French
French
Les enjeux du diagnostic de rejet humoral en transplantation pulmonaire
The diagnostic chalenges of humoral reject in lung transplantation
C. Ngo1, S. Duong-Quy1,2
1: Université Paris Descartes. Paris, France
2: Collège de Me1decine de Lam Dong. Dalat - Vietnam
Corresponding author
Dr. NGO Carine
Institut Curie. Université Paris Descartes. France
E-mail: carine.ngo@curie.fr
ABSTRACT
In lung transplantation, there is a increased recognition on the deleterious role of DSA for chronic dysfunction of pulmonary graft. In order to optimize the therapeutic stategies and to guide clinical trials, the standardized definition of humoral reject (HR) criteria in lung transplantation proves to be necessary.
The deposit of C4d complement, confirming the activation of secondary complement in interaction between DSA and target cells, is a reliable biomarker of HR in renal and cardiac transplantations. However, with the same histopathological criteria from HR of kidney and heart, which is less robust when applying in lung transplantation. The sometime contradictory results of C4d are in part linked to variability between medical centers and in the interpretation of this marker.
Although no definition of the criteria of HR had been established, ISHLT (International Society for Heart and Lung Transplantation) recommends a multidisciplinary approach to HR for lung transplantation, including the tripod diagnosis: 1) presence of clinical dysfunction, 2) presence of DSA and 3 ) presence of histopathological lesions of C4d with endothelial deposit in the alveolar capillaries.
KEYWORDS: Lung transplantation, humoral reject, C4d, DSA, ISHLT
RÉSUMÉ
En transplantation pulmonaire, il existe une reconnaissance accrue du rôle délétère des DSA dans la dysfonction chronique du greffon pulmonaire. Afin de mieux optimiser les stratégies thérapeutiques et de guider les essais cliniques, une définition standardisée des critères du RH en transplantation pulmonaire s’avère nécessaire.
Le dépôt endothélial du complément C4d, témoin de l’activation du complément secondaire à l’interaction des DSA avec la cellule cible, est un biomarqueur fiable du RH en transplantation rénale et cardiaque. Cependant, les mêmes critères histopathologiques du RH en rein et en cœur, appliqués à la transplantation pulmonaire, sont moins robustes. Les résultats parfois contradictoires du C4d sont en partie liés à une variabilité entre les centres dans l’interprétation de ce marqueur.
Bien qu’aucune définition sur les critères du RH n’ait été établie, l’ISHLT (International Society for Heart and Lung Transplantation) recommande une approche multidisciplinaire du RH en transplantation pulmonaire, incluant le trépied diagnostique: 1) présence d’une dysfonction clinique, 2) présence de DSA et 3) présence de lésions histopathologiques dont le dépôt endothélial de C4d dans les capillaires alvéolaires.
MOTS CLES: Transplantation pulmonaire, rejet humoral, C4d, DSA, ISHLT
LES BASES IMMUNOLOGIQUES DU REJET HUMORAL EN TRANSPLANTATION D’ORGANES SOLIDES
Les anticorps dirigés contre le donneur (DSA)
La physiopathologie du RH repose sur le rôle délétère des anticorps dirigés spécifiquement contre les antigènes du donneur (donor specific antibodies ou DSA) présents dans le sérum du receveur [1]. Ces anticorps peuvent être préformés, présents au moment de la transplantation ou peuvent se développer de novo après la transplantation. Les antigènes capables d’induire une réponse immunitaire humorale conduisant au rejet sont nombreux mais les rejets dus aux anticorps dirigés spécifiquement contre les antigènes HLA (de classe I et II) du donneur représentent de loin la situation la plus fréquente et la plus redoutée en pratique courante.
Les gènes du complexe majeur d’histocompatibilité (CMH), appelé complexe HLA chez l’homme, sont organisés en régions codant trois classes de molécules:
- Les gènes HLA de classe I codent des glycoprotéines exprimées à la surface de pratiquement toutes les cellules nucléées; la fonction essentielle de ces gènes est la présentation des antigènes peptiques aux cellules T cytotoxiques (Tc). Les molécules HLA de classe I sont codées par les locus A, B et C et sont appelées molécules de classe I classiques. Les locus E, F, G et H codent pour les molécules de classe I non classiques dont l’expression est limitée à certains types de cellules mais qui pourraient avoir des rôles hautement spécialisés dans l’immunité.
- Les gènes HLA de classe II codent des glycoprotéines exprimées essentiellement sur les cellules présentatrices de l’antigène (macrophages, cellules dendritiques et lymphocytes B), où elles présentent des peptides antigéniques aux cellules T auxiliaires (TH). Les molécules du HLA II sont également exprimées par les cellules endothéliales de la microcirculation et par d’autres cellules en réponse à des stimuli extérieurs. Elles sont codées par les régions DP, DQ et DR et sont appelées molécules de classe II classiques. Comme pour les molécules de classe II, il existe des molécules de classe II non classiques dont la molécule HLA-DM.
- Les gènes HLA de classe III codent diverses protéines sécrétées qui ont des fonctions immunitaires, parmi lesquelles figurent des composants du système du complément et des molécules impliquées dans l’inflammation.
Les locus qui constituent les gènes HLA sont très polymorphiques, c’est-à-dire que de nombreuses variantes alléliques existent au niveau de chaque locus.
Bien que la réponse immune aux antigènes HLA de classe I et II soit principalement impliquée dans les rejets d’allogreffe, il a également été montré que des antigènes non-HLA peuvent induire une immunité, parmi lesquels: les antigènes anti-A et B de groupe sanguin, présents à la surface des cellules épithéliales, des cellules endothéliales et des globules rouges, responsables également de réactions sévères de RH; les antigènes mineurs d’histocompatibilité; les antigènes apparentés à HLA, MICA et MICB (MHC class I-related molecules A and B), qui sont notamment exprimés par les cellules endothéliales des auto-antigènes incluant le récepteur de l’angiotensine II type I, la vimentine et la myosine; des cibles antigéniques non identifiées dont les anticorps sont dits « anti-cellules endothéliales » [2].
Les mécanismes lésionnels du rejet humoral
La première description du RH aigu en transplantation rénale au début des années 1990 a permis d’identifier deux caractéristiques distinctes: 1/ une infiltration de polynucléaires neutrophiles (PNN) dans les capillaires péritubulaires; 2/ la présence d’anticorps de novo dirigés spécifiquement contre les molécules HLA de classe I du donneur. Les auteurs ont suggéré que le rejet aigu associé à la production de novo de DSA constituait une entité clinico-pathologique de mauvais pronostic et que le principal mécanisme physiopathologique mis en jeu dans le développement des lésions médiées par les anticorps était l’activation du système du complément et le recrutement in situ de PNN.
Ce n’est qu’en 2003 que le RH a été définitivement reconnu comme une entité clinico-pathologique distincte du rejet cellulaire médié par les lymphocytes T. Le RH peut être classé, sur le plan antomo-clinique, en RH hyperaigu, aigu et chronique.
- Le RH hyperaigu apparaît dans les minutes suivant la greffe et est caractérisé par une thrombose des vaisseaux qui provoque la nécrose du greffon. Il est dû à la présence de DSA anti-HLA préformés qui se fixent sur l’endothélium du greffon et entrainent l’activation de la cascade du complément via la voie classique. Ceci conduit à une stimulation de la cellule endothéliale qui va relarguer des facteurs procoagulants tels que le facteur von Willebrandt, provoquant l’adhésion et l’agrégation des plaquettes, responsables de la thrombose des artères et de la nécrose hémorragique du greffon. Les anticorps anti-HLA préformés sont acquis au cours d’événements immunisant tels que transfusions, grossesses ou greffe antérieure et sont majoritairement des immunoglobulines (Ig) de classe G (IgG). De nos jours, ce type de rejet est évité grâce aux tests de crossmatch lymphocytaire évaluant la compatibilité HLA entre le donneur et le receveur.
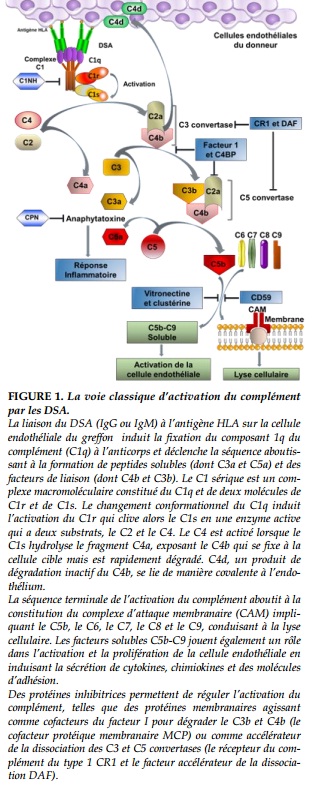
- Le RH aigu apparaît de quelques jours à quelques années après la transplantation et résulte de la présence des DSA préformés ou de novo. Comme dans le cas du RH hyperaigu historique, les DSA se fixent à la surface des cellules endothéliales, ce qui entraîne leur activation et celle de la voie classique du complément (24) (Figure 1). Quoique similaire au RH hyperaigu, le processus du RH aigu est toutefois moins sévère, dû à la mise en place de mécanismes de régulation élaborés par les cellules endothéliales limitant l’activation du système du complément.
Dans la cascade de l’activation du complément, le composant C4 est clivé en deux fragments: un petit fragment C4a – une anaphylatoxine, ou médiateur de l’inflammation – et un large fragment C4b dont la dégradation conduit à la génération de C4d, un composant stable du complément qui se lie de manière covalente à la membrane cellulaire endothéliale, contrairement au C1q et C4b. Le C4d constitue ainsi un marqueur in situ durable du RH.
L’atteinte des cellules endothéliales de la microcirculation est ainsi principalement causée par la cytotoxicité médiée par le complément. Il a également été démontré d’autres mécanismes d’atteinte lésionnelle médiés par les anticorps, indépendants du complément, tels que l’inflammation, la cytotoxicité médiée par les anticorps (via les récepteurs Fc) et l’activation de l’endothélium [3].
- Le RH chronique apparaît des mois voire des années après la greffe et résulte des dommages répétés de l’arbre vasculaire du greffon. Les lésions histologiques du RH chronique, irréversibles, ont été principalement décrites en transplantation rénale. La présence de DSA circulants et de dépôts de C4d dans les capillaires péri-tubulaires sur des biopsies de greffon rénal était associée au développement tardif d’une glomérulopathie. En cœur, il a également été montré que le RH était un facteur de risque de développement accéléré de la maladie vasculaire du greffon.
Les méthodes de détection des DSA anti-HLA
Le RH en transplantation d’organe solide est une entité dont l’importance est croissante depuis quelques années notamment grâce au développement de nouvelles techniques dites sensibles de dépistage des anticorps anti-HLA. Ce progrès a permis de mettre en évidence le fait qu’un grand nombre de patients en attente de transplantation étaient immunisés au moment de la transplantation.
Initialement, les méthodes de cross-match par lymphocytotoxicité (LCT) permettaient la mise en évidence des anticorps dirigés contre les molécules HLA de classe I et II du donneur par une réaction cytotoxique dépendante du complément, en présence du sérum du receveur. Elles permettaient également de déterminer la spécificité de ces anticorps anti-HLA et de quantifier l’immunisation en évaluant le pourcentage de cellules du panel lysées et donc reconnues par les anticorps anti-HLA du receveur (panel reactive antibody ou PRA). Cette technique a été, jusque dans les années 2000, le gold standard pour identifier les DSA et évaluer le niveau d’immunisation des patients inscrits sur liste d’attente de greffe, malgré une faible sensibilité et spécificité.
Depuis quelques années, de nouvelles techniques en phase solide, plus sensibles et reproductibles, ont été développées : les techniques enzymatiques de type ELISA dans un premier temps, puis des techniques de fluorescence (cytométrie en flux ou technologie Luminex). Le principe de ces techniques repose sur la reconnaissance d’antigènes HLA solubles purifiés, fixés sur un support solide (plaques, billes…), et ne dépend pas de l’activation du complément. Contrairement à la LCT, ces techniques permettent de mettre en évidence uniquement des anticorps d’isotype IgG, qu’ils soient cytotoxiques ou non, mais spécifiques des antigènes HLA de classe I et II.
La technologie Luminex est une nouvelle méthode de cytométrie en flux permettant l’analyse de multiples micro-sphères fluorescentes, portant un ou plusieurs variants alléliques d’un antigène HLA, dans un seul tube. Il s’agit également d’une méthode semi-quantitative par l’évaluation d’une intensité de fluorescence (mean fluorescence intensity ou MFI). La mise en évidence d’un seuil pourrait être utile en pratique courante pour définir le risque de rejet mais ce seuil est variable d’un laboratoire à l’autre et devrait donc être déterminé pour chaque laboratoire HLA.
La méthode actuelle la plus performante pour l’identification des spécificités des anticorps anti-HLA est la technique Luminex Single Antigen qui utilise non pas plusieurs cibles antigéniques HLA purifiées mais un seul Ag HLA par bille [4].
À ce jour, en France, l’immunisation anti-HLA des candidats à une transplantation d’organe est quantifiée par le TGI (Taux de greffons incompatibles) qui quantifie le pourcentage de donneurs incompatibles à partir de l’identification des spécificités HLA de classe I (A ou B) ou de classe II (DR ou DQ) interdites saisies dans la base de données nationale CRISTAL parmi l’ensemble des donneurs isogroupes prélevés sur le territoire national.
Malgré la multiplication des techniques de détection des anticorps anti-HLA, le paradigme, selon lequel un cross-match positif IgG en LCT constitue une contre-indication à la transplantation, reste intact. Toutefois, en transplantation pulmonaire, vu les temps réduits d’ischémie des greffons (4 à 5h), le cross-match est souvent effectué rétrospectivement.
CADRE DIAGNOSTIQUE DE REFERENCE POUR LE REJET HUMORAL EN TRANSPLANTATION D’ORGANES SOLIDES
Le concept de stades du rejet humoral
En 2003, une classification théorique du RH a été proposée à une conférence consensuelle du NIH, permettant de faciliter les recherches futures en transplantation d’organes solides. Cette classification repose sur quatre critères définissant quatre stades théoriques du RH.
Selon ce modèle, le RH serait un processus continu. La première étape dite de réponse humorale latente correspondrait à la présence de DSA circulants seule. L’étape suivante résulterait de l’activation du complément suite à l’interaction entre les DSA et les antigènes du donneur avec des dépôts in situ de C4d. A ce stade, il n’y aurait pas de manifestation histologique ni clinique du RH. L’apparition de lésions histologiques sans modification de la fonction de l’organe correspondrait au RH infraclinique. Au stade ultérieur, apparaîtrait la dysfonction clinique du greffon.
L’intervalle entre les différents stades du RH pourrait être long et variable sans que l’on puisse encore prédire si la progression vers la perte du greffon serait inévitable.
Le complément C4d comme biomarqueur du RH
Bien que les techniques de détection des DSA dans le sérum se soient considérablement améliorées en termes de sensibilité et spécificité, l’identification des lésions du greffon médiées par les allo-anticorps demeure un défi.
Le développement des techniques d’immunomarquage du C4d en 1991, initialement en transplantation rénale, a constitué une avancée majeure dans le domaine de la recherche puisqu’il fournit une preuve indirecte de l’interaction des DSA avec les molécules cibles HLA (ou non-HLA) à la surface de la cellule endothéliale et suggère un rôle de l’activation du complément pour le RH [5].
Le C4d, produit de dégradation inactif généré par l’activation de la cascade du complément par la voie classique, se lie de manière covalente par un composant thioesther, pour plusieurs jours voire plusieurs semaines, à la membrane cellulaire endothéliale cible. Le C4d n’a aucune fonction biologique et peut s’accumuler puis être dégradé soit en quelques jours, soit après quelques mois [6]. Le C4d marque comme une « empreinte tissulaire » et témoigne de la fixation des allo-anticorps au niveau des cellules endothéliales du greffon [7]. La détection du C4d se fait le plus souvent en immunohistochimie (IHC) sur tissu fixé en paraffine ou en immunofluorescence (IF) sur tissu congelé.
Plusieurs études ont montré que le dépôt de C4d au sein de la microcirculation (capillaires péritubulaires dans le rein, capillaires intramyocardiques dans le cœur) était significativement corrélé à l’existence de DSA dans le sérum des patients et à la perte accélérée du greffon.
Ainsi, la détection du dépôt in situ de C4d dans la microcirculation est un élément crucial pour le diagnostic de RH. Les critères diagnostiques du RH sont bien établis en transplantation rénale, et plus récemment en transplantation cardiaque, avec des classifications régulièrement mises à jour.
La cellule cible principale du RH aigu est la cellule endothéliale de la microcirculation et rend compte des anomalies histologiques dont l’inflammation microvasculaire est prédominante. L’histologie du RH aigu est caractérisée principalement par une infiltration de la microcirculation par des cellules inflammatoires (principalement monocytes, lymphocytes et parfois des polynucléaires neutrophiles).
LES MANIFESTATIONS DU REJET HUMORAL EN TRANSPLANTATION PULMONAIRE
Le rejet hyperaigu
Complication rare mais fatale, la forme hyperaigue du RH en transplantation pulmonaire est bien documentée et rapportée dans plusieurs cas cliniques. Elle est caractérisée par une dysfonction clinique fulminante du greffon avec des troubles sévères des échanges gazeux, un œdème pulmonaire et des infiltrats diffus bilatéraux visibles à la radiographie pulmonaire, conduisant à la perte du greffon dans les minutes qui suivent la greffe. Elle a été attribuée à la présence d’anticorps anti-HLA préformés qui n’avaient pas été détectés avant la greffe en raison d’un manque de sensibilité des techniques de dépistage des DSA. Le développement de nouvelles technologies en phase solide a amélioré de façon significative la capacité de détection et d’identification de la spécificité des anticorps anti-HLA avant la transplantation. Le cross-match virtuel a permis d’améliorer le choix du donneur pour les patients hyperimmunisés et de minimiser le risque de transplantation HLA incompatible et par conséquent, de diminuer l’incidence du rejet hyperaigu.
Les anomalies histologiques observées correspondaient à une atteinte parenchymateuse aigüe (acute lung injury ou ALI) sévère associant un dommage alvéolaire diffus (DAD), des lésions vasculaires caractérisées par la formation de thrombi, une margination de PNN dans les cloisons alvéolaires, une nécrose fibrinoïde au sein des capillaires interstitiels alvéolaires et une hémorragie alvéolaire [8].
Le pronostic après un épisode de rejet hyperaigu était généralement sombre et la perte du greffon inévitable. Des protocoles de traitement intensifs du RH ont été rapportés avec des résultats mitigés. Bittner et al. ont décrit le cas d’un patient greffé monopulmonaire ayant présenté un rejet hyperaigu traité avec succès par la combinaison de plasmaphérèse, de sérum anti-lymphocytaire et de cyclophosphamide. Dawson et al. ont rapporté le cas d’un patient greffé bipulmonaire ayant présenté un rejet hyperaigu réfractaire aux échanges plasmatiques, au rituximab, au bortezomib et aux IgIV mais ayant bien répondu à l’eculizumab [9].
DSA et dysfonction chronique du greffon
De multiples études ont ainsi pu démontrer le rôle délétère des DSA préformés et de novo chez des patients greffés pulmonaires.
Une étude rétrospective récente chez 56 patients greffés pulmonaires, réalisée dans les deux centres de transplantation pulmonaire à l’hôpital Bichat (Paris) et à l’hôpital Foch (Suresnes), a montré qu’un nombre élevé de patients (89%) étaient immunisés avant la greffe par la technique sensible du Luminex Single Antigen pour la détection des anticorps anti-HLA [10]. La survie et la survie sans BOS étaient significativement diminuées chez les patients ayant eu des DSA préformés dirigés contre HLA de classe II. Ces DSA étaient persistants après la transplantation, suggérant leur rôle délétère sur la survie à long terme du greffon.
Dans une autre étude rétrospective de large cohorte incluant 656 patients greffés pulmonaires, la survie médiane était de 1,5 ans chez les patients ayant eu des anticorps dirigés contre les antigènes HLA avant la greffe sur le panel (PRA>25%) contre 5,2 ans chez les patients non allo-immunisés avant la greffe (PRA = 0%) [11]. D’autres auteurs ont étudié l’impact des DSA anti-HLA développés après transplantation. Ils ont démontré que la présence d’allo-anticorps anti-HLA de novo était significativement associée au BOS [12], à un rejet aigu cellulaire de haut grade (A≥2) récurrent ou persistant et à l’inflammation bronchiolaire [12]. Une étude de large cohorte, sur une période de suivi de 10 ans, a récemment identifié le développement de novo d’anticorps anti-HLA comme un facteur de risque indépendant de mortalité [13]. Compte tenu de l’impact potentiellement délétère des DSA sur les résultats cliniques à long terme en transplantation pulmonaire, Hachem et al. ont évalué de façon prospective, dans une étude non randomisée, la survie et la survie sans BOS de patients transplantés pulmonaires ayant développé des DSA et leur réponse clinique au traitement par IgIV ou IgIV et rituximab [14]. Ils ont montré que le taux de survie et de survie sans BOS était significativement plus élevé chez les patients n’ayant plus de DSA détectables après traitement par rapport à ceux ayant des DSA persistants et était comparable à celui des patients n’ayant jamais développé de DSA après la greffe.
Des études in vitro et des modèles animaux ont également suggéré le rôle pathogène des anticorps anti-HLA et leur lien avec le développement d’un BOS. La liaison des anticorps anti-HLA aux antigènes de classe I exprimés par les cellules épithéliales bronchiques, induisait la prolifération de ces mêmes cellules épithéliales, la libération de facteurs de croissance fibrogéniques, suivie de l’apoptose des cellules épithéliales [15].
Les manifestations du rejet humoral aigu
Plusieurs cas rapportés depuis une dizaine d’années et études de série rétrospective ont permis d’identifier une forme de rejet aigu chez des patients greffés pulmonaires, dont les manifestations cliniques et histologiques seraient distinctes du rejet aigu cellulaire, et pourraient répondre aux critères diagnostiques du RH définis par le NIH.
En 1998, Badesh et al. [16] ont décrit 5 cas de patients greffés pulmonaires ayant développé une dysfonction aigue clinique du greffon associée à des lésions histologiques appelées « pulmonary capillaritis », survenant de 3 semaines à quelques mois après la transplantation. Les lésions histologiques décrites correspondaient à un œdème, une nécrose fibrinoïde, une infiltration de PNN dans les cloisons alvéolaires associée à une hémosidérose, similaires aux lésions décrites dans le rejet hyperaigu historique. 3 patients avaient une évolution fulminante et 2 d’entre eux une évolution fatale. Une réponse à la plasmaphérèse était transitoire. Les auteurs ont suggéré l’hypothèse d’un RH aigu mais aucun dosage des DSA et aucun marquage du C4d n’avait été réalisé.
Dans la classification actualisée du rejet pulmonaire de l’ISHLT en 2007, il a été proposé le concept de « dommage capillaire » (« capillary injury ») au lieu de capillarite pour décrire le pattern histologique pouvant être associé au RH.
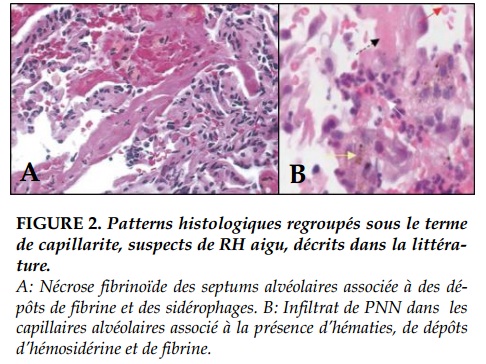
En 2013, l’ISHLT a publié une synthèse consensuelle sur les caractéristiques anatomo-pathologiques du RH en transplantation pulmonaire avec une liste de pattern histologiques qui ont été rapportés chez des patients présentant une dysfonction clinique du greffon et des DSA de novo: une capillarite à PNN, une margination de PNN dans les cloisons alvéolaires, un rejet aigu cellulaire de haut grade (≥A3), une inflammation bronchiolaire de haut grade (B2), des lésions d’ALI avec ou sans dommage alvéolaire diffus (DAD), une artérite en l’absence d’infection ou ACR et une bronchiolite oblitérante. (Figure 2)
La capillarite à PNN est définie par une infiltration dense focale ou diffuse des cloisons alvéolaires par des PNN associée à une nécrose fibrinoïde des capillaires alvéolaires et une hémorragie alvéolaire. La margination de PNN est caractérisée par un infiltrat de PNN dans les capillaires alvéolaires et les cloisons alvéolaires en l’absence de nécrose fibrinoïde.
Les lésions d’ALI incluent un spectre lésionnel allant d’un œdème interstitiel paucicellulaire, une hyperplasie des pneumocytes avec des dépôts de fibrine dans les alvéoles au dommage alvéolaire diffus défini par la présence de membranes hyalines.
Cependant, il est admis que les lésions capillaires et d’ALI ne sont pas spécifiques du RH et peuvent notamment se voir au cours d’un rejet aigu cellulaire sévère, d’une infection, d’une toxicité médicamenteuse ou d’un syndrome d’ischémie/reperfusion.
Le rôle du complément
Magro et al. ont décrit des dépôts de C4d en IF associés à des lésions capillaires mais qui n’étaient pas corrélés à la présence de DSA [17]. Wallace et al. ont montré que l’immunomarquage du C4d marquait de nombreuses structures sur les BTB d’allogreffe pulmonaire, mais aucun pattern de marquage spécifique n’était identifié [18]. Deux cas de DAD montraient des dépôts focaux de C4d en l’absence de DSA. Plus récemment, Roberts et al. ont évalué les dépôts de C4d en IF sur 92 patients greffés pulmonaires [19]. 8 patients avec des dépôts de C4d avaient des DSA concomitant vs 10 patients avec des dépôts de C4d qui n’avaient pas de DSA. Aucune corrélation entre les dépôts de C4d et la présence de DSA n’a été retrouvée. A l’inverse, Yousem et Zeevi ont identifié des dépôts endothéliaux de C4d en IHC dans 76% des cas avec des DSA vs 24% des cas en l’absence de DSA [20]. Dans leur série rétrospective, ces dépôts étaient focaux (<50% des capillaires marqués) dans la majorité des cas avec seulement 2 cas parmi 17 qui avaient des dépôts diffus de C4d (>50% de capillaires marqués).
La seule étude rétrospective de large cohorte menée par Witt et al. [15] a permis d’identifier, sur une période de 8 ans, 21 patients sur un total de 484 patients transplantés pulmonaires ayant répondu à tous les critères du RH définis par le NIH, incluant la présence d’une dysfonction clinique du greffon concomitante d’une recherche positive des DSA, la présence de lésions histologiques de dommage capillaire et des dépôts endothéliaux de C4d. Six patients étaient décédés pendant la période de suivi et 13 patients ont développé une dysfonction chronique du greffon/BOS. Ces résultats souvent contradictoires sont en partie dus à une variabilité entre les centres dans le protocole et l’interprétation du marquage C4d avec peu d’études proposant un grading du marquage C4d reposant sur la distribution et/ou l’intensité du marquage.
L’ISHLT suggère une approche multidisciplinaire du RH reposant sur le trépied diagnostique: 1) présence d’une dysfonction clinique du greffon; 2) présence de DSA et 3) présence de lésions histo-pathologiques incluant le dépôt in situ de C4d. L’ISHLT encourage les centres de transplantation pulmonaire à développer et à accumuler les expériences dans l’interprétation du marquage C4d en publiant une liste d’indications histopathologiques.
CONCLUSION
En transplantation pulmonaire, il existe une reconnaissance accrue du rôle délétère des DSA dans la dysfonction chronique du greffon pulmonaire. Afin de mieux optimiser les stratégies thérapeutiques et de guider les essais cliniques, une définition standardisée des critères du RH en transplantation pulmonaire s’avère nécessaire.
CONFLIT D’INTÉRÊTS
Aucun.
REFERENCES
1. Colvin RB, Smith RN. Antibody-mediated organ-allograft rejection. Nat Rev Immunol. 2005;5(10):807 17.
2. Bordron A, Révélen R, D’Arbonneau F, Dueymes M, Renaudineau Y, Jamin C, et al. Functional heterogeneity of anti-endothelial cell antibodies. Clin Exp Immunol. juin 2001;124(3):492 501.
3. Montgomery RA, Cozzi E, West LJ, Warren DS. Humoral immunity and antibody-mediated rejection in solid organ transplantation. Semin Immunol. août 2011;23(4):224 34.
4. Pei R, Lee J-H, Shih N-J, Chen M, Terasaki PI. Single human leukocyte antigen flow cytometry beads for accurate identification of human leukocyte antigen antibody specificities. Transplantation 2003;75(1):43 9.
5. Stegall MD, Chedid MF, Cornell LD. The role of complement in antibody-mediated rejection in kidney transplantation. Nat Rev Nephrol. nov 2012;8(11):670 8.
6. Baldwin WM, Kasper EK, Zachary AA, Wasowska BA, Rodriguez ER. Beyond C4d: other complement-related diagnostic approaches to antibody-mediated rejection. Am J Transplant Off J Am Soc Transplant Am Soc Transpl Surg. mars 2004;4(3):311 8.
7. Cohen D, Colvin RB, Daha MR, Drachenberg CB, Haas M, Nickeleit V, et al. Pros and cons for C4d as a biomarker. Kidney Int. avr 2012;81(7):628 39.
8. Masson E, Stern M, Chabod J, et al. Hyperacute rejection after lung transplantation caused by undetected low-titer anti-HLA antibodies. J Heart Lung Transplant 2007;26(6):642 5.
9. Dawson KL, Parulekar A, Seethamraju H. Treatment of hyperacute antibody-mediated lung allograft rejection with eculizumab. J Heart Lung Transplant Off Publ Int Soc Heart Transplant. déc 2012;31(12):1325 6.
10. Brugière O, Suberbielle C, Thabut G, Lhuillier E, Dauriat G, Metivier A-C, et al. Lung Transplantation in Patients with Pretransplantation Donor-Specific Antibodies Detected by Luminex Assay: Transplant J. mars 2013;95(5):761 5.
11. Hadjiliadis D, Chaparro C, Reinsmoen NL, et al. Pre-transplant panel reactive antibody in lung transplant recipients is associated with significantly worse post-transplant survival in a multicenter study. J Heart Lung Transplant Off Publ Int Soc Heart Transplant. juill 2005;24(7 Suppl):S249 54.
12. Girnita AL, Duquesnoy R, Yousem SA, Iacono AT, Corcoran TE, Buzoianu M, et al. HLA-Specific Antibodies are Risk Factors for Lymphocytic Bronchiolitis and Chronic Lung Allograft Dysfunction. Am J Transplant. 2005;5(1):131 8.
13. Snyder LD, Wang Z, Chen D-F, Reinsmoen NL, Finlen-Copeland CA, Davis WA, et al. Implications for human leukocyte antigen antibodies after lung transplantation: a 10-year experience in 441 patients. Chest. juill 2013;144(1):226 33.
14. Jaramillo A, Smith CR, Maruyama T, Zhang L, Patterson GA, Mohanakumar T. Anti-HLA class I antibody binding to airway epithelial cells induces production of fibrogenic growth factors and apoptotic cell death: a possible mechanism for bronchiolitis obliterans syndrome. Hum Immunol. mai 2003;64(5):521 9.
15. Witt CA, Gaut JP, Yusen RD, Byers DE, Iuppa JA, Bennett Bain K, et al. Acute antibody-mediated rejection after lung transplantation. J Heart Lung Transplant. oct 2013;32(10):1034 40.
16. Badesch DB, Zamora M, Fullerton D, Weill D, Tuder R, Grover F, et al. Pulmonary capillaritis: a possible histologic form of acute pulmonary allograft rejection. J Heart Lung Transplant Off Publ Int Soc Heart Transplant. avr 1998;17(4):415 22.
17. Magro CM, Deng A, Pope-Harman A, Waldman WJ, Collins AB, Adams PW, et al. Humorally mediated posttransplantation septal capillary injury syndrome as a common form of pulmonary allograft rejection: a hypothesis. Transplantation. 2002;74(9):1273 80.
18. Wallace WD, Reed EF, Ross D, Lassman CR, Fishbein MC. C4d staining of pulmonary allograft biopsies: an immunoperoxidase study. J Heart Lung Transplant. 2005;24(10):1565 70.
19. Roberts DM, Jiang SH, Chadban SJ. The treatment of acute antibody-mediated rejection in kidney transplant recipients-a systematic review. Transplantation. 27 oct 2012;94(8):775 83.
20. Yousem SA, Zeevi A. The histopathology of lung allograft dysfunction associated with the development of donor-specific HLA alloantibodies. Am J Surg Pathol. 2012;36(7):987 92.
FIGURES
REFERENCES
1. Colvin RB, Smith RN. Antibody-mediated organ-allograft rejection. Nat Rev Immunol. 2005;5(10):807 17.
2. Bordron A, Révélen R, D’Arbonneau F, Dueymes M, Renaudineau Y, Jamin C, et al. Functional heterogeneity of anti-endothelial cell antibodies. Clin Exp Immunol. juin 2001;124(3):492 501.
3. Montgomery RA, Cozzi E, West LJ, Warren DS. Humoral immunity and antibody-mediated rejection in solid organ transplantation. Semin Immunol. août 2011;23(4):224 34.
4. Pei R, Lee J-H, Shih N-J, Chen M, Terasaki PI. Single human leukocyte antigen flow cytometry beads for accurate identification of human leukocyte antigen antibody specificities. Transplantation 2003;75(1):43 9.
5. Stegall MD, Chedid MF, Cornell LD. The role of complement in antibody-mediated rejection in kidney transplantation. Nat Rev Nephrol. nov 2012;8(11):670 8.
6. Baldwin WM, Kasper EK, Zachary AA, Wasowska BA, Rodriguez ER. Beyond C4d: other complement-related diagnostic approaches to antibody-mediated rejection. Am J Transplant Off J Am Soc Transplant Am Soc Transpl Surg. mars 2004;4(3):311 8.
7. Cohen D, Colvin RB, Daha MR, Drachenberg CB, Haas M, Nickeleit V, et al. Pros and cons for C4d as a biomarker. Kidney Int. avr 2012;81(7):628 39.
8. Masson E, Stern M, Chabod J, et al. Hyperacute rejection after lung transplantation caused by undetected low-titer anti-HLA antibodies. J Heart Lung Transplant 2007;26(6):642 5.
9. Dawson KL, Parulekar A, Seethamraju H. Treatment of hyperacute antibody-mediated lung allograft rejection with eculizumab. J Heart Lung Transplant Off Publ Int Soc Heart Transplant. déc 2012;31(12):1325 6.
10. Brugière O, Suberbielle C, Thabut G, Lhuillier E, Dauriat G, Metivier A-C, et al. Lung Transplantation in Patients with Pretransplantation Donor-Specific Antibodies Detected by Luminex Assay: Transplant J. mars 2013;95(5):761 5.
11. Hadjiliadis D, Chaparro C, Reinsmoen NL, et al. Pre-transplant panel reactive antibody in lung transplant recipients is associated with significantly worse post-transplant survival in a multicenter study. J Heart Lung Transplant Off Publ Int Soc Heart Transplant. juill 2005;24(7 Suppl):S249 54.
12. Girnita AL, Duquesnoy R, Yousem SA, Iacono AT, Corcoran TE, Buzoianu M, et al. HLA-Specific Antibodies are Risk Factors for Lymphocytic Bronchiolitis and Chronic Lung Allograft Dysfunction. Am J Transplant. 2005;5(1):131 8.
13. Snyder LD, Wang Z, Chen D-F, Reinsmoen NL, Finlen-Copeland CA, Davis WA, et al. Implications for human leukocyte antigen antibodies after lung transplantation: a 10-year experience in 441 patients. Chest. juill 2013;144(1):226 33.
14. Jaramillo A, Smith CR, Maruyama T, Zhang L, Patterson GA, Mohanakumar T. Anti-HLA class I antibody binding to airway epithelial cells induces production of fibrogenic growth factors and apoptotic cell death: a possible mechanism for bronchiolitis obliterans syndrome. Hum Immunol. mai 2003;64(5):521 9.
15. Witt CA, Gaut JP, Yusen RD, Byers DE, Iuppa JA, Bennett Bain K, et al. Acute antibody-mediated rejection after lung transplantation. J Heart Lung Transplant. oct 2013;32(10):1034 40.
16. Badesch DB, Zamora M, Fullerton D, Weill D, Tuder R, Grover F, et al. Pulmonary capillaritis: a possible histologic form of acute pulmonary allograft rejection. J Heart Lung Transplant Off Publ Int Soc Heart Transplant. avr 1998;17(4):415 22.
17. Magro CM, Deng A, Pope-Harman A, Waldman WJ, Collins AB, Adams PW, et al. Humorally mediated posttransplantation septal capillary injury syndrome as a common form of pulmonary allograft rejection: a hypothesis. Transplantation. 2002;74(9):1273 80.
18. Wallace WD, Reed EF, Ross D, Lassman CR, Fishbein MC. C4d staining of pulmonary allograft biopsies: an immunoperoxidase study. J Heart Lung Transplant. 2005;24(10):1565 70.
19. Roberts DM, Jiang SH, Chadban SJ. The treatment of acute antibody-mediated rejection in kidney transplant recipients-a systematic review. Transplantation. 27 oct 2012;94(8):775 83.
20. Yousem SA, Zeevi A. The histopathology of lung allograft dysfunction associated with the development of donor-specific HLA alloantibodies. Am J Surg Pathol. 2012;36(7):987 92.
ARTICLE INFO
DOI: 10.12699/jfvp.6.19.2015.2
Conflict of Interest
Non
Date of manuscript receiving
22/1/2015
Date of publication after correction
15/6/2015
Article citation
Carine Ngo, Duong-Quy S. Current chalenge in lung transplantation. J Func Vent Pulm 2015;19(6):2-8.