
 English
English
 French
French
Etude de l’activité de la voie de NOS-3/NO dans le modèle murin de sclérodermie systémique induite par HOCl
Study of NOS-3/NO signaling pathway activity in mouce model of HOCl-induced systemic sclerosis
S. Rivière1,2, S. Duong-Quy1,3
1: Université Paris Descartes. Faculté de Médecine Port Royal. UPRES 2511, Paris - France
2: Service de Médecine Interne. Hôpital Saint Antoine, Paris - France
3: Collège de Médecine de Lam Dong. 6B Ngo Quyen, Dalat - Vietnam
Corresponding author
Dr. DUONG-QUY Sy
Collège de Médecine de Lam Dong - Dalat, Vietnam
Service de Physiologie - Explorations Fonctionnelles. Hôpital Cochin.
E-mail: sy.duong-quy@cch.aphp.fr
ABSTRACT
Introduction. Systemic sclerosis (SSc) is a disease characterized by, in addition to pulmonary fibrosis, endothelial dysfunction, progressing to pulmonary hypertension (PH). The role of NOS-3 pathway and PDE-5, which plays an important role in the modulation of pulmonary vascular tone has not yet been demonstrated.
Objectives. This study was designed to investigate the activity of NOS-3 and PDE-5 signaling pathways in the pulmonary arteries of scleroderma mouse model.
Methods. Studied mice received daily injections of saline (PBS), HOCl and bleomycin (BLM). The techniques of Western blot (WB) and immunohistochemistry (IHC) were used to analyze the expression of NOS-3 and PDE-5 at 6 and 8 weeks. Results. The expression of NOS-3, measured by IHC and WB, was significantly decreased in the pulmonary arteries in HOCl and BLM groups (p <0.05 and p <0.01, respectively) compared to the control group (PBS). The signal intensity of the PDE-5, measured by IHC, appears identical in the three groups at 6 weeks. However, there is a significant difference at 8 weeks (p = 0.02), where the expression of PDE-5 was increased in HOCl group compared to the other 2 groups. The expression of the PDE-5 measured by WB was not significantly increased at 6 and 8 weeks.
Conclusion. The decreased activity of NOS-3 associated with increased expression of the PDE-5 is involved in the pathophysiology of systemic sclerosis in mouse model.
KEYWORDS: Systemic sclerosis, pulmonary hypertension, NOS-3, PDE-5, HOCl, bleomycin
RÉSUMÉ
Introduction. La sclérodermie systémique (ScS) est une pathologie caractérisée par, en dehors de la fibrose pulmonaire, une dysfonction endothéliale, évoluant vers l’hypertension pulmonaire (HTP). Le rôle de la voie NOS-3 et la PDE-5, qui joue un rôle important dans la modulation du tonus vasculaire pulmonaire, n’a pas encore bien démontré.
Objectifs. Cette étude a été réalisée pour étudier l’activité de la voie de signalisation de NOS-3 et la PDE-5 dans les artères pulmonaires chez le modèle murin de sclérodermie systémique.
Méthodes. Les souris étudiées ont reçu des injections quotidiennes de saline (PBS), HOCl et Bléomycine (BLM). Les techniques de western-blot (WB) et d’immunohistochimie (IHC) ont été utilisées pour analyser l’expression de la NOS-3 et PDE -5 à 6 et 8 semaines.
Résultats. L’expression de la NOS-3, mesurée par IHC et WB, a été significativement diminuée dans les artères pulmonaires chez les souris des groupes HOCl et BLM (p<0,05 et p<0,01, respectivement) par rapport au contrôle (PBS). L’intensité du signal de la PDE-5, mesurée par IHC, apparait identique dans les 3 groupes à 6 semaines. Cependant, il existe une différence significative à 8 semaines (p = 0,02) où l’expression de PDE-5 a été augmentée dans le groupe HOCl par rapport aux 2 autres groupes. L’expression de la PDE-5 mesurée par WB a été augmentée non significativement à 6 et 8 semaines.
Conclusion. La diminution de l’activité de la NOS-3 associée à l’augmentation de l’expression de la PDE-5 est impliquée dans la physiopathologie de la sclérodermie systémique chez le modèle murin.
MOTS CLES: Sclérodermie systémique, hypertension pulmonaire, NOS-3, PDE-5, HOCl, bléomycine
INTRODUCTION
La sclérodermie systémique (ScS) est une pathologie caractérisée par une dysfonction endothéliale, des anomalies de régulation des fibroblastes à l’origine d’un excès de fabrication de collagène et des manifestions d’auto-immunité [1, 2]. Ces anomalies sont à l’origine d’une fibrose cutanée et des organes internes, pouvant aboutir à des défaillances viscérales et au décès [3]. La maladie touche beaucoup plus fréquemment les femmes (ratio de 3 à 8 femmes pour 1 homme selon les séries). Sa prévalence est évaluée à 154 par million d’habitant en Europe [4].
Les atteintes viscérales les plus fréquentes sont pulmonaires, rénales, digestives et cardiaques. Le pronostic dépend surtout aujourd’hui de l’existence d’une atteinte pulmonaire [5]. Les deux composantes majeures des manifestations pulmonaires de la ScS sont l’atteinte vasculaire d’une part, avec la survenue d’une hypertension pulmonaire (HTP), et parenchymateuse d’autre part, liée à la pneumopathie interstitielle fibrosante.
Le diagnostic d’HTP est établi lorsque la pression artérielle pulmonaire moyenne (PAPm) est supérieure ou égale à 25 mmHg au repos. L’HTP touche 8 à 12% des patients atteints de ScS. Plusieurs mécanismes (parfois intriqués) peuvent provoquer une HTP, mais le plus fréquent au cours de la ScS est une atteinte primitive des vaisseaux pulmonaires (groupe 1 de la classification). Elle affecte gravement le pronostic fonctionnel et vital des patients. Les données les plus récentes sur la survie l’évaluent à 56 % à 3 ans, alors que la survie globale à 10 ans des patients atteints de ScS varie entre 68% et 76,8% [3].
De nombreux progrès ont été faits dans la compréhension de la physiopathologie des HTP. Ils ont permis de montrer que le déséquilibre de la balance vasconstriction-vasodilatation n’est pas le seul phénomène impliqué. En effet, il est maintenant établi qu’il existe des micro-thromboses, un excès de prolifération cellulaire associé à un défaut d’apoptose, et des phénomènes inflammatoires. Toutes les couches des parois vasculaires sont concernées par ces anomalies.
Le NO est un médiateur exerçant de multiples fonctions biologiques, synthétisé à partir de la L-arginine par les NO synthases. Au niveau de la vascularisation pulmonaire, il est principalement synthétisé par la NO synthase endothéliale (NOSe ou NOS 3) exprimée constitutivement par les cellules endothéliales. Il est un agent vasodilatateur majeur, exerçant son action par la relaxation des cellules musculaires lisses (CML) en activant la guanylate cyclase soluble (GCs) qui catalyse la synthèse du GMP cyclique à partir du GTP.
Le GMPc active la protéine kinase G, l’un des principaux effecteurs du NO. Les phosphodiestérases (PDE) sont les enzymes qui inactivent le GMPc en le transformant en GMP. La PDE-5 est l’isoforme la plus représentée dans la vascularisation pulmonaire [6]. Le NO a également une action anti-proliférative sur les CML, et diminue l’agrégation plaquettaire [7]. Cette voie de signalisation est perturbée à différents niveaux dans l’HTP [8]. L’expression de la NOSe est diminuée dans l’endothélium des patients atteints, la biodisponibilité du NO est diminuée et la dégradation du GMPc par les phosphodiestérases (PDE) est accrue.
Il existe de nombreux modèles animaux d’HTP. Le modèle murin basé sur l’administration de bléomycine est utilisé pour les études sur l’HTP secondaire à la fibrose pulmonaire [9]. Par ailleurs, un modèle murin basé sur l’induction d’un stress oxydatif (1) a permis d’obtenir des phénotypes d’auto-immunité et de fibrose cutanées, pulmonaires et rénales proches de ceux observés dans la ScS chez l’homme. Les anomalies vasculaires pulmonaires éventuelles n’ont pas été étudiées dans ce modèle à ce jour.
OBJECTIFS
Ce travail a pour but d’étudier: 1) Les modifications d’expression de la voie de signalisation du NOS-3/ NO qui sont impliquées dans la physiopathologie des HTP ; 2) L’expression de PDE 5, enzyme inactivant le GMPc, le second messager du NO, dans un modèle murin de sclérodermie systémique.
MATERIELS ET METHODES
Animaux
Les souris sauvages (lignée C57BL/6) âgées de 6 semaines ont été achetées à la compagnie Harlan (Gannat, Biotechnologies France). Il s’agissait de femelles, compte tenu de la forte prédominance féminine de la ScS humaine. Elles ont reçus les soins selon les recommandations de l’Institut Cochin-Paris.
Les animaux ont été répartis de manière aléatoire en 3 groupes: groupe HOCl : injection quotidienne sous-cutanées de 100 µl de solution d’HOCl dans le bas du dos rasé ; groupe bléomycine: injection de 100µl de bléomycine ([100 μg/ml]), ce groupe représentant le témoin positif ; groupe témoin : injection quotidienne sous-cutanée de 100 µl de PBS. La durée des injections sous-cutanées étaient de 6 semaines dans les 3 groupes. Une partie des animaux ont été sacrifiés dès la fin des injections (6 semaines) et l’autre partie après 2 semaines de repos (8 semaines). Un poumon était inclus dans la paraffine pour les analyses histologiques et l’autre était utilisé pour les analyses moléculaires.
Immunohistochimie
Des coupes de 5 µm d’épaisseur ont été réalisées à partir des blocs de paraffine dans lesquels les poumons des souris avaient été inclus. Après déparaffinage puis réhydratation dans des bains décroissants d’éthanol, l’activité des peroxydases endogènes a été bloquée par l’eau oxygénée (H2O2) à 0,3%. Le blocage des sites non spécifiques a été réalisé par incubation au contact d’une solution de BSA à 2%. Les coupes de tissus ont ensuite été incubées avec les anticorps spécifiques dans une solution de PBS – Tween 20 à 0,05% à température ambiante. L’incubation avec les anticorps secondaires a été réalisée à température ambiante.
La révélation a été réalisée par le complexe biotine - avidine – peroxydase de raifort (RTU ACB Elite, Vector Laboratories), puis l’ajout de DAB, substrat oxydé par la peroxydase, permettait d’obtenir un signal brun visible en microscopie optique (Leica® DM LB). Après une contre-coloration à l’hématoxyline, les lames étaient traitées par un milieu de montage permanent. Les lames témoins négatifs ont été réalisées, selon le même protocole à l’exception de l’absence d’anticorps spécifiques.
L’intensité du signal au niveau des vaisseaux a été évaluée selon une méthode semi-quantitative, cotant le signal brun selon l’échelle suivante: absent = 0, faible= 2, moyen = 4, fort = 6. En cas de discontinuité du signal sur une partie de la paroi vasculaire, retrait d’un point. Les vaisseaux visibles dans les tissus étudiés ont été photographiés à l’aide d’un appareil photo numérique (Leica® DC 300) adapté au microscope.
Western Blot
La concentration de protéines homogénéité des tissues pulmonaires a été mesurée par Bicinchonic Acid Protein Assay Kit (Santa Cruz® Biotechnology). Des échantillons des surnageants ont ensuite été dénaturés à 96°c pendant 10 minutes en présence de tampon de Laemmli et d’antiprotéase. Les protéines ont été séparées par une électrophorèse à 200 volts pendant 45 minutes sur gel de polyacrylamide – sodium dodécylsulfate (SDS-PAGE) à 7,5% pour NOS3 et 10% pour PDE5. La progression des protéines pendant la migration était suivie grâce à un marqueur standard (Precision plus Protein Dual Color, Bio-rad®).
Les transferts des protéines sur membrane de nitrocellulose ont été réalisés en milieu humide, en 2 heures et à 60 volts. Après blocage des sites non spécifiques, les membranes ont été incubées au contact des anticorps spécifiques (anticorps primaire) pendant 12 heures dans une pièce maintenue à 4°C.
Les membranes ont ensuite été incubées en présence d’un anticorps secondaire dirigé contre les immunoglobulines correspondant à l’anticorps primaire pendant 45 minutes. Ces anticorps secondaires étaient couplés à la peroxydase de raifort (horseradish peroxydase, HRP). Après incubation des membranes en présence du soluté de révélation (ECL kit plus, GE Healthcare®) pendant 3 minutes, la chimiluminescence était détectée par exposition à des films photographiques. Les films ont été numérisés puis les images ont été analysées à l’aide du logiciel ImageJ (NIH image). La densité des bandes correspondantes aux protéines d’intérêt ont été rapportées à la densité de la bande de β-actine pour chaque échantillon.
Analyses statistiques
Les comparaisons entre les 3 groupes ont réalisées par le test non-paramétrique de Kruskal-Wallis (logiciel SPSS, IBM). Les valeurs p données dans la section résultats correspondent au résultat de ce test.
RESULTATS
Expression de la NOS-3 dans les artères pulmonaires des trois groupes
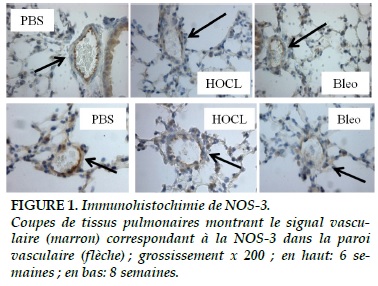
Immunohistochimie de la NOS-3
L’intensité du signal de la NOS-3 au niveau des cellules endothéliales des artères pulmonaires a été diminuée dans les groupes HOCl et Bléomycine par rapport au groupe de contrôle (Figure 1). I y a une différence significative à 6 et 8 semaines (p < 0,05).
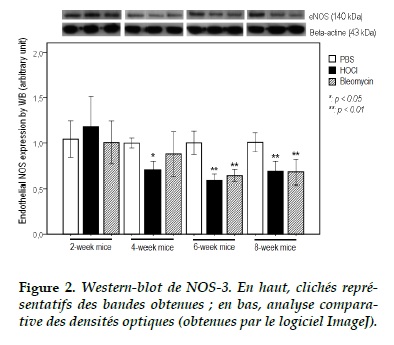
Western-Blot de la NOS-3
L’expression protéique de la NOS-3 dans les tissues pulmonaires a été diminuée significativement chez les souris des groupes HOCl et Bléomycine à 6 et 8 semaines (p < 0,01 ; Figure 2). Cependant, l’expression de la NOS-3 a été déjà diminuée significativement dès 4 semaine dans le groupe HOCl (p < 0,05).
L’expression de la PDE-5
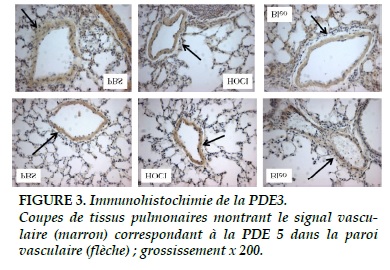
Immunohistochimie de la PDE-5
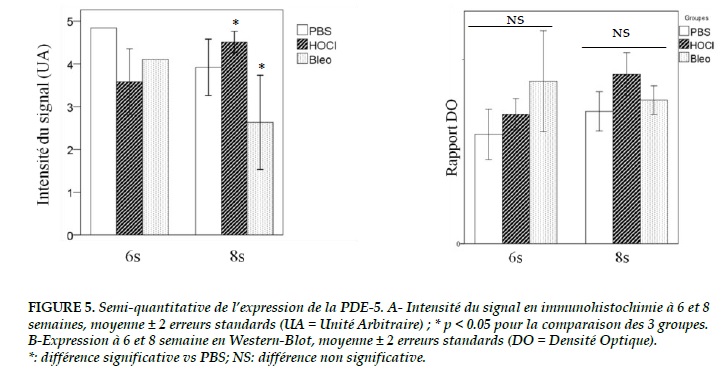
L’intensité du signal de la PDE-5 apparait identique dans les 3 groupes à 6 semaines (Figure 3).
En revanche, il existe une différence significative à 8 semaines (p = 0,02) où l’expression parait augmentée dans le groupe HOCl par rapport aux 2 autres groupes (Figure 3 et 5-A).
Western-Blot de la PDE-5
A 6 semaines (Figure 4), l’expression semble augmentée dans le groupe HOCL mais surtout dans le groupe bléomycine. Cependant, il n’y a pas de différence significative (p = 0,09 ; Figure 5-B).
A 8 semaines, cette tendance à la surexpression de la PDE 5 est retrouvée dans le groupe HOCl mais avec p = 0,06 (Figure 5-B).
DISCUSSION
Le résultat de cette a montré que: 1) L’expression de la NOS-3 mesurée par immunohistochimie et par Western-Blot a été diminuée chez les souris sclérodermiques induites par HOCl et Bléomycine ; 2) La diminution de l’expression de la NOS-3 est associée à l’augmentation de l’expression de la PDE-5 à 8 semaine dans le groupe HOCl.
Dans le modèle murin de sclérodermie systémique induite par HOCl, la voie de signalisation du NO, principal agent vasodilatateur de la vascularisation pulmonaire, est perturbée. L’expression protéique de la NOS endothéliale est diminuée, pouvant expliquer la réduction de la synthèse du NO d’origine endothéliale. De plus, la PDE-5, qui inactive le GMPc, le principal second messager du NO, parait surexprimée. Cette surexpression de la PDE-5 est retrouvée chez les animaux des 2 groupes. Nos résultats ne permettent pas d’établir cette association physiopathologique. Cependant les travaux de plusieurs équipes l’ont investiguée dans d’autres modèles.
Sauzeau et al [10] ont montré que la protéine kinase G phosphoryle RhoA, empêchant sa translocation à la membrane et donc son activation. De plus, le sildenafil, un inhibiteur de la PDE-5, diminue l’activité de la voie RhoA/ROCK dans les modèles d’HTP induite par l’hypoxie chronique [11] et la bléomycine [12]. Le NO semble donc avoir une activité inhibitrice sur la voie RhoA / ROCK, via le GMPc et la PKG.
Par ailleurs, dans un modèle utilisant des cellules endothéliales humaines exposées à l’hypoxie, Takemoto et al [13] ont montré que les ROCKs diminuent l’expression et l’activité de la NOSe. Muzaffar et al [14] ont montré sur des cellules musculaires lisses vasculaires humaines que la surexpression de la PDE 5 induite par l’anion superoxyde est limitée par les inhibiteurs de ROCK. Les interactions entre ces 2 voies de signalisation sont donc complexes. Les facteurs qui les provoquent ne sont pas identifiés à ce jour.
CONCLUSION
Dans le modèle murin de sclérodermie systémique induite par HOCl, il y a une modification de l’expression de la voie de signalisation NOS-3/NO/PDE -5. Ce résultat pourrait expliquer l’origine de dysfonctionnement endothélial menant à la perturbation de la régulation du tonus vasculaire des artères pulmonaires dans la sclérodermie systémique. Cependant, il est nécessaire de réaliser de plusieurs études sur un grand nombre effectif afin de clarifier cette hypothèse. Remerciements Le Pr. Anh-Tuan Dinh-Xuan, responsable de UPRES 2511 - Faculté de Médecine Paris-Descartes, pour sa direction et son soutien au cours de la réalisation de cette étude.
CONFLIT D’INTERÊTS
Aucun.
REFERENCES
1. Jimenez SA, Derk CT. Following the molecular pathways toward an understanding of the pathogenesis of systemic sclerosis. Ann Intern Med. 2004 Jan 6;140(1):37 -50.
2. Gabrielli A, Avvedimento EV, Krieg T. Scleroderma. N Engl J Med. 2009 May 7;360(19):1989-2003.
3. Steen VD, Medsger TA, Jr. Severe organ involvement in systemic sclerosis with diffuse scleroderma. Arthritis Rheum. 2000 Nov;43(11):2437-44.
4. Le Guern V, Mahr A, Mouthon L, Jeanneret D, Carzon M, Guillevin L. Prevalence of systemic sclerosis in a French multi-ethnic county. Rheumatology (Oxford, England). 2004 Sep;43(9):1129-37.
5. Steen VD, Medsger TA. Changes in causes of death in systemic sclerosis, 1972-2002. Ann Rheum Dis. 2007 Jul;66(7):940-4.
6. Murray F, MacLean MR, Pyne NJ. Increased expression of the cGMP-inhibited cAMP-specific (PDE3) and cGMP binding cGMP-specific (PDE5) phosphodiesterases in models of pulmonary hypertension. Br J Pharmacol. 2002 Dec;137(8):1187-94.
7. Crosswhite P, Sun Z. Nitric oxide, oxidative stress and inflammation in pulmonary arterial hypertension. J Hypertens. 2010 Feb;28(2):201-12.
8. Archer SL, Weir EK, Wilkins MR. Basic science of pulmonary arterial hypertension for clinicians: new concepts and experimental therapies. Circulation. 2010
9. Champion HC, Bivalacqua TJ, D'Souza FM, Ortiz LA, Jeter JR, Toyoda K, et al. Gene transfer of endothelial nitric oxide synthase to the lung of the mouse in vivo. Effect on agonist-induced and flow-mediated vascular responses. Circ Res. 1999 Jun 25;84(12):1422-32.
10. Sauzeau V, Le Jeune H, Cario-Toumaniantz C, Smolenski A, Lohmann SM, Bertoglio J, et al. Cyclic GMPdependent protein kinase signaling pathway inhibits RhoA-induced Ca2+ sensitization of contraction in vascular smooth muscle. J Biol Chem. 2000 Jul 14;275 (28):21722-9.
11. Guilluy C, Sauzeau V, Rolli-Derkinderen M, Guerin P, Sagan C, Pacaud P, et al. Inhibition of RhoA/Rho kinase pathway is involved in the beneficial effect of sildenafil on pulmonary hypertension. Br J Pharmacol. 2005 Dec;146(7):1010-8.
12. Hemnes AR, Zaiman A, Champion HC. PDE5A inhibition attenuates bleomycin-induced pulmonary fibrosis and pulmonary hypertension through inhibition of ROS generation and RhoA/Rho kinase activation. Am J Physiol Lung Cell Mol Physiol. 2008 Jan;294(1):L24-33.
13. Takemoto M, Sun J, Hiroki J, Shimokawa H, Liao JK. Rho-kinase mediates hypoxia-induced downregulation of endothelial nitric oxide synthase. Circulation. 2002 Jul 2;106(1):57-62.
14. Muzaffar S, Shukla N, Bond M, Sala-Newby GB, Newby AC, Angelini GD, et al. Superoxide from NADPH oxidase upregulates type 5 phosphodiesterase in human vascular smooth muscle cells: inhibition with iloprost and NONOate. Br J Pharmacol. 2008 Nov;155 (6):847-56.
FIGURES

REFERENCES
1. Jimenez SA, Derk CT. Following the molecular pathways toward an understanding of the pathogenesis of systemic sclerosis. Ann Intern Med. 2004 Jan 6;140(1):37 -50.
2. Gabrielli A, Avvedimento EV, Krieg T. Scleroderma. N Engl J Med. 2009 May 7;360(19):1989-2003.
3. Steen VD, Medsger TA, Jr. Severe organ involvement in systemic sclerosis with diffuse scleroderma. Arthritis Rheum. 2000 Nov;43(11):2437-44.
4. Le Guern V, Mahr A, Mouthon L, Jeanneret D, Carzon M, Guillevin L. Prevalence of systemic sclerosis in a French multi-ethnic county. Rheumatology (Oxford, England). 2004 Sep;43(9):1129-37.
5. Steen VD, Medsger TA. Changes in causes of death in systemic sclerosis, 1972-2002. Ann Rheum Dis. 2007 Jul;66(7):940-4.
6. Murray F, MacLean MR, Pyne NJ. Increased expression of the cGMP-inhibited cAMP-specific (PDE3) and cGMP binding cGMP-specific (PDE5) phosphodiesterases in models of pulmonary hypertension. Br J Pharmacol. 2002 Dec;137(8):1187-94.
7. Crosswhite P, Sun Z. Nitric oxide, oxidative stress and inflammation in pulmonary arterial hypertension. J Hypertens. 2010 Feb;28(2):201-12.
8. Archer SL, Weir EK, Wilkins MR. Basic science of pulmonary arterial hypertension for clinicians: new concepts and experimental therapies. Circulation. 2010
9. Champion HC, Bivalacqua TJ, D'Souza FM, Ortiz LA, Jeter JR, Toyoda K, et al. Gene transfer of endothelial nitric oxide synthase to the lung of the mouse in vivo. Effect on agonist-induced and flow-mediated vascular responses. Circ Res. 1999 Jun 25;84(12):1422-32.
10. Sauzeau V, Le Jeune H, Cario-Toumaniantz C, Smolenski A, Lohmann SM, Bertoglio J, et al. Cyclic GMPdependent protein kinase signaling pathway inhibits RhoA-induced Ca2+ sensitization of contraction in vascular smooth muscle. J Biol Chem. 2000 Jul 14;275 (28):21722-9.
11. Guilluy C, Sauzeau V, Rolli-Derkinderen M, Guerin P, Sagan C, Pacaud P, et al. Inhibition of RhoA/Rho kinase pathway is involved in the beneficial effect of sildenafil on pulmonary hypertension. Br J Pharmacol. 2005 Dec;146(7):1010-8.
12. Hemnes AR, Zaiman A, Champion HC. PDE5A inhibition attenuates bleomycin-induced pulmonary fibrosis and pulmonary hypertension through inhibition of ROS generation and RhoA/Rho kinase activation. Am J Physiol Lung Cell Mol Physiol. 2008 Jan;294(1):L24-33.
13. Takemoto M, Sun J, Hiroki J, Shimokawa H, Liao JK. Rho-kinase mediates hypoxia-induced downregulation of endothelial nitric oxide synthase. Circulation. 2002 Jul 2;106(1):57-62.
14. Muzaffar S, Shukla N, Bond M, Sala-Newby GB, Newby AC, Angelini GD, et al. Superoxide from NADPH oxidase upregulates type 5 phosphodiesterase in human vascular smooth muscle cells: inhibition with iloprost and NONOate. Br J Pharmacol. 2008 Nov;155 (6):847-56.
ARTICLE INFO
DOI: 10.12699/jfvp.4.10.2013.30
Conflict of Interest
Non
Date of manuscript receiving
21/09/2012
Date of publication after correction
15/01/2013
Article citation
Rivière S, Duong-Quy S. Study of NOS-3/NO signaling pathway activity in mouce model of HOCl-induced systemic sclerosis. J Func Vent Pulm 2013;04(10):30-35.