
 English
English
 French
French
Effet du NO inhalé sur le développement pulmonaire des ratons exposés à l’hypoxie et l’hyperoxie à pré- et post-natal
Effect of inhaled NO in lung development of pup rats exposed to hypoxia and hyperoxia in pre– and post natal periods
P. Nguyen Thi Lien1, S. Duong-Quy1,2
1: Université Paris Descartes. Faculté de Médecine Port Royal. UPRES 2511, Paris - France
2: Collège de Médecine de Lam Dong. 6B Ngo Quyen, Dalat - Vietnam
Corresponding author
Dr. DUONG-QUY Sy
Service de Physiologie - Explorations Fonctionnelles. Hôpital Cochin
Collège de Médecine de Lam Dong - Dalat, Vietnam
E-mail: sy.duong-quy@cch.aphp.fr
ABSTRACT
Background. The inhalation of nitric oxide (NO) is used in the treatment of bronchopulmonary dysplasia (BPD) and persistent pulmonary hypertension in the newborn (PH-NB), but this effect remains unknown.
Objectives. The aim of our study was to describe the pulmonary lesions induced by both prenatal hypoxia and post-natal hyperoxia, and to evaluate the effect of inhaled NO on these lesions.
Methods. Pup rats were subjected to prenatal hypoxia (FiO2 10%) for 17 days. Tha day before of birth, oxygen and NO were introduced into the cage to create a 80% hyperoxia and NO5ppm for 8 days. Control pup rats were left in room air. Rat lungs were collected at 3th and 10th day (D3 and D10) and evaluated by two techniques: hematoxylin-eosin, immunohistochemistry.
Results. Prenatal hypoxia or prolonged postnatal hyperoxia causes lung damage in newborn rats. These lesions resulted in an altered alveolization and decreased angiogenesis (P <0.05). The inhalation of NO with 5ppm prevents these abnormalities by increasing and improving of alveolization and angiogenesis (P <0.05 and P <0.01).
Conclusion. All of our results suggest that pre-natal hypoxia and hyperoxia induce postnatal lung injury and inhaled NO at a low dose (5 ppm) improves these lesions.
KEYWORDS: Inhaled NO, hypoxia, hyperoxia, newborn, aleolisation, angiogenesis, prenatal
RÉSUMÉ
Introduction. Le monoxyde d’azote (NO) inhalé est utilisé dans le traitement de la displasie broncho-pulmonaire (DBP) et de l’hypertension artérielle pulmonaire persistante du nouveau-né (HTAP-NN), mais cet effet reste peu connu.
Objectifs. L’objectif de notre étude est de décrire les lésions pulmonaires induites à la fois par l’hypoxie prénatale et par l’hyperoxie post-natale, et d’évaluer l’effet du NO inhalé sur ces lésions.
Méthodes. Les ratons ont été soumis à l’hypoxie anténatale (FiO2 10%) pendant 17 jours. A la veille de la naissance, l’oxygène et le NO ont été introduits dans la cage pour créer une hyperoxie à 80% et NO5ppm pendant 8 jours. Les ratons de contrôles ont été laissés à l’air ambiante. Les poumons ont été récupérés à 3è et 10è jours (J3 et J10) et évalués par des techniques: coloration hématoxyline-éosine, immunohistochimie.
Résultats. L’hypoxie anténatale prolongée ou l’hyperoxie post-natale entraîne des lésions pulmonaires chez les ratons nouveau-nés. Ces lésions sont traduites par une altération de l’alvéolisation et une diminution de l’angiogénèse (P<0,05). Le NO inhalé 5ppm prévient ces lésions pulmonaires exprimant par une augmentation de l’alvéolisation et une amélioration de l’angiogénèse (P<0,05 et P<0,01).
Conclusion. L’ensemble de nos résultats suggère que l’hypoxie pré-natale et l’hyperoxie postnatale induisent des lésions pulmonaires, et que le NO inhalé à une faible dose (5ppm) améliore ces lésions.
MOTS CLES: NO inhalé, hypoxie, hyperoxie, nouveau-né, alvéolisation, angiogénèse, pré-natal
INTRODUCTION
L’inhalation du monoxyde d’azote (NO) est utilisée depuis plus de vingt ans pour traiter les détresses respiratoires des nouveau-nés à terme ou prématurés. Les premières indications thérapeutiques du NO inhalé reposaient sur sa capacité à réduire la résistance vasculaire pulmonaire et optimiser les échanges gazeux pulmonaires permettant à la fois la diminution du tonus vasculaire pulmonaire et l’ amélioration de l’oxygénation tissulaire systémique des nouveaunés souffrant de détresse respiratoire néonatale [1]. Les études récentes ont montré que le NO inhalé pourrait aussi réduire les risques de lésions cérébrales et prévenir l’incidence de la dysplasie broncho-pulmonaire (DBP) des prématurés atteints d’une insuffisance respiratoire sévère [2-5]. De récents progrès ont par ailleurs permis d’améliorer la survie des nouveau-nés prématurés, notamment grâce à la ventilation mécanique à pression positive continue, l’oxygénothérapie à haut débit et surtout l’administration de surfactant par voie intratrachéale.
Cependant, malgré les effets bénéfiques de l’administration du surfactant exogène et la corticothérapie anténatale, bon nombre de nouveau-nés prématurés évoluent encore vers une nouvelle forme clinicoradiologique de DBP, parfois même en l’absence de maladies respiratoires sévères initiales. Cette nouvelle forme est principalement liée à la raréfaction du lit capillaire et du nombre des alvéoles lors du développement pulmonaire. Ainsi, certaines études cliniques ont montré que l’hyperoxie, en favorisant la formation de dérivés réactifs de l’oxygène, altérait le développement pulmonaire normal et augmentait la morbidité et la mortalité liées à la DBP [6].
Face à ce problème, de nombreuses études expérimentales ont montré que le NO inhalé pouvait améliorer le développement pulmonaire, en particulière l’alvéolisation et l’angiogenèse pulmonaire [7]. Cependant, les mécanismes précis de ces effets thérapeutiques bénéfiques du NO inhalé sur le développement pulmonaire pendant la vie foetale et en période post-natale ne sont pas encore clairement connus. En plus du problème de l’immaturité pulmonaire, les nouveau-nés peuvent également être exposés à l’hypoxie durant la grossesse, et à l’hyperoxie pendant la période post-natale due aux traitements intensifs en réanimation néonatale, l’hyperoxie et le stress oxydatif étant des facteurs de risque connus pour la DBP [8].
Notre travail a consisté à évaluer l’effet du NO inhalé sur le développement pulmonaire des rats nouveau-nés à terme exposés à l’hypoxie prénatale et l’hyperoxie post-natale.
OBJECTIFS
Évaluer les effets du NO à faible dose sur le développement pulmonaire reflété par l’alvéolisation et l’angiogenèse chez les rats nouveau-nés soumis à l’hypoxie gestationnelle et/ou à l’hyperoxie post-natale.
MATÉRIELS ET MÉTHODES
Sujets
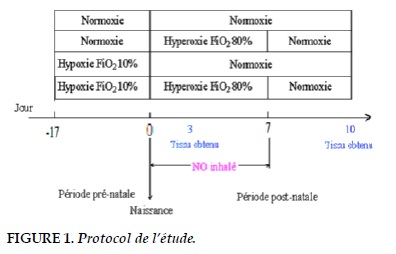
Les rates gestantes Sprague Dawley ont été élevées conformément aux règlements d’utilisation et de soins des animaux en recherche biomédicale. Elles étaient maintenues à 24°C dans un cycle jour/nuit de 12 heures avec accès libre aux aliments. Une surveillance régulière était assurée 2 fois par jour pendant la semaine et 1 fois par jour pendant les week-ends et jours fériés.
Ces rates étudiées ont été divisées en 2 groupes (Figure 1): le groupe normoxique et le groupe hypoxique (10% FiO2). Elles ont été nourries dans les mêmes conditions jusqu’au dernier jour de la grossesse (21ème jour). Les rats nouveau-nés accompagnés de leurs mères continuaient à vivre dans différentes conditions: normoxique et hyperoxique (FiO2 = 80% ; pendant 8 premiers jours à partir de la naissance). Ainsi, les rats ont été randomisés dans 4 groupes : NN, HN, NH, HH (NN: Normo-Normoxie, HN: Hypo-Normoxie, NH: Normo-Hyperoxie, HH: Hypo-Hyperoxie).
Les rats nouveau-nés ont été placés dans la chambre d’inhalation de NO et surveillés pendant 8 jours. L’administration du NO est faite par l’appareil spécialisé (BioSpherix, Redfield, IL, USA) qui se compose d’une source de NO à débit modulable et d’une chambre étanche équipée de dispositifs de mesure de la composition de l’air (N2, O2, NO, CO2). Les protocoles expérimentaux ont été validés et acceptés par le comité éthique de l’Institut National de Santé et de la Recherche Médicale (INSERM Unité 676, Hôpital Robert-Debré ; UPRES-2511, Faculté de Médecine Paris Descartes. Paris, France).
Prélèvements d’organes et préparations de tissus
Le sacrifice des rats nouveau-nés a été fait par décapitation (obtention du cerveau frais par l’équipe de l’INSERM U676). Le poids corporel a été obtenu et enregistré avant le sacrifice. L’accès aux poumons est faute par incision médio-sternale. Une fois disséqués, les poumons sont rincés par injection et réaspiration du sérum physiologique (NaCl 0,9% ; 200- 400μL/fois) à travers le ventricule droit jusqu’à ce que le liquide retiré devienne clair. Une fois détachés et enlevés d’autres structures médiastinales, les poumons ont été pesés et trempés dans la solution de para-formaldéhyde (4%) jusqu’à l’immersion totale (1 à 5 jours). Ils étaient conservés dans l’alcool 70% avant l’inclusion en paraffine. Les blocs paraffinés ont été coupés (5μm d’épaisseur) et les sections de tissus pulmonaires apposées sur les lames (SuperFrost Ultra Plus®, Braunschweig, Allemagne) pour les études morphométriques.
Méthodes
Les effets du NO inhalé sur le développement pulmonaire ont été évalués par l’étude de l’alvéolisation et de l’angiogénèse.
Étude de l’alvéolisation
L’alvéolisation est évaluée par l’étude morphométrique des poumons à l’aide de la coloration d’hématoxyline et éosine, suivie de la détermination du compte alvéolaire radial (RAC : Radial Alveolar Count) et de l’intercept linéaire moyen (MLI : Mean Linear Intercept).
Évaluation de l’angiogénèse
La maturation microvasculaire, indispensable au développement pulmonaire postnatal, est évaluée par la mesure de la densité capillaire après immunomarquage à l’aide des anticorps spécifiques de l’endothélium (CD31 et facteur Von Willebrand).
Technique d’immunohistochimie du CD31 et du facteur Von Willebrand (vWF) Déparaffiner les sections dans les trois bains du xylène, puis les réhydrater par des bains d’éthanol aux concentrations décroissantes (100%, 95%, 70% et 50%).
Bloquer l’activité de la peroxydase endogène, essentiellement celle des érythrocytes, par un bain de peroxyde d’hydrogène (0,3% dans le tampon saline de phosphate, PBS) pendant 30 minutes, et après le rinçage au PBS-Tween 20 (0.05%), les sections ont été entourée à l’aide d’un stylo ImmEdge (Vector Laboratories, Burlingame, USA). Démasquer les antigènes par la mise en place de protéase sur les sections et l’incubation pendant 30 minutes en température ambiante. Bloquer les sites de fixation non spécifique par l’incubation des tissus pendant 1 heure dans une solution de PBS-Tween 0.05%-BSA 4%. La solution PBS-Tween 0.05%-sérum de chèvre 10% a été utilisée dans l’immunomarquage de vWF. Incuber les coupes de tissu pulmonaire avec l’anticorps primaire (PECAM-1 (M-20), sc-1506-R, rabbit polyclonal IgG, Santa Cruz Biotechnology, dilution à 1:50 dans une solution PBS-Tween-BSA 2%, et vWF (Rabbit antihuman polyclonal) dans PBS avec la même dilution) pendant 1 heure en température ambiante. Un lavage dans le PBS a été fait en 3 fois de 5 minutes. Incuber les tissus pendant 45 minutes avec l’anticorps secondaire (Biotinylated antirabbit IgG, Vector, BA 1000), dilution 1:400 pour CD31, et 1:200 pour vWF.
Utiliser le système de révélation comprenant le complexe Avidin-Biotin (R.T.U. Vectastain Universal Elite ABC Kit, Vector Laboratories, Burlingham, CA, USA) à la peroxydase. Enfin, incuber les sections avec le substrat chromogène de l’enzyme peroxydase (DAB: diaminobenzidine tétrahydrochloride). Une fois que la coloration brune de vWF et la coloration rouge de CD31 étaient bien visualisées au microscope, la réaction enzymatique a été arrêtée par l’immersion dans l’eau distillée et les lames étaient soumises à une contre-coloration à l’hématoxyline et à la déshydratation dans des bains d’alcool à concentration croissante et de xylène avant le montage.
Le nombre des vaisseaux pulmonaires est déterminé par le comptage des microvaisseaux (20-100μm) exprimés en vWF. Pour mesurer l’expression du CD31, le ratio de tous les points sur les sites exprimés en CD31 aux points sur le parenchyme représente la densité vasculaire pulmonaire en utilisant une grille de 100 points disposées au hasard sur les images (x 200 magnification).
Analyse statistique
L’analyse statistique a été effectuée à l’aide du logiciel de SPSS version 16.0. Les données quantitatives ont été exprimées sous formes de moyenne ± écarttype. Les comparaisons statistiques ont été réalisées par le test-t Student. La valeur de p inférieure à 0,05 était considérée comme significative.
RÉSULTATS
Répartition des groupes de rats
Au total, les rats nouveau-nés ont été repartis en 16 groupes : 4 groupes de rats à J3 et 4 groupes de rats à J10 n’ont pas reçu le NO inhalé ; 4 groupes de rats P3 et 4 groupes de rats P10 ont inhalé du NO à 5 ppm. Chaque groupe comportait 5 rats, sélectionnés par hasard à partir de 2 ou 3 portées différentes.
Caractéristiques des rats étudiés
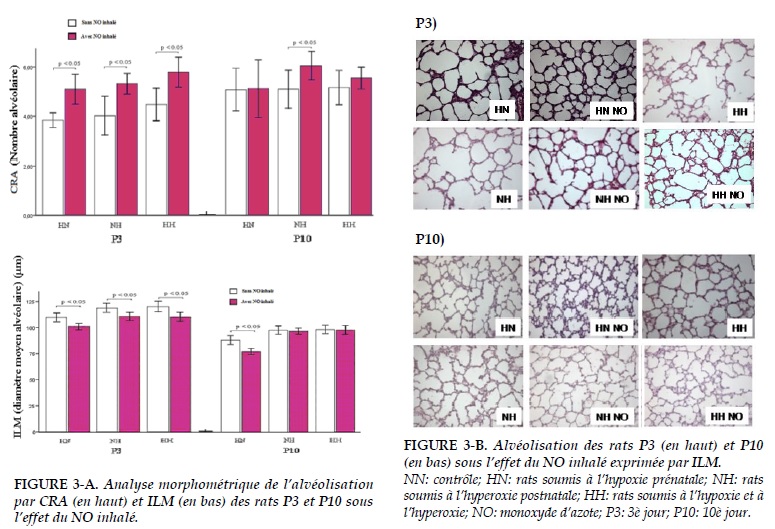
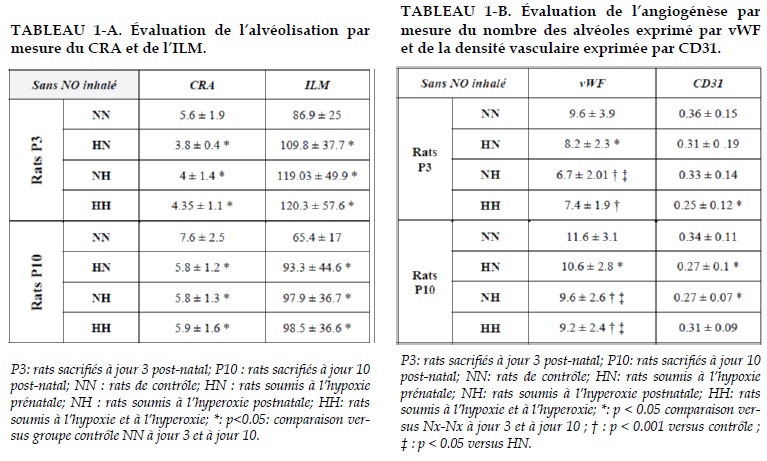
Évaluation de l’alvéolisation des groupes sans NO inhalé L’alvéolisation a été évaluée par deux paramètres classiques: le compte radial alvéolaire (CRA) et l’intercept linéaire moyen (ILM). L’alvéolisation est caractérisée par l’augmentation du nombre total d’alvéoles et par la diminution de leur taille, ce qui représente le CRA et l‘ILM, respectivement. On remarque une diminution significative du CRA et une augmentation effectivement du ILM chez les groupes des rats par rapport au groupe de contrôle (NN) de 3 jours et de 10 jours (Tableau 1, Figure 2). Ces résultats ont prouvé que les rats nouveau-nés dans ce modèle ont eu élargissement des alvéoles (augmentation de l’ILM) une diminution de leurs nombres (diminution du CRA).
Effet du NO inhalé sur l’alvéolisation
On constate que le nombre des alvéoles a été augmenté de façon significative entre les groupes des rats de 3 jours traités par NO inhalé et ceux des rats sans inhalation du NO. Il y a également une accélération du CRA du groupe des rats P10 soumis à l’hyperoxie post-natale traités par NO par rapport à celui sans NO.
Les autres groupes des rats P10 n’ont pas trouvé une différence significative après l’inhalation du NO (Figure 3).
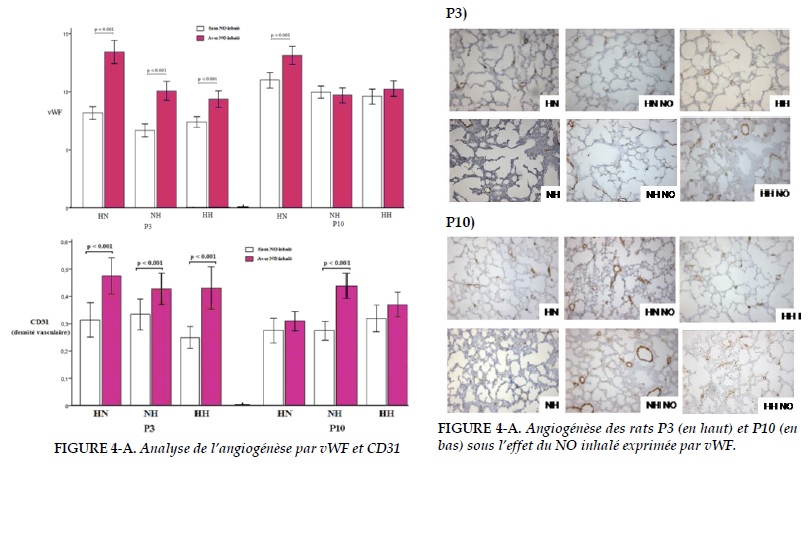
Effet du NO inhalé sur l’angiogénèse
On a trouvé une augmentation significative du nombre des vaisseaux exprimant le vWF et celle de la densité vasculaire des groupes de rats P3 traités par NO inhalé par rapport aux groupes sans NO inhalé.
Dans le groupe P10, le nombre des micro-vaisseaux des rats à l’hypoxie gestationnelle et la densité vasculaire sont significativement augmentées. On n’a pas trouvé de différence significative pour les autres groupes de P10 (Figure 4A-B).
DISCUSSION
Malgré l’utilisation depuis plusieurs décennies du NO exogène (NO inhalé) pour traiter les HTAP de l’adulte, de l’HTAPP-NN et de la DBP, l’effet du NO inhalé sur le développement pulmonaire reste peu connu. De nombreuses études expérimentales ont montré l’implication de la voie de signalisation du NO/VEGF dans la restauration d’une alvéolisation et d’une angiogénèse normales. Les études cliniques testant l’administration du NO inhalé en période post-natale immédiate n’ont pu démontrer l’efficacité clinique de cette stratégie thérapeutique. Après des observations de plusieurs études cliniques chez les enfants prématurés, il y a des résultats contradictoires sur les effets du NO inhalé qui dépend apparemment de la sévérité d’une malade et de l’administration du NO inhalé.
Selon Van Meurs, l’utilisation du NO inhalé à court terme (1 à 3 jours) ne peut pas être considérée comme un traitement effectif chez les prématurés ayant une insuffisance respiratoire sévère. Au contraire, le NO inhalé administré pendant quelques semaines en petite quantité de la dose peut améliorer le développement du système respiratoire (tels que les effets sur l’angiogénèse, la maturation du parenchyme pulmonaire et la prolifération du muscle lisse respiratoire) [5].
Cependant, les enfants plus légèrement malades peuvent bénéficier de ce traitement à court terme ou à long terme. De côté, Schreiber et ses collaborateurs ont trouvé la réduction de la mortalité et de l’incidence de la maladie pulmonaire chronique après le NO inhalé 10 ppm dans le premier jour et continué par 5 ppm dans 6 jours. Par ailleurs, dans l’étude de Kinsella, l’incidence de la mortalité et la DBP ne réduisaient que chez les prématurés ayant le poids corporel de 1 000–1 250g sous l’effet de NO inhalé 5 ppm à long terme (21 jours) [2].
L’utilisation du NO inhalé à haute dose pourrait provoquer une hémorragie intracrânienne ou une lésion ischémique cérébrale. En sachant que la production de produit toxique (tel que peroxynitrite) est formée de la combinaison du NO avec une haute concentration de l’oxygène, et le NO empêche l’activité des plaquettes.
L’intérêt de notre étude est de créer des lésions pulmonaires, combinant deux types d’agressions (hypoxie et hyperoxie) pouvant survenir en clinique, étudiées soit isolément, soit ensemble et d’observer les modifications de ces lésions sous l’effet du NO inhalé. Notre étude a montré que le NO inhalé à faible dose (5 ppm) a plus au moins un effet bénéfique sur le développement pulmonaire.
Nous avons trouvé que l’hypoxie anténatale prolongée et/ou l’hyperoxie post-natale entraînent des lésions pulmonaires chez les ratons nouveaunés. Ces lésions sont traduites par une altération de l’alvéolisation via une réduction du nombre des alvéoles (CRA) et un élargissement des alvéoles (ILM) et par une diminution de l’angiogénèse évaluée par deux paramètres: le nombre des microvaisseaux (vWF) et la densité vasculaire (CD31).
Au niveau de l’alvéolisation, le traitement par le NO inhalé a amélioré l’alvéolisation du groupe des rats P3. Ces résultats sont similaires à ceux d’une étude récente ayant estimé l’effet du NO inhalé (10ppm) dans deux semaines sur les lésions pulmonaires induites par l’hyperoxie néonatale 95% O2 [7]. Elle a confirmé que l’inhalation du NO après hyperoxie pourrait augmenter le CAR et réduire l’ILM. Une autre étude a montré que l’alvéolisation des rats dont le gène codant la NOSe est invalidé (NOSe-/-) et soumis à l’hypoxie post-natale (FiO2 16%) pendant 10 jours est améliorée par le NO inhalé à 10 ppm [21]. Pour le groupe de ratons ayant à la fois l’hypoxie prénatale et l’hyperoxie postnatale, ces lésions pulmonaires sont nettement moins importantes par rapport à celles des rats témoins, et elles sont même réversibles après l’inhalation du NO. Pourtant, nous constatons qu’il n’y a pas d’effet du NO inhalé chez les groupes de rats P10. Selon une étude réalisée sur les poumons des rats nouveau-nés dans la condition normoxique, le NO inhalé à la dose de 20 ppm a donné un effet bénéfique sur l’alvéolisation chez les rats de 7 jours par rapport au contrôle et aux rats de 7 jours ayant reçu le NO inhalé à 5 ppm. Cependant, il n’y a pas d’effet significatif du NO inhalé à la dose 5ppm ou 20 ppm chez les rats de 14 jours [27].
Quant à l’angiogénèse, le groupe des rats P3 a effectivement bénéficié de l’effet du NO inhalé objectivé par l’augmentation du nombre des microvaisseaux et l’amélioration de la densité vasculaire. Le développement pulmonaire des rats de 3 jours reste encore instable et il est facilement altéré par des agents agressifs. L’absence d’amélioration de l’angiogénèse des ratons nouveau-nés de 10 jours est probablement due au temps d’exposition très long aux agents oxydatifs. De l’autre côté, une étude a été réalisée chez les rats exposés à l’hyperoxie (FiO2 > 95%) pendant 6 jours, et le traitement du NO inhalé à faible dose (10 ppm) et à long terme (2 semaines) durant la période de formation de l’architecture pulmonaire augmentait la volume de densité vasculaire par rapport au contrôle et au groupe sans NO inhalé [7]. D’ailleurs, l’effet du NO exogène pendant 10 jours était également remarquable sur l’angiogénèse chez les rats en hypoxie post-natale (16% O2) [21].
CONCLUSION
Les facteurs agressifs tels que l’hypoxie et l’hyperoxie ont des conséquences néfastes sur le développement alvéolaire et vasculaire pulmonaire.
Ces lésions ont été corrigées et améliorées par le traitement du NO inhalé. Notre etude montre que le NO exogène a un effet bénéfique sur le développement pulmonaire, il accélère et corrige l’alvéolisation et l’angiogénèse dans le modèle animal.
Remerciement
Les auteurs remercient tous les Collaborateurs de l’INSERM Unité 676, Hôpital Robert-Debré et l’UPRES2511, Faculté de Médecine Paris Descartes ainsi le Pr. A.T. Dinh-Xuan pour sa direction dans la réalisation de cette étude.
CONFLIT D’INTERÊTS
Aucun
REFERENCES
1. Davidson D, Barefield ES, et al. Inhaled nitric oxide for the early treatment of persistent pulmonary hypertension of the term newborn: a randomized, doublemasked, placebocontrolled, dose-response, multicenter study. The I-NO/PPHN Study Group. Pediatrics. 1998;101:325-34.
2. Kinsella JP, Cutter GR, et al. Early inhaled nitric oxide therapy in premature newborns with respiratory failure. N Engl J Med. 2006;355(4):354-64.
3. Martin RJ, Walsh MC. Inhaled nitric oxide for preterm infants: who benefits? N Engl J Med. 2005;353(1):82-4.
4. Schreiber MD, Gin-Mestan K, et al. Inhaled nitric oxide in premature infants with the respiratory distress syndrome. N Engl J Med. 2003;349(22):2099-107.
5. Van Meurs KP, Wright LL, et al. Inhaled nitric oxide for premature infants with severe respiratory failure. N Engl J Med. 2005;353(1):13-22.
6. Bhatt AJ, Pryhuber GS, et al. Disrupted pulmonary vasculature and decreased vascular endothelial growth factor, Flt-1, and TIE-2 in human infants dying with bronchopulmonary dysplasia. Am J Respir Crit Care Med. 2001;164(10 Pt 1):1971-80.
7. Lin YJ, Markham NE, et al. Inhaled nitric oxide enhances distal lung growth after exposure to hyperoxia in neonatal rats. Pediatr Res. 2005;58(1):22-9.
8. Sternmark KR, Abman SH. Lung vascular development: implications for the pathogenesis of bronchopulmonary dysplasia. Annu. Rev. Physiol. 2005. 67:623–61
9. Coalson JJ. Pathology of bronchopulmonary dysplasia. Semin Perinatol 2006; 30: 179-84.
10. Thébaud B. Bronchopulmonary dysplasia. Where have all the vessels gone? Roles of angiogenic growth factors in chronic lung disease. Am J Respir Crit Care Med 2007; 175: 978-85 10.
11. Engle WA. American academy of pediatrics committee on fetus and newborn. Surfactantreplacement therapy for respiratory distress in the preterm and term neonate. Pediatrics 2008; 121: 419-32.
12. Lévy M, Maurey C, Dinh-Xuan AT, et al. Developmental expression of vasoactive and growth factors in human lung. Role in pulmonary vascular resistance adaptation at birth.Pediatr Res 2005; 57(5 Pt 2): 21R-25R.
13. Dakshinamurti S. State of the Art: Pathophysiologic Mechanisms of persistent pulmonary hypertension of the newborn. Pediatr Pulmonol 2005; 39: 492-503.
14. Dao P, Montani D, Duong-Quy S, Dinh-Xuan AT. Cellular signalling pathways and pathophysiology of pulmonary arterial hypertension. Rev Mal Respir 2006; 23 (1 Suppl): 3S75-83.
15. M, Le Cras TD, Gebb S, et al. Inhibition of angiogenesis decreases alveolarization in the developing rat lung. Am J Physiol 2000; 279:L600-L607.
16. Tang JR, Markham NE, et al. Inhaled nitric oxide attenuates pulmonary hypertension and improves lung growth in infant rats after neonatal treatment with a VEGF receptor inhibitor. Am J Physiol Lung Cell Mol Physiol. 2004 Apr;287:344-51.
17. Barrington KJ, Finer NN. Inhaled ntric oxide for respiratory failure in preterm infants. Cochrane Database Syst Rev. 2007; 3:CD000509.
18. Pepke-Zaba J, Higenbottam TW, Dinh-Xuan AT, et al. Inhaled nitric oxide as a cause of selective pulmonary vasodilatation in pulmonary hypertension. Lancet 1991; 9; 338(8776): 1173-4.
19. Emery JL, Mithal A. The number of alveoli in the terminal respiratory unit of man during late intrauterine life and childhood. Arch Dis Child. 1960 Dec;35:544-7.
20. Dunnill MS. Quantitative methods in the study of pulmonary pathology. Thorax 1962;17:320-8.
21. Balasubramaniam V, Maxey AM, et al. Inhaled NO restores lung structure in eNOS-deficient mice recovering from neonatal hypoxia. Am J Physiol Lung Cell Mol Physiol 2006; 291: L119–L127.
22. Gebb SA, Shannon JM. Tissue interactions mediate early events in pulmonary vasculogenesis. Dev Dyn. 2000 Feb;217(2):159-69.
23. Kheradmand F, Rishi K, and Werb Z. Signaling through the EGF receptor controls lung morphogenesis in part by regulating MT1-MMP-mediated activation of gelatinase A/MMP2. J Cell Sci 115: 839-48, 2002.
24. Bourbon J, Boucherat O, and Delacourt C. Control mechanisms of lung alveolar development and their disorders in bronchopulmonary dysplasia. Pediatr Res 2005; 57: 38-46.
25. Buckley S, and Warburton D. Dynamics of metalloproteinase-2 and –9, TGF-beta, and uPA activities during normoxic vs. hyperoxic alveolarization. Am J Physiol Lung Cell Mol Physiol 283: 747-54, 2002.
26. Dik WA, De Krijger RR, Bonekamp L, Naber BA et al. Localization and potential role of matrix metalloproteinase-1 and tissu inhibitors of metalloproteinase-1 and –2 in different phases of bronchopulmonary dysplasia. Pediatr Res 50: 761-66, 2001.
27. Duong-Quy S, Hua-Huy T, Tang X, Pham Thi H, Baud O, Dinh-Xuan AT. Effects of inhaled nitric oxide on normal rat lung development. Biology, Chemistry and Therapeutic Applications of Nitric Oxide. 2008; 19 (1 Suppl): 34.
FIGURES/TABLE

REFERENCES
1. Davidson D, Barefield ES, et al. Inhaled nitric oxide for the early treatment of persistent pulmonary hypertension of the term newborn: a randomized, doublemasked, placebocontrolled, dose-response, multicenter study. The I-NO/PPHN Study Group. Pediatrics. 1998;101:325-34.
2. Kinsella JP, Cutter GR, et al. Early inhaled nitric oxide therapy in premature newborns with respiratory failure. N Engl J Med. 2006;355(4):354-64.
3. Martin RJ, Walsh MC. Inhaled nitric oxide for preterm infants: who benefits? N Engl J Med. 2005;353(1):82-4.
4. Schreiber MD, Gin-Mestan K, et al. Inhaled nitric oxide in premature infants with the respiratory distress syndrome. N Engl J Med. 2003;349(22):2099-107.
5. Van Meurs KP, Wright LL, et al. Inhaled nitric oxide for premature infants with severe respiratory failure. N Engl J Med. 2005;353(1):13-22.
6. Bhatt AJ, Pryhuber GS, et al. Disrupted pulmonary vasculature and decreased vascular endothelial growth factor, Flt-1, and TIE-2 in human infants dying with bronchopulmonary dysplasia. Am J Respir Crit Care Med. 2001;164(10 Pt 1):1971-80.
7. Lin YJ, Markham NE, et al. Inhaled nitric oxide enhances distal lung growth after exposure to hyperoxia in neonatal rats. Pediatr Res. 2005;58(1):22-9.
8. Sternmark KR, Abman SH. Lung vascular development: implications for the pathogenesis of bronchopulmonary dysplasia. Annu. Rev. Physiol. 2005. 67:623–61
9. Coalson JJ. Pathology of bronchopulmonary dysplasia. Semin Perinatol 2006; 30: 179-84.
10. Thébaud B. Bronchopulmonary dysplasia. Where have all the vessels gone? Roles of angiogenic growth factors in chronic lung disease. Am J Respir Crit Care Med 2007; 175: 978-85 10.
11. Engle WA. American academy of pediatrics committee on fetus and newborn. Surfactantreplacement therapy for respiratory distress in the preterm and term neonate. Pediatrics 2008; 121: 419-32.
12. Lévy M, Maurey C, Dinh-Xuan AT, et al. Developmental expression of vasoactive and growth factors in human lung. Role in pulmonary vascular resistance adaptation at birth.Pediatr Res 2005; 57(5 Pt 2): 21R-25R.
13. Dakshinamurti S. State of the Art: Pathophysiologic Mechanisms of persistent pulmonary hypertension of the newborn. Pediatr Pulmonol 2005; 39: 492-503.
14. Dao P, Montani D, Duong-Quy S, Dinh-Xuan AT. Cellular signalling pathways and pathophysiology of pulmonary arterial hypertension. Rev Mal Respir 2006; 23 (1 Suppl): 3S75-83.
15. M, Le Cras TD, Gebb S, et al. Inhibition of angiogenesis decreases alveolarization in the developing rat lung. Am J Physiol 2000; 279:L600-L607.
16. Tang JR, Markham NE, et al. Inhaled nitric oxide attenuates pulmonary hypertension and improves lung growth in infant rats after neonatal treatment with a VEGF receptor inhibitor. Am J Physiol Lung Cell Mol Physiol. 2004 Apr;287:344-51.
17. Barrington KJ, Finer NN. Inhaled ntric oxide for respiratory failure in preterm infants. Cochrane Database Syst Rev. 2007; 3:CD000509.
18. Pepke-Zaba J, Higenbottam TW, Dinh-Xuan AT, et al. Inhaled nitric oxide as a cause of selective pulmonary vasodilatation in pulmonary hypertension. Lancet 1991; 9; 338(8776): 1173-4.
19. Emery JL, Mithal A. The number of alveoli in the terminal respiratory unit of man during late intrauterine life and childhood. Arch Dis Child. 1960 Dec;35:544-7.
20. Dunnill MS. Quantitative methods in the study of pulmonary pathology. Thorax 1962;17:320-8.
21. Balasubramaniam V, Maxey AM, et al. Inhaled NO restores lung structure in eNOS-deficient mice recovering from neonatal hypoxia. Am J Physiol Lung Cell Mol Physiol 2006; 291: L119–L127.
22. Gebb SA, Shannon JM. Tissue interactions mediate early events in pulmonary vasculogenesis. Dev Dyn. 2000 Feb;217(2):159-69.
23. Kheradmand F, Rishi K, and Werb Z. Signaling through the EGF receptor controls lung morphogenesis in part by regulating MT1-MMP-mediated activation of gelatinase A/MMP2. J Cell Sci 115: 839-48, 2002.
24. Bourbon J, Boucherat O, and Delacourt C. Control mechanisms of lung alveolar development and their disorders in bronchopulmonary dysplasia. Pediatr Res 2005; 57: 38-46.
25. Buckley S, and Warburton D. Dynamics of metalloproteinase-2 and –9, TGF-beta, and uPA activities during normoxic vs. hyperoxic alveolarization. Am J Physiol Lung Cell Mol Physiol 283: 747-54, 2002.
26. Dik WA, De Krijger RR, Bonekamp L, Naber BA et al. Localization and potential role of matrix metalloproteinase-1 and tissu inhibitors of metalloproteinase-1 and –2 in different phases of bronchopulmonary dysplasia. Pediatr Res 50: 761-66, 2001.
27. Duong-Quy S, Hua-Huy T, Tang X, Pham Thi H, Baud O, Dinh-Xuan AT. Effects of inhaled nitric oxide on normal rat lung development. Biology, Chemistry and Therapeutic Applications of Nitric Oxide. 2008; 19 (1 Suppl): 34.
ARTICLE INFO
DOI: 10.12699/jfvp.4.10.2013.43
Conflict of Interest
Non
Date of manuscript receiving
21/10/2012
Date of publication after correction
16/01/2013
Article citation
Nguyen Thi Lien P, Duong-Quy S. Effect of inhaled NO in lung development of pup rats exposed to hypoxia and hyperoxia in pre– and post natal periods. J Func Vent Pulm 2013;04(10):43-50.