
 English
English
 French
French
Etude de la voie de RhoA/Rho-kinase dans la vascularisation pulmonaire d’un modèle murin de sclérodermie systémique
Study of RhoA/Rho-kinase signaling pathway in pulmonary vascularisation in systemic sclerosis
S. Rivière1,2, S. Duong-Quy1,3
1: Université Paris Descartes. Faculté de Médecine Port Royal. UPRES 2511, Paris - France
2: Service de Médecine Interne. Hôpital Saint Antoine, Paris - France
3: Collège de Médecine de Lam Dong. 6B Ngo Quyen, Dalat - Vietnam
Corresponding author
Dr. DUONG-QUY Sy
Collège de Médecine de Lam Dong - Dalat, Vietnam
Service de Physiologie - Explorations Fonctionnelles. Hôpital Cochin
E-mail: sy.duong-quy@cch.aphp.fr
ABSTRACT
Introduction. Pulmonary hypertension (PH) is a serious complication of systemic sclerosis (SSc), whose pathophysiology is poorly understood. A recently described mouse model, based on the induction of oxidative sress, achieves near-human form of the disease characteristics.
Objectives. We studied in this model signaling pathways of nitric oxide (NO) and RhoA/Rho-kinase, whose involvement in the HTP is demonstrated.
Methods. The techniques of Western blot (WB) and immunohistochemistry (IHC) were used to analyze the expression and activity of RhoA/Rho kinase pathway via ROCK 1 and 2. The phosphorylated form of MYPT1 reflects ROCKs activity.
Results. At 8 weeks, IHC showed significant overexpression of ROCK-1 in HOCl group (p=0.02). There is no significant difference ROCK 2 (p =0.48). WB found the expression of ROCK-1 and 2 in lung tissue at 6 weeks was higher in the bleomycin group than in the other 2 groups (p=0.07 and 0.08, respectively). After eight weeks, there is a tendency to overexpression of ROCK 1 and 2 in HOCl and bleomycin groups (p=0.131 and 0.364, respectively). For p-MYPT1: there is no significant difference at 6 weeks (p=0.6). At 8 weeks, the expression of p-MYPT1 was significantly higher in HOCl and bleomycin groups than in the control group (p=0.03).
Conclusion. The results of this preliminary work carried out on small numbers suggest that this model is useful for the study of PH in SSc.
KEYWORDS: Pulmonary hypertension, nitric oxide, RhoA/Rho-kinase, ROCK 1, ROCK 2, HOCl, bleomycin
RÉSUMÉ
Introduction. L'hypertension pulmonaire (HTP) est une complication grave de la sclérodermie systémique (ScS), dont la physiopathologie est mal connue. Un modèle murin récemment décrit, basé sur l'induction d'un sress oxydatif, permet d'obtenir des caractéristiques proches de la forme humaine de la maladie.
Objectifs. Nous avons étudié dans ce modèle les voies de signalisation du monoxyde d'azote (NO) et RhoA/Rho-kinases, dont l'implication dans l'HTP est démontrée.
Méthodes. Les techniques de western-blot (WB) et d’immunohistochimie (IHC) ont été utilisées pour analyser l’expression et l’activité de la voie RhoA/Rho-kinases: ROCK 1 et 2. La forme phosphorylée de MYPT1 reflet de la'activité des ROCKs.
Résultats. A 8 semaines, IHC montre une surexpression significative de ROCK-1 dans le groupe HOCl (p=0,02). Il n’existe pas de différence significative pour ROCK 2 (p = 0,48 ). WB retrouve l’expression de ROCK-1 et 2 dans le tissu pulmonaire à 6 semaines est plus élevée dans le groupe bléomycine que dans les 2 autres groupes (p=0,07 et 0,08). Au terme de 8 semaines, il existe une tendance à la surexpression de ROCK 1 et 2 dans les groupes HOCl et bléomycine (p=0,131 et 0,364). Pour p-MYPT1: il n’existe pas de différence significative à 6 semaines (p = 0,6). A 8 semaines, l’expression de p-MYPT1 est significativement plus élevée dans les groupes HOCl et bléomycine que dans le groupe témoin (p= 0,03).
Conclusion. Les résultats de ce travail préliminaire mené sur de petits effectifs suggèrent que ce modèle est utile pour l'étude de l'HTP dans la ScS.
MOTS CLES: Hypertension pulmonaire, monoxyde d’azote, RhoA/Rho-kinases, ROCK 1, ROCK 2, HOCl, bléomycine
INTRODUCTION
L’hypertension pulmonaire (HTP) est une complication grave de la sclérodermie systémique (ScS), qui représente aujourd’hui la principale cause de décès dans cette maladie. Les traitements récents n’apportent qu’un bénéfice limité. La physiopathologie est complexe. Elle associe un excès de vasoconstriction, qui est la cible des thérapeutiques actuelles, une prolifération anormale des cellules de la paroi vasculaire et des phénomènes inflammatoires.
Cependant, tous les mécanismes moléculaires en jeu ne sont pas élucidés à ce jour. De nombreuses études menées sur différents modèles animaux d’HTP ont suggéré les rôles majeurs de la voie de signalisation du monoxyde d’azote (NO) et plus récemment de la voie RhoA / Rho-kinases.Un modèle murin de sclérodermie systémique a été récemment décrit [1], qui produit un phénotype plus proche de la ScS observée chez l’homme que les modèles antérieurs.
Ce travail a pour but d’étudier les voies de signalisation RhoA / Rho-kinases dans la vascularisation pulmonaire de ce modèle murin.
OBJECTIFS
Ce travail a pour but d’étudier les modifications d’expression des voie de signalisation du NO et RhoA/Rho-kinases, qui sont impliquées dans la physiopathologie des HTP, dans un modèle murin de sclérodermie systémique. Les protéines suivantes ont été étudiées: ROCKs 1 et 2 (effecteurs de RhoA) et p-MYTPT 1 (forme phosphorylée de cette cible des ROCKs) comme marqueurs de la voie RhoA/ ROCK.
MATERIELS ET METHODES
Préparation des animaux
Les souris sauvages (lignée C57BL/6) âgées de 6 semaines ont été achetées à la compagnie Harlan (Gannat, Biotechnologies France). Il s’agissait de femelles, compte tenu de la forte prédominance féminine de la ScS humaine. Elles ont reçus les soins selon les recommandations de notre institution.
Nous avons reproduit le modèle de souris sclérodermiques en injectant par voie sous-cutanée de l’acide hypochloreux (HOCl), qui induit un stress oxydatif systémique. Les animaux ont été répartis de manière aléatoire en 3 groupes.
Groupe HOCl Injection quotidienne souscutanées de 100 µl de solution d’HOCl dans le bas du dos rasé. L’HOCl a été produit en ajoutant 166 μl de solution de NaClO à 11,1 ml de solution de KH2PO4. La concentration en HOCl a été contrôlée par spectrophotométrie à 292 nm (coefficient d’absorption molaire: 350 M-1cm-1).
Groupe bléomycine
Injection de 100µl de bléomycine (concentration de 100 μg/ml) selon les mêmes modalités, ce groupe représentant le témoin positif.
Groupe témoin
Injection quotidienne sous-cutanée de 100 µl de PBS (soluté vecteur utilisé pour la préparation des principes actifs des 2 autres groupes).
La durée des injections sous-cutanées étaient de 6 semaines dans les 3 groupes. Une partie des animaux ont été sacrifiés dès la fin des injections (6 semaines) et l’autre partie après 2 semaines de repos (8 semaines). Un poumon était inclus dans la paraffine pour les analyses histologiques et l’autre était utilisé pour les analyses moléculaires.
Ces animaux ont été utilisés lors de précédentes études menées au laboratoire. Pour rationnaliser l’usage de l’expérimentation animale, nous avons utilisés les matériels encore disponibles pour cette étude complémentaire, ce qui explique les effectifs limités.
Immunohistochimie
Technique
Des coupes de 5 µm d’épaisseur ont été réalisées à partir des blocs de paraffine dans lesquels les poumons des souris avaient été inclus. Après déparaffinage dans des bains de xylène puis réhydratation dans des bains décroissants d’éthanol, l’activité des peroxydases endogènes a été bloquée par l’immersion des lames dans une solution de méthanol avec de l’eau oxygénée (H2O2) à 0,3% pendant 30 minutes.
Afin de démasquer les sites antigéniques, les tissus ont été incubés pendant 30 minutes avec une solution de protéase de Streptomyces griseus (P6911, Sigma-Aldrich®). Le blocage des sites non spécifiques a été réalisé par incubation au contact d’une solution de BSA à 2% pendant 1 heure pour les ROCKs et P-MYPT 1, et 2 heures pour la PDE-5, à température ambiante.
Les coupes de tissus ont ensuite été incubées avec les anticorps spécifiques (dilués dans une solution de PBS –Tween 20 à 0,05%) dans les conditions suivantes: pour ROCK-1 à une dilution de 1/75 sur toute une nuit à 4°C ; pour ROCK-2 à une dilution de 1/100 sur toute une nuit à 4°C ; pour P-MYPT1 à une dilution de 1/50 sur toute une nuit à 4°C. Après rinçage, l’incubation avec les anticorps secondaires a été réalisée à température ambiante pendant 1 heure aux dilutions suivantes: 1/100 pour ROCK-1 et ROCK-2, et 1/200 pour P-MYPT1.
La révélation, basée sur un système enzymatique (peroxydase de raifort), comprenait 2 étapes: incubation de 30 minutes avec un complexe biotine - avidine – peroxydase de raifort (RTU ACB Elite, Vector Laboratories), puis l’ajout de DAB, substrat oxydé par la peroxydase, permettait d’obtenir un signal brun visible en microscopie optique (Leica® DM LB).
Enfin, après une contre-coloration à l’hématoxyline, les lames étaient traitées par un milieu de montage permanent. Pour chaque groupe des lames témoins négatifs ont été réalisées, selon le même protocole à l’exception de l’absence d’anticorps spécifiques, les tissus ayant alors été incubés avec le soluté de dilution (PBS – Tween 20 0,05%).
Acquisition des images et analyse semi-quantitative
Les vaisseaux visibles dans les tissus étudiés ont été photographiés à l’aide d’un appareil photo numérique (Leica® DC 300) adapté au microscope. L’intensité du signal au niveau des vaisseaux a été évaluée selon une méthode semi-quantitative, cotant le signal brun selon l’échelle suivante: absent = 0, faible= 2, moyen = 4, fort = 6. En cas de discontinuité du signal sur une partie de la paroi vasculaire, retrait d’un point.
Les clichés (préalablement anonymisés par un autre intervenant) ont été interprétés en aveugle par 2 lecteurs. Si la différence entre leurs évaluations était supérieure à 1 point, le cliché était rediscuté par les 2 lecteurs pour établir la cotation définitive.
Western Blot
Préparation des échantillons protéiques
Les fragments de poumons ont été immergés dans un tampon de lyse de type RIPA puis broyés. Après centrifugation, la concentration en protéines du surnageant a été mesurée en spectrophotométrie par une méthode à l’acide bicinchonique (Bicinchonic Acid Protein Assay Kit, Santa Cruz® Biotechnology). Des échantillons des surnageants ont ensuite été dénaturés à 96°c pendant 10 minutes en présence de tampon de Laemmli et d’antiprotéase.
Electrophorèse et transfert sur membrane
Les protéines ont été séparées par une électrophorèse à 200 volts pendant 45 minutes sur gel de polyacrylamide – sodium dodécylsulfate (SDS-PAGE) à 7,5% pour ROCK-1, ROCK-2 et P-MYPT1. La progression des protéines pendant la migration était suivie grâce à un marqueur standard (Precision plus Protein Dual Color, Bio-rad®).
Les transferts des protéines sur membrane de nitrocellulose ont été réalisés en milieu humide, en 2 heures et à 60 volts. La partie des membranes qui contenait la β-actine, protéine de structure (poids moléculaire de 42 kDa) qui constituait notre contrôle interne, a été séparée de la partie de membrane contenant la protéine d’intérêt.
Incubation avec les anticorps
Après blocage des sites non spécifiques dans une solution de PBS, Tween 20 à 0,1% et lait à 5% pendant 1 heure, les membranes ont été incubées au contact des anticorps spécifiques (anticorps primaire) pendant 12 heures dans une pièce maintenue à 4°C. Les parties de membrane comprenant la β-actine ont été incubées en présence d’un anticorps dirigé contre cette protéine, pendant 2 heures. Toutes les membranes ont ensuite été incubées en présence d’un anticorps secondaire dirigé contre les immunoglobulines correspondant à l’anticorps primaire pendant 45 minutes. Ces anticorps secondaires étaient couplés à la peroxydase de raifort (horseradish peroxydase, HRP). Les concentrations et durées d’incubation sont:
- ROCK 1: anticorps primaires: 1/500, 12 heures, 4° C ; anticorps secondaires: 1/40000, 45 minutes.
- ROCK 2: anticorps primaires: 1/500, 12 heures à 4° C ; anticorps secondaires: 1/30000, 45 minutes.
- p-MYPT: anticorps primaires: 1/1000, 12 heures à 4°C ; anticorps secondaires: 1/20000, 45 minutes.
- β-actine: anticorps primaires: 1/30000, 2 heures ; anticorps secondaires: 1/30000, 45 minutes.
Révélation
Le système de détection était basé sur un substrat contenant de l’acridan, converti en ester d’acridinium en présence de l’HRP (ECL kit plus, GE Healthcare®). Après incubation des membranes en présence du soluté de révélation pendant 3 minutes, la chimiluminescence était détectée par exposition à des films photographiques.
Analyse semi-quantitative
Les films ont été numérisés puis les images ont été analysées à l’aide du logiciel ImageJ (NIH image). La densité des bandes correspondantes aux protéines d’intérêt ont été rapportées à la densité de la bande de β-actine pour chaque échantillon.
Analyses statistiques
Devant les effectifs restreints, les comparaisons entre les 3 groupes ont réalisées par le test nonparamétrique de Kruskal-Wallis (logiciel SPSS, IBM). Les valeurs du degré de significativité (p) données dans la section résultats correspondent au résultat de ce test. Aucun test statistique n’était réalisé si l’effectif d’au moins un groupe était inférieur à 3.
RESULTATS
Immunohistochimie
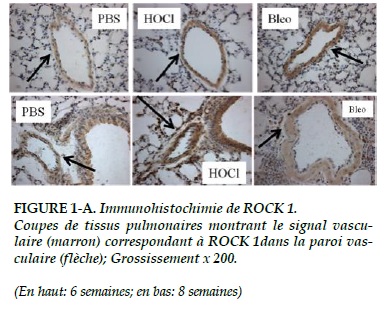
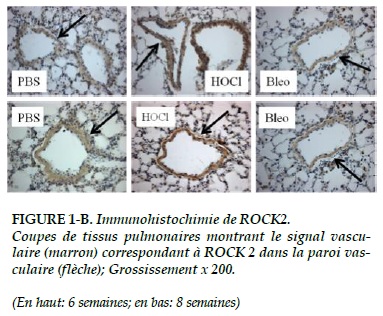
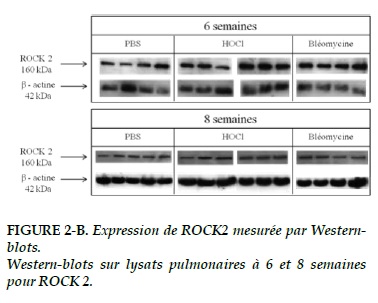
L’intensité du signal des ROCK-1 et 2 dans les vaisseaux pulmonaires (Figures 1-A, 1-B) semble plus intense dans le groupe HOCl au terme de 6 semaines.
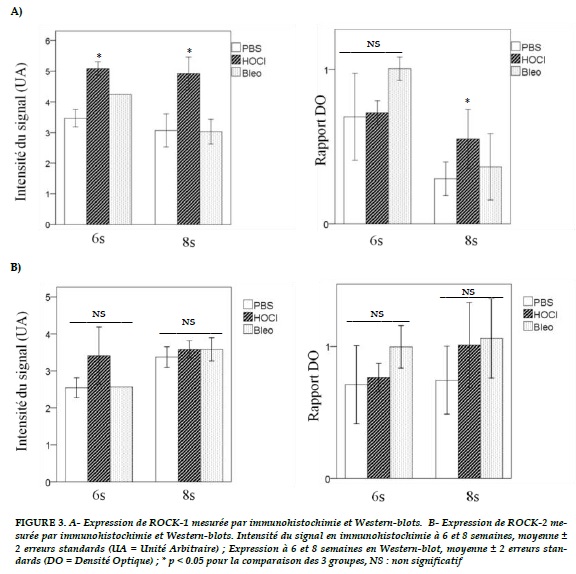
A huit semaines, on retrouve une surexpression significative de ROCK-1 dans le groupe HOCl (p = 0,02 ; Figure 3-A).
Alors qu’il n’existe pas de différence significative pour ROCK 2 (p = 0,48 ; Figure 3-B).
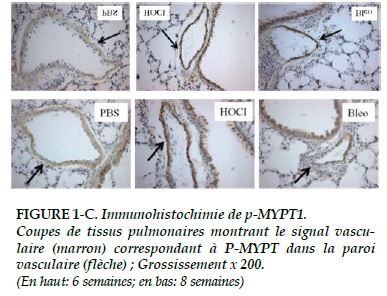
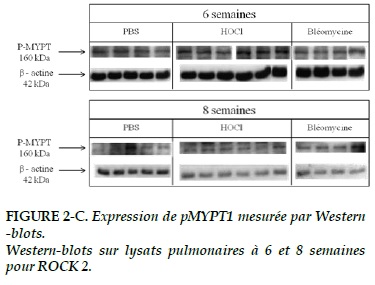
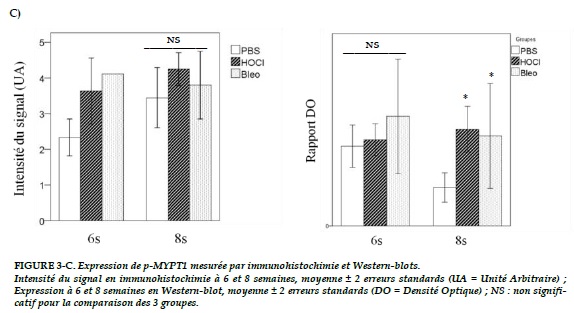
Le signal de p-MYPT1 (Figures 1-C) parait plus intense dans les groupes HOCl et bléomycine par rapport au groupe témoin à 6 et 8 semaines, sans atteindre la significativité (p = 0,326 pour la comparaison des 3 groupes à 8 semaines ; Figure 3-C).
Western-blot
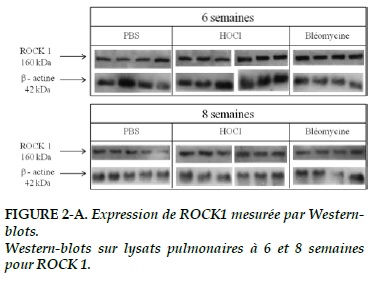
L’expression de ROCK-1 et 2 (Figure 2-A, 2–B) dans le tissu pulmonaire à 6 semaines est plus élevée dans le groupe bléomycine que dans les 2 autres groupes, sans atteindre la significativité statistique (p = 0,07 et 0,08 respectivement).
Au terme de 8 semaines, il existe une tendance à la surexpression de ROCK 1 et 2 dans les groupes HOCl et bléomycine (p = 0,131 et 0,364 respectivement ; Figure 2-A, 2–B).
Concernant p-MYPT1, il n’existe pas de différence significative à 6 semaines (p = 0,6), même si l’expression parait supérieure dans le groupe bléomycine que dans les 2 autres (Figure 3-C). A 8 semaines, l’expression de p-MYPT1 est significativement plus élevée dans les groupes HOCl et bléomycine que dans le groupe témoin (p = 0,03 ; Figure 3-C).
DISCUSSION
Ce travail permet d’appréhender les anomalies de voie de signalisation impliquées dans la physiopathologie des HTP, dans un modèle murin de ScS récemment décrit.
Nos résultats sont en faveur d’une activation exagérée de la voie RhoA/Rho-kinases. Tout d’abord l’expression de ROCK-1 et 2, qui sont les 2 effecteurs les mieux caractérisés de RhoA, est augmentée. De plus, la forme phosphorylée de MYPT1, cible des ROCKs, est surexprimée ce qui conforte l’hypothèse d’une activité accrue de ces protéines kinases. Ces anomalies existent également dans le groupe bléomycine, mais avec une cinétique différente. En effet, l’activité accrue de cette voie de signalisation est apparente dans ce groupe dès 6 semaines d’injection et semble moins marquée après les 2 semaines de repos (groupe 8 semaines), principalement pour ROCK 1.
Il est montré que l’administration systémique de bléomycine induit des lésions pulmonaires précoces (dès 4 semaines), notamment au niveau de l’endothélium [2]. Plusieurs auteurs [3, 4] ayant utilisé la bléomycine en administration unique (voie intratrachéale) ont rapporté que les lésions régressent à distance de l’injection, ce qui pourrait expliquer la régression partielle des anomalies constatée ici après les 2 semaines sans injection. A l’inverse, dans le groupe HOCl, les anomalies sont plus marquées dans le groupe 8 semaines. L’administration d’HOCl induit un stress oxydatif systémique, responsable de désordres inflammatoires et immunologiques [1] dont le degré de réversibilité est plus difficile à déterminer. Chez l’homme, le stress oxydatif et les mécanismes inflammatoires sont très marqués à la phase initiale de la maladie. Les lésions observées dans la ScS (fibrose, atteintes vasculaires) sont peu réversibles, alors que les phénomènes inflammatoires initiaux sont moins actifs dans les phases tardives [5] de la maladie.
Cependant les travaux de plusieurs équipes l’ont investiguée dans d’autres modèles. Sauzeau et al [6] ont montré que la protéine kinase G phosphoryle RhoA, empêchant sa translocation à la membrane et donc son activation. De plus, le sildenafil, un inhibiteur de la PDE-5, diminue l’activité de la voie RhoA/ ROCK dans les modèles d’HTP induite par l’hypoxie chronique [7] et la bléomycine [8]. Le NO semble donc avoir une activité inhibitrice sur la voie RhoA / ROCK, via le GMPc et la PKG.
Par ailleurs, dans un modèle utilisant des cellules endothéliales humaines exposées à l’hypoxie, Takemoto et al [9] ont montré que les ROCKs diminuent l’expression et l’activité de la NOSe.
Muzaffar et al [10] ont montré sur des cellules musculaires lisses vasculaires humaines que la surexpression de la PDE 5 induite par l’anion superoxyde est limitée par les inhibiteurs de ROCK. Les interactions entre ces 2 voies de signalisation sont donc complexes. Les facteurs qui les provoquent ne sont pas identifiés à ce jour.
La principale limite de ce travail est la taille réduite des effectifs, qui a limité l’utilisation et la puissance des analyses statistiques. Nous avons choisi de travailler sur des tissus d’animaux utilisés pour de précédentes études, d’une part pour limiter le recours à l’expérimentation animale et d’autre part pour guider les futurs travaux du laboratoire. Au plan méthodologique, nous avons choisi d’associer 2 techniques pour l’étude des protéines d’intérêt. Le WB a permis une évaluation semi-quantitative de leur expression. L’IHC permettait de localiser au niveau des structures vasculaires le signal correspondant à ces protéines, que nous avons également quantifié. Cette analyse quantitative du signal en IHC par une échelle de notation est sujette à la subjectivité, ce que nous pensons avoir limité par l’analyse en aveugle effectuée par 2 intervenants. Il n’y a pas une concordance complète entre les résultats ce cette analyse et ceux du WB, ce qui peut être dû aux effectifs plus restreints pour l’IHC.
Enfin, si nous apportons des éléments en faveur de la présence des 2 facteurs impliqués dans la physiopathologie de l’HTP dans ce modèle murin de ScS induite par le stress oxydatif, l’existence réelle d’une HTP, définie par l’élévation de la PAP moyenne, n’a pas été documentée par de réelles mesures hémodynamiques. Cela fera l’objet de futurs travaux dans le laboratoire, où seront mesurées les pressions vasculaires pulmonaires par cathétérisme.
CONCLUSION
Nous mettons en évidence des anomalies des voies de signalisations RhoA / Rho-kinases et du NO dans le modèle murin de ScS induite par le stress oxydatif, qui sont semblables à celles retrouvées dans différents modèle d’HTP. Ce modèle pourra donc être utile pour l’étude de l’HTP liée à la ScS. Ce travail préliminaire permet d’envisager de futures études. D’une part des études hémodynamiques seront nécessaires pour documenter l’HTP et sa sévérité dans ce modèle. D’autre part des études d’interventions thérapeutiques utilisant les inhibiteurs des ROCK et de la PDE 5, ainsi que leur association, permettront d’évaluer leur efficacité sur les différents aspects de la pathologie comme la vasoconstriction, la prolifération cellulaire ou l’infiltration inflammatoire.
Remerciements
Les auteurs remercient le Dr T. Hua-Huy et le Pr. AT. Dinh-Xuan pour leur aide dans la réalisation de cette étude.
CONFLIT D’INTERÊTS
Aucun.
REFERENCES
1. Servettaz A, Goulvestre C, Kavian N, Nicco C, Guilpain P, Chereau C, et al. Selective oxidation of DNA topoisomerase 1 induces systemic sclerosis in the mouse. J Immunol. 2009 May 1;182(9):5855-64.
2. Moore BB, Hogaboam CM. Murine models of pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 2008 Feb;294(2):L152-60.
3. Gharaee-Kermani M, Hatano K, Nozaki Y, Phan SH. Gender-based differences in bleomycin-induced pulmonary fibrosis. Am J Pathol. 2005 Jun;166(6):1593-606.
4. Lawson WE, Polosukhin VV, Stathopoulos GT, et al. Increased and prolonged pulmonary fibrosis in surfactant protein C-deficient mice following intratracheal bleomycin. Am J Pathol. 2005 Nov;167(5):1267-77.
5. Gabrielli A, Avvedimento EV, Krieg T. Scleroderma. N Engl J Med. 2009 May 7;360(19):1989-2003.
6. Sauzeau V, Le Jeune H, Cario-Toumaniantz C, et al. Cyclic GMP-dependent protein kinase signaling pathway inhibits RhoA-induced Ca2+ sensitization of contraction in vascular smooth muscle. J Biol Chem. 2000 Jul 14;275(28):21722-9.
7. Guilluy C, Sauzeau V, Rolli-Derkinderen M, Guerin P, Sagan C, Pacaud P, et al. Inhibition of RhoA/Rho kinase pathway is involved in the beneficial effect of sildenafil on pulmonary hypertension. Br J Pharmacol. 2005 Dec;146(7):1010-8.
8. Hemnes AR, Zaiman A, Champion HC. PDE5A inhibition attenuates bleomycin-induced pulmonary fibrosis and pulmonary hypertension through inhibition of ROS generation and RhoA/Rho kinase activation. Am J Physiol Lung Cell Mol Physiol. 2008 Jan;294(1):L24-33.
9. Takemoto M, Sun J, Hiroki J, Shimokawa H, Liao JK. Rho-kinase mediates hypoxia-induced downregulation of endothelial nitric oxide synthase. Circulation. 2002 Jul 2;106(1):57-62.
10. Muzaffar S, Shukla N, Bond M, Sala-Newby GB, Newby AC, Angelini GD, et al. Superoxide from NADPH oxidase upregulates type 5 phosphodiesterase in human vascular smooth muscle cells: inhibition with iloprost and NONOate. Br J Pharmacol. 2008 Nov;155 (6):847-56.
FIGURES
REFERENCES
1. Servettaz A, Goulvestre C, Kavian N, Nicco C, Guilpain P, Chereau C, et al. Selective oxidation of DNA topoisomerase 1 induces systemic sclerosis in the mouse. J Immunol. 2009 May 1;182(9):5855-64.
2. Moore BB, Hogaboam CM. Murine models of pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 2008 Feb;294(2):L152-60.
3. Gharaee-Kermani M, Hatano K, Nozaki Y, Phan SH. Gender-based differences in bleomycin-induced pulmonary fibrosis. Am J Pathol. 2005 Jun;166(6):1593-606.
4. Lawson WE, Polosukhin VV, Stathopoulos GT, et al. Increased and prolonged pulmonary fibrosis in surfactant protein C-deficient mice following intratracheal bleomycin. Am J Pathol. 2005 Nov;167(5):1267-77.
5. Gabrielli A, Avvedimento EV, Krieg T. Scleroderma. N Engl J Med. 2009 May 7;360(19):1989-2003.
6. Sauzeau V, Le Jeune H, Cario-Toumaniantz C, et al. Cyclic GMP-dependent protein kinase signaling pathway inhibits RhoA-induced Ca2+ sensitization of contraction in vascular smooth muscle. J Biol Chem. 2000 Jul 14;275(28):21722-9.
7. Guilluy C, Sauzeau V, Rolli-Derkinderen M, Guerin P, Sagan C, Pacaud P, et al. Inhibition of RhoA/Rho kinase pathway is involved in the beneficial effect of sildenafil on pulmonary hypertension. Br J Pharmacol. 2005 Dec;146(7):1010-8.
8. Hemnes AR, Zaiman A, Champion HC. PDE5A inhibition attenuates bleomycin-induced pulmonary fibrosis and pulmonary hypertension through inhibition of ROS generation and RhoA/Rho kinase activation. Am J Physiol Lung Cell Mol Physiol. 2008 Jan;294(1):L24-33.
9. Takemoto M, Sun J, Hiroki J, Shimokawa H, Liao JK. Rho-kinase mediates hypoxia-induced downregulation of endothelial nitric oxide synthase. Circulation. 2002 Jul 2;106(1):57-62.
10. Muzaffar S, Shukla N, Bond M, Sala-Newby GB, Newby AC, Angelini GD, et al. Superoxide from NADPH oxidase upregulates type 5 phosphodiesterase in human vascular smooth muscle cells: inhibition with iloprost and NONOate. Br J Pharmacol. 2008 Nov;155 (6):847-56.
ARTICLE INFO
DOI: 10.12699/jfvp.3.9.2012.40
Conflict of Interest
Non
Date of manuscript receiving
23/01/2012
Date of publication after correction
15/10/2012
Article citation
Rivière S, Duong-Quy S. Study of RhoA/Rho-kinase signaling pathway in pulmonary vascularisation in systemic sclerosis . J Func Vent Pulm 2013;04(10):40-46.