
 English
English
 French
French
Lobectomie pulmonaire vidéo-assistée : technique, indications et résultats
Video-assisted pulmonary lobectomy : technique, indications, and results
V. Nguyen The, D. Le Tien, H. Nguyen Thanh, T. Truong Thanh
Service de Chirurgie Thoracique
Hôpital Pneumo-Phtisiologie Pham Ngoc Thach. HCM Ville - Vietnam
Corresponding author
Dr. NGUYEN THE Vu
Service de Chirurgie Thoracique
Hôpital Pneumo—Phtisiologie Pham Ngoc Thach. Ho Chi Minh Ville - Vietnam
E-mail: thevu2000@yahoo.com
ABSTRACT
Introduction and objectives. Video-assisted pulmonary lobectomia (VAPL) has been reported for the first time by Kirby and Walker in 1993. We realized this study to evaluate the efficiency and safety of VAPL at Surgical Department of Pham Ngoc Thach hospital.
Results. From February 2007 to August 2011 there were 43 VAPL pulmonary lobectomy cases. Among them there were 20 men and 23 women, the average age was 50.3 years (from 21 to 73 years). There were 26 cases with lesion in right lung and 17 cases in the left. Post-operation (post-op) histopathology: lung cancer: 22 (51.2%), tuberculoma: 7 (16.3%), bronchiectasis: 5 (11.6%), tumor-like pneumonia: (11.6%), bronchogenic cyst: 3 (7%) and vascular tumor: 1 (2.3%). The average surgical time was 120 minutes (from 90 to 210 minutes). The average blood loss was 148ml (from 50ml to 350ml). The average time of post-op morphine use for pain relief was one day for all cases. The average post-op recovery time was 4.8 days (from 2 days to 20 days). No bleeding complication had been happened during and after the surgery. There were four cases (9.3%) which have postoperative air leak lasting more than 7 days, among them 2 cases (4.7%) required a thoracoscopic talc pleudoresis.
Conclusion. VAPL can be handled efficiently and safely with lower complication rates and earlier recovery. In early stage, VAPL for non-small cell lung cancer can be performed both lobectomy and radical lymphadenectomy exactly as a conventional thoracotomy.
KEYWORDS: Lobectomy, pulmonary lobectomy, VAPL, lung cancer, thoracoscopy, thoracotomy
RÉSUMÉ
Introduction et objectif. La lobectomie pulmonaire video-assitée (LPVA) a été rapportée la première fois par Kirby et Walker en 1993. Nous avons réalisé cette étude pour évaluer l’efficacité et la morbi-mortalité de la lobectomie pulmonaire video-assitée au département chirurgical de l’hôpital Pham Ngoc Thach.
Résultats. Entre 2/2007 et 8/2011, 43 cas de LPVA ont été réalisés, dont 20 hommes et 23 femmes. L’âge moyen est de 50,3 ans (de 21 à 73 ans). 26 lésions étaient situées à droite, et 17 à gauche. L’histopathologie post-opératoire était: cancer pulmonaire (n =22/51,2%), tuberculome (n = 7/16,3%), dilatation des bronches (n = 5/11,6%), pseudotumeur inflammatoire (n = 5/11,6%), kyste bronchogénique (n = 3/7%) et tumeur vasculaire (n = 1/2,3%). Le temps moyen de l’opération est de 120 minutes (de 90 à 210 min).
La perte de sang moyenne est 148 ml (de 50ml à 350ml). Le temps moyen d’utilisation de morphine post-opératoire pour calmer la douleur est de 1 jour dans tous les cas. Le temps moyen post-opératoire du rétablissement est de 4.8 jours (de 2 a 20 jours). Il n’y a pas de complication hémorragique pendant et après l’opération. Il y a 4 cas (9.3%) de fuite d’air post – opératoire ayant duré plus de 7 jours dont 2 cas (4.7%) nécessitent un talcage thoracoscopique.
Conclusion. La LPVA est une technique efficace et sûre, avec peu de complications et un temps de rétablissement court. Dans les cancers pulmonaires non à petite cellule, de stade précoce, cette technique permet la lobectomie mais également le curage ganglionnaire radical dans même temps exactement comme une thoracotomie conventionnelle.
MOTS CLES: Lobectomie, lobectomie pulmonaire, LPVA, cancer pulmonaire, thoracoscopie, thoracotomie
INTRODUCTION
La lobectomie pulmonaire video-assitée (LPVA) a été rapportée la première fois par Kirby et Walker WS en 1993 [1, 2]. Avec l’apparition des nouveaux instruments et ses avantages: peu invasive, temps du rétablissement court, esthétique …la thoracoscopie a été largement appliquée dans la lobectomie dans plusieurs grands centres opératoires mondiaux comme celui de chirurgie thoracique au Viet Nam. Jusqu’à maintenant, nous avons eu connaissance des expérience en LPVA des hôpitaux Binh Dan et VietDuc (données nationales).
Le département chirurgical de l’hôpital Pham Ngoc Thach est un département récent, créé en 2004. Dès l’ouverture de ce département, nous avons entrepris d’appliquer la thoracoscopie pour diagnostiquer et traiter des pathologies thoraciques telles que les pathologies médiatisnales, ou les pneumothorax …. Cette technique récente nécessite un plateau technique de haute performance et des chirurgiens expérimentés. Avec l’aide de l’Association FrancoVietnamienne de Pneumologie (AFVP), nous recourons à cette technique depuis 2007. Et nous avons réalisé 43 cas de lobectomie pulmonaire vidéoassistée avec succès.
OBJECTIF DE L’ETUDE
Cette étude a été réalisée pour évaluer l’efficacité de la LPVA et la morbi-mortalité liée à cette technique à l’hôpital Pham Ngoc Thach (PNT).
MATERIEL ET METHODE
Patients
Entre 2/2007 et 8/2011, 43 cas de LPVA ont été réalisés au département chirurgical de l’hôpital PNT, dont 20 hommes et 23 femmes.
L’âge moyen des patients est 50 ans (de 21-73 ans).
Méthode d’analyse
Etude rétrospective.
Processus opératoire
• Tout d’abord, le malade est anesthésié par anesth- ésie générale, et ventilé par une sonde endotrachéale à double lumière.
• Il est installé en décubitus latéral du côté sain. Pour mieux élargir les espaces intercostaux, on utilise un coussin qui sert à rembourrer ou une table chirurgicale fléchie.
• On choisit l’emplacement de l’incision cutanée de 2 cm de long pour introduire le trocart (normalement
INTRODUCTION
La lobectomie pulmonaire video-assitée (LPVA) a été rapportée la première fois par Kirby et Walker WS en 1993 [1, 2]. Avec l’apparition des nouveaux instruments et ses avantages: peu invasive, temps du rétablissement court, esthétique …la thoracoscopie a été largement appliquée dans la lobectomie dans plusieurs grands centres opératoires mondiaux comme celui de chirurgie thoracique au Viet Nam. Jusqu’à maintenant, nous avons eu connaissance des expérience en LPVA des hôpitaux Binh Dan et VietDuc (données nationales).
Le département chirurgical de l’hôpital Pham Ngoc Thach est un département récent, créé en 2004. Dès l’ouverture de ce département, nous avons entrepris d’appliquer la thoracoscopie pour diagnostiquer et traiter des pathologies thoraciques telles que les pathologies médiatisnales, ou les pneumothorax …. Cette technique récente nécessite un plateau technique de haute performance et des chirurgiens expérimentés. Avec l’aide de l’Association FrancoVietnamienne de Pneumologie (AFVP), nous recourons à cette technique depuis 2007. Et nous avons réalisé 43 cas de lobectomie pulmonaire vidéoassistée avec succès.
OBJECTIF DE L’ETUDE
Cette étude a été réalisée pour évaluer l’efficacité de la LPVA et la morbi-mortalité liée à cette technique à l’hôpital Pham Ngoc Thach (PNT).
MATERIEL ET METHODE
Patients
Entre 2/2007 et 8/2011, 43 cas de LPVA ont été réalisés au département chirurgical de l’hôpital PNT, dont 20 hommes et 23 femmes.
L’âge moyen des patients est 50 ans (de 21-73 ans).
Méthode d’analyse
Etude rétrospective.
Processus opératoire
• Tout d’abord, le malade est anesthésié par anesth- ésie générale, et ventilé par une sonde endotrachéale à double lumière.
• Il est installé en décubitus latéral du côté sain. Pour mieux élargir les espaces intercostaux, on utilise un coussin qui sert à rembourrer ou une table chirurgicale fléchie.
• On choisit l’emplacement de l’incision cutanée de 2 cm de long pour introduire le trocart (normalement
dans le 7ème ou le 8ème espace intercostal, en avant de la ligne axillaire moyenne). On passe ensuite le thoracoscope dans l’espace pleural à travers cette incision.
• On évalue les lésions. Si besoin, on pratique une biopsie avec examen extemporanné. On décide enfin la prise en charge chirurgicale : à savoir : abstention chirugicale, thoracotomie conventionnelle ou vidéoassistée.
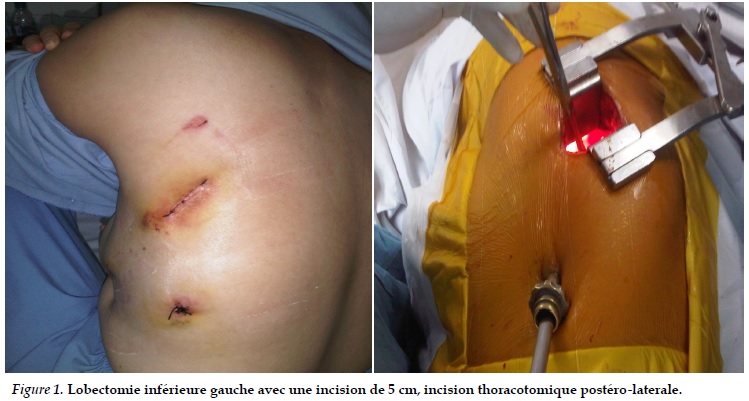
• En cas de thoracotomie vidéo-assisté, on incise la paroi thoracique environ sur 4 à 6 cm, normalement dans le 3ème ou 4ème espace intercostal, en postion latérale ou postéro - latérale. On peut utiliser un petit écarteur dans certains cas. Le cas échéant, le thoracoscope est utilisée comme lumière. On résalise la lobectomie avec des équipements endoscopiques comme la pince pulmonaire, le couteau ultrasonique, le clip endoscopique ou stapler. A la fin de l’intervention, la pièce opératoire et la tumeur sont mis dans un sac et évacuées hors de l’espace pleural.
RESULTATS
Age, sexe
Age: âge moyen: 50 ans (extrêmes entre 21 et 73 ans). Sexe: hommes: 20 cas, femmes: 23 cas.
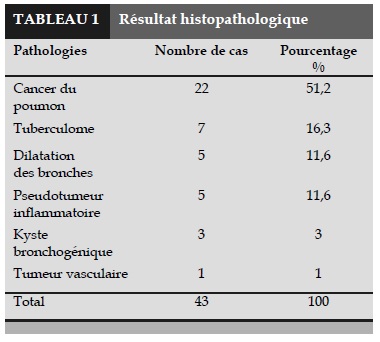
Histopathologie
Le résultat de la histopathologie est présenté sur le Tableau 1.
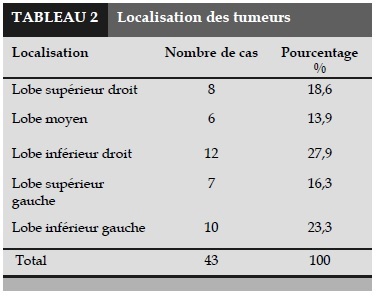
Localisation des tumeurs
Localisation des tumeurs sont présentée dans le Tableau 2.
Taille des lesions
Moyenne: 4,7 cm (extrêmes entre 2 cm et 7cm).
Durée de l’intervention et perte du sang
Durée moyenne
142 min (extrêmes entre 90 et 210 mn)
Perte du sang moyenne
165 ml (extrêmes entre 50ml et 400ml).
Temps de rétablissement post-opératoire
Temps de rétablissement post-opératoire moyen: 4,8 jours (extrêmes entre 2 et 20 jours).
Il y a eu 4 cas (9,3%) de fuite d’air post-opératoire prolongée (ayant duré plus de 7 jours), dont 2 cas ont nécessité un talcage thoracoscopique.
La quantité moyenne de liquide drainé dans les 24 premières heures a été de 322,5 ml (extrêmes entre 100 ml et 600 ml).
Il n’y a eu aucun cas d’hémorrhagie nécessite une reprise chirurgicale.
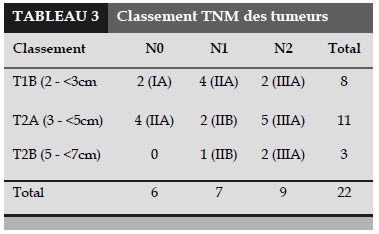
Classement TNM des cas de cancer du poumon (UICC 2009)
Le classement TNM des cas de cancer est présenté dans le Tableau 3.
DISCUSSION
Indications
La LPVA a été utilisée par de nombreux chirurgiens pour traiter des pathologies pulmonaires bénignes et malignes comme le cancer du poumon non à petites cellules au stade précoce, de moins de 6 cm, les tumeurs vasculaires, les tuberculomes, les dilatations des bronches, le kyste bronchogénique, l’aspergillome et l’emphysème pulmonaire [3, 4].
Dans plusieurs études rapportées, les auteurs ont également précisé les contre-indications de cette technique qui sont la dimension de la lésion (> 6cm), une pachypleurite diffuse,l’ infiltration de la paroi thoracique par la tumeur [5, 6].
Certains auteurs y ajoutent des contre-indications relatives : chimio ou radiothérapie néo-adjuvante, la présence d’adénopathies hypervascularisées (risque hémorrhagique lors du curage), une tumeur pulmonaire centrale [5].
L’histopathologie la plus fréquente dans cette étude est celle de cancer du poumon non à petites cellules (CPNC) avec 22 cas, juste avant celle de tuberculome. Dans notre équipe, nous avons réalisé une LPVA dans de cancer pulmonaire de stade IIIA (n = 9) avec des métastases ganglionnaires sous carinaires, de la fenêtre aorto-pulmonaire ou paratrachéale dont un cas où la tumeur se situait dans le lobe inférieur droit et mesurait plus de 7 cm.
Technique de la lobectomie pulmonaire videoassistée
Jusqu’ici, la technique appliquée pour la LPVA par la plupart des chirurgiens est une incision de 4 à 6 cm avec 2 à 4 trocarts [1, 2, 4, 5, 7]. En cas de lobectomie pulmonaire endoscopique complète, on n’utilise pas d’écarteur et on observe le champ opératoire sur l’écran vidéo.
En cas de LPVA, la longeur de l’incision de la peau peut atteindre 8 à 10 cm avec l’utilisation d’écarteurs, le thoracoscope ne servant que de lumière. Les chirurgiens peuvent observer le champ opératoire directement ou sur l’écran vidéo.
L’intensité de la douleur post-opératoire des malades est différente en fonction de l’utilisation ou non des écarteurs [5, 7]. En cas de LPVA, les chirurgiens peuvent utiliser des instruments conventionnels en plus des équipements endoscopiques [5, 6]. Cependant, la différence entre la LPVA et la lobectomie conventionnelle est l’observation du champ opératoire sur l’écran vidéo [5]. Les stapplers sont utilisés fréquemment pour couper les scissures, les bronches et les gros vaisseaux.
Dans les 43 cas de LPVA, nous avons fait une incision de 4 à 6cm et utilisé un petit écarteur, et entre 2 et 3 trocarts. Normalement, on utilise l’incision thoracotomique latérale pour les lésions du lobe supérieur et moyen et l’incision thoracotomique postéro-latérale pour les lésions du lobe inférieur. Nous utilisons des instruments conventionnels pour disséquer les vaisseaux et les ganglions. Le stappler est utilisé pour couper et suturer le parenchyme pulmonaire, les vaisseaux sont coupés et suturés avec des clips ou du fil.
Efficacité de la LPVA
Les avantages de la chirurgie thoracique vidéoassistée en général et de la LPVA en particulier sont connus de tous les chirurgiens. Il s’agit de l’intensité de la douleur, du temps de rétablissement court et du résultat esthétique. Dans les cas de chirurgie oncologique, la capacité de curage ganglionnaire radicale est équivalente à celle de l’opération conventionnelle.
Sugiura H et al. [8] a rapporté que le temps d’intervention de la LPVA et de celui de la lobectomie conventionnelle sont équivalents. La perte du sang moyenne est moindre dans la LPVA (150 ± 126 ml) en comparaison à la lobectomie conventionnelle (300 ± 192 ml).
Dans l’étude de Demmy et Curtis [9], le temps d’hospitalisation après une LPVA est de 5,3 ± 3,7 jours versus 12,2 ± 11,1 jours en cas d’opération conventionnelle. D’après Walter et al., les données sont de 4 jours et 7 jours [10].
La complication la plus importante de la LPVA redoutée par les opérateurs est l’hémorrhagie par rupture d’ un vaisseau lors de la dissection. Néanmoins, les études les plus récentes montrent que le pourcentage d’hémorrhagie est inférieur à 1% et contrôlable [6].
Une autre complication est le défaut d’aérostase, mais l’utilisation large des staplers pour couper le parenchyme pulmonaire et la bronche réduit ce risque à 4% à 5% des cas [7, 11].
Dans notre étude, la durée moyenne de l’intervention est de 142 minutes et la perte du sang moyenne est de 165 ml. Nous avons rencontré un cas de déchirure d’une artère médiastinale lors de la dissection. Le problème a été résolu par l’utilisation des clips et par la suture de l’artère. Dans notre série, le pourcentage de fuite d’air de plus de 7 jours est de 9,3% (n = 4), dont 2 cas ont nécessité un talcage thoracoscopique.
Ce pourcentage est plus élevé que celui des autres auteurs parce que nous n’utilisons pas le stapler de manière systématique. Nous n’avons aucun cas d’hémorrhagie post opératoire nécessitant une reprise chirurgicale. Tous les patients n’ont eu besoin d’une antalgie injectable que dans les 24 premières heures après l’opération. Le temps d’hospitalisation moyen est de 4,8 jours.
Dans les cas de chirurgie oncologique, nous avons fait un curage de tous les ganglions visibles dans le champ opératoire.
CONCLUSION
La LPVA peut être réalisée de manière efficace, sécurisante avec peu de complications. En cas du CPNC de stade précoce, l’opération vidéo-assistée permet la lobectomie radicale et la curage ganglionnaire dans le meme temps opératoire, avec le même résultat qu’une lobectomie conventionnelle.
CONFLICT D’INTERÊT
Aucun.
REFERENCES
1. Kirby TJ, Rice TW: Thoracoscopic lobectomy. Ann Thorac Surg 56(3):784-786,1993.
2. Walker WS: Carnochan FM, Pugh GC: Thoracoscopic pulmonary lobectomy. Early operative experience and prelimimary clinicals results. J Thorac Cardiovasc Surg 106(6): 1111-1117, 1993.
3. Alberto Weber, Uz Stammberger, Ilhan Inci, Ralph A. Schmid, et al. Thoracoscopic lobectomy for benign disease – a single centre study on 64 cases. European Journal of Cardio-Thoracic Surgery 2001(3): 443 -448.
4. Anthony P.C.Yim: Video-assisted lobectomy: Indication and Techniques. Heart, Lung and Circulation 2001; 10(2): A33-A34.
5. Michael Kent, Miguel Avelo-Rivera and James Luketich: “Minimally Intensive Surgery for Lung Cancer”. Lung cancer 2010, Chapter 12, 180-192.
6. Robert J. McKenna JR: “Minimally Intensive Techniques for the Management of Lung Cancer” Principles and Practice of Lung Cancer 4th Edition, Chapter 31, 455-458.
7. McKenna R.J, Houck W, Fuller CB. Video-assisted thoracic surgery lobectomy: experience with 1,100 cases. Ann Thorac Surg 2006;81:421– 6.
8. Sugiura H, Morikawa T, Kaji M, et al “Longterm benefits for the quality of life after video-assited thoracoscopic lobectomy in patients with lungcancer”. Surg Laparocs Percutant Tech 1999; 9(6): 403-8.
9. Demmy TL, Curtis JJ. Minimally invasive lobectomy directed toward frail and high-risk patients: a casecontrol study. Ann Thorac Surg 1999; 68: 194 –200.
10. Walter J. Scott, Mark S. Allen,Gail Darling,Bryan Meyers,Paul A. Decker,Joe B. Putnam,Robert W. Mckenna,Rodney J. Landrenau,David R. Jones,Richard I. Inculet,Richard A. Malthaner. ”Video-assisted thoracic surgery versus open lobectomy for lung cancer: A secondary analysis of data from the American College of Surgeons Oncology Group Z0030 randomized clinical trial”. J Thorac Cardiovasc Surg 2010; 139: 976983.
11. Onaitis MW, Petersen RP, Balderson SS, et al. Thoracoscopic lobectomy is a safe and versatile procedure: experience with 500 consecutive patients. Ann Surg 2006; 244: 420 –5.
FIGURE/TABES
REFERENCES
1. Kirby TJ, Rice TW: Thoracoscopic lobectomy. Ann Thorac Surg 56(3):784-786,1993.
2. Walker WS: Carnochan FM, Pugh GC: Thoracoscopic pulmonary lobectomy. Early operative experience and prelimimary clinicals results. J Thorac Cardiovasc Surg 106(6): 1111-1117, 1993.
3. Alberto Weber, Uz Stammberger, Ilhan Inci, Ralph A. Schmid, et al. Thoracoscopic lobectomy for benign disease – a single centre study on 64 cases. European Journal of Cardio-Thoracic Surgery 2001(3): 443 -448.
4. Anthony P.C.Yim: Video-assisted lobectomy: Indication and Techniques. Heart, Lung and Circulation 2001; 10(2): A33-A34.
5. Michael Kent, Miguel Avelo-Rivera and James Luketich: “Minimally Intensive Surgery for Lung Cancer”. Lung cancer 2010, Chapter 12, 180-192.
6. Robert J. McKenna JR: “Minimally Intensive Techniques for the Management of Lung Cancer” Principles and Practice of Lung Cancer 4th Edition, Chapter 31, 455-458.
7. McKenna R.J, Houck W, Fuller CB. Video-assisted thoracic surgery lobectomy: experience with 1,100 cases. Ann Thorac Surg 2006;81:421– 6.
8. Sugiura H, Morikawa T, Kaji M, et al “Longterm benefits for the quality of life after video-assited thoracoscopic lobectomy in patients with lungcancer”. Surg Laparocs Percutant Tech 1999; 9(6): 403-8.
9. Demmy TL, Curtis JJ. Minimally invasive lobectomy directed toward frail and high-risk patients: a casecontrol study. Ann Thorac Surg 1999; 68: 194 –200.
10. Walter J. Scott, Mark S. Allen,Gail Darling,Bryan Meyers,Paul A. Decker,Joe B. Putnam,Robert W. Mckenna,Rodney J. Landrenau,David R. Jones,Richard I. Inculet,Richard A. Malthaner. ”Video-assisted thoracic surgery versus open lobectomy for lung cancer: A secondary analysis of data from the American College of Surgeons Oncology Group Z0030 randomized clinical trial”. J Thorac Cardiovasc Surg 2010; 139: 976983.
11. Onaitis MW, Petersen RP, Balderson SS, et al. Thoracoscopic lobectomy is a safe and versatile procedure: experience with 500 consecutive patients. Ann Surg 2006; 244: 420 –5.
ARTICLE INFO
DOI: 10.12699/jfvp.3.8.2012.47
Conflict of Interest
Non
Date of manuscript receiving
22/01/2012
Date of publication after correction
15/7/2012
Article citation
Nguyen The V, Le Tien D, Nguyen Thanh H, Truong Thanh T. Video-assisted pulmonary lobectomy: technique, indications, and results. J Func Vent Pulm 2012;03(08):47-51.