
 English
English
 French
French
Rôle des différents paramètres du NO expiré dans la détection de l’hyperréactivité bronchique
Role of different parameters of exhaled NO in detection of bronchial hyperresponsiveness
N.N. Le-Dong, S. Duong-Quy, T. Hua-Huy, A.T. Dinh-Xuan
Service de Physiologies - Explorations Fonctionnelles. Hôpital Cochin. Université Paris Descartes. Paris
Corresponding author
Dr. Nhat-Nam LE-DONG
Service de Physiologie - Explorations Fonctionnelles
Hôpital Cochin 27, Rue du Faubourg St Jacques. 75014 Paris - France
E-mail: ledongnhatnam@yahoo.com
ABSTRACT
Introduction and objective. The concentration of exhaled nitric oxide (FENO) is a biomarker of airway inflammation in asthma. However, the relationship between FENO and bronchial hyperresponsiveness (BHR) has not been well clarified. Dans presented study, we studied the predictive value of exhaled NO in the detection of BHR.
Method. The concentration of exhaled NO was measured at different levels of expiratory flow in 140 patients with clinical suspicion of asthma, followed by methacholine challenge. Maximum bronchial flow of NO (J’awNO) and alveolar NO concentration (CANO) were calculated using the Condorelli’s mathematical formula. Comparison and correlation between parameters were performed by Student's t test, and Pearson. Analysis of the ROC curve was also performed for all the parameters of exhaled NO in order to determine their ability detective HRB.
Results. In the group BHR (+), the FENO was significantly higher than in normal subjects (13 ppb versus 34 ppb, p<0.001) and was correlated with the PD20 MCH (r =-0.53, p<0.001). The J’awNO was significantly increased in patients with BHR compared to patients without BHR (40 against 136 nl/min) and significantly correlated with PD20 MCH (r=-0.61,p<0.001). The sensitivity & specificity of FENO in the detection of BHR with an optimal threshold of 35 ppb were 0.9& 0.75 respectively.
Conclusion. The J’awNO can detect BHR specifically with respect to these two parameters and FENO may be used independently or coupled with the methacholine challenge test in the diagnosis of BHR.
KEYWORDS: FENO, bronchial hyperresponsiveness, BHR J’awNO, CANO, asthma, methacholine, PD20
RÉSUMÉ
Introduction et objectif. La concentration du monoxyde d’azote expiré (FENO) est un biomarqueur de l’inflammation bronchique dans l’asthme. Cependant, la relation entre la FENO et l’hyperréactivité bronchique (HRB) n’a pas été bien clarifiée. Dans cette étude, nous avons étudié les valeurs prédictives du NO expiré dans la détection de l’HRB.
Méthode. La concentration du NO expiré a été mesurée à différents niveaux de débit expiratoire chez 140 patients avec suspicion clinique de l’asthme, suivie de l’épreuve à la méthacholine. Le débit bronchique maximal du NO (J’awNO) et la concentration alvéolaire du NO (CANO) ont été calculés selon la formule mathématique de Condorelli. La comparaison et la corrélation entre les paramètres ont été réalisées par le test t-Student et Pearson. L’analyse de la courbe de ROC a été également effectuée pour tous les paramètres du NO expiré afin de déterminer leur capacité détective de l’HRB.
Résultats. Dans le groupe HRB (+), la FENO a été significativement plus élevée que celle des sujets normaux (13 ppb versus 34 ppb, p < 0,001) et a été corrélée avec la PD20 de MCH (r = -0,53, p <0.001). Le J’awNO a été fortement augmenté chez les patients ayant une HRB par rapport aux sujets exempts de l’HRB (40 contre 136 nl/min) et significativement corrélé à la PD20 de MCH (r = -0,61, p <0.001). La sensibilité et la spécificité de la FENO dans la détection de l’HRB avec un seuil optimal de 35 ppb étaient de 0,9 et 0,75 respectivement.
Conclusion. Le J’awNO permet de détecter l’HRB plus spécifiquement par rapport à la FENO et ces deux paramètres pourraient être utilisés, indépendamment ou couplés à l’épreuve de métacholine, dans le diagnostic de l’HRB.
MOTS CLES: FENO, hyperréactivité bronchique, HRB, J’awNO, CANO, asthme, métacholine, PD20
INTRODUCTION
L’hyperréactivité bronchique (HRB) est un phénomène pathologique lié à l’obstruction bronchique et à l’inflammation chronique de l’asthme [1]. Ce phénomène contribue également à la pathogénie de la bronchopneumopathie chronique obstructive [2] et représente un facteur de risque de la progression des symptômes respiratoires et de la dégradation des fonctions pulmonaires [3]. En clinique, l’HRB est déterminée par une bronchoconstriction excessive en réponse à des stimuli spécifiques ou non spécifiques.
Le test de provocation bronchique à la métacholine [4] est la méthode la plus répandue dans l’évaluation de l’HRB. Cette épreuve utilise la métacholine, un agent pharmacologique agissant directement sur les cellules musculaires lisses. L’analyse du test est basée sur la relation dose/réponse entre la concentration de la métacholine inhalée et la diminution du débit expiratoire (lié au tonus musculaire bronchique) et cette relation dose/réponse est soumise à la pathologie étudiée. Le test à la méthacholine est très utile dans le diagnostic de l’asthme, notamment chez les patients ayant une fonction respiratoire basale dans les limites de la normale.
La concentration du monoxyde d’azote (NO) dans l’air expiré est un indice de l’inflammation [6]. La mesure de la concentration du NO expiré (FENO) est une méthode non-invasive pour évaluer l’état inflammatoire des voies aériennes et joue un rôle important dans le diagnostic et le suivi de l’asthme [6]. La relation entre le NO expiré et l’HRB n’est souvent pas claire malgré que une bonne corrélation entre la FENO et les autres marqueurs de l’inflammation [7, 8] et inversement, l’inflammation est un facteur favorisant de l’HRB.
Récemment, les mécanismes régulateurs du tonus bronchique via la biosynthèse du NO ont été d’ actualité [10]. Cependant, la relation entre la FENO et l’HRB n’a pas été bien clarifiée en raison des résultats souvent opposés selon des études publiées. Certains auteurs [7-9, 11] ont trouvé une corrélation entre la concentration provocatrice 20% (PC20) de métacholine et la FENO alors que d’autres ont montré l’absence de relation significative [12, 13]. Ces résultats controversés pouvaient se justifier par la diversité des populations étudiées [14] ou par la technique de mesure du NO expiré utilisée.
Dans cette étude, nous nous sommes intéressés à un autre aspect concernant le rôle de deux origines anatomiques du NO expiré: NO venant des bronches et celui des alvéoles. L’analyse de la littérature nous a révélé que dans les études montrant la relation positive entre la FENO et l’HRB, la FENO a été mesurée à faibles débits expiratoires, y compris celui recommandé par la Société Thoracique Américaine (ATS) à 50 ml/s ; tandis qu’aux débits expiratoires plus élevés (150-250ml/s), cette corrélation n’a pas existé [12, 13].
La dynamique du NO dans les voies aériennes est complexe et la FENO dépend largement des débits expiratoires [15]. Cette caractéristique du NO représente la principale difficulté pour déterminer les origines anatomiques de l’inflammation [15]. La FENO est dérivée de toutes les sources possibles du NO dans l’appareil respiratoire, comprenant des bronches, bronchioles, alvéoles et capillaires pulmonaires. Ceci explique l’intérêt prépondérant de la technique d’analyse multiple du NO expiré en comparaison avec la mesure simple de la FENO.
Nous pouvons ainsi différencier le NO provenant des bronches (J’awNO) de celui des alvéoles (CANO), en utilisant les modèles mathématiques [15, 18]. C’est la raison pour laquelle nous avons utilisé le modèle de la « trompette » pour évaluer la relation entre le NO bronchique et l’HRB provoquée par la métacholine dans une population avec suspicion de l’asthme. L’objectif subsidiaire de l’étude est de déterminer la valeur prédictive des paramètres localisés de la FENO dans le diagnostic de l’HRB.
METHODES
Population
Tous les patients adressés dans le service de Physiologie – Explorations Fonctionnelles, CHU Cochin (Paris) pour réalisation d’un test à la métacholine du décembre 2008 au juin 2009 ont été inclus dans l’étude. Nous avons exclu des patients qui ont fumé dans les 5 dernières années ou qui ont utilisé un corticoïde inhalé dans les 3 derniers mois. Tout traitement par bronchodilatateurs de type beta-2-adrénergique a été arrêté au moins 24 heures avant l’examen.
Après avoir éliminé les contre-indications à l’épreuve de métacholine (MCH), la mesure du NO expiré aux débits multiples a été réalisée chez tous les patients, suivie de l’épreuve de MCH.
Mesure du NO expiré
La concentration du NO expiré a été mesurée en utilisant un analyseur de NO (Seres EndoNO 8000, Aixen-Provence, France) par chemiluminescence. L’appareil a été journalièrement calibré avec un mélange gazeux de NO standardisé à 100 ppb (Air Liquide, France).
La concentration de NO a été mesurée à multiples débits expiratoires progressivement croissants (V’E).
Enfin, la concentration alvéolaire de NO (CANO) et le débit bronchique maximal de NO (J’awNO) ont été automatiquement calculés d’après l’équation linéaire de Condorelli et al. [18].
Brièvement, après une inspiration maximale en air ambiant (contenant < 5ppb en NO), le sujet a expiré contre une pression positive qui était gardée constante, variant entre 5 et 20 cm H2O pour générer de différents débits expiratoires de 50, 100, 150 et 200 ml/s. L’ordre de réalisation de ces débits expiratoires était au hasard et à chaque débit expiratoire, la FENO a été enregistrée selon les critères de l’ATS/ ERS (Société respiratoire européenne) [19].
La valeur moyenne des trois mesures consécutives a été notée pour l’analyse finale. Premièrement, la FENO standard a été mesurée à débit expiratoire de 50 ml/s (FENO50). Pour les débits expiratoires plus élevés, le débit d’élimination du NO a été exprimé par la relation linéaire avec le débit expiratoire (V'NO = V'E • FENO). Trois valeurs différentes de V’NO correspondant à 3 niveaux de débits expiratoires restant (V’E = 100-150-200 ml/s) ont été utilisés pour établir un graph linéaire (car V’E > 50 ml/s) illustré par l’équation : V’NO = (CANO + JawNO x 0,00087) * V’E + J’awNO / 1,7.
Avec la pente du graph (S) de CANO + J'awNO x 0,00078 et l’intercept avec l’ordonnée (I) de J’awNO / 1,7. Ainsi, le J’awNO (nl/min) et la CANO (ppb) ont été déterminés comme suivants: CANO = S-I/740 và J'awNO = 1,7*I.
Explorations fonctionnelles respiratoires (EFR)
La pléthysmographie est calibrée tous les matins avec une seringue standard de 3 litres. Chaque sujet a réalisé trois courbes de débit-volume et la mailleure valeur a été enregistrée, selon les recommandations techniques de l’ATS/ERS [20]. Les données ont été expirmées comme pourcentage de la valeur théorique moyenne.
Epreuve de provocation bronchique à la métacholine La métacholine (ou acetyl-β-methylcholine cloride) a été fournie par le département de pharmacologie de l’hôpital Cochin sous forme de solution 5%. Avant chaque épreuve, une solution 2,5% est préparée par dilution de la solution « mère » dans 2ml de sérum physiologique (NaCl 0,9%). Le sujet assis dans la cabine de pléthysmographie avec un pince-nez, inhale des doses de MCH via l’embout bucal relié directement à un aérosol-doseur automatique, déclenché et contrôlé par un ordinateur. Après la première mesure (d’une courbe débit-volume) suite à l’inhalation du sérum physiologique (sans MCH)
pour éliminer un asthme induit par exercice et obtenir le VEMS de base, le sujet inhale de la MCH par palliers de doses doublées (100-200-400-800-1600 µg). Le VEMS est mesuré à 30 puis 90 secondes après chaque inhalation et la valeur la plus basse est enregistrée. L’épreuve est arrêtée soit lorsqu’il y a une diminution ≥ 20% du VEMS par rapport à la valeur de base, soit lorsque la dermière dose a été atteinte (donc une dose cumulée de 3100 µg de métacholine).
Si le VEMS à la fin du test est diminué de 10% par rapport au VEMS de base ou qu’une gêne respiratoire survient, le sujet est traité par bronchodilatateurs inhalés (Salbutamol 400µg et/ou Bronchodual 100µg/40µg) jusqu’à ce que le VEMS remonte au moins à 90% de la valeur initiale. La dose provocative 20% (PD20) de MCH, correspondant à la dose provoquant une chute de 20% du VEMS à partir de sa valeur basale, est calculée via l’équation linéaire de la courbe dose/réponse.
Analyse statistique
Les analyses statistiques ont été effectuées par le logiciel SPSS (version 16.0, Chicago, IL). La distribution normale des paramètres de NO expiré (FENO, CANO et J’awNO) a été vérifiée par le test Kolmogorov-Smirnov. La PD20 a été transformée en échelle logarithmique avant les tests statistiques. Les résultats ont été exprimés sous forme de Moyenne ± Ecart -type. Les sujets ont été divisés en deux groupes selon le résultat de l’épreuve de MCH.
La comparaison entre ces groupes a été réalisée avec le test t-Student. Le coefficient de Pearson a été utilisé pour étudier la corrélation entre les paramètres de NO expiré et la PD20 et le seuil statistique est déterminé par un p <0,005. Pour chaque paramètre de NO expiré, nous avons établi une courbe de ROC pour évaluer la valeur prédictive de l’hyperréactivité bronchique.
RESULTATS
Cent quarante sujets ont été inclus dans notre étude. Les sujets avec HRB (test positif) ont été classés dans le groupe 1 (n = 48) et d’autres (test négatif) dans le groupe 2 (n = 92). Sept sujets demandeurs d’une attestation de santé en raison de la pratique professionnelle et sportive avec un test négatif ont été placés dans le groupe 2.
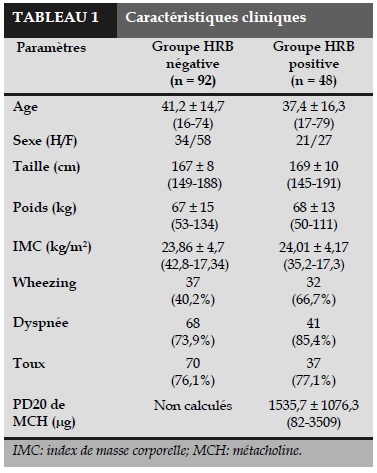
Les caractéristiques épidémiologiques de ces deux groupes ont été présentées dans le Tableau 1. L’âge varie entre 16 et 79 ans et tous les sujets se sont plaints d’un ou de plusieurs symptômes suggestifs d’asthme sans en avoir un diagnostic de confirmation.
Les caractéristiques de base incluant l’âge, le sexe et l’indice de masse corporel (IMC) ont été comparés entre ces deux groupes. Chez les sujets avec HRB (test positif), la valeur moyenne de la dose cumulée de MCH était de 1536 µg. Le taux de fréquence de gêne respiratoire avec « wheezing » était plus élevé chez les HRB+ que chez les HRB- (66,7% versus 40,2%).
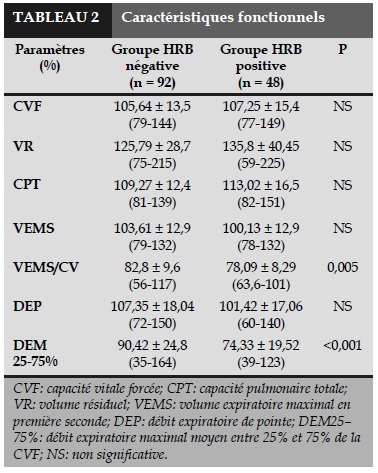
Les résultats d’EFR de base ont été présentés dans le Tableau 2. La plupart des sujets ont eu une fonction respiratoire dans les limites de la normale. Cependant, le VEMS et le rapport VEMS/CVmax étaient significativement plus bas chez les HRB+ que chez les HRB-, suggérant qu’il existait déjà une obstruction bronchique légère chez les sujets présentant une hyperréactivité bronchique.
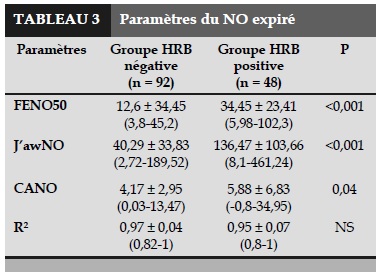
La modélisation de Condorelli était aptes à tous les sujets étudiés avec un coefficient de R² moyen >0,9 dans les deux groupes. Le Tableau 3 présentait les données de NO expiré. Par rapport au groupe HRB-, les sujets avec HRB+ ont obtenu une valeur de FENO, CANO et J’awNO fortement plus élevée.
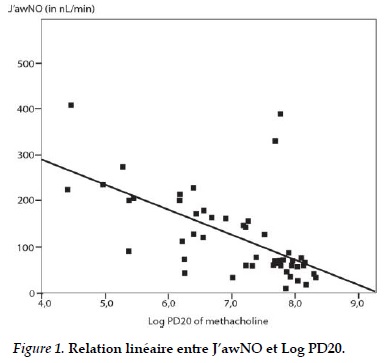
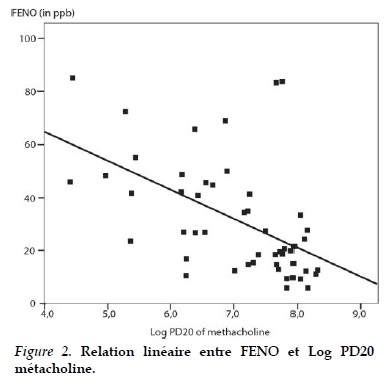
Les équations de relation linéaire entre le J’awNO, la FENO et le Log PD20 ont été illustrées dans les Figures 1 et 2. Dans le groupe HRB+, la FENO a été significativement corrélée au Log PD20, la corrélation étant plus forte pour J’awNO (r =-0,53 pour FENO50 et r =-0,61 pour J’awNO), alors qu’il n’y a pas eu de corrélation significative entre le LogPD20 et la CANO.
L’analyse par regression linéaire multiple nous a confirmé que la corrélation entre le J’awNO ou la FENO et le Log PD20 était indépendante d’autres facteurs comme le VEMS de base, l’âge, le sexe, la taille ou le poids.
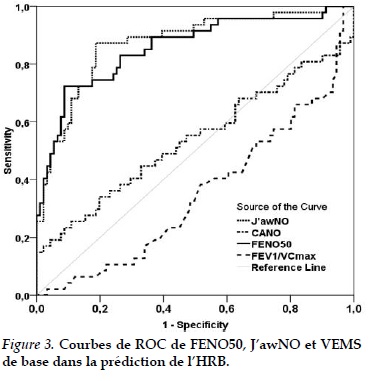
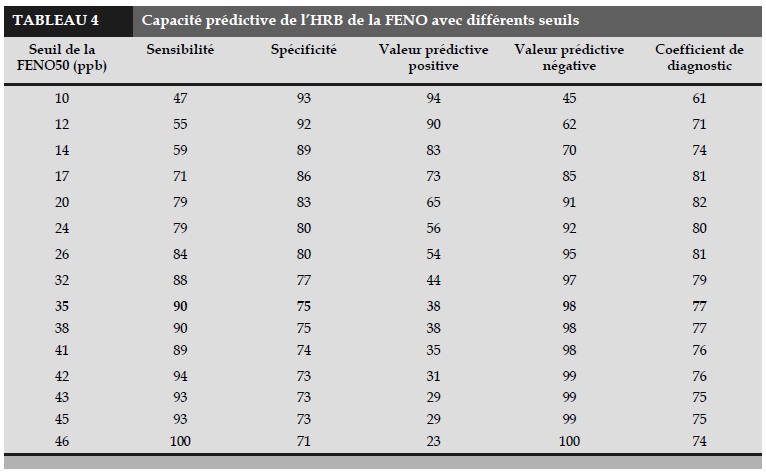
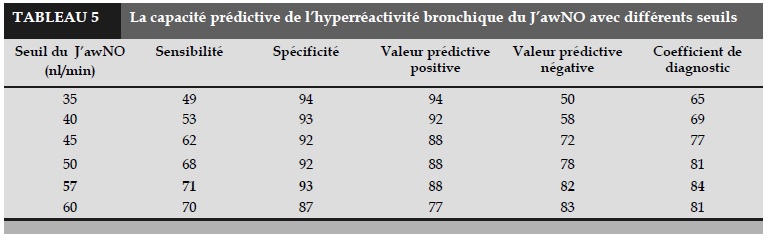
La Figure 3 a présenté la comparaison des 3 courbes de ROC de FENO50, J’awNO et VEMS de base dans la prédiction de l’hyperréactivité bronchique.
L’aire sous la courbe (AUC) du J’awNO était plus importante que celle de la FENO. Concernant le J’awNO, le seuil optimal était de 57 nl/min (Tableau 4), avec sensibilité de 71%, spécificité de 93%, valeur prédictive positive de 88% et valeur prédictive négative de 82%. Celui de la FENO était de 35 ppb, pouvant déterminer l’HRB avec spécificité de 90% et valeur prédictive négative de 98%.
DISCUSSION
Notre étude a démontré les principaux résultats suivants: 1) Les sujets avec HRB ont augmenté considérablement leur concentration du NO expiré ; 2) Le débit bronchique maximal de NO a été significativement corrélé avec la PD20 de MCH alors qu’il n’y pas eu de relation entre PD20 et CANO ; 3) Le J’awNO est plus spécifique que la FENO dans la détection de l’HRB. Comme nous avons mentionné ci-dessus, la relation entre la FENO et l’HRB évaluée par le test de MCH reste controversée. Dans cette étude, nous avons vérifié la relation entre la dose de réponse positive de MCH et le NO expiré avec la mesure compartimentée. Certaines études ont mis en évidence que la contribution du NO alvéolaire est négligeable dans l’asthme en comparaison à celle du NO bronchique. Hogman et al. [22] ont trouvé une augmentation de la FENO avec une CANO restant dans les limties de la normale chez les asthmatiques légers. Lehtimaki [23] a montré que la CANO était normale dans l’asthme léger et modéré, et que le traitement par corticoïdes inhalés n’a pas modifié la CANO de base. Dans notre étude, il n’a pas eu de corrélation entre l’HRB et la CANO. Ces résultats sont en accord avec ceux de Lehtimaki en 2001 [24], prouvant que la CANO a interféré à la relation entre la FENO globale et la PD20.
Dans une étude récente de Delclaux et al. [11], le J’awNO et la CANO étaient tous les deux corrélés à la PD20 de MCH. En revanche, dans cette étude, les auteurs ont utilisé la méthode de mesure du NO expiré à 2 compartiments qui n’a donc pas tenu compte de la rétrodiffusion du NO à partir des bronches jusqu’aux alvéoles, conduisant faussement à une surestimation de la CANO. Yannicke et al. [17] ont mis en évidence que cette rétrodiffusion du NO était un facteur principal modifiant la CANO dans l’asthme et qu’après la correction, la CANO redevenait normale chez les asthmatiques. Nous avons ainsi proposé ce nouveau modèle selon Condorelli pour calculer le J’awNO et la CANO avec la compensation correcte de cette rétrodiffusion du NO afin de se rapprocher le mieux possible aux structures anatomiques de l’appareil respiratoire. Le modèle de la « trompette » (18) est capable de corriger la perte du NO bronchique induite par la rétrodiffusion du NO, permettant d’évaluer plus exactement les valeurs de J’awNO et de CANO.
La production des cytokines pro-inflammatoires en réponse aux antigènes est considérée comme un facteur premier conduisant à la biosynthèse excessive du NO par les NOS inductibles et à l’apparition de l’hyperréactivité bronchique [25]. Bien que les NOS inductibles sont la principale source du NO expiré [26], elles ne jouent pas un rôle clé dans la pathogénie de l’HRB [10]. Par contre, les deux autres isoformes, la NOS neuronale (NOS-1) et la NOS endothéliale (NOS-3), sont liées à l’HRB. Les études expérimentales ont démontré que la NOS-3 joue un rôle protecteur en inhibant l’HRB [27] et que la NOS1 induit la réactivité bronchique de manière indépendante de l’inflammation [28]. De plus, l’HRB est liée au remodelage des voies aériennes [25] dont le rôle du NO n’est pas clairement identifié.
Le débit bronchique maximal (J’awNO) reflète l’importance de la production endogène du NO et sa diffusion dans l’épithélium bronchique [29]. Une surexpression d’une des trois isoformes de NOS entraîne une augmentation du J’awNO, ce qui logiquement explique la corrélation entre le J’awNO et l’HRB non spécifique à la MCH.
Notre étude ont montré que la FENO et le J’awNO pourraient être utilisés pour détecter l’HRB. Par rapport à la FENO, le J’awNO s’est montré plus spécifique avec une sensibilité comparable dans cette application. Nous proposons alors de combiner ces deux paramètres évalués par une seule technique de mesure du NO expiré afin de connaître mieux son statut chez les asthmatiques. La FENO a une sensibilité élevée alors que la valeur diagnostique et la spécificité du J’awNO sont meilleurs. Chez un patient avec suspicion d’asthme, une valeur de FENO élevée nécessite un J’awNO pour confirmer la probabilité d’HRB positive.
La mesure du NO expiré semble facile à réaliser et moins dangereuse qu’à l’épreuve à la MCH. Il a été démontré que ces deux examens avaient la même valeur de diagnostique de l’asthme [13]. Néanmoins, la mesure du NO expiré ne peut remplacer le test à la méthacholine au vu de la littérature actuelle. Chacun de ces deux examens garde ses propres intérêts et le pouvoir de détection de l’asthme du NO expiré est imparfait.
La FENO devient utile en clinique lorsque le test à la MCH est irréalisable (contre-indications absolues ou chez un enfant ou dans les conditions dépourvues de matériels de réanimation et d’aide d’urgences médicales). L’épreuve de MCH ne semble pas nécessaire chez un patient ayant une augmentation importante de la FENO et du J’awNO, ou bien chez un patient avec une FENO parfaitement normale. Dans ces cas précis, la mesure du NO expiré peut remplacer le test à la MCH et fournit suffisamment de preuve pour établir un traitement satisfaisant de l’asthme.
CONCLUSION
Pour conclure, la mesure du NO expiré aux débits multiples nous permet de mieux connaître la relation entre le NO et l’HRB. Le débit bronchique maximal est plus spécifique que la FENO50 dans la prédiction de l’HRB et ces deux paramètres peuvent être utilisés ensemble pour détecter l’HRB dans les conditions où ne peut se réaliser le test de provocation bronchique.
CONFLICT D’INTERÊT
Aucun.
REFERENCES
1. Bousquet J, Jeffery PK, Busse WW, Johnson M, Vignola AM. Asthma. From bronchoconstriction to airways inflammation and remodeling. Am J Respir Crit Care Med 2000; 161: 1720–1745.
2. Tashkin DP, Altose MD, Connett JE, Kanner RE, Lee WW, Wise RA. Methacholine reactivity predicts changes in lung function over time in smokers with early chronic obstructive pulmonary disease. The Lung Health Study Research Group. Am J Respir Crit Care Med. 1996;153(6 Pt 1):1802–11.
3. O’Connor G, Sparrow D, Weiss S. A prospective longitudinal study of methacholine airway responsiveness as a predictor of pulmonary-function decline: the Normative Aging Study. Am J Respir Crit Care Med 1995; 152: 87–92
4. Crapo RO, Casaburi R, Coates AL, Enright PL, Hankinson JL, Irvin CG, MacIntyre NR, McKay RT, Wanger JS, Anderson SD, Cockcroft DW, Fish JE, Sterk PJ. Guidelines for methacholine and exercise challenge testing-1999. Am J Respir Crit Care Med. 2000;161(1):30929.
5. N. Scichilone, M. Messina, S. Battaglia, F. Catalano, V. Bellia. Airway hyperresponsiveness in the elderly: prevalence and clinical implications. Eur Respir J 2005; 25: 364–375.
6. Kharitonov SA, Barnes PJ. Exhaled markers of pulmonary disease. Am J Respir Crit Care Med. 2001 163 (7):1693-722
7. A Jatakanon, S Lim, S A Kharitonov, K F Chung, P J Barnes. Correlation between exhaled nitric oxide, sputum eosinophils, and methacholine responsiveness in patients with mild asthma. Thorax 1998; 53: 91–95 91.
8. Strunk RC, Szefler SJ, Phillips BR, Zeiger RS, Chinchilli VM, Larsen G, Hodgdon K, Morgan W, Sorkness CA, Lemanske RF Jr; Childhood Asthma Research and Education Network of the National Heart, Lung, and Blood Institute. Relationship of exhaled nitric oxide to clinical and inflammatory markers of persistent asthma in children. J Allergy Clin Immunol. 2003;112(5):883-92.
9. Henriksen AH, Lingaas-Holmen T, Sue-Chu M, Bjermer L. Combined use of exhaled nitric oxide and airway hyperresponsiveness in characterizing asthma in a large population survey. Eur Respir J2000;15:849-55.
10. Meurs, R. Gosens and J. Zaagsma. SERIES ‘‘CELL AND ANIMAL STUDIES IN RESPIRATORY MEDICINE’’, Edited by R. Farre´ and A.T. Dinh-Xuan, Number 3 in this Series. Airway hyperresponsiveness in asthma: lessons from in vitro model systems and animal models. Eur Respir J 2008; 32: 487–502.
11. Delclaux C, Zerah-Lancner F, Mahut B, Ribeil S, Dubois A, Larger C, Harf A. Alveolar nitric oxide and effect of deep inspiration during methacholine challenge. Chest. 2005;127(5):1696-702.
12. Silvestri M, Spallarossa D, Battistini E, Brusasco V, Rossi GA. Dissociation between exhaled nitric oxide and hyperresponsiveness in children with mild intermittent asthma. Thorax. 2000;55(6):484-8
13. Berkman N, Avital A, Breuer R, Bardach E, Springer C, Godfrey S. Exhaled nitric oxide in the diagnosis of asthma: comparison with bronchial provocation tests. Thorax. 2005;60(5):383-8.
14. Grönke, L.; Kanniess, F; Holz, O; Jörres, R. A; Magnussen, H. The relationship between airway hyperresponsiveness, markers of inflammation and lung function depends on the duration of the asthmatic disease. Clinical & Experimental Allergy 2002 , 7: 57-63.
15. Tsoukias NM, George SC. A two-compartment model of pulmonary nitric oxide exchange dynamics. J Appl Physiol 1998; 85:653–666.
16. James L. Puckett, Steven C. George. NO Measurement Differentiates between Alveolar and Bronchial Inflammation. Respiratory Physiology & Neurobiology 163; 2008;12; 166–177.
17. Kerckx Y, Michils A, Van Muylem A. Airway contribution to alveolar nitric oxide in healthy subjects and stable asthma patients. J Appl Physiol. 2008; 104(4):91.
18. Peter Condorelli, Hye-Won Shin, Anna S. Aledia, Philip E. Silkoff and Steven C Geogres. A simple technique to characterize proximal and peripheral nitric oxide exchange using constant flow exhalations and an axial diffusion model. J Appl Physiol 2007; 102: 417– 425.
19. American Thoracic Society; European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide. Am J Respir Crit Care Med. 2005; 171(8):912-30.
20. Miller MR, Hankinson J, Brusasco V, Burgos F, Casaburi R, Coates A, Crapo R, Enright P, van der Grinten CP, Gustafsson P, Jensen R, Johnson DC, MacIntyre N, McKay R, Navajas D, Pedersen OF, Pellegrino R, Viegi G, Wanger J; ATS/ERS Task Force. Standardisation of spirometry. Eur Respir J. 2005;26(2):319-38.
21. MAARTEN Van Den BERGE, RONALD J. MEIJER, HUIB A. M. KERSTJENS, DOROTHEA M. de REUS, GERARD H. KOËTER, HENK F. KAUFFMAN, and DIRKJE S. POSTMA. PC20 Adenosine 5'Monophosphate Is More Closely Associated with Airway Inflammation in Asthma Than PC20 Methacholine. Am. J. Respir. Crit. Care Med 2001,163(5):1546-1550.
22. Högman, M., Anderson, S.D., Hakansson, L., Ludviksdottir, D., Merilainen, P., George, S.C., 1999). Increased airway production of nitric oxide in asthmatics determined by elimination rate flow diagram (abstract). Am J Respir Crit Care Med. 1999; 159, A862.
23. Lehtimäki, L., Kankaanranta, H., Saarelainen, S., Turjanmaa, V., Moilanen, E. Inhaled fluticasone decreases bronchial but not alveolar nitric oxide output in asthma. Eur. Respir. J;2001;18: 635–639.
24. Lehtimaki L, Kankaanranta H, Saarelainen S, et al. Extended exhaled NO measurement differentiates between alveolar and bronchial inflammation. Am J Respir Crit Care Med 2001; 163:1557–1561.
25. Cockcroft DW, Davis BE. Mechanisms of airway hyperresponsiveness. J Allergy Clin Immunol. 2006;118 (3):551-9;
26. Yates, D.H., S.A. Kharitonov, P.S. Thomas, and P.J. Barnes. Endogenous nitric oxide is decreased in asthmatic patients by an inhibitor of inducible nitric oxide synthase. Am. J. Respir. Crit. Care Med. 1996; 154:247– 250.
27. Feletou M, Lonchampt M, Coge F, Galizzi JP, Bassoullet C, Merial C, Robineau P, Boutin JA, Huang PL, Vanhoutte PM, Canet E. Regulation of murine airway responsiveness by endothelial nitric oxide synthase. Am J Physiol Lung Cell Mol Physiol 2001; 281: L258– L267.
28. De Sanctis GT, Metha S, Kobzik L, Yandava C, Jiao A, Huang PL, and Drazen JM. Contribution of type I NOS to expired gas NO and bronchial responsiveness in mice. Am J Physiol Lung Cell Mol Physiol. 1997;273: 883–888.
29. Shin HW, Rose-Gottron CM, Cooper DM, Newcomb RL, George SC. Airway diffusing capacity of nitric oxide and steroid therapy in asthma. J Appl Physiol. 2004 Jan;96(1):65-75.
FIGURES/TABLES
REFERENCES
1. Bousquet J, Jeffery PK, Busse WW, Johnson M, Vignola AM. Asthma. From bronchoconstriction to airways inflammation and remodeling. Am J Respir Crit Care Med 2000; 161: 1720–1745.
2. Tashkin DP, Altose MD, Connett JE, Kanner RE, Lee WW, Wise RA. Methacholine reactivity predicts changes in lung function over time in smokers with early chronic obstructive pulmonary disease. The Lung Health Study Research Group. Am J Respir Crit Care Med. 1996;153(6 Pt 1):1802–11.
3. O’Connor G, Sparrow D, Weiss S. A prospective longitudinal study of methacholine airway responsiveness as a predictor of pulmonary-function decline: the Normative Aging Study. Am J Respir Crit Care Med 1995; 152: 87–92
4. Crapo RO, Casaburi R, Coates AL, Enright PL, Hankinson JL, Irvin CG, MacIntyre NR, McKay RT, Wanger JS, Anderson SD, Cockcroft DW, Fish JE, Sterk PJ. Guidelines for methacholine and exercise challenge testing-1999. Am J Respir Crit Care Med. 2000;161(1):30929.
5. N. Scichilone, M. Messina, S. Battaglia, F. Catalano, V. Bellia. Airway hyperresponsiveness in the elderly: prevalence and clinical implications. Eur Respir J 2005; 25: 364–375.
6. Kharitonov SA, Barnes PJ. Exhaled markers of pulmonary disease. Am J Respir Crit Care Med. 2001 163 (7):1693-722
7. A Jatakanon, S Lim, S A Kharitonov, K F Chung, P J Barnes. Correlation between exhaled nitric oxide, sputum eosinophils, and methacholine responsiveness in patients with mild asthma. Thorax 1998; 53: 91–95 91.
8. Strunk RC, Szefler SJ, Phillips BR, Zeiger RS, Chinchilli VM, Larsen G, Hodgdon K, Morgan W, Sorkness CA, Lemanske RF Jr; Childhood Asthma Research and Education Network of the National Heart, Lung, and Blood Institute. Relationship of exhaled nitric oxide to clinical and inflammatory markers of persistent asthma in children. J Allergy Clin Immunol. 2003;112(5):883-92.
9. Henriksen AH, Lingaas-Holmen T, Sue-Chu M, Bjermer L. Combined use of exhaled nitric oxide and airway hyperresponsiveness in characterizing asthma in a large population survey. Eur Respir J2000;15:849-55.
10. Meurs, R. Gosens and J. Zaagsma. SERIES ‘‘CELL AND ANIMAL STUDIES IN RESPIRATORY MEDICINE’’, Edited by R. Farre´ and A.T. Dinh-Xuan, Number 3 in this Series. Airway hyperresponsiveness in asthma: lessons from in vitro model systems and animal models. Eur Respir J 2008; 32: 487–502.
11. Delclaux C, Zerah-Lancner F, Mahut B, Ribeil S, Dubois A, Larger C, Harf A. Alveolar nitric oxide and effect of deep inspiration during methacholine challenge. Chest. 2005;127(5):1696-702.
12. Silvestri M, Spallarossa D, Battistini E, Brusasco V, Rossi GA. Dissociation between exhaled nitric oxide and hyperresponsiveness in children with mild intermittent asthma. Thorax. 2000;55(6):484-8
13. Berkman N, Avital A, Breuer R, Bardach E, Springer C, Godfrey S. Exhaled nitric oxide in the diagnosis of asthma: comparison with bronchial provocation tests. Thorax. 2005;60(5):383-8.
14. Grönke, L.; Kanniess, F; Holz, O; Jörres, R. A; Magnussen, H. The relationship between airway hyperresponsiveness, markers of inflammation and lung function depends on the duration of the asthmatic disease. Clinical & Experimental Allergy 2002 , 7: 57-63.
15. Tsoukias NM, George SC. A two-compartment model of pulmonary nitric oxide exchange dynamics. J Appl Physiol 1998; 85:653–666.
16. James L. Puckett, Steven C. George. NO Measurement Differentiates between Alveolar and Bronchial Inflammation. Respiratory Physiology & Neurobiology 163; 2008;12; 166–177.
17. Kerckx Y, Michils A, Van Muylem A. Airway contribution to alveolar nitric oxide in healthy subjects and stable asthma patients. J Appl Physiol. 2008; 104(4):91.
18. Peter Condorelli, Hye-Won Shin, Anna S. Aledia, Philip E. Silkoff and Steven C Geogres. A simple technique to characterize proximal and peripheral nitric oxide exchange using constant flow exhalations and an axial diffusion model. J Appl Physiol 2007; 102: 417– 425.
19. American Thoracic Society; European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide. Am J Respir Crit Care Med. 2005; 171(8):912-30.
20. Miller MR, Hankinson J, Brusasco V, Burgos F, Casaburi R, Coates A, Crapo R, Enright P, van der Grinten CP, Gustafsson P, Jensen R, Johnson DC, MacIntyre N, McKay R, Navajas D, Pedersen OF, Pellegrino R, Viegi G, Wanger J; ATS/ERS Task Force. Standardisation of spirometry. Eur Respir J. 2005;26(2):319-38.
21. MAARTEN Van Den BERGE, RONALD J. MEIJER, HUIB A. M. KERSTJENS, DOROTHEA M. de REUS, GERARD H. KOËTER, HENK F. KAUFFMAN, and DIRKJE S. POSTMA. PC20 Adenosine 5'Monophosphate Is More Closely Associated with Airway Inflammation in Asthma Than PC20 Methacholine. Am. J. Respir. Crit. Care Med 2001,163(5):1546-1550.
22. Högman, M., Anderson, S.D., Hakansson, L., Ludviksdottir, D., Merilainen, P., George, S.C., 1999). Increased airway production of nitric oxide in asthmatics determined by elimination rate flow diagram (abstract). Am J Respir Crit Care Med. 1999; 159, A862.
23. Lehtimäki, L., Kankaanranta, H., Saarelainen, S., Turjanmaa, V., Moilanen, E. Inhaled fluticasone decreases bronchial but not alveolar nitric oxide output in asthma. Eur. Respir. J;2001;18: 635–639.
24. Lehtimaki L, Kankaanranta H, Saarelainen S, et al. Extended exhaled NO measurement differentiates between alveolar and bronchial inflammation. Am J Respir Crit Care Med 2001; 163:1557–1561.
25. Cockcroft DW, Davis BE. Mechanisms of airway hyperresponsiveness. J Allergy Clin Immunol. 2006;118 (3):551-9;
26. Yates, D.H., S.A. Kharitonov, P.S. Thomas, and P.J. Barnes. Endogenous nitric oxide is decreased in asthmatic patients by an inhibitor of inducible nitric oxide synthase. Am. J. Respir. Crit. Care Med. 1996; 154:247– 250.
27. Feletou M, Lonchampt M, Coge F, Galizzi JP, Bassoullet C, Merial C, Robineau P, Boutin JA, Huang PL, Vanhoutte PM, Canet E. Regulation of murine airway responsiveness by endothelial nitric oxide synthase. Am J Physiol Lung Cell Mol Physiol 2001; 281: L258– L267.
28. De Sanctis GT, Metha S, Kobzik L, Yandava C, Jiao A, Huang PL, and Drazen JM. Contribution of type I NOS to expired gas NO and bronchial responsiveness in mice. Am J Physiol Lung Cell Mol Physiol. 1997;273: 883–888.
29. Shin HW, Rose-Gottron CM, Cooper DM, Newcomb RL, George SC. Airway diffusing capacity of nitric oxide and steroid therapy in asthma. J Appl Physiol. 2004 Jan;96(1):65-75.
ARTICLE INFO
DOI: 10.12699/jfvp.3.8.2012.52
Conflict of Interest
Non
Date of manuscript receiving
17/3/2012
Date of publication after correction
15/7/2012
Article citation
Le-Dong N.N, Duong-Quy S, Hua-Huy T, Dinh-Xuan A.T. Role of different parameters of exhaled NO in detection of bronchial hyperresponsiveness. J Func Vent Pulm 2012;03(08):52-59.