
 English
English
 French
French
Hémorragie intra-alvéolaire au cours d’une thyroïdite de Hashimoto
Alveolar hemorrhage in Hashimoto’s thyroiditis
L. Baili1, B. Ben Dhaou1, Z. Aydi1, F. Boussema1, Faouzi El Mezni2, L. Rokbani1
1: Service de Médecine Interne, Hôpital Habib Thameur Tunis Tunisie
2: Service d'Anatomie Pathologique, Hôpital de Pneumo-Phtisiologie Abderrahman-Mami
Université de Tunis El Manar. Faculté de Médecine de Tunis. Ariana Tunisie
Corresponding author
Dr. Besma Ben Dhaou Hmaidi
Service de Médecine Interne. Hôpital Habib Thameur Tunis
Université de Tunis El Manar. Faculté de Médecine de Tunis. Ariana Tunisie
E-mail: besma_2@yahoo.fr
ABSTRACT
Auto-immune thyroiditis or Hashimoto’s thyroiditis is the most frequent organ-specific autoimmune disease.
A variety of systemic manifestations have been described in association with autoimmune thyroiditis. Although the possible pathogenesis of these manifestations is not completely established, responsibility of the autoimmunity process is incriminated: including a role of antibodies, characteristics of autoimmune thyroiditis a possible overlap between autoimmune thyroiditis and some autoimmune rheumatic disease and systemic inflammatory reaction associated with thyroiditis.
Among the most frequent systemic manifestations, there are rheumatic and cutaneous disorders. To our knowledge, occurrence of isolated alveolar hemorrhage in Hashimoto’s thyroiditis has been never described.
By the way, we report a case of alveolar hemorrhage as a unique systemic manifestation of Hashimoto’s thyroiditis in a 62 year-old woman. Evolution of alveolar hemorrhage was favorable with corticoid and immunosuppressive treatment.
KEYWORDS: Autoimmune thyroiditis, Hashimoto’s thyroiditis, idiopathic haemosiderosis, pulmonary alveolar hemorrhage
RESUME
La thyroïdite chronique auto-immune ou la thyroïdite de Hashimoto, est la maladie auto-immune spécifique d’organe la plus fréquemment rencontrée.
De nombreuses manifestations systémiques ont été décrites comme étant associées aux thyroïdites auto-immunes. Elles sont dominées par les atteintes articulaires, musculaires et cutanées. Si la physiopathologie exacte de ces manifestations n’est pas totalement élucidée, le rôle du système immunitaire est de plus en plus incriminé: intervention des auto-anticorps caractéristiques des thyroïdites auto-immunes, syndrome de chevauchement entre thyroïdite auto-immune et d’autres maladies systémiques, réaction inflammatoire systémique associée à la thyroïdite.
La survenue d’une hémorragie intra-alvéolaire au cours de la thyroïdite de Hashimoto en dehors de toute connectivite ou vascularite n’a jamais été décrite.
Nous rapportons pour la première fois l’observation d’une patiente de 62 ans ayant présenté une hémorragie intraalvéolaire comme seule manifestation systémique d’une thyroïdite de Hashimoto. L’évolution de l’hémorragie intraalvéolaire sous traitement corticoïde et immunosuppresseur était favorable.
MOTS CLES: Thyroïdite auto-immune, thyroïdite de Hashimoto, hémosidérose idiopathique, hémorragie intra-alvéolaire
INTRODUCTION
La thyroïdite chronique auto-immune, encore appelée thyroïdite chronique lymphocytaire ou thyroïdite de Hashimoto (TH), est la maladie auto-immune spécifique d’organe la plus fréquemment observée. Elle est caractérisée par l’association d’une infiltration lymphocytaire diffuse de la glande thyroïde, d’anticorps antithyroïdiens dans le sérum et de signes cliniques de dysthyroïdie de type et d’intensité variable [1,2].
Même si les mécanismes physiopathologiques de la TH ne sont pas totalement expliqués, le rôle du système immunitaire est démontré par de nombreux éléments tels que l’existence d’une activation des lymphocytes T CD4 [3], l’expression des antigènes HLA de classe II induite par l’interféron [4], la stimulation des cellules B auto-réactives [5] et la régulation cytokinique des voies de l’apoptose [6].
Des manifestations systémiques ont été décrites dans de nombreuses observations de TH. Elles sont dominées par les atteintes articulaires, musculaires et cutanées. Ces manifestations systémiques peuvent être attribuées à une maladie auto-immune associée telles qu’un syndrome de Gougerot-Sjögren (SGS), une polyarthrite rhumatoïde (PR), un lupus érythémateux systémique (LES) ou une sclérodermie systémique (SS) formant dans ce cas un syndrome de chevauchement. Elles peuvent aussi être expliquées par les mécanismes auto-immuns impliqués dans la genèse de la TH.
La survenue d’une hémorragie intra-alvéolaire (HIA) au cours de la TH en dehors de toute cause évidente en particulier infectieuse ou immune n’a jamais été décrite à notre connaissance. Nous rapportons l’observation d’une patiente ayant présenté une HIA au cours d’une TH.
OBSERVATION
Données cliniques
Mme SH, âgée de 62 ans, aux antécédents de diabète de type 2 insulino-nécessitant a été adressée pour aggravation récente d’une dyspnée stade 3. Son diabète, évoluant depuis 1990, était compliqué d’un accident vasculaire cérébral ischémique, d’une cardiopathie ischémique avec triple sténose coronarienne, d’une néphropathie et d’une rétinopathie diabétiques ainsi qu’une hypertension artérielle. Sa dyspnée, datant de un mois, était associée à une toux, des crachats hémoptoiques, une fièvre chiffrée à 39°C et une altération de l’état général. Elle a été traitée par plusieurs antibiothérapies mais l’ évolution clinique a été marquée par l’aggravation
de la dyspnée. L’examen physique à l’admission de la patiente a objectivé une fébricule à 37,8°C, une pâleur cutanéo-muqueuse et des râles crépitants fins aux deux bases pulmonaires. Il n’y avait ni goitre, ni exophtalmie, ni signes d’insuffisance cardiaque gauche ou droite.
Examens complémentaires
Les bandelettes urinaires étaient négatives. La biologie a montré un syndrome inflammatoire biologique: C-réactive protéine: 104 mg/l, VS: 75 mm, fibrinogène: 5 g/l. La numération-formule sanguine a révélé une anémie normocytaire avec une hémoglobine à 8 g/dl, (VGM: 84fL), des globules blancs à 11G/l à prédominance PNN (8,6G/l). Il n’y avait ni hyper-éosinophilie, ni lymphopénie.
Une insuffisance rénale modérée a aussi été mise en évidence avec une urée plasmatique à 12,6 mmol/ l (VN, valeurs normales: 2,5 -7,5), une créatinémie à 103 µmol/l (VN: 50 -100) et une clairance de la créatine à 32 ml/mn. La protéinurie des 24 heures était à 0,2 g. Il n’y avait ni hématurie, ni leucocyturie à l’étude cytobactériologique des urines. Le bilan thyroïdien a objectivé une hyperthyroïdie périphérique avec une TSH à 0,06 mUI/l (VN: 0,35,6) et une FT4 à 41 pmol/l (VN: 7-23). Il y avait une hypocholestérolémie à 2,6 mmol/l (VN: 3,6-5,2) et un taux normal des triglycérides à 0,8 mmol/l (VN: 0,61,9). Le bilan d’hémostase était sans anomalie (TP: 100%, TCA M/T: 32/32 sec) et le chiffre des plaquettes était normal.
L’électrocardiogramme a objectivé une arythmie complète par fibrillation auriculaire (ACFA) rapide à 100 c/mn. L’étude de la gazométrie artérielle à l’air ambiant a montré une hypoxie à 75 mmHg, une hypocapnie à 32 mmHg et une saturation en oxygène à 94%.
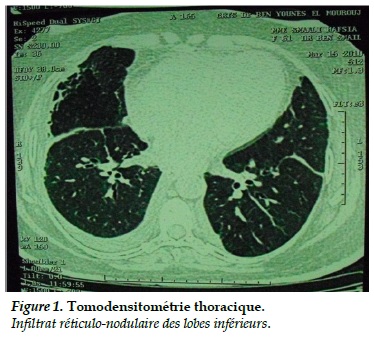
La radiographie thoracique a montré un émoussement du cul de sac pleural gauche sans cardiomégalie, ni images alvéolaires. L’échographie cardiaque a montré une cardiopathie hypertensive avec une fraction d’éjection du ventricule gauche à 60% sans valvulopathie, ni thrombus intracardiaque. L’échographie cervicale a montré une glande thyroïde de taille et d’aspect normaux. Le scanner thoracique a montré un aspect d’infiltrat réticulo-nodulaire du lobe moyen et des deux lobes inférieurs associé à une lame d’épanchement pleural gauche (Figure 1).
La fibroscopie bronchique a montré un aspect macroscopique normal de la muqueuse bronchique. Le liquide d’aspiration bronchique était clair. L’étude bactériologique et la recherche du bacille de Koch dans le liquide bronchique étaient négatives à l’examen direct et à la culture.
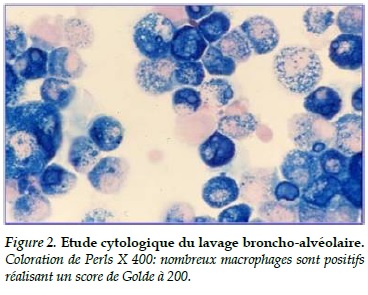
L’étude cytologique du liquide d’aspiration bronchique a montré un liquide de type inflammatoire sans cellule maligne. L’étude anatomopathologique de la biopsie bronchique a objectivé une muqueuse bronchique inflammatoire sans granulome, ni nécrose caséeuse. L’étude du lavage bronchoalvéolaire (LBA) a révélé une formule hypercellulaire faite de nombreux macrophages alvéolaires et d’hématies et un score de Golde à 200 faisant suspecter le diagnostic de HIA (Figure 2).
Ce diagnostic a alors été retenu devant la dyspnée, l’hémoptysie, les râles crépitants à l’auscultation pulmonaire, l’anémie, le syndrome interstitiel au scanner thoracique et les données de l’étude cytologique du LBA. Il n’y avait pas de signes extra-pulmonaires associée à cette HIA tels qu’un rash malaire, un purpura vasculaire, une arthrite, une atteinte ORL, ou d’atteinte rénale de type glomérulaire.
Les anticorps antinucléaires et anti-phospholipides étaient négatifs. La recherche des anticorps antimembrane basale, anti-cytoplasme des polynucléaires neutrophiles et d’une cryoglobulinémie était négative. Le complément n’était pas consommé.
Concernant l’hyperthyroïdie périphérique, il n’y avait ni exophtalmie, ni goitre vasculaire et les anticorps anti-récepteurs de la TSH étaient négatifs. Une thyroidite auto-immune (TAI) type TH a alors été retenue devant la présence d’anticorps antiperoxydase (anti-TPO) à 200 mUI/l (VN inférieure à 150). Les anticorps anti-thyroglobulines étaient à 50 mUI/l (VN inférieure à 100).
Traitement
Devant la gravité du tableau clinique avec en particulier une hypoxie avec désaturation en oxygène, elle a été traitée par oxygénothérapie, β-bloquants et benzylthiouracile.
Une corticothérapie et un traitement immunosuppresseur ont été rapidement instaurés. La patiente a reçu 1g de méthylprédnisolone par jour pendant trois jours relayés par la prednisone à la dose de 1mg/kg/j pendant 4 semaines et associés à 6 bolus bimensuels de cyclophosphamide relayé ensuite par azathioprine a aussi été instauré.
L’évolution
L’évolution clinique et biologique de la patiente était favorable avec amélioration de la dyspnée et disparition du syndrome inflammatoire biologique. L’hémoglobine de contrôle était à 12g/dl. L’évolution de l’hyperthyroïdie a aussi été favorable avec disparition de l’ACFA et retour en rythme sinusal mais aussi l’obtention d’une euthyroîdie clinique et biologique (TSH: 2.1 mUI/l, FT4: 5.81 pmol/l).
DISCUSSION
Les causes des HIA sont nombreuses et variées, comprenant des causes immunologiques (HIA immunes) et des causes non immunologiques (HIA non immunes) [7]. Parmi les causes non immunes, un rétrécissement mitral ou une insuffisance ventriculaire gauche par le biais d’une hypertension veineuse peuvent être à l’origine d’une HIA [8]. La présence d’une cardiopathie ischémique avec triple sténose coronarienne et d’une ACFA rapide par cardiothyréose dans notre observation n’ont pas été incriminées comme cause de l’HIA devant les données échocardiographiques.
De nombreux agents médicamenteux ou toxiques, non retrouvées chez notre patiente, sont incriminés dans la survenue d’HIA tels que la D-pénicillamine (trolovol®) ou l’amiodarone (cordarone®) [9] mais aussi l’inhalation de certains toxiques comme la cocaïne [10]. De multiples autres causes à l’origine d’hémorragie alvéolaire sont inventoriées, tumorales [11-13] et infectieuses (leptospirose) [14] ou certaines viroses comme la grippe maligne et les hantavirus [15]. La présentation clinique et la résistance de la symptomatologie à plusieurs antibiothérapies à large spectre ainsi que la négativité des examens bactériologiques du liquide bronchique et du LBA n’étaient pas en faveur des étiologies infectieuses.
La liste des HIA d’origine immune est longue, bien qu’en réalité trois causes prédominent: les vascularites, la maladie de Goodpasture, et les connectivites. Les HIA immunes réalisent le plus souvent un syndrome pneumo-rénal, caractérisé par un des éléments de la triade suivante: protéinurie (entre 1 et 3 g/24 h), une hématurie, et/ou une insuffisance rénale rapidement progressive [16].
Le diagnostic d’une vascularite systémique sous jacente à cette HIA chez notre patiente telle qu’une maladie de Wegener ou une polyangéite microscopique était peu probable. Il n’y avait, en effet, ni atteinte cutanée à type de purpura vasculaire, ni signes ORL, ni atteinte rénale de type glomérulaire, ni hématurie et ni insuffisance rénale rapidement progressive. D’autre part, la négativité des anticorps anti-cytoplasme des polynucléaires neutrophiles, de la cryoglobulinémie et l’absence de capillarite et de granulome vasculaire ou extravasculaire à la biopsie bronchique était contre l’hypothèse d’une vascularite systémique.
Les connectivites telles qu’un LES associé ou non à un syndrome des anticorps anti-phospholipides, une PR, une SS ou une polymyosite ont aussi été incriminées dans les HIA immune [17-20]. Chez notre patiente, l’absence de rash malaire, de photosensibilité, de sérite et la négativité des anticorps anti -nucléaires, des anti-phospholipides ainsi que la normalité des fractions du complément étaient tous des arguments contre l’hypothèse d’une connectivite.
Enfin, la maladie à anticorps anti-membrane basale ou le syndrome de Goodpasture dans sa forme pulmonaire isolée sans atteinte rénale peut être cause de HIA. L’absence de signe anatomopathologique à la biopsie bronchique mais aussi la négativité des anticorps anti-membranes basales rendent ce diagnostic peu probable. Dans notre observation, le diagnostic de HIA « idiopathique » repose sur le caractère isolé de celle-ci et l’absence d’arguments cliniques, biologiques ou histologiques en faveur d’une vascularite ou d’une connectivite [21].
L’origine immune de l’HIA idiopathique parait la plus vraisemblable. Plusieurs arguments plaident en faveur de cette hypothèse: l’évolution de certaines HIA considérées initialement comme idiopathiques vers une maladie systémique comme un LES, une granulomatose de Wegener ou une PAN [22-24], l’association des HIA idiopathiques avec des maladies immunes telles qu’une maladie cœliaque ou anémie hémolytique auto-immune [25-27] et l’ efficacité des corticoïdes voire des immunosuppresseurs.
Dans une étude concernant 34 cas de HIA avec capillarite pulmonaire prouvée histologiquement, une maladie systémique a été retrouvée dans 21 cas: un syndrome de goodpasture (4 cas), une maladie de Wegener (11 cas), une vascularite systémique nécrosante non classée (3 cas), un LES (2 cas), une PR (1 cas), une arthrite chronique juvénile séronégative (1 cas). Une maladie auto-immune limitée à un ou deux organes a été mise en évidence dans 9 cas: un cas de néphropathie à Ig A, 3 cas de glomérulonéphrite idiopathique dont 2 avec complexes immuns circulants et 5 cas de syndrome pneumo-rénal non classé [28].
La survenue simultanée de la TH et de la HIA illustrée par notre observation fait discuter du caractère fortuit ou non de cette association. Compte tenu de leur fréquence, les TAI se trouvent souvent associées à d’autres pathologies dys-immunitaires ou non. Le caractère fortuit ou non de ces associations et leur signification physiopathologique ont été largement étudiées mais sans que les biais méthodologiques n’aient toujours été évités [29]. Les associations les mieux caractérisées sont celles des TAI et des maladies auto-immunes spécifiques d’organe, notamment dans le cadre de polyendocrinopathie auto-immune principalement de type 2.
Les TAI s’associent fréquemment au LES [30], à la PR [31] et au SGS [32]. L’association d’une HIA à une TAI a été rapportée dans deux cas de maladie de Basedow [33-34]. Des manifestations atypiques des TH ont aussi été décrites telles que l’encéphalopathie de Hashimoto avec ou sans troubles psychiatriques [35] indépendamment de la prise d’iode et non liée à l’état fonctionnel thyroïdien. Cette encéphalopathie est caractérisée par la présence d’un infiltrat lymphocytaire objectivé aux biopsies cérébrales et une bonne réponse à la corticothérapie. Un cas mortel de myocardite lymphocytaire aigue associée à une TH a aussi été décrit [36].
Si les manifestations systémiques décrites au cours des TH sont diverses, le lien causal avec la pathologie thyroïdienne reste discuté. Plusieurs arguments plaident en faveur de la responsabilité des mécanismes impliqués dans l’auto-immunité, plutôt que celle liée à la dysfonction thyroïdienne: certaines manifestations systémiques surviennent même chez les patients euthyroïdiens, certaines sont plus fréquentes chez les patients ayant une hypothyroïdie d’origine auto-immune par rapport à ceux ayant une hypothyroïdie sans thyroïdite auto-immune. Il est utile de connaitre ces associations, d’une part pour mettre en place dans certains cas un dépistage et d’’autre part en raison des possibilités thérapeutiques.
CONCLUSION
Dans certaines situations, la pathologie thyroïdienne auto-immune ne peut pas être tenue pour responsable des manifestations mais pourrait être le marqueur de la présence d’un autre processus autoimmun dont les antigènes sont encore inconnus.
CONFLIT D’INTERÊT
Aucun.
REFERENCES
1. Hashimoto H. Zur Kenntniss der lymphomatösen Veränderung der Schilddrüse (Struma lymphomatosa). Arch Klin Chir 1912; 97: 219– 48.
2. Dayan CM, Daniels GH. Chronic autoimmune thyroiditis. N Engl J Med 1996; 335: 99–107.
3. Weetman AP, McGregor AM. Autoimmune thyroid disease: further developments in our understanding. Endocr Rev 1994; 15: 788– 830.
4. Todd I, Pujol-Borrell R, Hammond LJ, Bottazzo GF, Feldmann M. Interferon-gamma induces HLA-DR expression by thyroid epithelium. Clin Exp Immunol 1985; 61: 265– 73.
5. Del Prete GF,Vercelli D, Tiri A, Maggi E, Mariotti S, Pinchera A, et al. In vivo activated cytotoxic T cells in the thyroid infiltrate of patients with Hashimoto’s thyroiditis. Clin Exp Immunol 1986; 65: 140– 7.
6. Stassi G, De Maria R. Autoimmune thyroid disease: new models of cell death in autoimmunity. Nat Rev Immunol 2002;2:195–204.
7. Silverman ES, Mark EJ. Case records of the Massachusetts General Hospital. Weekly clinicopathological exercises. Case 36-2002. A 32-year-old man with hemoptysis of nearly three decades’ duration. N Engl J Med 2002; 347: 1693– 701.
8. Denis M, Parrot A, Houacine S, Lafon B, Akoun G, Mayaud C. Conduite à tenir devant une hémorragie intra-alvéolaire asphyxiante de l’adulte commun. In : Actualités en réanimation et urgences. Paris: Arnette; 1992. p. 415–35.
9. Camus P, Bonniaud P, Fanton A, Camus C, Baudaun N, Foucher P. Clin Chest Med 2005; 25: 479– 519.
10. Mayaud C, Boussaud V, Saidi F, Parrot A. La pathologie bronchopulmonaire des toxicomanes. Rev Pneumol Clin 2001; 57: 259– 69.
11. Baird RD, Shee CD. Carcinoma-induced diffuse pulmonary haemorrhage. Hosp Med 2002; 63:176–7.
12. Segal SL, Lenchner GS, Cichelli AV, Promisloff RA, Hofman WI, Baiocchi GA. Angiosarcoma presenting as diffuse alveolar hemorrhage. Chest 1988; 94: 214– 6.
13. Spragg RG, Wolf PL, Haghighi P, Abraham JL, Astarita RW. Angiosarcoma of the lung with fatal pulmonary hemorrhage. Am J Med 1983; 74: 1072– 6.
14. Niwattayakul K, Homvijitkul J, Niwattayakul S, Khow O, Sitprija V. Hypotension, renal failure, and pulmonary complications in leptospirosis. Ren Fail 2002; 24: 297–305.
15. Ferreira MS, Nishioka S, Santos TL, Santos RP, Santos PS, Rocha AH. Antivirus pulmonary syndrome in Brazil: clinical aspects of three new cases. Rev Inst Med Trop Sao Paulo 2000;42:41–6.
16. Gallagher H, Kwan JT, Jayne DR. Pulmonary renal syndrome: a 4-year, single-center experience. Am J Kidney Dis 2002;39:42–7.
17. Santos-ocampo AS, Mandell B, Fessler B. Alveolar haemorrhage in systemic lupus erythematosus. Presentation and management. Chest 2000; 118:1083–90.
18. Schwarz MI, Zamora MR, Hodges TN, Chan ED, Bowler RP, Tuder RM. Isolated pulmonary capillaritis and diffuse alveolar hemorrhage in rheumatoid arthritis and mixed connective tissue disease. Chest 1998;113: 1609–15.
19. Bar J, Erhenfeld M, Rozemman J, Perelman M, Sidi Y, Gur H. Pulmonary-renal syndrome in systemic sclerosis. Semin Arthritis Rheum 2001; 30: 403–10.
20. Schwarz MI, Sutarik JM, Nick JA, Leff JA, Emlen JW, Tuder RM. Pulmonary capillaritis and diffuse alveolar hemorrhage. A primary manifestation of polymyositis. Am J Respir Crit Care Med 1995;151: 2037–40.
21. Leatherman JW, Davies SF, Hoidal JR. Alveolar hemorrhage syndromes: diffuse microvascular lung hemorrhage in immune and idiopathic disorders. Medicine 1984; 63(6): 343-61.
22. Leaker B, Cambridge G Du Bois RM. Nield GH. Idiopathic haemosiderosis: a form of microscopic polyarteritis? Thorax 1992; 47: 988-90.
23. O'Donohue WJ Jr. Idiopathic pulmonary hemosiderosis with manifestations of multiple connective tissue and immune disorders. Treatment with cyclophosphamide. Am Rev Respir Dis. 1974; 109(4): 473-9.
24. Quieffin J, Capron F. Critères diagnostiques, physiopathologiques et étiologiques des hémorragies alvéolaires. Rev Pneumol Clin 1992;48(4): 149-56. 25. Wright PH. Menzies IS. Pounder RE. Keeling PW. Adult idiopathic pulmonary haemosiderosis and coeliac disease. Q J Med. 1981; 50(197): 95-102.
26. Perelman S, Dupuy C, Bourrillon A. The association of pulmonary hemosiderosis and celiac disease. Apropos of a new case in a child. Ann Pediatr 1992; 39(3): 185-8.
27. Rafferty JR, Cook MK. Idiopathic pulmonary haemosiderosis with auto immune haemolytic anemia. C/re.st l984; 78: 282-5
28. Travis WD, Colby TV, Lombard C, Carpenter HA. A clinicopathologic study of 34 cases of diffuse pulmonary hemorrhage with lung biopsy confirmation. Am J Surg Pathol. 1990; 14(12): 1112-25.
29. Jenkins RC, Weetman AP. Disease associations with autoimmune thyroid disease. Thyroid. 2002; 12:977-88.
30. Weetman AP, Walport MJ. The association of autoimmune thyroiditis with systemic lupus erythematosus. Br J Rheumatol. 1987; 26(5): 359-61.
31. Silman AJ, Ollier WE, Bubel MA. Autoimmune thyroid disease and thyroid autoantibodies in rheumatoid arthritis patients and their families. Br J Rheumatol. 1989; 28(1): 18-21.
32. Hansen BU, Ericsson UB, Henricsson V, Larsson A, Manthorpe R, Warfvinge G. Autoimmune thyroiditis and primary Sjögren's syndrome: clinical and laboratory evidence of the coexistence of the two diseases. Clin Exp Rheumatol. 1991; 9(2):137-41.
33. Blain SC. Bryan RL, Hawkins JB. Idiopathic pulmonary haemosiderosis and auto immune thyrotoxicosis. Respir Med l989; 83: 347-50.
34. Nguyen TB, Gest V, Galezowski N,Blanche P, Got D, Reumont G . Hémorragies intra-pulmonaires associées à une maladie de Basedow. Rev Med interne 1996; l7:933-935.
35. Fatourechi V. Hashimoto's encephalopathy: myth or reality? An endocrinologist's perspective. Best Pract Res Clin Endocrinol Metab. 2005; 19(1): 53- 66.
36. Lorin De La Grandmaison G, Izembart M, Fornes P, Paraire F. Myocarditis associated with Hashimoto's disease: a case report. Int J Legal Med. 2003; 117 (6): 361- 4.
FIGURES
REFERENCES
1. Hashimoto H. Zur Kenntniss der lymphomatösen Veränderung der Schilddrüse (Struma lymphomatosa). Arch Klin Chir 1912; 97: 219– 48.
2. Dayan CM, Daniels GH. Chronic autoimmune thyroiditis. N Engl J Med 1996; 335: 99–107.
3. Weetman AP, McGregor AM. Autoimmune thyroid disease: further developments in our understanding. Endocr Rev 1994; 15: 788– 830.
4. Todd I, Pujol-Borrell R, Hammond LJ, Bottazzo GF, Feldmann M. Interferon-gamma induces HLA-DR expression by thyroid epithelium. Clin Exp Immunol 1985; 61: 265– 73.
5. Del Prete GF,Vercelli D, Tiri A, Maggi E, Mariotti S, Pinchera A, et al. In vivo activated cytotoxic T cells in the thyroid infiltrate of patients with Hashimoto’s thyroiditis. Clin Exp Immunol 1986; 65: 140– 7.
6. Stassi G, De Maria R. Autoimmune thyroid disease: new models of cell death in autoimmunity. Nat Rev Immunol 2002;2:195–204.
7. Silverman ES, Mark EJ. Case records of the Massachusetts General Hospital. Weekly clinicopathological exercises. Case 36-2002. A 32-year-old man with hemoptysis of nearly three decades’ duration. N Engl J Med 2002; 347: 1693– 701.
8. Denis M, Parrot A, Houacine S, Lafon B, Akoun G, Mayaud C. Conduite à tenir devant une hémorragie intra-alvéolaire asphyxiante de l’adulte commun. In : Actualités en réanimation et urgences. Paris: Arnette; 1992. p. 415–35.
9. Camus P, Bonniaud P, Fanton A, Camus C, Baudaun N, Foucher P. Clin Chest Med 2005; 25: 479– 519.
10. Mayaud C, Boussaud V, Saidi F, Parrot A. La pathologie bronchopulmonaire des toxicomanes. Rev Pneumol Clin 2001; 57: 259– 69.
11. Baird RD, Shee CD. Carcinoma-induced diffuse pulmonary haemorrhage. Hosp Med 2002; 63:176–7.
12. Segal SL, Lenchner GS, Cichelli AV, Promisloff RA, Hofman WI, Baiocchi GA. Angiosarcoma presenting as diffuse alveolar hemorrhage. Chest 1988; 94: 214– 6.
13. Spragg RG, Wolf PL, Haghighi P, Abraham JL, Astarita RW. Angiosarcoma of the lung with fatal pulmonary hemorrhage. Am J Med 1983; 74: 1072– 6.
14. Niwattayakul K, Homvijitkul J, Niwattayakul S, Khow O, Sitprija V. Hypotension, renal failure, and pulmonary complications in leptospirosis. Ren Fail 2002; 24: 297–305.
15. Ferreira MS, Nishioka S, Santos TL, Santos RP, Santos PS, Rocha AH. Antivirus pulmonary syndrome in Brazil: clinical aspects of three new cases. Rev Inst Med Trop Sao Paulo 2000;42:41–6.
16. Gallagher H, Kwan JT, Jayne DR. Pulmonary renal syndrome: a 4-year, single-center experience. Am J Kidney Dis 2002;39:42–7.
17. Santos-ocampo AS, Mandell B, Fessler B. Alveolar haemorrhage in systemic lupus erythematosus. Presentation and management. Chest 2000; 118:1083–90.
18. Schwarz MI, Zamora MR, Hodges TN, Chan ED, Bowler RP, Tuder RM. Isolated pulmonary capillaritis and diffuse alveolar hemorrhage in rheumatoid arthritis and mixed connective tissue disease. Chest 1998;113: 1609–15.
19. Bar J, Erhenfeld M, Rozemman J, Perelman M, Sidi Y, Gur H. Pulmonary-renal syndrome in systemic sclerosis. Semin Arthritis Rheum 2001; 30: 403–10.
20. Schwarz MI, Sutarik JM, Nick JA, Leff JA, Emlen JW, Tuder RM. Pulmonary capillaritis and diffuse alveolar hemorrhage. A primary manifestation of polymyositis. Am J Respir Crit Care Med 1995;151: 2037–40.
21. Leatherman JW, Davies SF, Hoidal JR. Alveolar hemorrhage syndromes: diffuse microvascular lung hemorrhage in immune and idiopathic disorders. Medicine 1984; 63(6): 343-61.
22. Leaker B, Cambridge G Du Bois RM. Nield GH. Idiopathic haemosiderosis: a form of microscopic polyarteritis? Thorax 1992; 47: 988-90.
23. O'Donohue WJ Jr. Idiopathic pulmonary hemosiderosis with manifestations of multiple connective tissue and immune disorders. Treatment with cyclophosphamide. Am Rev Respir Dis. 1974; 109(4): 473-9.
24. Quieffin J, Capron F. Critères diagnostiques, physiopathologiques et étiologiques des hémorragies alvéolaires. Rev Pneumol Clin 1992;48(4): 149-56. 25. Wright PH. Menzies IS. Pounder RE. Keeling PW. Adult idiopathic pulmonary haemosiderosis and coeliac disease. Q J Med. 1981; 50(197): 95-102.
26. Perelman S, Dupuy C, Bourrillon A. The association of pulmonary hemosiderosis and celiac disease. Apropos of a new case in a child. Ann Pediatr 1992; 39(3): 185-8.
27. Rafferty JR, Cook MK. Idiopathic pulmonary haemosiderosis with auto immune haemolytic anemia. C/re.st l984; 78: 282-5
28. Travis WD, Colby TV, Lombard C, Carpenter HA. A clinicopathologic study of 34 cases of diffuse pulmonary hemorrhage with lung biopsy confirmation. Am J Surg Pathol. 1990; 14(12): 1112-25.
29. Jenkins RC, Weetman AP. Disease associations with autoimmune thyroid disease. Thyroid. 2002; 12:977-88.
30. Weetman AP, Walport MJ. The association of autoimmune thyroiditis with systemic lupus erythematosus. Br J Rheumatol. 1987; 26(5): 359-61.
31. Silman AJ, Ollier WE, Bubel MA. Autoimmune thyroid disease and thyroid autoantibodies in rheumatoid arthritis patients and their families. Br J Rheumatol. 1989; 28(1): 18-21.
32. Hansen BU, Ericsson UB, Henricsson V, Larsson A, Manthorpe R, Warfvinge G. Autoimmune thyroiditis and primary Sjögren's syndrome: clinical and laboratory evidence of the coexistence of the two diseases. Clin Exp Rheumatol. 1991; 9(2):137-41.
33. Blain SC. Bryan RL, Hawkins JB. Idiopathic pulmonary haemosiderosis and auto immune thyrotoxicosis. Respir Med l989; 83: 347-50.
34. Nguyen TB, Gest V, Galezowski N,Blanche P, Got D, Reumont G . Hémorragies intra-pulmonaires associées à une maladie de Basedow. Rev Med interne 1996; l7:933-935.
35. Fatourechi V. Hashimoto's encephalopathy: myth or reality? An endocrinologist's perspective. Best Pract Res Clin Endocrinol Metab. 2005; 19(1): 53- 66.
36. Lorin De La Grandmaison G, Izembart M, Fornes P, Paraire F. Myocarditis associated with Hashimoto's disease: a case report. Int J Legal Med. 2003; 117 (6): 361- 4.
ARTICLE INFO
DOI: 10.12699/jfvp.3.8.2012.60
Conflict of Interest
Non
Date of manuscript receiving
9/2/2012
Date of publication after correction
15/7/2012
Article citation
Baili L, Ben Dhaou B, Aydi Z, Boussema F, Faouzi El Mezni, Rokbani L. Alveolar hemorrhage in Hashimoto’s thyroiditis. J Func Vent Pulm 2012;03(08):60-65.