
 English
English
 French
French
La pneumologie au 21ème siècle : de la génomique à la biologie des systèmes complexes
The pulmonology in 21th century : from genomic to biology of complex systems
A.T. Dinh-Xuan
Service de Physiologie - Explorations Fonctionnelles
Hôpital Cochin. 27, rue du Faubourg St Jacques. 75014 Paris - France
Corresponding author
Pr. Anh-Tuan DINH-XUAN
Service de Physiologie-EFR. Hôpital Cochin. 75014 Paris
E-mail: anh-tuan.dinh-xuan@cch.aphp.fr
Biologie des systemes complexes
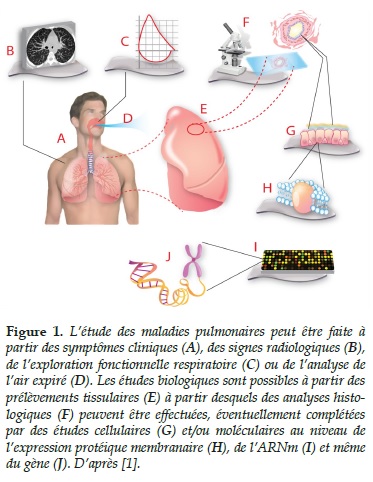
La complexité des poumons ne se limite pas à la distribution fractale de ses structures anatomiques. Cet organe représente un véritable défi cognitif tant la compréhension de ses nombreuses fonctions physiologiques, allant de la dynamique moléculaire (diffusion des molécules de gaz) aux lois biophysiques de la mécanique des fluides (débits aériens) et des structures élastiques (compliance pulmonaire) nécessite une approche intégrative, allant de la molécule jusqu’à l’organe entier (Figure 1). Une telle approche ne peut se faire aujourd’hui que grâce à l’utilisation des concepts modernes tels ceux fournis par la biologie des systèmes complexes [1, 2].
La physiologie des organes, comme la physiopathologie des maladies, sont bien sûr des domaines dont la complexité est érigée en dogme depuis l’origine des temps. Pour faire face à cette complexité, liée tant aux ramifications des concepts physiopathologiques qu’aux faibles performances des outils biologiques, le chercheur a jusqu’ici favorisé une approche réductionniste, partant de l’étude anatomique du corps entier, pour se focaliser ensuite à la physiologie des organes et finalement à la biologie des cellules et des molécules. Cette approche verticale et descendante, allant de la macroscopie à la micro-, voire « nano-scopie » (néologisme à la mode), permet d’isoler une composante (molécule) de l’ensemble auquel cette composante appartient. Elle a de plus le mérite de nous fournir des renseignements précis sur des éléments infiniment petits constitutifs de nos cellules, tissus et organes.
Très vite, l’on s’est rendu compte que le fonctionnement d’une molécule n’a de sens que lorsque celui-ci est intégré dans des réseaux moléculaires dont les interactions représentent d’autant de possibilités d’ échange de matière, d’énergie et d’informations dans la cellule [3]. Force est de constater que le concept réductionniste a trouvé là ses propres limites. C’est ainsi qu’une autre approche plus globale, intégrant les flux d’informations verticaux (allant de l’organe à la molécule) et les ramifications horizontales d’ interactions intermoléculaires, telle que celle proposée par la biologie des systèmes complexes, s’est peu à peu imposée à la médecine du 21ème siècle [4].
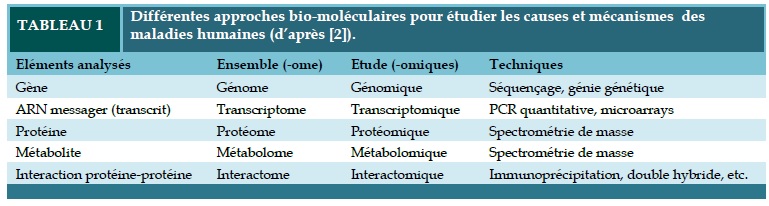
La biologie des systèmes complexes est caractérisée par une vision d’ensemble et exhaustive nécessitant une approche globale ou holistique (déjà préconisée par Claude Bernard !) du vivant. A l’ère de la biologie moderne, cette approche se caractérise surtout par l’avènement des techniques d’analyse moléculaire à haut débit où chaque molécule (gène ou ADN, transcrit ou ARN, produit protéique ou métabolique) n’est plus appréhendée de façon individuelle, mais « en masse » avec ses congénères. Les technologies à haut débit permettant cette approche globale ont donné naissance à des nouvelles disciplines biomédicales dont l’appellation se termine par le terme « omique » (Tableau 1), où le suffixe « ome » vient du sanscrit et signifie « totalité », et non du grec « ôma » terme habituellement utilisé pour désigner une tumeur. Ainsi l’identification de l’ensemble des gènes permet la description du génome et correspond à l’étude de la génomique, etc. (Tableau 1).
Métabolites, métabolome et métabolomique
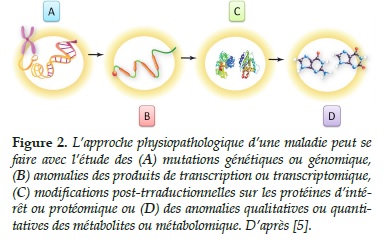
Les métabolites sont de petites molécules produites par des réactions chimiques régissant le métabolisme cellulaire. Puisque les métabolites sont assimilés à des produits finaux d’une chaîne de production partant des gènes et passant par leur transcription en ARN messagers et la traduction de ces derniers en protéines enzymatiques pour aboutir à la formation finale des métabolites (Figure 2), il est licite de penser qu’une anomalie du métabolome (qui représente l’ensemble des métabolites impliqués dans une maladie) est plus représentative des phénotypes associés à des maladies respiratoires que des anomalies jusqu’alors décrites à propos des génomes ou autres transcriptomes ou protéomes [5]. Ainsi l’étude du métabolome a montré son intérêt diagnostique dans le syndrome de détresse respiratoire aigüe de l’adulte causée par le virus grippal H1N1 [6].
Une approche systématique (sans a priori) a également permis aux auteurs espagnols de mettre en évidence le rôle clé des dérivés des lipides membranaires dans les lésions alvéolaires induite par la ventilation [7]. La métabolomique peut aussi favoriser une meilleure compréhension de la physiopathologie des maladies inflammatoires bronchiques comme l’asthme [8, 9], la mucovicisdose [9] et la BPCO [9-11]. L’étude du métabolome serait également intéressante dans d’autres maladies, comme l’hypertension artérielle [12] ou le choc septique [13, 14].
CONCLUSION
Il nous est désormais nécessaire d’adopter une approche globale où la génomique (qui fut tellement à la mode dans les années 2000) ne peut expliquer qu’une partie, mais pas la totalité des mécanismes physiopathologiques des maladies respiratoires. Il existe au moins deux raisons pour expliquer cette insuffisance (relative) de l’apport de l’étude du génome humain. Premièrement, des anomalies phénotypiques peuvent survenir en l’absence de modifications génétiques, avec notamment l’ intervention des mécanismes épigénétiques [15]. Dans ce contexte, l’apport de la métabolomique et l’étude des interactions entre différents métabolites cellulaires semble d’une utilité plus grande que le simple séquençage des gènes et la description de leurs mutations et/ou polymorphismes (Tableau 1). L’étude des interactions moléculaires nous amène naturellement à la deuxième raison justifiant l’approche globale précitée. En effet, dans un organisme sain et/ou malade, les molécules (ou autres cellules et tissus) fonctionnent en réseau, et non pas isolément. Une même anomalie d’une composante de ce réseau affectera différemment les individus selon la robustesse des autres composantes et leurs capacités à plus ou moins suppléer la composante défaillante.
Après l’ère des études individuelles de chaque organe, tissu, cellule, voire molécule (selon une approche descendante et réductionniste), la biologie des systèmes complexes s’impose désormais comme une évidence, voire une nécessité, permettant une approche globale et holistique des études des maladies humaines en général, et les affections respiratoires en particulier.
Remerciements
L’auteur remercie le Dr Nhat-Nam LE-DONG pour son aide dans la réalisation des figures.
CONFLIT D’INTERETS
Aucun.
REFERENCES
1. Auffray C, Adcock I, Chung K, Djukanovic R, Pison C, Sterk PJ. An integrative systems biology approach for understanding of pulmonary diseases. Chest 2010 ; 137 : 1410-6.
2. Haiech J, Ranjeva R, Kilhoffer MC. Biologie des systèmes et ingénierie biologique modifient la découverte et le développement des medicaments. Med Sci (Paris) 2012; 27: 207-12.
3. Oltvai ZN, Barabasi AL. Systems biology. Life’s complexity pyramid. Science 2002; 298: 763-4.
4. Kaminsky DA, Irvin CG, Sterk PJ. Complex systems in pulmonary medicine: a systems biology approach to lung disease. J Appl Physiol 2011 ; 110 : 1716-22.
5. Patti GJ, Yanes O, Siuzdak G. Metabolomics: the apogee of the omics trilogy. Nat Rev Mol Cell Biol 2012 ; 13 : 263-9.
6. Izquierdo-Garcia JL, Ruiz-Cabello J, Cardinal P, Fernandez-Segoviano P, Esteban A, Lorente JA. Metabolomic analysis as a diagnostic tool for acute respiratory distress syndrome caused by H1N1 Influenza infection in humans. Am J Respir Crit Care Med 2012 ; 185 : A1149.
7. Naz S, Garcia A, Erazo M, Ruiz-Cabello J, Esteban A, Lorente JA, Izquierdo-Garcia JL, Barbas C. A novel non -targeted metabolomic approach in ventilator induced lung injury: mass spectrometric characterization of fatty amide, sphinganine and lysophophatidylcholine. Am J Respir Crit Care Med 2012 ; 185 : A6724.
8. Fettig J, Kalhan S, Erzurum SC, Comhair S. Metabolomic profile of asthma. Am J Respir Crit Care Med 2012 ; 185 : A6826.
9. Montuschi P, Paris D, Melck D, Mondino C, Mores N, Trove A, Fuso L, Lucidi V, Macagno F, Motta A. NMR Spectroscopy-based metabolomics of exhaled breath condensate in inflammatory respiratory diseases. Am J Respir Crit Care Med 2012 ; 185 : A5658.
10. Bowler RP, Petrache I, Kechris K, Mahaffey S, Reisdorph N, Reisdorph R, Armstrong M, Bahr T, Hughes G. Translational metabolomics and genomics for chronic obstructive pulmonary disease (COPD): discovering a promising role for sphingolipids. Am J Respir Crit Care Med 2012 ; 185 : A6831.
11. Shim YM, Lee J, Kim S, Xu J, Burdick MD, Paige M. Metabolite Profiling Of Plasma From Emphysematous COPD Patients. Am J Respir Crit Care Med 2012 ; 185 : A4510.
12. Fessel JP, Hamid R, Austin ED, Tada Y, Wittmann B, Hemnes A, West J. Metabolomic analysis reveals widespread metabolic derangements in pulmonary arterial hypertension. Am J Respir Crit Care Med 2012; 185 : A6512.
13. Mickiewicz B, Wong HR, Vogel HJ, Winston BW. Metabolomic profiling of serum samples by 1h nmr spectroscopy as a novel approach for diagnosis of pediatric septic shock. Am J Respir Crit Care Med 2012; 185 : A4911.
14. Izquierdo-Garcia JL, Izquierdo JL, Ruiz-Cabello J, Cardinal P, Rojas Y, Martinez-Caro L, de Paula M, Granados R, Esteban A, Lorente JA. Metabolomic analysis of serum, renal cortex tissue and urine in experimental sepsis. Am J Respir Crit Care Med 2012 ; 185 : A5990.
15. Dinh-Xuan AT. Modifications épigénétiques et maladies respiratoires : départager l’inné et l’acquis. Rev Mal Respir 2008; 25: 5–7.
Biologie des systemes complexes
La complexité des poumons ne se limite pas à la distribution fractale de ses structures anatomiques. Cet organe représente un véritable défi cognitif tant la compréhension de ses nombreuses fonctions physiologiques, allant de la dynamique moléculaire (diffusion des molécules de gaz) aux lois biophysiques de la mécanique des fluides (débits aériens) et des structures élastiques (compliance pulmonaire) nécessite une approche intégrative, allant de la molécule jusqu’à l’organe entier (Figure 1). Une telle approche ne peut se faire aujourd’hui que grâce à l’utilisation des concepts modernes tels ceux fournis par la biologie des systèmes complexes [1, 2].
La physiologie des organes, comme la physiopathologie des maladies, sont bien sûr des domaines dont la complexité est érigée en dogme depuis l’origine des temps. Pour faire face à cette complexité, liée tant aux ramifications des concepts physiopathologiques qu’aux faibles performances des outils biologiques, le chercheur a jusqu’ici favorisé une approche réductionniste, partant de l’étude anatomique du corps entier, pour se focaliser ensuite à la physiologie des organes et finalement à la biologie des cellules et des molécules. Cette approche verticale et descendante, allant de la macroscopie à la micro-, voire « nano-scopie » (néologisme à la mode), permet d’isoler une composante (molécule) de l’ensemble auquel cette composante appartient. Elle a de plus le mérite de nous fournir des renseignements précis sur des éléments infiniment petits constitutifs de nos cellules, tissus et organes.
Très vite, l’on s’est rendu compte que le fonctionnement d’une molécule n’a de sens que lorsque celui-ci est intégré dans des réseaux moléculaires dont les interactions représentent d’autant de possibilités d’ échange de matière, d’énergie et d’informations dans la cellule [3]. Force est de constater que le concept réductionniste a trouvé là ses propres limites. C’est ainsi qu’une autre approche plus globale, intégrant les flux d’informations verticaux (allant de l’organe à la molécule) et les ramifications horizontales d’ interactions intermoléculaires, telle que celle proposée par la biologie des systèmes complexes, s’est peu à peu imposée à la médecine du 21ème siècle [4].
La biologie des systèmes complexes est caractérisée par une vision d’ensemble et exhaustive nécessitant une approche globale ou holistique (déjà préconisée par Claude Bernard !) du vivant. A l’ère de la biologie moderne, cette approche se caractérise surtout par l’avènement des techniques d’analyse moléculaire à haut débit où chaque molécule (gène ou ADN, transcrit ou ARN, produit protéique ou métabolique) n’est plus appréhendée de façon individuelle, mais « en masse » avec ses congénères. Les technologies à haut débit permettant cette approche globale ont donné naissance à des nouvelles disciplines biomédicales dont l’appellation se termine par le terme « omique » (Tableau 1), où le suffixe « ome » vient du sanscrit et signifie « totalité », et non du grec « ôma » terme habituellement utilisé pour désigner une tumeur. Ainsi l’identification de l’ensemble des gènes permet la description du génome et correspond à l’étude de la génomique, etc. (Tableau 1).
Métabolites, métabolome et métabolomique
Les métabolites sont de petites molécules produites par des réactions chimiques régissant le métabolisme cellulaire. Puisque les métabolites sont assimilés à des produits finaux d’une chaîne de production partant des gènes et passant par leur transcription en ARN messagers et la traduction de ces derniers en protéines enzymatiques pour aboutir à la formation finale des métabolites (Figure 2), il est licite de penser qu’une anomalie du métabolome (qui représente l’ensemble des métabolites impliqués dans une maladie) est plus représentative des phénotypes associés à des maladies respiratoires que des anomalies jusqu’alors décrites à propos des génomes ou autres transcriptomes ou protéomes [5]. Ainsi l’étude du métabolome a montré son intérêt diagnostique dans le syndrome de détresse respiratoire aigüe de l’adulte causée par le virus grippal H1N1 [6].
Une approche systématique (sans a priori) a également permis aux auteurs espagnols de mettre en évidence le rôle clé des dérivés des lipides membranaires dans les lésions alvéolaires induite par la ventilation [7]. La métabolomique peut aussi favoriser une meilleure compréhension de la physiopathologie des maladies inflammatoires bronchiques comme l’asthme [8, 9], la mucovicisdose [9] et la BPCO [9-11]. L’étude du métabolome serait également intéressante dans d’autres maladies, comme l’hypertension artérielle [12] ou le choc septique [13, 14].
CONCLUSION
Il nous est désormais nécessaire d’adopter une approche globale où la génomique (qui fut tellement à la mode dans les années 2000) ne peut expliquer qu’une partie, mais pas la totalité des mécanismes physiopathologiques des maladies respiratoires. Il existe au moins deux raisons pour expliquer cette insuffisance (relative) de l’apport de l’étude du génome humain. Premièrement, des anomalies phénotypiques peuvent survenir en l’absence de modifications génétiques, avec notamment l’ intervention des mécanismes épigénétiques [15]. Dans ce contexte, l’apport de la métabolomique et l’étude des interactions entre différents métabolites cellulaires semble d’une utilité plus grande que le simple séquençage des gènes et la description de leurs mutations et/ou polymorphismes (Tableau 1). L’étude des interactions moléculaires nous amène naturellement à la deuxième raison justifiant l’approche globale précitée. En effet, dans un organisme sain et/ou malade, les molécules (ou autres cellules et tissus) fonctionnent en réseau, et non pas isolément. Une même anomalie d’une composante de ce réseau affectera différemment les individus selon la robustesse des autres composantes et leurs capacités à plus ou moins suppléer la composante défaillante.
Après l’ère des études individuelles de chaque organe, tissu, cellule, voire molécule (selon une approche descendante et réductionniste), la biologie des systèmes complexes s’impose désormais comme une évidence, voire une nécessité, permettant une approche globale et holistique des études des maladies humaines en général, et les affections respiratoires en particulier.
Remerciements
L’auteur remercie le Dr Nhat-Nam LE-DONG pour son aide dans la réalisation des figures.
CONFLIT D’INTERETS
Aucun.
REFERENCES
1. Auffray C, Adcock I, Chung K, Djukanovic R, Pison C, Sterk PJ. An integrative systems biology approach for understanding of pulmonary diseases. Chest 2010 ; 137 : 1410-6.
2. Haiech J, Ranjeva R, Kilhoffer MC. Biologie des systèmes et ingénierie biologique modifient la découverte et le développement des medicaments. Med Sci (Paris) 2012; 27: 207-12.
3. Oltvai ZN, Barabasi AL. Systems biology. Life’s complexity pyramid. Science 2002; 298: 763-4.
4. Kaminsky DA, Irvin CG, Sterk PJ. Complex systems in pulmonary medicine: a systems biology approach to lung disease. J Appl Physiol 2011 ; 110 : 1716-22.
5. Patti GJ, Yanes O, Siuzdak G. Metabolomics: the apogee of the omics trilogy. Nat Rev Mol Cell Biol 2012 ; 13 : 263-9.
6. Izquierdo-Garcia JL, Ruiz-Cabello J, Cardinal P, Fernandez-Segoviano P, Esteban A, Lorente JA. Metabolomic analysis as a diagnostic tool for acute respiratory distress syndrome caused by H1N1 Influenza infection in humans. Am J Respir Crit Care Med 2012 ; 185 : A1149.
7. Naz S, Garcia A, Erazo M, Ruiz-Cabello J, Esteban A, Lorente JA, Izquierdo-Garcia JL, Barbas C. A novel non -targeted metabolomic approach in ventilator induced lung injury: mass spectrometric characterization of fatty amide, sphinganine and lysophophatidylcholine. Am J Respir Crit Care Med 2012 ; 185 : A6724.
8. Fettig J, Kalhan S, Erzurum SC, Comhair S. Metabolomic profile of asthma. Am J Respir Crit Care Med 2012 ; 185 : A6826.
9. Montuschi P, Paris D, Melck D, Mondino C, Mores N, Trove A, Fuso L, Lucidi V, Macagno F, Motta A. NMR Spectroscopy-based metabolomics of exhaled breath condensate in inflammatory respiratory diseases. Am J Respir Crit Care Med 2012 ; 185 : A5658.
10. Bowler RP, Petrache I, Kechris K, Mahaffey S, Reisdorph N, Reisdorph R, Armstrong M, Bahr T, Hughes G. Translational metabolomics and genomics for chronic obstructive pulmonary disease (COPD): discovering a promising role for sphingolipids. Am J Respir Crit Care Med 2012 ; 185 : A6831.
11. Shim YM, Lee J, Kim S, Xu J, Burdick MD, Paige M. Metabolite Profiling Of Plasma From Emphysematous COPD Patients. Am J Respir Crit Care Med 2012 ; 185 : A4510.
12. Fessel JP, Hamid R, Austin ED, Tada Y, Wittmann B, Hemnes A, West J. Metabolomic analysis reveals widespread metabolic derangements in pulmonary arterial hypertension. Am J Respir Crit Care Med 2012; 185 : A6512.
13. Mickiewicz B, Wong HR, Vogel HJ, Winston BW. Metabolomic profiling of serum samples by 1h nmr spectroscopy as a novel approach for diagnosis of pediatric septic shock. Am J Respir Crit Care Med 2012; 185 : A4911.
14. Izquierdo-Garcia JL, Izquierdo JL, Ruiz-Cabello J, Cardinal P, Rojas Y, Martinez-Caro L, de Paula M, Granados R, Esteban A, Lorente JA. Metabolomic analysis of serum, renal cortex tissue and urine in experimental sepsis. Am J Respir Crit Care Med 2012 ; 185 : A5990.
15. Dinh-Xuan AT. Modifications épigénétiques et maladies respiratoires : départager l’inné et l’acquis. Rev Mal Respir 2008; 25: 5–7.
FIGURES/TABLE
REFERENCES
1. Auffray C, Adcock I, Chung K, Djukanovic R, Pison C, Sterk PJ. An integrative systems biology approach for understanding of pulmonary diseases. Chest 2010 ; 137 : 1410-6.
2. Haiech J, Ranjeva R, Kilhoffer MC. Biologie des systèmes et ingénierie biologique modifient la découverte et le développement des medicaments. Med Sci (Paris) 2012; 27: 207-12.
3. Oltvai ZN, Barabasi AL. Systems biology. Life’s complexity pyramid. Science 2002; 298: 763-4.
4. Kaminsky DA, Irvin CG, Sterk PJ. Complex systems in pulmonary medicine: a systems biology approach to lung disease. J Appl Physiol 2011 ; 110 : 1716-22.
5. Patti GJ, Yanes O, Siuzdak G. Metabolomics: the apogee of the omics trilogy. Nat Rev Mol Cell Biol 2012 ; 13 : 263-9.
6. Izquierdo-Garcia JL, Ruiz-Cabello J, Cardinal P, Fernandez-Segoviano P, Esteban A, Lorente JA. Metabolomic analysis as a diagnostic tool for acute respiratory distress syndrome caused by H1N1 Influenza infection in humans. Am J Respir Crit Care Med 2012 ; 185 : A1149.
7. Naz S, Garcia A, Erazo M, Ruiz-Cabello J, Esteban A, Lorente JA, Izquierdo-Garcia JL, Barbas C. A novel non -targeted metabolomic approach in ventilator induced lung injury: mass spectrometric characterization of fatty amide, sphinganine and lysophophatidylcholine. Am J Respir Crit Care Med 2012 ; 185 : A6724.
8. Fettig J, Kalhan S, Erzurum SC, Comhair S. Metabolomic profile of asthma. Am J Respir Crit Care Med 2012 ; 185 : A6826.
9. Montuschi P, Paris D, Melck D, Mondino C, Mores N, Trove A, Fuso L, Lucidi V, Macagno F, Motta A. NMR Spectroscopy-based metabolomics of exhaled breath condensate in inflammatory respiratory diseases. Am J Respir Crit Care Med 2012 ; 185 : A5658.
10. Bowler RP, Petrache I, Kechris K, Mahaffey S, Reisdorph N, Reisdorph R, Armstrong M, Bahr T, Hughes G. Translational metabolomics and genomics for chronic obstructive pulmonary disease (COPD): discovering a promising role for sphingolipids. Am J Respir Crit Care Med 2012 ; 185 : A6831.
11. Shim YM, Lee J, Kim S, Xu J, Burdick MD, Paige M. Metabolite Profiling Of Plasma From Emphysematous COPD Patients. Am J Respir Crit Care Med 2012 ; 185 : A4510.
12. Fessel JP, Hamid R, Austin ED, Tada Y, Wittmann B, Hemnes A, West J. Metabolomic analysis reveals widespread metabolic derangements in pulmonary arterial hypertension. Am J Respir Crit Care Med 2012; 185 : A6512.
13. Mickiewicz B, Wong HR, Vogel HJ, Winston BW. Metabolomic profiling of serum samples by 1h nmr spectroscopy as a novel approach for diagnosis of pediatric septic shock. Am J Respir Crit Care Med 2012; 185 : A4911.
14. Izquierdo-Garcia JL, Izquierdo JL, Ruiz-Cabello J, Cardinal P, Rojas Y, Martinez-Caro L, de Paula M, Granados R, Esteban A, Lorente JA. Metabolomic analysis of serum, renal cortex tissue and urine in experimental sepsis. Am J Respir Crit Care Med 2012 ; 185 : A5990.
15. Dinh-Xuan AT. Modifications épigénétiques et maladies respiratoires : départager l’inné et l’acquis. Rev Mal Respir 2008; 25: 5–7.
ARTICLE INFO
DOI: 10.12699/jfvp.3.8.2012.1
Conflict of Interest
Non
Date of manuscript receiving
5/2/2012
Date of publication after correction
15/7/2012
Article citation
Dinh-Xuan A.T. The pulmonology in 21th century : from genomic to biology of complex systems. J Func Vent Pulm 2011;03(08):1-3.