
 English
English
 French
French
Etude sur le rôle du NO exhalé dans la prise en charge des patients asthmatiques
Study of the role of exhaled NO in management of asthma patients
L. Nguyen Thi Hong1, T. Pham Van1, S. Duong-Quy1,2, D. Phan Quang3, D. Nguyen Van3
1: Université de Médecine de Hai Phong
2: Service de Physiologie - Explorations Fonctionnelles. Hôpital Cochin, Paris
3: Centre d’Immuno-Allergologie Clinique. Université de Médecine de Hanoi
Hôpital Cho Ray. Ho Chi Minh Ville, Viet Nam
Corresponding author
Dr NGUYEN THI HONG Lien
Université de Médecine de Hai Phong
Viet Nam Email: sieucoik23@yahoo.com
ABSTRACT
Introduction. Fraction concentration of nitric oxide in exhaled air (FeNO) is correlated with airway inflammation. The measurement of FeNO is an important non-invasive test for evaluating airway inflammation in asthma and for monitoring therapeutic response by inhaled corticosteroids (ICS).
Objectives. 1). To assess clinical improvement, the change of respiratory function, and FeNO in asthmatic patients after treatment with ICS/BLA (long-acting beta agonists) ; 2). To measure correlation between clinical improvement, lung function, and FeNO these patients.
Method. Study of cases-controls of asthma patients who come for consultation in Allergo-Immunology Center at Bach Mai Hospital from June 2011 to September 2011.
Results. FeNO of asthma patients before treatment is 49.38 ± 28.10 is ppb. After treatment with ICS + BLA, FeNO is reduced: average 18.71 ± 7.80 ppb after 3 months. There is a correlation between FeNO and the level of asthma control after 3 months of treatment.
Conclusion. The measurement of FeNO is an necessary examination to assess the degree of airway inflammation. In the future, measurement of FeNO will be a important routine test in the management of asthma patients.
KEYWORDS: Asthma, nitric oxide, FeNO, inhaled corticosteroids, long-acting beta agonists.
RÉSUMÉ
Introduction. La fraction de concentration du monoxide d’azote dans l’air expiré (FeNO) est corrélée avec l’inflammation de voies aériennes. La mesure de la FeNO est un examen non invasif important pour l’évaluation de l’inflammation chez les sujets asthmatiques et pour la surveillance de la réponse thérapeutique par corticostéroïdes inhalées (CSI).
Objectif de l’étude. 1). Evaluer l’amélioration clinique, le changement de la ventilation respiratoire et la FeNO chez les patients asthmatiques après traitement par CSI/BLA (beta 2 de longue durée d’action) ; 2). Examiner la relation entre l’amélioration clinique, la fonction respiratoire et la FeNO de ces patients.
Méthode. Etude des cas-témoignes des patients asthmatiques sont venus en consultation au Centre d’Allergo-Immunologie de l’hôpital Bach Mai de juin 2011 à Septembre 2011.
Résultats. La FeNO des patients avant le traitement est à 49,38 ± 28,10 ppb. Après le traitement par CSI + BLA, la FeNO est diminuée: en moyenne à 18,71 ± 7,80 ppb après 3 mois. Il y a une corrélation entre la FeNO et le niveau de contrôle de l’asthme après 3 mois de traitement.
Conclusion. La mesure de la FeNO est un examen nécessaire pour évaluer le degré de l’inflammation des voies aériennes. Dans l’avenir, la mesure de la FeNO serait un des examen routin important à faire dans la prise en charge des patients asthmatiques.
MOTS CLES: Asthme, monoxyde d’azote, FeNO, corticostéroïdes, beta 2 de longue durée d’action.
INTRODUCTION
L’asthme est une maladie chronique des voies aériennes, caractérisée par l’inflammation chronique, la broncho-constriction et l’hyperréactivité bronchique. Elle est de plus en plus courante dans le monde et également au Vietnam [1]. D’après GINA 2006, cette maladie a touché environ 300 millions de personnes (5-6% de la population du monde) et en 2025, ce chiffre serait 400 millions de patients [2]. La prévalence de l’asthme au Vietnam est d’environ 5% de la population (environ 4 millions de personnes [3, 4].
Malgré cela, il est encore difficile sur la surveillance et le contrôle thérapeutique, l’influence sur la qualité de vie, le cout élevé du traitement ainsi que le nombre augmenté des décès par asthme. D’après GINA 2006, il y a environ 250000 cas de décès dus à l’asthme chaque année [2]. Donc la surveillance et le traitement asthmatique ont un rôle important socialement et économiquement. [3].
La surveillance asthmatique actuelle se base principalement sur la situation clinique des patients, le besoin de médicament et l’exploration fonctionnelle respiratoire. La surveillance et l’évaluation de l’ inflammation des voies aériennes, facteur principal de sa pathogénèse, ne sont pas encore réalisables. Quelques méthodes invasives comme la biopsie bronchique, le lavage broncho-alvéolaire sont difficiles à réaliser et ne sont pas recommandées dans la pratique [5].
Suite à la découverte du monoxyde d’azote dans l’air expiré (exhaled nitric oxide/eNO; la FeNO: la fraction de concentration d’eNO) en 1991 [6] et les recherches sur sa corrélation avec l’inflammation de voies aériennes [7], le NO est devenu un des biomarqueurs non invasif important pour l’évaluation de l’inflammation chez les sujets asthmatiques [8] et pour la surveillance de la réponse thérapeutique par les CSI (corticostéroïdes inhalées) [9, 10]. D’après nombreuses études, la FeNO est élevée chez les patients asthmatiques et peut être normale quand la maladie est bien contrôlée par CSI [8, 9, 11, 12].
Actuellement au Vietnam il y a encore peu d’étude sur le changement du taux de NO exhalé chez les patients asthmatiques traités par ICS. Pour cela, nous avons réalisé cette étude avec les objectifs suivants:
1). Evaluer l’amélioration clinique, le changement de la ventilation respiratoire et la FeNO chez les patients asthmatiques après traitement par CSI/BLA.
2). Examiner la relation entre l’amélioration clinique, la fonction respiratoire et la FeNO de ces patients.
PATIENTS ET METHODES
Patients
Notre étude a été réalisée sur 34 patients asthmatiques dont le diagnostic a été confirmé à la consultation du Centre d’Allergo-Immunologie Clinique de l’hôpital de Bach Mai (du juin 2011 jusqu’au septembre 2011).
Critères d’inclusion
• Âge de 18 - 55.
• Critère de diagnostic asthmatique d’après GINA 2006 [2]:
• Clinique: Crises de dyspnée:
- Prodromes: prurit nasal, éternuement, rhinorrhée, oppression thoracique .
- Dyspnée en relation avec un contact avec des allergènes comme: poussière de la maison, acariens, pollens, aliments, poils, fumée.
- Dyspnée saisonnière ou par période, quand il y a des changements de climat.
- Dyspnée en crise, souvent apparue à la fin de la nuit, dyspnée souvent expiratoire avec sifflements.
• L’auscultation pulmonaire: En crise, on peut trouver des râles ronflants bronchiques, des râles sibilants bilatéraux mais au décours de la crise, l’auscultation pulmonaire se normalise.
• Les ATCD allergiques personnels ou familiaux. Les critères de contrôle asthmatique se basent sur ceux de GINA 2006.
Critères d’exclusion
• La crise de dyspnée dûe à: BPCO, insuffisance cardique, asthme cardiaque, pneumothorax, pneumonie, corps étranger.
• Syndrome de reflux gastro-oesophagien
• Comorbidités: hyperthyroïdie, arythmie, infarctus du myocarde, insuffisance cardiaque, glaucome, prostatite, inflammation de la vessie.
• Tabagisme, tabac pour pipe à eau.
• Grossesse, allaitement.
• ATCD allergique à la fluticasone propionate, au salmeterol ou lactose inhalé.
• Utilisation de corticoides inhalées pendant 4 semaines avant la première visite.
• Patients ne donnant pas leur accord pour participer.
Méthode
Cas–témoins prospectifs.
• Cas: tous les patients asthmatiques sont venus en consultation au Centre Allergo-Immunologie de l’hôpital Bach Mai de juin 2011 à Septembre 2011 répondant aux critères d’inclusion.
• Témoins: 30 sujets en bonne santé, âgés de 18 à 55 ans, non-fumeurs, sans symptômes d’asthme, EFR normale.
RESULTATS
Caractéristique des patients et témoins
Âge moyen pour les témoins (n = 30): 32 ± 10 ans. Âge moyen pour les patients (n = 34): 36 ± 12 ans. Sexe: dans le groupe de patients: le sex-ratio (femme/homme) est 1,43. Celui des témoins est 1,5.
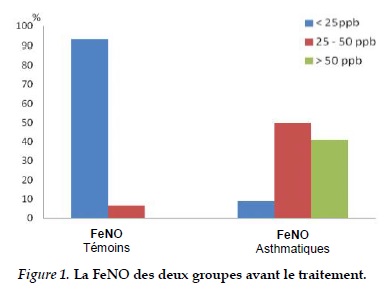
Chez les témoins: FeNO moyenne est de 14,40 ± 5,54 ppb ; aucune personne n’ayant une FeNO > 50 ppb. Chez les patients: la plupart des patients asthmatiques ont une FeNO qui est supérieure à celle des témoins et à la normale: environ 91,2%. La FeNO est de 49,38 ± 28,10 ppb.
Pour les patients: l’antériorité de la maladie est en moyenne de 9,47 ± 6,74 ans ; la plus longue est presque 30 ans. Parmi les patients, 35,3% ont utilisé le médication préventive sous forme de BLA (beta 2 mimétique de longue durée d’action) + CSI. La majorité des patients ont utilisé des bronchodilatateurs (inhalés ou oraux) ou certains ont utilisés des antibiotiques en cas de dyspnée.
Changements de la FeNO chez les patients après 3 mois de traitement
La FeNO est élevée chez les patients avant le traitement, le taux maximum est 145 ppb, la moyenne à 49,38 ± 28,10 ppb.
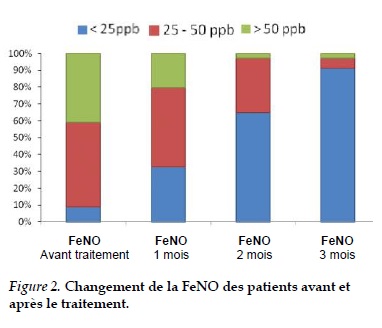
Après le traitement par CSI + BLA, la FeNO est progressivement diminuée, en moyenne à 18,71 ± 7,80 ppb après 3 mois.
Avant le traitement 91,2% des patients ont eu une FeNO supérieure à la normale, dont 41,2% ont une FeNO supérieure à 50ppb. Après 3 mois de traitement, la FeNO est diminuée significativement avec p < 0,001.
La corrélation entre l’amélioration clinique, la fonction respiratoire et la FeNO
La corrélation entre les signes cliniques et la FeNO
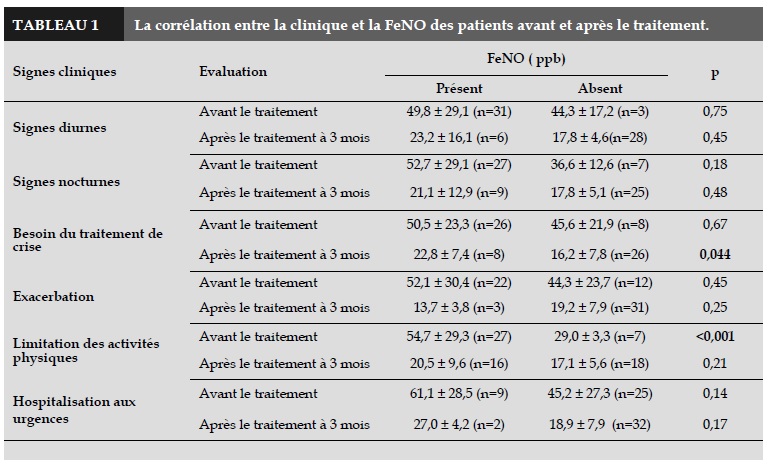
Pas de différence significative entre le taux moyen de la FeNO dans le groupe d’asthmatiques ayant des signes diurnes ou non (p > 0,05), ni dans le groupe d’asthmatiques ayant des signes nocturnes, une exacerbation et un recours aux urgences.
Avant le traitement, la FeNO dans le groupe d’asthmatiques ayant une limitation des activités physiques est significativement supérieure à celle du groupe de patients ayant des activités normales (p < 0,001).
Après 3 mois de traitement, le taux moyen de la FeNO est significativement supérieur dans le groupe d’asthmatiques ayant utilisé les médicaments pendant les crises (p < 0,05).
La corrélation entre les TCA et la FeNO
Avant le traitement, le score du test de contrôle de l’asthme (TCA) et la FeNO des patients ont une corrélation inverse r = - 0,385 et p < 0,05.
Après le traitement, le score du TCA et la FeNO des patients n’ont pas de corrélation.
La corrélation entre le contrôle de l’asthme et la FeNO
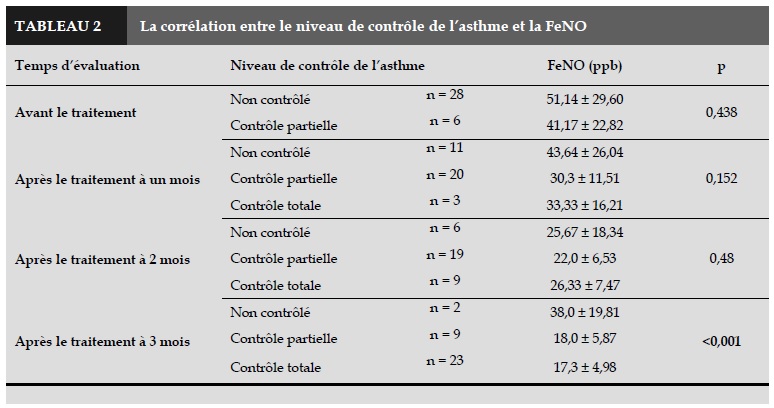
Il y a de différence significative des FeNO dans le groupe de patients asthmatiques contrôlés, partiellement contrôlés et non contrôlés après 3 mois de traitement p < 0,001.
Pas de différence des FeNO dans le groupe d’ asthmatiques avant le traitement, après un mois et deux mois de traitement.
La corrélation entre le VEMS et la FeNO
Pas de corrélation entre le VEMS et la FeNO des patients avant le traitement, ni après le premier, deuxième et troisième mois de traitement.
La corrélation entre le DEP et la FeNO
Pas de corrélation entre DEP (débit expiratoire de point) et la FeNO des patients avant le traitement, ni après le premier, deuxième et troisième mois de traitement.
DISCUSSIONS
L’amélioration clinique, la fonction respiratoire, et le changement de la FeNO des asthmatiques après le traitement par CSI/BLA
L’asthme est une maladie qui touche aussi bien les hommes que les femmes et tous les âges Dans notre étude, il y a 34 asthmatiques de 18 à 55 ans (36 ± 12 ans).
Nous avons choisi 30 témoins qui sont en bonne santé avec un âge moyen de 32,1 ± 9,59, le sex-ratio est de 1,43 et la FeNO est en moyenne de 14,4 ± 5,54 ppb. Ce taux de l’eNO est à la normale d’après les recommandations de l’ATS/ERS.
L’étude d’Olin et col. sur 1 131 adultes non fumeurs a retrouvé que la FeNO mesurée avec débit expiratoire à 50 ml/s était en moyenne de 16,6 ± 5,16 (ppb) [13].
L’étude de Gelb et col. sur 34 témoins (femmes/ hommes = 1,62 ; âge moyen 40 ± 17) a montré que la FeNO était en moyenne de 12 ± 5 ppb (mesurée avec un débit expiratoire à 100 ml/s) [14].
L’étude de Smith et col. sur 30 témoins (femmes/ hommes = 1,72 et âge moyen = 31,8 ) a également montré la FeNO à 15,7 ± 12,9 ppb (mesurée avec un débit expiratoire à 50 ml/s) [15].
La FeNO des 34 asthmatiques avant le traitement est nettement supérieure à celle des témoins et la valeur recommandée par l’ATS/ERS (49,38 ± 28,1 ppb). Parmi eux, il n’y a que 3 patients (8,8%) ayant une FeNO inférieure à 25 ppb et il y a 41,2 % ayant une FeNO supérieure à 50 ppb (taux maximum = 145 ppb). Il n’y a pas de différence significative de la FeNO entre notre étude et celle de l’étude de Smith [15].
La FeNO des asthmatiques n’ayant pas de traitement par ICS était 52,0 ± 34,0 ppb. L’étude de Hewitt et col. [16], sur 78 asthmatiques a retrouvé 70,51% des patients ayant une FeNO supérieure à 30 ppb.
Changement au niveau du contrôle de l’asthme
D’après notre étude, aucun patient n’a un asthme contrôlé : 82, 4% était partiellement non-contrôlé et seulement 17,6 % partiellement contrôlé. Le pourcentage des asthmatiques contrôlés augmente à 67,6% après 3 mois de traitement (p < 0,001).
Changement de la FeNO des patients après 3 mois de traitement
Dans notre étude, la FeNO des patients augmente avant le traitement, le taux maximum est de 145 ppb, en moyenne de 9,38 ± 28,1ppb. Après le traitement par CSI/BLA, la FeNO diminue progressivement par mois, en moyenne 34,88 ± 18,34 ppb après 1 mois de traitement, 23,79 ± 9,59 ppb après 2 mois et après 3 mois est de 18,71 ± 7,8 ppb. Avant traitement 91,2 % des patients ont une FeNO supérieure à la normale et parmi eux 41% ont une FeNO > 50ppb.
Le résultat de notre étude était compatible avec celui de l’étude de Sipple et col. sur 100 sujets dont la FeNO moyenne était de 59,9 ± 5,3 ppb [17], celui de Senna G et col., sur 27 sujets asthmatiques lors de la première crise a montré que la FeNO a varié de 18 à 208 ppb [18].
L’étude de Hewitt et col. [16] a trouvé que le pourcentage des asthmatiques avant traitement ayant une FeNO > 45 ppb était de 50% (39/78) ainsi que une FeNO moyenne très élevée à 101,4 ppb (86,6 - 116,1 ppb).
Après 3 mois de traitement par CSI/BLA, ce pourcentage a diminué, restant à 19,2% (15/78) et en particulier la FeNO moyenne était à 54,9 ppb (42,0 67,9 ppb).
Dans notre étude, après 3 mois de traitement, la FeNO moyenne des patients a diminué progressivement avec p < 0,001, en particulier 31/34 patients (91,2%) ont eu une FeNO < 25ppb. Donc après le traitement par ICS plus LABA, la FeNO dans la plupart des patients asthmatiques a été diminué vers la valeur normale.
La corrélation entre l’amélioration clinique et la FeNO
La corrélation entre la clinique et la FeNO
D’après le Tableau 1, nous n’avons pas trouvé de différence de la FeNO moyenne entre le groupe des patients ayant les symptômes diurnes et celui ne les ayant pas (p > 0,05) et également dans le groupes des patients avec symptômes nocturnes, exacerbation et recours aux urgences.
Cependant, avant le traitement, la FeNO moyenne des patients ayant des limitations d’activités était significativement élevée par rapport à celle des patients ayant des activités normales (p < 0,001). La FeNO était significativement différente après 3 mois de traitement entre les groupes des patients ayant besoin de médicament pour traiter la crise et ceux qui n’ont pas besoin de traitement (p < 0,05).
Il y a eu beaucoup d’études trouvant que la FeNO avait une relation avec le besoin en médicaments, l’obstruction bronchique et le nombre d’éosinophiles dans las crachats [7, 19, 20], mais la corrélation n’est pas nette avec les symptômes de l’asthme [5, 15].
La corrélation entre le score du TCA et la FeNO
Le Tableau 2 de notre étude a montré qu’avant le traitement, il y avait une corrélation inversement proportionnelle entre le score de TCA et FeNO des asthmatiques (r = - 0,385 ; p < 0,05), signifiant que quand la FeNO augmentait, le score de TCA diminuait (après cette équation mathématique Y = - 0,47X +15,234). Cependant, il n’y avait pas la corrélation entre le score de TCA et la FeNO après traitement.
La corrélation entre le niveau de contrôle de l’asthme et la FeNO
Plusieurs auteurs s’intéressent à la corrélation entre le niveau de contrôle de l’asthme et la FeNO.
D’ après l’étude de Francisco et col., il n’y avait pas de relation entre le niveau de contrôle de l’asthme (d’après les critères de GINA 2006) et la FeNO des asthmatiques avec p = 0,171 [21]. Cependant, l’ auteur a montré qu’il y avait environ 41% des asthmatiques non contrôlés ayant une FeNO nettement élevée ≥ 35 ppb et à l’inverse, il n’y avait que 26% des asthmatiques contrôlés ayant une FeNO ≥ 35 ppb et environ 44% des asthmatiques contrôlés ayant une FeNO ≤ 20 ppb.
Dans l’étude de Hewitt, le pourcentage des asthmatiques non contrôlés ayant une FeNO supérieure à 45 ppb a été diminué avec le traitement (avant le traitement: 69,2% versus 26,5% après 3 mois de traitement par fluticasone 250 μg/jour [16].
Le résultat de notre étude a montré qu’il y avait une différence significative des FeNO dans les trois groupes des patients asthmatiques: contrôlés, partiellement contrôlés et non-contrôlés après 3 mois de traitement (p < 0,001 ; Tableau 2). Cependant, il n’y avait pas de différence dans les groupes des patients avant le traitement et après un ou deux mois de traitement.
CONCLUSION
La mesure de la FeNO est un examen nécessaire pour évaluer le degré de l’inflammation des voies aériennes. Le résultat de notre étude montre qu’il y a une corrélation entre la FeNO et le niveau de contrôle de l’ asthme à moyen terme. Dans l’avenir, la mesure de la FeNO serait un des examen routin important à faire dans la prise en charge des patients asthmatiques.
Remerciements Les auteurs remercient l’Association Franco– Vietnamienne de Pneumologie (AFVP) pour le don de matériel afin de réaliser de l’étude etle Dr HUYNH ANH Tuan pour la traduction en français de l’article original.
CONFLIT D’INTERETS
Aucun.
REFERENCES
1. Braman SS. The global burden of asthma. Chest 2006; 130(1 Suppl): 4S-12S.
2. GINA (2006), component 3: assess, treat and monitor asthma. p. 57-63.
3. Sy DQ, Thanh Binh MH, Quoc NT, Hung NV, Quynh Nhu DT, Bao NQ, Khiet LQ, Hai TD, Raffard M, Aelony Y, Homasson JP. Prevalence of asthma and asthma -like symptoms in Dalat Highlands, Vietnam. Singapore Med J 2007;48(4): 294-303.
4. Chai SK, Nga NN, Checkoway H, et al. Comparison of local risk factors for children’s atopic symptoms in Hanoi, Vietnam. Allergy 2004; 59: 637-44.
5. American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide. Am J Respir Crit Care Med 2005; 171: 912-30.
6. Gustafsson LE, Leone AM, Persson MG et al. Endogenous nitric oxide is present in the exhaled air of rabbits, guinea pigs and humans. Biochem Biophys Res Commun 1991; 181: 852-7.
7. Warke TJ, Fitch PS, Brown V et al. Exhaled nitric oxide correlates with airway eosinophils in chilhood asthma. Thorax 2002; 57: 383-7.
8. Kharitonov SA, Yales D, Robbins RA et al. Increased nitric oxide in exhaled air of asthmatic patients. Lancet 1994; 343: 133-5.
9. Kharitonov SA, Yales DH, Barnes PJ. Inhaled glucocorticoids decrease nitric oxide in exhaled air of asthmatic patients. Am J Respir Crit Care Med 1998; 153: 4547.
10. Smith AD, Cowan JO, Brasselt KP, Herbison GP, Taylor DR. Use of exhaled nitric oxide measurements to guide treatment in chronic asthma. N Engl J Med 2005; 352: 2163-73.
11. Dinh-Xuan AT, Barouxis C, Nguyen Thi Van et al. Monoxyde d’azote (NO) et asthme.Rev Fr Allergol1998;38 (3): 165-74.
12. Dinh-Xuan AT. Rôles du monoxyde d’azote en physiologie respiratoire et dans la physiopathologie des maladies pulmonaires. Rev Mal Respir 1996; 13: 3818.
13. Olin AC, Bake B, Toren K. Fraction of exhaled nitric oxide at 50ml/s: reference values for adult lifelong never-smokers. Chest 2007; 131: 1852-6.
14. Gelb AF, Taylor CF, Shinar CM et al. Effect of fluticasone 250 μg/salmeterol 50 μg and montelukast on exhaled nitric oxide in asthmatic patients. Can Respir J 2008; 15(4): 193-8.
15. Smith AD, Cowan JO, Filsell S et al. Diagnosing asthma: Comparisons between exhaled nitric oxide measurements and conventional tests. Am J Respir Crit Care Med 2004; 169: 473-8.
16. Hewitt RS, Modrich CM, Cowan JO, Herbison GP, Taylor DR. Outcomes using exhaled nitric oxide measurements as an adjunct to primary care asthma management. Prim Care Resp J 2009; 18(4): 320-7.
17. Sippel JM, Holden WE, Tilles SA et al. Exhaled nitric oxide levels correlate with measures of disease control in asthma”. J Allergy Clin Immunol 2000; 106:645-50.
18. Senna G, Passalacqua G, Schiappoli M, et al. Correlation among FEV1, nitric oxide and asthma control test in newly diagnosed asthma. Allergy 2007; 62: 207-12.
19. Deykin A, Halpern O, Massaro AF et al. Expired nitric oxide after bronchoprovocation and repeated spirometry in patients with asthma. Am J Respir Crit Care Med 1998; 157: 769-75.
20. Garnier P, Fajac I, Dinh-Xuan AT et al. Exhaled nitric oxide during acute changes of airways calibre in asthma. Eur Respir J 1996; 9: 1134-8.
21. Alvarez-Gutiérrez FJ, Medina-Gallardo JF, PérezNavarro P, Martín-Villasclaras JJ, Martin Etchegoren B, Romero-Romero B, Praena-Fernández JM. Relationship of the Asthma Control Test (ACT) with Lung Function, Levels of Exhaled Nitric Oxide and Control According to the Global Initiative for Asthma (GINA). Arch Bronconeumol 2010; 46(7): 370-7.
FIGURES/TABLES
REFERENCES
1. Braman SS. The global burden of asthma. Chest 2006; 130(1 Suppl): 4S-12S.
2. GINA (2006), component 3: assess, treat and monitor asthma. p. 57-63.
3. Sy DQ, Thanh Binh MH, Quoc NT, Hung NV, Quynh Nhu DT, Bao NQ, Khiet LQ, Hai TD, Raffard M, Aelony Y, Homasson JP. Prevalence of asthma and asthma -like symptoms in Dalat Highlands, Vietnam. Singapore Med J 2007;48(4): 294-303.
4. Chai SK, Nga NN, Checkoway H, et al. Comparison of local risk factors for children’s atopic symptoms in Hanoi, Vietnam. Allergy 2004; 59: 637-44.
5. American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide. Am J Respir Crit Care Med 2005; 171: 912-30.
6. Gustafsson LE, Leone AM, Persson MG et al. Endogenous nitric oxide is present in the exhaled air of rabbits, guinea pigs and humans. Biochem Biophys Res Commun 1991; 181: 852-7.
7. Warke TJ, Fitch PS, Brown V et al. Exhaled nitric oxide correlates with airway eosinophils in chilhood asthma. Thorax 2002; 57: 383-7.
8. Kharitonov SA, Yales D, Robbins RA et al. Increased nitric oxide in exhaled air of asthmatic patients. Lancet 1994; 343: 133-5.
9. Kharitonov SA, Yales DH, Barnes PJ. Inhaled glucocorticoids decrease nitric oxide in exhaled air of asthmatic patients. Am J Respir Crit Care Med 1998; 153: 4547.
10. Smith AD, Cowan JO, Brasselt KP, Herbison GP, Taylor DR. Use of exhaled nitric oxide measurements to guide treatment in chronic asthma. N Engl J Med 2005; 352: 2163-73.
11. Dinh-Xuan AT, Barouxis C, Nguyen Thi Van et al. Monoxyde d’azote (NO) et asthme.Rev Fr Allergol1998;38 (3): 165-74.
12. Dinh-Xuan AT. Rôles du monoxyde d’azote en physiologie respiratoire et dans la physiopathologie des maladies pulmonaires. Rev Mal Respir 1996; 13: 3818.
13. Olin AC, Bake B, Toren K. Fraction of exhaled nitric oxide at 50ml/s: reference values for adult lifelong never-smokers. Chest 2007; 131: 1852-6.
14. Gelb AF, Taylor CF, Shinar CM et al. Effect of fluticasone 250 μg/salmeterol 50 μg and montelukast on exhaled nitric oxide in asthmatic patients. Can Respir J 2008; 15(4): 193-8.
15. Smith AD, Cowan JO, Filsell S et al. Diagnosing asthma: Comparisons between exhaled nitric oxide measurements and conventional tests. Am J Respir Crit Care Med 2004; 169: 473-8.
16. Hewitt RS, Modrich CM, Cowan JO, Herbison GP, Taylor DR. Outcomes using exhaled nitric oxide measurements as an adjunct to primary care asthma management. Prim Care Resp J 2009; 18(4): 320-7.
17. Sippel JM, Holden WE, Tilles SA et al. Exhaled nitric oxide levels correlate with measures of disease control in asthma”. J Allergy Clin Immunol 2000; 106:645-50.
18. Senna G, Passalacqua G, Schiappoli M, et al. Correlation among FEV1, nitric oxide and asthma control test in newly diagnosed asthma. Allergy 2007; 62: 207-12.
19. Deykin A, Halpern O, Massaro AF et al. Expired nitric oxide after bronchoprovocation and repeated spirometry in patients with asthma. Am J Respir Crit Care Med 1998; 157: 769-75.
20. Garnier P, Fajac I, Dinh-Xuan AT et al. Exhaled nitric oxide during acute changes of airways calibre in asthma. Eur Respir J 1996; 9: 1134-8.
21. Alvarez-Gutiérrez FJ, Medina-Gallardo JF, PérezNavarro P, Martín-Villasclaras JJ, Martin Etchegoren B, Romero-Romero B, Praena-Fernández JM. Relationship of the Asthma Control Test (ACT) with Lung Function, Levels of Exhaled Nitric Oxide and Control According to the Global Initiative for Asthma (GINA). Arch Bronconeumol 2010; 46(7): 370-7.
ARTICLE INFO
DOI: 10.12699/jfvp.3.7.2012.29
Conflict of Interest
Non
Date of manuscript receiving
21/10/2011
Date of publication after correction
15/4/2012
Article citation
Nguyen Thi Hong L, Pham Van T, Duong-Quy S, Phan Quang D, Nguyen Van D. Study of the role of exhaled NO in management of asthma patients. J Func Vent Pulm 2012;03(07):29-35.