
 English
English
 French
French
Effet de la fumée de cigarettes sur les récepteurs d’ET-1 dans les cellules vasculaires pulmonaires
Effect of cigarette smoke on ET-1 receptors in pulmonary vascular cells
S. Duong-Quy*, Y. Bei*, T. Hua-Huy, N.N. Le-Dong, A.T. Dinh-Xuan
Service de Physiologie-Explorations Fonctionnelles Cardio-Respiratoires. Hôpital Cochin - Paris
Laboratoire Biologie - Physiologie des Maladies Respiratoires. UPRES - EA 2511. Université Paris Descartes
(*): Co-premiers auteurs
Corresponding author
Dr Sy DUONG-QUY
UPRES - EA 2511, Université Paris Descartes. Hôpital Cochi - Paris
E–mail: sy.duong-quy@cch.aphp.fr
DOI: 10.12699/jfvp.2.5.2011.39
ABSTRACT
Introduction. It is demonstrated that cigarette smoke induces endothelial dysfunction and increases vascular tone. Among the numerous vasoactive mediators produced by endothelium, enthothelin-1 (ET-1) is a the most potent vasoconstrictor and mitogenic agent. The aims of the present study was to demonstrate the effect of cigarette smoke extract (CSE) on the regulation of ET-1 receptors (ET-A and ET-B) of pulmonary arterial endothelial (EC) and smooth muscle cells (SMC).
Methods. In the present study, human pulmonary artery EC and SMC were exposed to CSE with increased concentrations (5-30%), during 24, 48 and 72 hours (h), respectively. ET-A and ET-B receptor expressions were measured by Western-Blot.
Results. At 24h and 48h, whatever CSE concentration, there were no significant differences of ET-B receptor expressions in EC between all groups. At 72h, in comparison with control group, CSE (5-30%) reduced significantly ET-B receptor expression in EC. In SMC, ET-A and ET-B receptor expressions were not significant different between exposed-CSE and control groups. However, at 72h, there were the significant differences of ET-A receptor expression in SMC between exposed-CSE groups and control (15-30% CSE).
Conclusion. Cigarette smoke extract induces abnormal expressions of ET-1 receptors in EC and SMC of pulmonary artery, which might be responsible of vasoconstriction alteration as well as vascular remodelling.
KEYWORDS: Cigarette smoke, ET-1, ET-1 receptors, endothelial cells, smooth muscle cells
RÉSUMÉ
Introduction. Il est démontré que la fumée de cigarette peut induire à un dysfonctionnement endothélial et une augmentation du tonus vasculaire. Parmi de nombreux médiateurs vasoactifs produits par l’endothélium, l’endothéline-1 (ET-1) est un puissant agent vasoconstricteur possèdant également des propriétés mitogéniques. Le but de ce travail était d’étudier la régulation de l’expression des récepteurs d’ET-1 (ET-A et ET-B), dans les cellules endothéliales (CE) et musculaires lisses (CML) des artères pulmonaires exposées à l’extrait de la fumée de cigarette (EFC).
Méthodes. Dans cette étude, les CE ou les CML ont été incubées pendant 24, 48, et 72 heures (h), avec l’EFC à différentes concentrations (5-30%). Les expressions protéiques des récepteurs ET-A et ET-B ont été mesurées par Western-Blot.
Résultats. A 24h et 48h, il n’y avait pas de différence significative entre tous les groups sur l’expression des récepteurs ET-B dans les CE. A 72h, par rapport au groupe de contrôle, l’EFC (5-30%) diminuait significativement l’expression des récepteurs ET-B au niveau des CE. Dans les CML, l’expression des récepteurs ET-A et ET-B n’était pas significativement différent entre les groupes exposés à l’EFC et le groupe de contrôle. Cependant, à 72h, il y avait une différence significative de l’expression des récepteurs ET-A dans les CML entre le groupe de contrôle et les groupes exposés à l’EFC.
Conclusion. L’extrait de la fumée de cigarette induit une expression anormale des récepteurs ET-1 dans les CE et CML des artères pulmonaires. Elle pourrait être responsable du trouble de la vasoconstriction et du remodelage vasculaire.
MOTS CLES: Fumée de cigarette, ET-1, ET-1 récepteurs, cellules endothéliales, cellules musculaires lisses
INTRODUCTION
La consommation de tabac représente un problème de santé publique majeur dont les conséquences sont considérables. Les répercussions sur la santé les plus communes sont la broncho-pneumopathie chronique obstructive (BPCO), le cancer broncho-pulmonaire et les atteintes du système cardiovasculaire. Dans le monde, chaque année, il y a environ 5 millions de décès liés aux effets nocifs du tabac [1].
En France, le tabagisme représente un coût humain important. En 1999, il était estimé que 66 000 personnes étaient victimes des morts prématurées à cause du tabac, dont une grande partie survient avant 65 ans [2].
La fumée de cigarette qui se compose de plus de 4 000 substances chimiques, est capable de nuire à tous les organes, en particulier le poumon et le système cardiovasculaire.
Au niveau tissulaire pulmonaire, les cellules endothéliales (CE) et musculaires lisses (CML) des artères pulmonaires sont particulièrement sensibles aux effets toxiques de la fumée de cigarette. La réponse anormale de ces cellules entraîne un dysfonctionnement endothélial vasculaire, une augmentation du tonus basal des vaisseaux pulmonaires ainsi que le remodelage vasculaire pulmonaire et des voies aériennes.
Ce phénomène est ainsi à l’origine des maladies cardiovasculaires ou respiratoires telles que l’athérosclérose et la BPCO. De plus, le stress oxydatif [3] et l’inflammation chronique provoqués par la fumée de cigarette jouent un rôle important dans la vasoréactivité.
Parmi de nombreux médiateurs vasoactifs produits essentiellement par l’endothélium, l’endothéline-1 (ET-1) est un puissant agent vasoconstricteur qui possède également des propriétés mitogéniques. Différentes études expérimentales et cliniques laissent à penser que l’ET-1 pourrait jouer un rôle dans le remodelage vasculaire lié au tabagisme [4-6].
Il existe déjà plusieurs études in vivo et in vitro sur l’effet du tabac dans l’expression et la libération d’ET -1 et ses récepteurs (ET-A et ET-B) [7, 8]. Mais la régulation des récepteurs d’ET-1 au niveau des CE et des CML en réponse à la fumée de cigarette a été peu étudiée, en particulier en culture cellulaire [9,10].
Notre travail a donc pour but d’étudier la régulation de l’expression des récepteurs d’ET-1 (ET-A et ET-B), dans les CE et les CML des artères pulmonaires exposées à l’extrait de la fumée de cigarette (EFC).
MATERIELS ET METHODES
Matériels
L’expression des récepteurs ET-B au niveau des CE vasculaires pulmonaires, ainsi que l’expression des récepteurs ET-A et des récepteurs ET-B au niveau des CML vasculaires pulmonaires, ont été évaluées dans cette étude.
Les CE (Human Pulmonary Artery Endothelial Cells, HPAEC, C-12241, Promo Cell) et les CML (Human Pulmonary Artery Smooth Muscle Cells, HPASMC, C-12521, Promo Cell) des artères pulmonaires sont réparties en trois groupes en fonction de la durée d’exposition à l’EFC de 24h, 48h, 72h respectivement, par rapport aux cellules-contrôles. On a fait, dans chaque groupe, 2 séries pour évaluer l’expression des récepteurs ET-B au niveau des CE et des CML. De plus, pour étudier l’expression des récepteurs ET-A au niveau des CML, on a fait 3 séries pour le groupe 1 (24h) et le groupe 2 (48h), et 4 séries pour le groupe 3 (72h).
Pour chaque série, l’extrait de la fumée de cigarette (EFC ; Camel avec 0,8 mg nicotine), à une concentration différente de 5%, 10%, 15%, 20%, 25% et 30%, est donné aux CE et CML en diluant dans les milieux de culture (Endothelial Cell Growth Medium C-22010 ou Smooth Muscle Cell Growth Medium 2 C-22062, fournis par Promo Cell), par rapport aux cellules-contrôles.
• Groupe 1: les CE et CML des artères pulmonaires sont exposées à l’extrait de la fumée de cigarette durant 24h.
• Groupe 2: les CE et CML des artères pulmonaires sont exposées à l’extrait de la fumée de cigarette durant 48h.
• Groupe 3: les CE et CML des artères pulmonaires sont exposées à l’extrait de la fumée de cigarette durant 72h.
Méthodes
Stimulation des cellules avec l’extrait de la fumée de cigarette (EFC)
Les CE ou les CML sont incubées dans le milieu compatible pendant 24, 48 ou 72 heures, avec l’EFC à différentes concentrations (5%, 10%, 15%, 20%, 25% et 30%) dilué dans le même milieu par rapport au contrôle (milieu sans EFC).
Protocole de stimulation
• Pour des CE des artères pulmonaire humaines (HPAEC) ou des CML des artères pulmonaire humaines (HPASMC):
• Passage 4-6ème.
• Boite de 25 cm2 ou de 75cm2.
• Temps d’exposition: 24h - 48h - 72h.
• Contrôle visuel tous les 24 heures.
• EFC exposée dès après le changement de milieu avec une confluence cellulaire plus de 90%.
• Les cellules exposées ont été récupérées après le temps adéquat.
Récupération et dosage des protéines
Une fois que les cellules sont exposées à l’EFC pendant 24, 48 ou 72 heures, on récupère les protéines en écrasant les cellules mécaniquement avec le scraper stérilisé sous la hotte. Les cellules on été récupérées dans les tubes de centrifugation de 1.5 mL et centrifugées 10 minutes à 14000 tpm à 4°C avant le dosage des protéines. Les surnageants ont été utilisés pour le dosage des protéines ou ont été récupérés et conservés dans les cryotubes à - 20°C.
Pour doser la concentration des protéines dans les surneagants, nous avons utilisé le kit BACTM Protéin Assay-Reducing Agent Compatible (Bicinchoninic Acid ) selon le protocole du fournisseur (Pierce Biotechnologie, USA) .
Mesure de l’expression des récepteurs ET-A ou ET-B par Western-Blot
Préparation des gels
Le gel SDS-PAGE 12% a été utilisé pour la migration des protéines. Le pourcentage de ce gel était favorable pour la migration des protéines moléculaires de 48 kDa ou 35 kDa, pour des récepteurs ET-A ou ET-B, respectivement. Et le gel SDS-PAGE 6% a été choisi pour le dépôt des échantillons.
Préparation des échantillons
Les extraits des protéines ont été conservés à -20°C dans le tampon de reprise composé de Laemmli, d’eau distillée et d’Anti-protéase. Le volume de chaque préparation était suffisant pour 4 dépôts de 25 µg par puits dont le rapport de composition était de Laemmli (50 µl), Antiprotéase 5X (40 µl), eau distillée plus extrait de protéine (110 µl). En revanche, le volume préparé était de 300 µl pour garantir la quantité des échantillons.
Nous avons utilisé le marqueur de protéine fourni par Invitrogen Corporation (SeeBlue Plus2-Pre-Stained Standard) pour contrôler la migration des protéines dans le gel SDS-PAGE. Avant de déposer les échantillons, ces derniers ont été dénaturés à 95°C dans le bain-marie pendant 5 minutes et ont été centrifugés après la dénaturation thermique pour obtenir l’homogénéisation des échantillons.
Migration et transfert des protéines
La migration a été réalisée dans le tampon composé de Tris 50 mM, Glycine 0.38 M, SDS 0,1% et d’eau distillée avec l’appareil de Bio Rad. Nous avons choisi la membrane polyvinylidene fluoride (PVDF, Immobilon-P) pour le transfert semi-sec en utilisant
l’appareil Trans-Blot SD-Bio Rad. Le protocole de transfert a été strictement respecté selon la recommandation du fournisseur (Millipore Corporation, USA).
Traitement par des anticorps spécifiques
La membrane PVDF a été rincée pendant 5 minutes par PBS-Tween (0,1%) et puis incubée dans la solution PBS-Tween-Lait écrémé (5%) pendant une heure pour bloquer les sites non-spécifiques. La membrane a été ensuite incubée avec le 1er anticorps dans la solution PBS-Tween-Lait écrémé (5%) sous agitateur pendant la nuit à 4°C. On a choisi la dilution de 1/1000 pour le 1er anticorps du récepteur ET-A et 1/5 000 pour l’anticorps secondaire. Pour le récepteur ET-B, la dilution de 1/500 pour le 1er anticorps et la dilution de 1/5 000 pour l’anticorps secondaire ont été choisies.
Après l’incubation avec le 1er anticorps pendant la nuit à 4°C, la membrane a été incubée dans la solution PBS-Tween-Lait pendant 45 minutes à la température ambiante avec l’anticorps secondaire après 6 rinçages de 5 minutes par la solution PBS-Tween. La membrane a été ensuite rincée 6 fois pendant 5 minutes avant la révélation par le kit ECL.
Le contrôle de la quantité des protéines a été fait après la révélation de l’anticorps des récepteurs ET-A et ET-B en utilisant l’anticorps de b-actine (Mouse anti-b-actine IgG, Tebu-bio, dilution 1/1 500) avec les mêmes étapes citées ci-dessus pour Western-Blot sans bloquer les sites non-spécifiques.
Détection des complexes antigène-anticorps
Le kit ECL Plus (Chimiluminescence amplifiée) était utilisé pour la détection luminescente grâce à sa haute sensibilité et sa détection rapide. Le film Hyper-film (Amersham, Biosciences) a été choisi pour développer des signaux. Le temps d’exposition était de tous les 1 minutes jusqu’à 5 minutes pour chaque membrane.
Analyse statistique
Les expressions protéiques des récepteurs ET-A ou ET-B ont été mesurées par densitométrie. Les résultats sont présentés par les valeurs moyennes. Une comparaison par l’analyse de variance (ANOVA) et le test de T-student étaient utilisées pour l’étude statistique des données. Une valeur de p<0,05 est considérée comme étant significative.
RESULTATS
Expression des récepteurs ET-B au niveau des cellules endothéliales mesurée par Western-Blot
L’expression des récepteurs ET-B au niveau des CE mesurée par western-blot des 3 groupes est rapportée: dans le groupe 1 (24h) et le groupe 2 (48h), il n’y avait pas de différence significative sur les expressions des récepteurs ET-B au niveau des CE exposées à l’EFC à une concentration de 5% à 30% par rapport au contrôle (Tableau 1).
Idem, on n’a pas trouvé de différence significative dans le groupe 3 (72h) sur les expressions des récepteurs ET-B au niveau des CE. Les résultats ont montré que l’expression des récepteurs ET-B était diminuée après exposition à l’EFC à une concentration de 5% à 30% par rapport au contrôle (Tableau 1).
Expression des recepteurs ET-A et ET-B au niveau des CML mesurée par Western-Blot
Expressions des récepteurs ET-A au niveau des CML mesurée par Western-Blot des 3 groupes
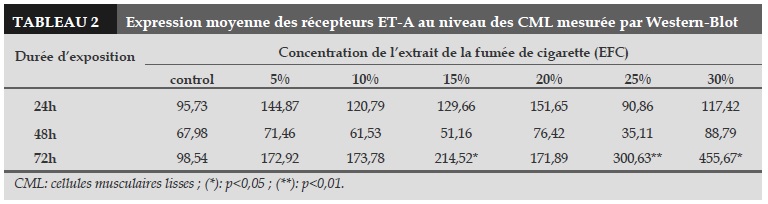
Comme les résultats sur l’expression des récepteurs ET-B au niveau des CE, il n’y avait pas de différence significative sur les expressions des récepteurs ET-A au niveau des CML exposées à l’EFC à 24h et 48h par rapport au contrôle (Tableau 2).
Dans le groupe 3 (72h), il y avait une différence significative sur les expressions des récepteurs ET-A au niveau des CML. L’expression des récepteurs ET-A était significativement plus élevée après exposition à l’EFC, à concentration de 15%, 25% et 30%, par rapport au contrôle (p<0,05, p<0,01 et p<0,05; respectivement ; Tableau 2).
Expressions des récepteurs ET-B au niveau des CML mesurée par Western-Blot des 3 groupes
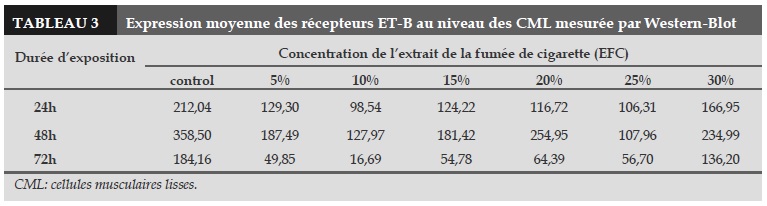
Dans les 3 groupes, il n’y avait pas de différence significative sur les expressions des récepteurs ET-B au niveau des CML exposées à l’EFC par rapport au contrôle (Tableau 3).
DISCUSSION
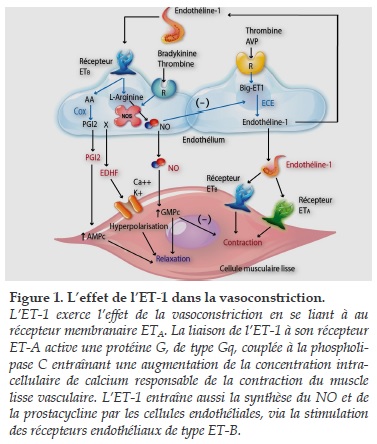
Le tabagisme est un facteur de risque pour les maladies cardiovasculaires et respiratoires. Un grand nombre d’études ont montré que la fumée de cigarette peut aboutir à un dysfonctionnement des CE et à une hyper-réactivité des CML (Figure 1). La diminution de la production du NO, l’augmentation de l’expression d’ET-1, l’aggravation du stress oxydatif et l’inflammation chronique dues au tabac, ont été déjà largement étudiées. Cependant, la modulation de l’expression des récepteurs d’ET-1 au niveau des CE et des CML dans le tabagisme sur les modèles de cellules cultivées a été peu explorée.
Dans cette étude, nous avons trouvé une diminution de l’expression des récepteurs ET-B au niveau des CE et une augmentation de l’expression des récepteurs ET-A au niveau des CML après exposition à l’extrait de la fumée de cigarette (EFC).
Après exposition à l’EFC durant 72 heures, l’expression des récepteurs ET-B au niveau des CE était manifestement diminuée par rapport au contrôle. Quoique l’expression moyenne était diminuée dès à faible concentration de l’EFC, mais il n’y avait pas différence significative par rapport au contrôle. Ce fait était lié au nombre limite d’échantillons inclus. Il serait préférable d’augmenter le nombre d’échantillons afin de mettre en évidence une différence significative dans de prochaines études.
Au niveau des CE où se trouvent des récepteurs ETB qui sont responsables de la clairance de l’ET-1 plasmatique [11]. La diminution de l’expression protéique des récepteurs ET-B au niveau des CE après exposition à l’EFC pourrait conduire à une altération de la production du NO. De même la clairance de l’ET-1 plasmatique est atténuée. Tous favorisent l’explication d’une augmentation du tonus basal des artères pulmonaires liée au tabac. C’est la raison pour laquelle le tabac est impliqué dans l’augmentation du tonus basal des artères pulmonaires.
Les récepteurs ET-A et ET-B, situés au niveau des CML, jouent un rôle important dans la vasoconstriction. Dans le poumon, la proportion des récepteurs ET-A est plus importante que celle des récepteurs ET -B. Dans le groupe 3 (72h), l’expression des récepteurs ET-A au niveau des CML était significativement plus élevée après exposition à l’EFC à une concentration augmentée (Tableau 2). De plus, l’ activation des récepteurs ET-A est aussi responsable de la prolifération des CML et de la production de la matrice extra-cellulaire. En effet, Dadmanesh et al ont montré que la prolifération cellulaire vasculaire et aérienne induite par le tabac était liée à la stimulation des récepteurs ET-A [12].
Même si le mécanisme de la régulation positive des récepteurs d’ET-1 n’a pas été clairement établi, ce phénomène a déjà été constaté par plusieurs études sur les CML des vaisseaux et des voies aériennes. Des cytokines dérivées des cellules inflammatoires au niveau des voies aériennes peuvent conduire à une régulation positive du niveau d’ET-1 plasmatique ainsi que des 2 sous-types de son récepteur qui renforcent l’effet synergique de la contractilité des muscles lisses. L’efficacité des antagonistes des récepteurs spécifiques ou non-spécifiques d’ET-1 a été bien établie dans le traitement de l’hypertension pulmonaire [13].
Par rapport aux résultats des autres études in vivo, dans cette étude, il n’y avait pas de différence significative sur les expressions des récepteurs ET-B au niveau des CML exposées à l’EFC par rapport au contrôle. Cependant, il existe très certainement une différence non négligeable entre le modèle in vivo et in vitro comme le nôtre dans les cellules cultivées.
En ce qui concerne la relation dose - effet du tabagisme dans l’expression des récepteurs d’ET-1 au niveau des CE et des CML, il n’y avait pas de corrélation étroite entre l’expression protéique et la concentration de l’EFC exposée. En fait, les CE et les CML étaient plus sensibles à l’EFC à une concentration plus de 20%. Dans cette étude, la concentration maximale de 30% a été choisie en fonction du pourcentage des cellules mortes (< 25%) après l’ exposition à différente concentration de l’EFC à 24h – 48h.
La majeure partie d’ET-1 est sécrétée dans les CML et les CE de façon paracrine et autocrine, alors que seulement une petite partie d’ET-1 est sécrétée de façon endocrine. Borissova et al. ont suggéré que la concentration plasmatique d’ET-1 était augmentée à cause du tabagisme [14].
Il a été admis que l’expression des récepteurs ET-B au niveau des CE serait influencée par la modulation de la concentration d’ET-1. Mais dans cette étude, le dosage de la concentration d’ET-1 dans le milieu de la culture cellulaire en même temps que celui de l’ expression protéique n’a pas encore été réalisé.
CONCLUSIONS
Dans cette étude, après l’exposition de l’EFC au milieu des cultures cellulaires, il y avait une diminution de l’expression protéique des récepteurs ET-B au niveau des CE et une augmentation de l’expression protéique des récepteurs ET-A au niveau des CML.
Ces résultats contribuent à expliquer l’altération du tonus basal vasculaire pulmonaire et le remodelage vasculaire pulmonaire à cause du tabac. D’autres recherches in vitro seront nécessaires pour étudier le mécanisme de la modulation des récepteurs d’ET-1 et leur rôle dans la régulation du tonus vasculaire, et ainsi dans la prolifération cellulaire sous l’effet du tabagisme.
CONFLIT D’INTERETS
Aucun.
REFERENCES
1. Ezzati M, Hoorn SV, Rodgers A, Lopez AD, Mathers CD, Murray CJ: Estimates of global and regional potential health gains from reducing multiple major risk factors. Lancet 2003; 362: 271-280.
2. Hill C, Laplanche A: Tabagisme et mortalité. BEH 2003; 22-23: 98-100.
3. Heitzer T, Brockoff C, Mayer B, Warnholtz A, Mollnau H, Henne S, Meinertz T, and Munzel T:Tetrahydrobiopterin improves endotheliumdependent vasodilation in chronic smokers: evidence for a dysfunctional nitric oxide synthase. Circ Res 2000; 86: E36–E41.
4. Perros F, Humbert M : Physiopathologie de l’hypertension artérielle pulmonaire: aspects cellulaires et moléculaires. Pneumologie 2006; 6-024-A-91.
5. Ferrer E, Peinado VI, Diez M, Carrasco JL, Musri MM, Martinez A, Rodriguez-Roisin R, Barbera JA: Effects of cigarette smoke on endothelial function of pulmonary arteries in the guinea pig. Respir Res 2009; 10(1): 76.
6. Joanne L. Wright, Hsin Tai and Andrew Churg: Vasoactive mediators and pulmonary hypertension after cigarette smoke exposure in the guinea pig. J Appl Physiol 2006; 100: 672–678.
7. Karen A Fagan, Ivan F McMurtry and David M Rodman: Role of endothelin-1 in lung disease. Respir Res 2001; 2: 90–101.
8. Joanne L. Wright, Hsin Tai, and Andrew Churg: Cigarette Smoke Induces Persisting Increases of Vasoactive Mediators in Pulmonary Arteries. Am J Respir Cell Mol Biol 2004; 31: 501–509.
9. Lee, S.-D., D.-S. Lee, Y.-G. Chun, T.-S. Shim, C.-M. Lim, Y. Koh, W.-S. Kim, D.-S. Kim, and W.-D. Kim: Cigarette smoke extract induces endothelin-1 via protein kinase C in pulmonary artery endothelial cells. Am J Physiol 2001; 281: L403–L411.
10. Bengt W Granström, Cang-Bao Xu, Elisabeth Nilsson, Petter Vikman and Lars Edvinsson: Smoking particles enhance endothelin A and endothelin B receptormediated contractions by enhancing translation in rat bronchi. BMC Pulmonary Medicine 2006; 6:6. doi: 10.1186/1471-2466-6-6.
11. Dupuis J, Stewart DJ, Cernacek P, Gosselin G: Human pulmonary circulation is an important site for both clearance and production of endothelin-1. Circulation 1996; 94:1578–1584.
12. Dadmanesh F, Wright JL: Endothelin-A receptor antagonist BQ-610 blocks cigarette smoke-induced mitogenesis in rat airways and vessels. Am J Physiol 1997; 272(4 Pt 1): L614-8.
13. Liu C, Chen J, Gao Y, Deng B, Liu K: Endothelin receptor antagonists for pulmonary arterial hypertension. Cochrane Database Syst Rev 2009; (3): CD004434.
14. Borissova AM, Tankova T, Kirilov G, Dakovska L, Krivoshiev S: The effect of smoking on peripheral insulin sensitivity and plasma endothelin level. Diabetes Metab 2004; 30:147-152.
FIGURE/TABLES

REFERENCES
1. Ezzati M, Hoorn SV, Rodgers A, Lopez AD, Mathers CD, Murray CJ: Estimates of global and regional potential health gains from reducing multiple major risk factors. Lancet 2003; 362: 271-280.
2. Hill C, Laplanche A: Tabagisme et mortalité. BEH 2003; 22-23: 98-100.
3. Heitzer T, Brockoff C, Mayer B, Warnholtz A, Mollnau H, Henne S, Meinertz T, and Munzel T:Tetrahydrobiopterin improves endotheliumdependent vasodilation in chronic smokers: evidence for a dysfunctional nitric oxide synthase. Circ Res 2000; 86: E36–E41.
4. Perros F, Humbert M : Physiopathologie de l’hypertension artérielle pulmonaire: aspects cellulaires et moléculaires. Pneumologie 2006; 6-024-A-91.
5. Ferrer E, Peinado VI, Diez M, Carrasco JL, Musri MM, Martinez A, Rodriguez-Roisin R, Barbera JA: Effects of cigarette smoke on endothelial function of pulmonary arteries in the guinea pig. Respir Res 2009; 10(1): 76.
6. Joanne L. Wright, Hsin Tai and Andrew Churg: Vasoactive mediators and pulmonary hypertension after cigarette smoke exposure in the guinea pig. J Appl Physiol 2006; 100: 672–678.
7. Karen A Fagan, Ivan F McMurtry and David M Rodman: Role of endothelin-1 in lung disease. Respir Res 2001; 2: 90–101.
8. Joanne L. Wright, Hsin Tai, and Andrew Churg: Cigarette Smoke Induces Persisting Increases of Vasoactive Mediators in Pulmonary Arteries. Am J Respir Cell Mol Biol 2004; 31: 501–509.
9. Lee, S.-D., D.-S. Lee, Y.-G. Chun, T.-S. Shim, C.-M. Lim, Y. Koh, W.-S. Kim, D.-S. Kim, and W.-D. Kim: Cigarette smoke extract induces endothelin-1 via protein kinase C in pulmonary artery endothelial cells. Am J Physiol 2001; 281: L403–L411.
10. Bengt W Granström, Cang-Bao Xu, Elisabeth Nilsson, Petter Vikman and Lars Edvinsson: Smoking particles enhance endothelin A and endothelin B receptormediated contractions by enhancing translation in rat bronchi. BMC Pulmonary Medicine 2006; 6:6. doi: 10.1186/1471-2466-6-6.
11. Dupuis J, Stewart DJ, Cernacek P, Gosselin G: Human pulmonary circulation is an important site for both clearance and production of endothelin-1. Circulation 1996; 94:1578–1584.
12. Dadmanesh F, Wright JL: Endothelin-A receptor antagonist BQ-610 blocks cigarette smoke-induced mitogenesis in rat airways and vessels. Am J Physiol 1997; 272(4 Pt 1): L614-8.
13. Liu C, Chen J, Gao Y, Deng B, Liu K: Endothelin receptor antagonists for pulmonary arterial hypertension. Cochrane Database Syst Rev 2009; (3): CD004434.
14. Borissova AM, Tankova T, Kirilov G, Dakovska L, Krivoshiev S: The effect of smoking on peripheral insulin sensitivity and plasma endothelin level. Diabetes Metab 2004; 30:147-152.
ARTICLE INFO
DOI: 10.12699/jfvp.2.5.2011.39
Conflict of Interest
Non
Date of manuscript receiving
22/2/2011
Date of publication after correction
15/9/2011
Article citation
Duong-Quy S, Bei Y, Hua-Huy T, Le-Dong N.N, Dinh-Xuan A.T. Effect of cigarette smoke on ET-1 receptors in pulmonary vascular cells. J Func Vent Pulm 2011;02(05):39-44.