
 English
English
 French
French
L’efficacité des associations thérapeutiques dans la broncho-pneumopathie chronique obstructive (BPCO)
The effectiveness of combination therapy in chronic obstructive pulmonary disease (COPD)
C. Duong-Ngo1, S. Duong-Quy1,2
1: Faculté de Médecine Paris Descartes - France
2: Service de Physiologie-Exploration Fonctionnelle. Hôpital Cochin - Paris
Corresponding author
Dr Sy DUONG-QUY
Service de Physiologie-Exploration Fonctionnelle. Hôpital Cochin - Paris
E-mail: sy.duong-quy@cch.aphp.fr
ABSTRACT
The chronic obstructive pulmonary disease (COPD) is one of the leading causes of morbidity and mortality in the worldwide. It will become the 3rd cause of death in 2020.
In the management of COPD, the pharmacological treatment is based on the bronchodilators. One of the main goals is to limit the morbidity and mortality associated with exacerbation. The association of long-acting β-agonists (LABA) and long-acting muscarinic antagonists (LAMA) is the cornerstone in the treatment of COPD. The combination of β-agonists and muscarinic antagonists improves the clinical symptoms and the degree of airway obstruction. In COPD, the efficacy of the combination of LABA, LAMA, inhaled corticosteroids (ISC), and inhibitors of PDE4 (type 4 of phosphodiesterase) in reducing the frequency of exacerbations has been demonstrated.
The use of ICS is recommended in the treatment of patients with advanced COPD. It reduces the frequency of exacerbations and improves the survival. Roflumilast, an iPDE4 having bronchodilator and anti-inflammatory effect, improves lung function and reduces the frequency of exacerbations.
However, in advanced stages of COPD, the choice of an optimal treatment is still debatable.
KEYWORDS: COPD, bronchodilator, exacerbation, β-agonist, muscarinic antagonist, PDE4
RÉSUMÉ
La broncho-pneumopathie chronique obstructive (BPCO) est une des premières causes de morbidité et mortalité dans le monde. Elle deviendra la 3è cause de mortalité en 2020.
Dans la prise en charge de la BPCO, le traitement pharmacologique est basé sur les bronchodilatateurs. Un des principaux objectifs thérapeutiques est de limiter la morbidité et mortalité liées aux exacerbations. L’association des βagonistes (BALA) et des antagonistes muscariniques de longue durée d’action (AMLA) est la pierre angulaire dans le traitement de la BPCO. L’association des β-agonistes et antagonistes muscariniques améliorait les signes cliniques et le degré d’obstruction des voies aériennes. Chez les BPCO, l’efficacité de l’association des BALA, AMLA, inhaled corticosteroids (CSI) et inhibiteurs de la PDE4 (phosphodiestérase de type 4) dans la réduction de la fréquence des exacerbations a été démontrée.
L’utilisation des CSI est recommandée dans le traitement des patients atteints de BPCO au stade avancé. Les CSI réduisent la fréquence des exacerbations et améliorent la survie. Roflumilast, un iPDE4 ayant un effet bronchodilatateur et anti -inflammatoire, améliore la fonction respiratoire et réduit la fréquence des exacerbations.
Cependant, chez les BPCO au stade avancé, le choix d’un traitement optimal reste discutable.
MOTS CLES: BPCO, bronchodilatateur, exacerbation, β-agoniste, antagoniste muscarinique, PDE4
INTRODUCTION
La broncho-pneumopathie chronique obstructive (BPCO) est une des premières causes de morbidité et mortalité dans le monde [1]. Selon l’OMS (Organisation Mondiale de la Santé), la BPCO deviendra la 3è cause de mortalité , avec une forte augmentation dans les pays en voie de développement et d’émergence.
D’un point de vue de la physiopathologie, la BPCO est caractérisée par l’obstruction progressive et irréversible ainsi que d’un remodelage excessif des voies aériennes. Ce phénomène est lié principalement à l’effet direct de la toxicité de la fumée du tabac . Dans une étude réalisée au Viet Nam chez les fumeurs de plus de 40 ans, la prévalence de la BPCO était de 13,5% [2].
Dans la prise en charge de la BPCO, en dehors du traitement pharmacologique et de la réhabilitation respiratoire, le sevrage du tabac a un rôle prépondérant. Selon les recommandations internationales, le principal traitement pharmacologique de la BPCO est les bronchodilatateurs. Il a pour but de diminuer à la fois la résistance des voies aériennes et la distension thoracique. Actuellement, l’association des β2 agoniste (BALA) et antagoniste muscarinique de longue durée d’action (AMLA) est la pierre angulaire du traitement de la BPCO.
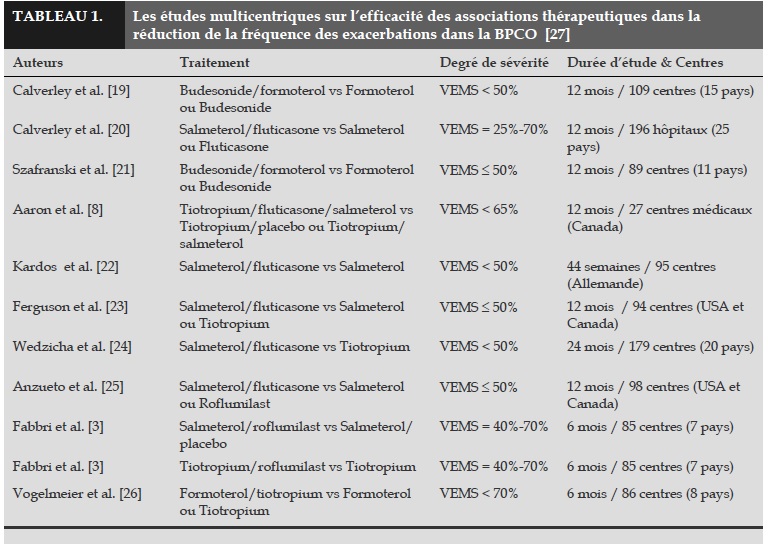
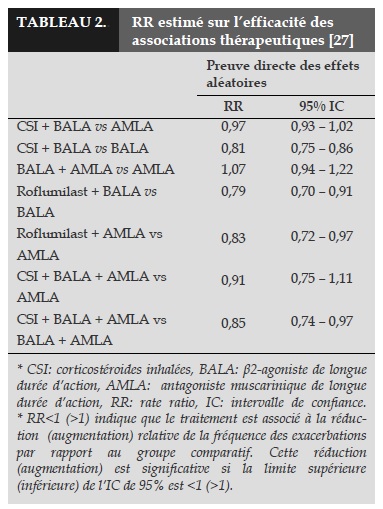
Dans son évolution, la BPCO est caractérisée par des épisodes d’exacerbations dont la fréquence et la sévérité dépendent du traitement de base et du phénotype des patients. Ainsi, dans la prise en charge thérapeutique de la BPCO, un des principaux objectifs est de limiter la morbidité et la mortalité liées à ces exacerbations. Des études récentes ont montré l’efficacité de l’association des BALA, AMLA, corticostéroides inhalées et inhibiteurs de la PDE4 (phosphodiestérase de type 4) dans la réduction de la fréquence des exacerbations chez des patients atteints de BPCO [3].
Cependant, le choix de la stratégie thérapeutique optimale en fonction de la sévérité de la BPCO et du phénotype des patients reste discutable.
ASSOCIATIONS DES BALA ET AMLA
L’efficacité
L’efficacité thérapeutique de l’association d’un β2agoniste et d’un antagoniste muscarinique a été démontrée dans plusieurs études. Chez les patients atteints de BPCO, l’association d’un β2-agoniste (albutérole) et d’un antagoniste muscarinique de courte durée d’action (ipratropium) améliorait le VEMS après 12 semaines de traitement par rapport à la monothérapie [4]. Ces traitements étant de courte durée d’action, ils devraient être utilisés en plusieurs prises par jour (3-4 prises/jour).
L’association de BALA et AMLA présente un avantage en réduisant le nombre de prises par jour grâce à leur longue durée d’action (1-2 prises par jour). L’efficacité de l’association de tiotropium et de salmétérol ou formotérol a été démontrée dans plusieurs études [4-8]. Van Noord et al. ont montré que l’association du tiotropium (une prise par jour) avec le formotérol (deux prises par jour) améliorait le VEMS après 24 semaines de traitement par rapport au traitement par tiotropium seul [6].
Mécanisme d’action
Les β2-agonistes exercent un effet bronchodilatateur en agissant sur les récepteurs β2–adrénergiques. L’activation des récepteurs β2–adrénergiques induit une relaxation des muscles lisses bronchiques via l’augmentation de la concentration de l’AMPc (adénosine monophosphate cyclique) médiée par l’adénine cyclase. Dans les voies aériennes, les récepteurs β2–adrénergiques sont exprimés en forte densité au niveau des cellules musculaires lisses (CML). Les antagonistes muscariniques s’opposent à l’effet de l’acétylcholine au niveau des récepteurs muscariniques M3. Ils induisent aussi la relaxation des CML bronchiques grâce à leur effet sur les récepteurs M2 via la diminution de la concentration de l’AMPc.
Mécanisme d’action synergique
Dans la BPCO, l’association de β2-agoniste et d’antagoniste muscarinique permet l’amélioration clinique (dyspnée) et fonctionnelle (VEMS) de l’obstruction des voies aériennes.
En effet, les CML bronchiques possèdent à la fois les récepteurs M2, M3 et β2 –adrénergiques [9]. Les agonistes des récepteurs muscariniques diminuent l’effet potentiel des β2 –agonistes [10]. Alors que les antagonistes des récepteurs M2 et M3 augmentent l’effet bronchodilatateur des β2–agonistes [11]. Le mécanisme par lequel le récepteur M2 a un effet bronchoconstricteur est lié à la régulation négative de la relaxation des CML bronchiques dépendante d’AMPc. Il est démontré que le récepteur M2 inhibe l’adénylate cyclase et les canaux potassiums calciumdépendants [12]. Cependant, le mécanisme d’interaction entre le récepteur M3 et β2-agonistes est très complexe.
In vitro, l’activation du récepteur M3 diminuait la production d’AMPc médiée par les β2–agonistes [13]. Après avoir été traitées par l’association d’antagoniste muscarinique et β2-agonistes, les cellules étudiées présentaient une augmentation de la production de l’AMPc par rapport au traitement par β2agoniste seul. Certains auteurs ont suggéré que l’interaction entre les récepteurs M3/β2-agonistes est médiée par un mécanisme dépendent du calcium, d’IP3 (inositol triphosphate) et de PLC (phospholipase C) [14, 15].
ASSOCIATIONS DES BALA, AMLA ET CSI
Efficacité
L’utilisation des corticostéroides inhalées (CSI) est recommandée dans le traitement des patients atteints de BPCO au stade avancé (stade III et IV). Ce traitement a pour but de diminuer la fréquence des exacerbations [16].
Une étude récente a montré que l’association de BALA/CSI (salmétérole/fluticasone) diminuait la fréquence des exacerbations et améliorait la survie moyenne des patients atteints de BPCO. L’efficacité du traitement associant BALA, CSI et AMLA dans la BPCO a aussi été démontrée chez les patients atteints de BPCO. L’association de BALA/CSI/AMLA amélioraitla fonction respiratoire et la qualité de vie [17].
ASSOCIATIONS DES BALA, AMLA, CSI ET iPDE4
Efficacité
La PDE4 (phosphodiestérase de type 4inhibe l’activité de l’AMPc et du GMPc (guanosine monophosphate cyclique).
Les inhibiteurs de la PDE4 (iPDE4) sont une nouvelle classe thérapeutique la BPCO [13]. Roflumilast, un des iPDE4 ayant un effet bronchodilatateur, inhibe l’activité de la PDE4 sur l’AMPc. Roflumilast a aussi un effet anti-inflammatoire car il inhibe l’activité de plusieurs types de cellules inflammatoires. Il est démontré que, chez les BPCO, Roflumilast améliorait la fonction respiratoire et réduisait la fréquence des exacerbations. De plus, il est aussi efficace en association avec les BALA, AMLA et CSI [18].
CONCLUSION
L’introduction récente des bronchodilatateurs de longue durée d’action et des anti-inflammatoires à effet bronchodilatateur apporte des modifications dans la stratégie thérapeutique de la BPCO. Chez les BPCO au stade avancé, malgré l’efficacité prouvée des traitements d’association, le choix thérapeutique doit être adapté à la sévérité de l’obstruction bronchique et au phénotype des patients.
CONFLIT D’INTERETS
Aucun.
REFERENCES
1. Barnes PJ. Chronique obstructive pulmonary disease: a growing but neglected global epidemic. PLoS Med 2007;4:e112.
2. Duong-Quy S, Hua-Huy T, Mai-Huu-Thanh B, DoanThi-Quynh N, Le-Quang K, Nguyen-Van H, Phan-Van D, Tran-Dinh H, Reboud P, Dinh-Xuan AT, Homasson JP Early detection of smoking related chronic obstructive pulmonary disease in Vietnam. Rev Mal Respir 2009;26(3):267-74.
3. Fabbri L, Calverley P, Izquierdo-Alonso J, et al. Roflumilast in moderate-to-severe chronic obstructive pulmonary disease treated with longacting bronchodilatators: two randomised clinical trials. Lancet 2009;374:695-703.
4. COMBIVENT Inhalation Aerosol Study Group. In chronic obstructive pulmonary disease, a combination of ipratropium and albuterol is more effective than either agent alone. An 85-day multicenter trial. Chest 1994;105(5):1411-9.
5. Cazzola M, Centanni S, Santus P, Verga M, Mondoni M, di Marco F, Matera MG.. The functional impact of adding salmeterol and tiotropium in patients with stable COPD. Respir Med 2004;98(12):1214-21.
6. van Noord JA, Aumann JL, Janssens E, Verhaert J, Smeets JJ, Mueller A, Cornelissen PJ. Effects of tiotropium with and without formoterol on airflow obstruction and resting hyperinflation in patients with COPD. Chest 2006;129(3):509-17.
7. Tashkin DP, Littner M, Andrews CP, Tomlinson L, Rinehart M, Denis-Mize K. Concomitant treatment with nebulized formoterol and tiotropium in subjects with COPD: a placebo-controlled trial. Respir Med 2008;102(4):479-87.
8. Aaron SD, Vandemheen KL, Fergusson D, et al. Tiotropium in combination with placebo, salmeterol, or fluticasone-salmeterol for treatment of COPD: a randomized trial. Ann Intern Med
2007;146:545-55.
9. Barnes PJ. Distribution of receptor targets in the lung. Proc Am Thorac Soc 2004;1(4):345-51.
10. Effect of indacaterol, a novel long-acting beta2-agonist, on isolated human bronchi. Naline E, Trifilieff A, Fairhurst RA, Advenier C, Molimard M. Eur Respir J 2007; 29(3): 575-81.
11. Rossoni G, Manfredi B, Razzetti R, Civelli M, Berti F. Positive interaction of the novel beta2-agonist carmoterol and tiotropium bromide in the control of airway changes induced by different challenges in guinea -pigs. Pulm Pharmacol Ther 2007;20(3):250-7.
12. Sarria B, Naline E, Zhang Y, Cortijo J, Molimard M, Moreau J, Therond P, Advenier C, Morcillo EJ. Muscarinic M2 receptors in acetylcholine-isoproterenol functional antagonism in human isolated bronchus. Am J Physiol Lung Cell Mol Physiol 2002;283(5):L1125-32.
13. McGraw DW, Almoosa KF, Paul RJ, Kobilka BK, Liggett SB. Antithetic regulation by beta-adrenergic receptors of Gq receptor signaling via phospholipase C underlies the airway beta-agonist paradox. J Clin Invest 2003;112(4):619-26.
14. Zamah AM, Delahunty M, Luttrell LM, Lefkowitz RJ. Protein kinase A-mediated phosphorylation of the beta 2-adrenergic receptor regulates its coupling to Gs and Gi. Demonstration in a reconstituted system. J Biol Chem 2002;277(34):31249-56.
15. Bai Y, Sanderson MJ. Airway smooth muscle relaxation results from a reduction in the frequency of Ca2+ oscillations induced by a cAMP-mediated inhibition of the IP3 receptor. Respir Res 2006;237:34.
16. Calverley Peter MA. The role of corticosteroids in chronic obstructive pulmonary disease. Semin Respir Crit Care Med 2005;26:235-45.
17. Calverley PM, Anderson JA, Celli B, Ferguson GT, Jenkins C, Jones PW, Yates JC, Vestbo J; TORCH investigators. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med 2007;356(8):775-89.
18. Calverley P, Rabe K, Goehring U, et al. Roflumilast in symptomatic chronic obstructive pulmonary disease: two randomised clinical trials. Lancet. 2009;374:685–94.
19. Calverley P, Boonsawat W, Cseke Z, et al. Maintenance therapy with Budesonide and Formoterol in chronic obstructive pulmonary disease.
20. Calverley P, Anderson J, Celli B, et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med 2007;356:775–89.
21. Szafranski W, Cukier A, Ramirez A, et al. Efficacy and safety of budesonide/formoterol in the management of chronic obstructive pulmonary disease. Eur Respir J. 2003;21:74–81.
22. Kardos P, Wencker M, Glaab T, Vogelmeier C. Impact of Salmeterol/fluticasone propionate versus salmeterol on exacerbations in severe chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2007;175:144–9.
23. Ferguson G, Anzueto A, Fei R, et al. Effect of fluticasone propionate/Salmeterol (250/50 microg) or salmeterol (50 microg) on COPD exacerbations. Respir Med 2008;102:1099–1108.
24. Wedzicha J, Calverley P, Seemungal T, et al. The prevention of chronic obstructive pulmonary disease exacerbations by salmeterol/fluticasone propionate or tiotropium bromide. Am J Respir Crit Care Med. 2008;177:19–26.
25. Anzueto A, Ferguson G, Feldman G, et al. Effect of fluticasone propionate/salmeterol (250/50) on COPD exacerbations and impact on patient outcomes. COPD 2009;6:320–329.
26. Vogelmeier C, Kardos P, Harari S, et al. Formoterol mono- and combination therapy with tiotropium in patients with COPD: a 6-month study. Respir Med. 2008;102:1511–1520.
27. Mills EJ, Druyts E, Ghement I, Puhan MA. Pharmacotherapies for chronic obstructive pulmonary disease: a multiple treatment comparison meta-analysis. Clin Epidemiol 2011;3:107-29.
TABLES
REFERENCES
1. Barnes PJ. Chronique obstructive pulmonary disease: a growing but neglected global epidemic. PLoS Med 2007;4:e112.
2. Duong-Quy S, Hua-Huy T, Mai-Huu-Thanh B, DoanThi-Quynh N, Le-Quang K, Nguyen-Van H, Phan-Van D, Tran-Dinh H, Reboud P, Dinh-Xuan AT, Homasson JP Early detection of smoking related chronic obstructive pulmonary disease in Vietnam. Rev Mal Respir 2009;26(3):267-74.
3. Fabbri L, Calverley P, Izquierdo-Alonso J, et al. Roflumilast in moderate-to-severe chronic obstructive pulmonary disease treated with longacting bronchodilatators: two randomised clinical trials. Lancet 2009;374:695-703.
4. COMBIVENT Inhalation Aerosol Study Group. In chronic obstructive pulmonary disease, a combination of ipratropium and albuterol is more effective than either agent alone. An 85-day multicenter trial. Chest 1994;105(5):1411-9.
5. Cazzola M, Centanni S, Santus P, Verga M, Mondoni M, di Marco F, Matera MG.. The functional impact of adding salmeterol and tiotropium in patients with stable COPD. Respir Med 2004;98(12):1214-21.
6. van Noord JA, Aumann JL, Janssens E, Verhaert J, Smeets JJ, Mueller A, Cornelissen PJ. Effects of tiotropium with and without formoterol on airflow obstruction and resting hyperinflation in patients with COPD. Chest 2006;129(3):509-17.
7. Tashkin DP, Littner M, Andrews CP, Tomlinson L, Rinehart M, Denis-Mize K. Concomitant treatment with nebulized formoterol and tiotropium in subjects with COPD: a placebo-controlled trial. Respir Med 2008;102(4):479-87.
8. Aaron SD, Vandemheen KL, Fergusson D, et al. Tiotropium in combination with placebo, salmeterol, or fluticasone-salmeterol for treatment of COPD: a randomized trial. Ann Intern Med
2007;146:545-55.
9. Barnes PJ. Distribution of receptor targets in the lung. Proc Am Thorac Soc 2004;1(4):345-51.
10. Effect of indacaterol, a novel long-acting beta2-agonist, on isolated human bronchi. Naline E, Trifilieff A, Fairhurst RA, Advenier C, Molimard M. Eur Respir J 2007; 29(3): 575-81.
11. Rossoni G, Manfredi B, Razzetti R, Civelli M, Berti F. Positive interaction of the novel beta2-agonist carmoterol and tiotropium bromide in the control of airway changes induced by different challenges in guinea -pigs. Pulm Pharmacol Ther 2007;20(3):250-7.
12. Sarria B, Naline E, Zhang Y, Cortijo J, Molimard M, Moreau J, Therond P, Advenier C, Morcillo EJ. Muscarinic M2 receptors in acetylcholine-isoproterenol functional antagonism in human isolated bronchus. Am J Physiol Lung Cell Mol Physiol 2002;283(5):L1125-32.
13. McGraw DW, Almoosa KF, Paul RJ, Kobilka BK, Liggett SB. Antithetic regulation by beta-adrenergic receptors of Gq receptor signaling via phospholipase C underlies the airway beta-agonist paradox. J Clin Invest 2003;112(4):619-26.
14. Zamah AM, Delahunty M, Luttrell LM, Lefkowitz RJ. Protein kinase A-mediated phosphorylation of the beta 2-adrenergic receptor regulates its coupling to Gs and Gi. Demonstration in a reconstituted system. J Biol Chem 2002;277(34):31249-56.
15. Bai Y, Sanderson MJ. Airway smooth muscle relaxation results from a reduction in the frequency of Ca2+ oscillations induced by a cAMP-mediated inhibition of the IP3 receptor. Respir Res 2006;237:34.
16. Calverley Peter MA. The role of corticosteroids in chronic obstructive pulmonary disease. Semin Respir Crit Care Med 2005;26:235-45.
17. Calverley PM, Anderson JA, Celli B, Ferguson GT, Jenkins C, Jones PW, Yates JC, Vestbo J; TORCH investigators. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med 2007;356(8):775-89.
18. Calverley P, Rabe K, Goehring U, et al. Roflumilast in symptomatic chronic obstructive pulmonary disease: two randomised clinical trials. Lancet. 2009;374:685–94.
19. Calverley P, Boonsawat W, Cseke Z, et al. Maintenance therapy with Budesonide and Formoterol in chronic obstructive pulmonary disease.
20. Calverley P, Anderson J, Celli B, et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med 2007;356:775–89.
21. Szafranski W, Cukier A, Ramirez A, et al. Efficacy and safety of budesonide/formoterol in the management of chronic obstructive pulmonary disease. Eur Respir J. 2003;21:74–81.
22. Kardos P, Wencker M, Glaab T, Vogelmeier C. Impact of Salmeterol/fluticasone propionate versus salmeterol on exacerbations in severe chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2007;175:144–9.
23. Ferguson G, Anzueto A, Fei R, et al. Effect of fluticasone propionate/Salmeterol (250/50 microg) or salmeterol (50 microg) on COPD exacerbations. Respir Med 2008;102:1099–1108.
24. Wedzicha J, Calverley P, Seemungal T, et al. The prevention of chronic obstructive pulmonary disease exacerbations by salmeterol/fluticasone propionate or tiotropium bromide. Am J Respir Crit Care Med. 2008;177:19–26.
25. Anzueto A, Ferguson G, Feldman G, et al. Effect of fluticasone propionate/salmeterol (250/50) on COPD exacerbations and impact on patient outcomes. COPD 2009;6:320–329.
26. Vogelmeier C, Kardos P, Harari S, et al. Formoterol mono- and combination therapy with tiotropium in patients with COPD: a 6-month study. Respir Med. 2008;102:1511–1520.
27. Mills EJ, Druyts E, Ghement I, Puhan MA. Pharmacotherapies for chronic obstructive pulmonary disease: a multiple treatment comparison meta-analysis. Clin Epidemiol 2011;3:107-29.
ARTICLE INFO
DOI: 10.12699/jfvp.2.4.2011.9
Conflict of Interest
Non
Date of manuscript receiving
21/02/2011
Date of publication after correction
15/11/2011
Article citation
Duong-Ngo C, Duong-Quy S. The effectiveness of combination therapy in chronic obstructive pulmonary disease (COPD). J Func Vent Pulm 2011;02(04):7-11.