
 English
English
 French
French
Necrotizing fasciitis of the chest wall: our preliminary results on the 14 observations treated by negative pressure
Les fasciites nécrosantes de la paroi thoracique: nos résultats préliminaires sur les 14 observations traitées par une pression négative
N.N.M. Razafimanjato1, T.D. Ravelomihary1, M. Ravoatrarilandy1, T.A. Rajaonera2, F.A. Hunald3, L.H. Samison4, H.J.L. Rakotovao1
1: USFR de Chirurgie Thoracique, Hôpital Joseph Ravoahangy Andrianavalona (HJRA). CHU Tananarive. Faculté de Médecine de Tananarive. Madagascar.
2: USFR de Réanimation Chirurgicale. HJRA. CHU Tananarive. Faculté de Médecine de Tananarive.
3: USFR de Chirurgie Pédiatrique et Plastique. HJRA. CHU Tananarive. Faculté de Médecine de Tananarive.
4: USFR de Chirurgie Viscérale. HJRA. CHU Tananarive. Faculté de médecine de Tananarive
Corresponding author
Dr. Narindra Njarasoa Mihaja RAZAFIMANJATO
Université de Tananarive. Faculté de Médecine Tananarive
E-mail: razafesteban@yahoo.fr ou razafesteban@laposte.net
ABSTRACT
Background. We describe the clinical aspects and surgical management of soft tissue infections with a three-step procedure: antibiotherapy-debridement, negative pressure aspirating dressing.
Method. A retrospective case series of fourteen patients with necrositing fasciitis and myonecrosis of the chest wall who underwent operated at the unit of thoracic surgery of the University Hospital of Tananarive, Madagascar between January and December 2016.
Results. There are 8 men and 6 women (sex ratio = 1.33). The average age was 31.21 years old. We recorded 4 cases (28.57%) of myonecrosis and 10 cases (71.42%) of necrotizing fasciitis. The average diagnostic delay before surgical management of patients was 22.92 days with a standard deviation of 12.16. The clinic is dominated by infectious syndrome and deterioration of general status in 100% and 85.71%, respectively. The lesions of necrotizing fasciitis are associated in 35.71% of cases with cervico-mediastinitis, 4 cases (28.57%) accompanied by cervical cellulitis and 2 cases (14.28%) are associated with a thoracic empyema. Intraoperative bacteriological specimens identified polymicrobial germs with an average of 3.85 microorganisms per patient (Staphylococcus Aureus in 57.14% and Pseudomonas Aeruginosa in 42.85%) mean length of hospital stay was 15.35 days with extremes ranging from 8 to 30 days The operative course was marked by a favorable evolution in 57.14% of cases Six deaths in the first 30 days after surgery were noted following septic shock (5 cases or 35.71%) and cardiogenic shock (1 case or 7.14%).
Conclusion. The three pillars, which guarantee the favorable evolution of this devastating affection, consist of an adequate medical reanimation, an appropriate antibiotherapy and an aggressive debridement surgical. Negative pressure therapy allowed us to achieve a good result while avoiding a major reconstructive surgery of the chest wall.
KEYWORDS: Gas gangrene, necrotizing fasciitis, soft tissue infectious, negative pressure.
RÉSUMÉ
Objectif. Nous décrivons les aspects cliniques et la gestion chirurgicale des infections des tissus mous à l’aide d’un pansement aspiratif par pression négative.
Méthodologie. Etude rétrospective portant sur les 14 cas de fasciite nécrosante et de myonécrose de la paroi thoracique opérés dans le service de chirurgie thoracique du CHU de Tananarive, Madagascar entre janvier et décembre 2016.
Résultats. Sont inclus 8 hommes et 6 femmes (sex ratio= 1,33). L’âge moyen était de 31,21 ans. Nous avons répertorié 4 cas (soit 28,57%) d’une myonécrose et 10 cas (soit 71,42%) de fasciite nécrosante. La moyenne du délai diagnostic avant la prise en charge chirurgicale des patients était de 22,92 jours avec un écart type de 12,16. La clinique est dominée par un syndrome infectieux et une altération de l’état général dans 100% et 85,71% respectivement. Les lésions de fasciite nécrosante sont associé dans 35,71% des cas à une cervico-médiastinite aigue, 4 cas (soit 28,57%) accompagnés d’une cellulite cervicale et 2 cas (soit 14,28%) sont associés à un empyème thoracique. Les résultats des prélèvements bactériologiques en per-opératoire ont identifié des germes polymicrobiens avec une moyenne de 3,85 germes par patient (Staphylococcus Auréus dans 57,14% et des Pseudomonas Aeruginosa dans 42,85%. Le nombre moyen de parages chirurgicaux durant la durée d’hospitalisation de nos patients était de 12,60 fois avec des extrêmes entre 6 et 45 fois. La durée moyenne de séjour d’hospitalisation était de 15,35 jours avec des extrêmes allant de 8 à 30 jours. La suite opératoire était marquée par une évolution favorable chez 57,14% des cas. Six cas de décès dans les 30 premiers jours post- opératoires ont été noté suite à un choc septique (5 cas soit 35,71%) et à un choc cardiogénique (1 cas soit 7,14 %).
Conclusion. Les trois pierres angulaires, qui garantirent l’évolution favorable de cette affection dévastatrice, sont constituées par une réanimation adéquate, une antibiothérapie appropriée et un parage chirurgical agressif. La thérapie par pression négative (TPN) nous a permis d’obtenir un bon résultat tout en contournant une chirurgie reconstructive étendue de la paroi thoracique.
MOTS CLÉS: Gangrène gazeuse, fasciite nécrosante, infection des parties molles, pression négative.
INTRODUCTION
Par définition, les fasciites nécrosantes (FN) sont des infections souvent d’origine bactérienne de la peau, des tissus mous et des aponévroses caractérisées par une nécrose diffuse [1,2]. La localisation au niveau de la paroi thoracique de ces deux entités représente une forme rare, inhabituelle et associée à un taux de mortalité élevé allant de 59% à 89% selon la littérature [3,4]. Malgré, les données disponibles et les rapports de cas de fasciite nécrosante de la paroi thoracique le taux de morbi-mortalité de ces dernières reste peu amélioré depuis les premières descriptions d’où l’intérêt que porte les auteurs dans cette étude à décrire les aspects de prise en charge chirurgicale de ces pathologies dans un pays à faible ressources, de souligner l’importance d’une sensibilisation à la prévention de certains facteurs déterminants évitables de ces entités et la nécessité d’un diagnostic précoce afin d’éviter l’évolution fatale dans certaines formes graves évoluées vers une septicémie.
MATÉRIEL ET MÉTHODES
Il s’agit d’une étude rétrospective portant sur les cas de fasciite nécrosante et les myonécroses de la paroi thoracique pris en charge dans le service de chirurgie thoracique de l’hôpital Universitaire Joseph Ravoahangy Andrianavalona de Tananarive, Madagascar entre janvier et décembre 2016 soit une période d’un an.
Pour chaque dossier, les éléments suivants ont été analysés: l’état civil, les antécédents médico-chirurgicaux, les signes cliniques, les résultats bactériologiques des prélèvements per-opératoires, le compte rendu opératoire et l’aspect évolutif de ces entités. Le diagnostic positif a été retenu devant les signes locaux et est confirmé par une atteinte nécrotique de l’aponévrose et/ou des muscles sous jacents de la paroi thoracique dans le protocole opératoire de chaque patient. Tous nos patients avaient reçu une antibiothérapie durant leurs hospitalisations. Sont non inclus de notre série, les dossiers qui ne contiennent pas des résultats d’examen bactériologique et les malades qui n’ont pas bénéficié d’un pansement aspiratif.
Le volet chirurgical consistait à effectuer, sous anesthésie générale au bloc opératoire, des parages et débridements chirurgicaux des tissus nécrotiques et gangrénés à travers des multiples incisions cutanées tunnélisées entre les logettes et les différentes couches de la paroi thoraciques. La plaie opératoire est recouverte de compresses imbibées de polyvidone iodée. Deux drains de Redon sont placés entre deux couches de compresses et le pansement était recouvert d’un film transparent adhésif.
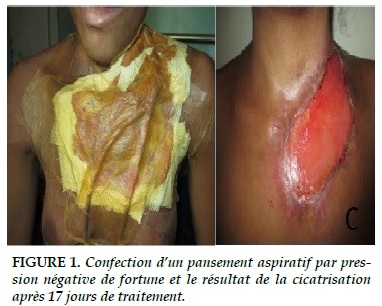
Les drains sont raccordés à un bocal aspiratif puis branchés sur un manomètre régulateur de vide mural à moins 100 mm Hg pour réaliser un pansement aspiratif continu (Figure 1).
Le délai de prise en charge est défini comme étant la période de temps entre la date de diagnostic et la date de début du premier traitement. Il est estimé en nombre de jours. Le délai moyen de prise en charge, correspond à la moyenne des délais enregistrés pour chaque patient. Il est présenté avec l’écart-type qui mesure la dispersion des délais individuels. Les données collectées sont statistiquement analysées avec Excel 2010.
RÉSULTATS
Durant cette période d’étude, nous avons recensés 14 cas de fasciite nécrosante de la paroi thoracique: 8 hommes et 6 femmes (sex ratio= 1,33). L’âge moyen était de 31,21 ans, avec des extrêmes de 21 et 55 ans. Nous avons pu colliger 4 cas (soit 28,57%) d’une myonécrose et 10 cas (soit 71,42%) de fasciite nécrosante de la paroi thoracique.
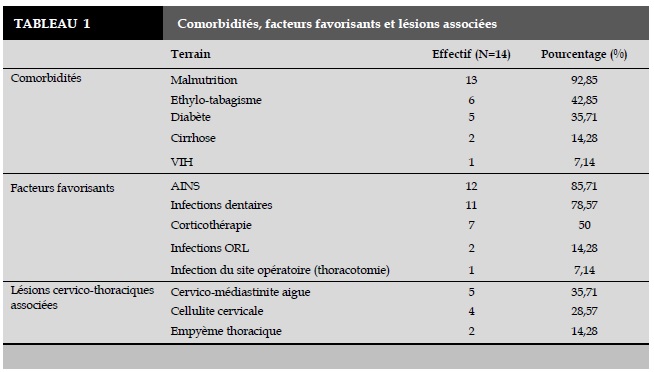
La moyenne du délai diagnostic avant la prise en charge chirurgicale des patients était de 22,92 jours avec un écart type de 12,16. Dans l’anamnèse, les comorbidités et les facteurs favorisants sont répertoriés et regroupés dans le Tableau 1.
Sur le plan clinique, la fièvre était retrouvée chez tous les patients (soit 100%), l’état général était altéré dans 12 cas (soit 85,71%), 8 cas ont présenté un tableau de sepsis sévère à l’entrée et qui nécessitaient une hospitalisation en réanimation, une tachycardie sans hypotension était notée dans 6 cas (soit 42,85 %).
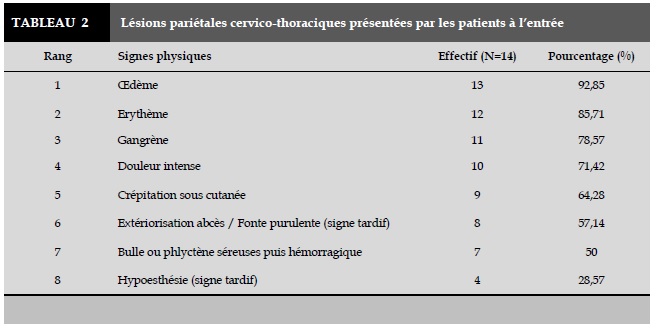
Les signes physiques correspondant aux lésions pariétales cervico-thoraciques présentées par les patients à l’entrée sont répartis dans le Tableau 2.
Sur le plan biologique, en préopératoire, nous avons noté sur l’hémogramme une élévation de la VSH dans 9 cas (64,28%), une anémie dans 10 cas (71,42%) dont 8 cas nécessitaient une correction transfusionnelle et une hyperleucocytose dans 8 cas (57,14%). En outre, l’hyperglycémie était retrouvée dans 9 cas (64,28%), une augmentation de la créatininémie dans 6 cas. En dehors des cas d’insuffisance rénale, les troubles ioniques sont notés sur les 11 cas (soit 78,57%).
La radiographie du thorax standard était demandée dans 9 cas (soit 64,28%) et la tomodensitométrie cervico-thoracique n’était obtenue que seulement sur les 5 patients (soit 35,71%). Au terme de ces examens clinico-radiologiques, les lésions de fasciite nécrosante sont associé dans 35,71% des cas à une cervico-médiastinite aigue, 4 cas (soit 28,57%) accompagnés d’une cellulite cervicale et 2 cas (soit 14,28%) sont associés à un empyème thoracique.
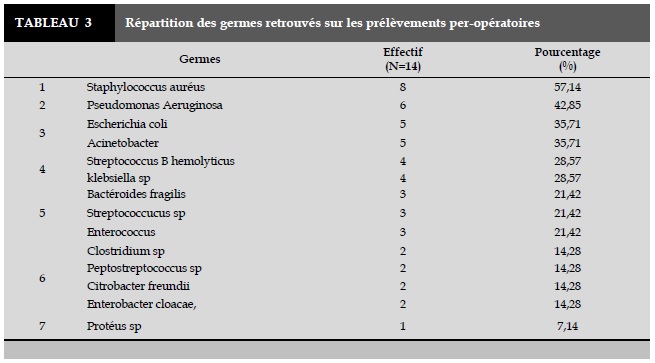
Les résultats des prélèvements bactériologiques en per-opératoire (Tableau 3) ont identifié des germes polymicrobiens avec une moyenne de 3,85 germes par patient et dominés par la présence de Staphylococcus Auréus dans 57,14% (8 cas) des cas et des Pseudomonas Aeruginosa dans 42,85% (6 cas).
Le nombre moyen de parages et débridements chirurgicaux au bloc opératoire durant la durée d’hospitalisation de nos patients était de 12,60 fois avec des extrêmes entre 6 et 45 fois.
La durée moyenne de séjour d’hospitalisation de nos patients était de 15,35 jours avec des extrêmes allant de 8 à 30 jours.
La suite opératoire était marquée par une évolution
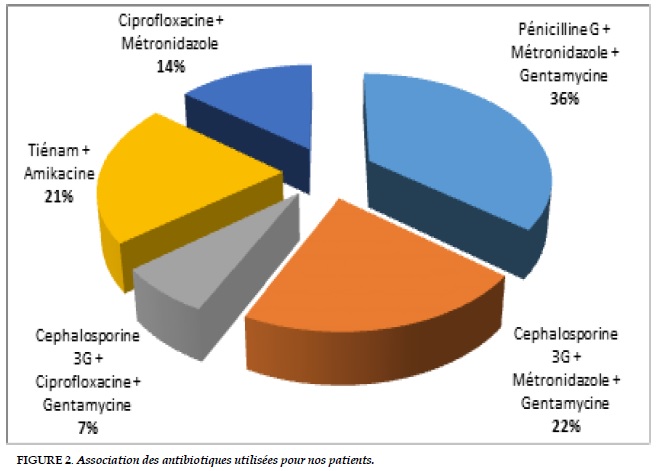
Chaque patient avait bénéficié d’une antibiothérapie empirique dans un premier temps dont la moyenne d’association des antibiotiques était de 2,6 (Figure 2). Ces derniers ont été adaptés secondairement en favorable chez 57,14% des cas. Six cas de décès dans les 30 premiers jours post- opératoires ont été noté suite à un choc septique (5 cas soit 35,71%) et à un choc cardiogénique (1 cas soit 7,14 %) (Tableau 4).
fonction des résultats bactériologiques.
DISCUSSION
Dans la littérature, peu de données spécifiques concernent la prévalence et l’incidence des fasciites nécrosantes et des myonécroses car seules les formes liées au streptocoque du groupe A ont bénéficié d’un système de surveillance montrant leur augmentation ces dernières années.
L’incidence annuelle est estimée à 500-1000 cas annuels et une prévalence globale 0,40 cas/100000 habitants aux USA [5].
Malgré les limites de cette étude, à savoir une description des seules pratiques dans un centre hospitalier universitaire et un échantillon restreint, cette étude nous a permis de dégager le profil épidémio-clinique, évolutif et démontrer les résultats des traitements des fasciite de la paroi thoracique après un pansement aspiratif de fortune.
La prédominance masculine constatée dans notre série est concordante à celui de plusieurs cas rapportés et les études portés sur infections des tissus mous par les auteurs dans la littérature [3,6,7]. La moyenne d’âge des principales séries se situe autour de 50 ans avec des écarts allant de 15 à 87 ans [5]. Dans la cohorte de l’Ontario, l’incidence augmente avec l’âge: de 0,15/100 000 pour les moins de 45 ans à 0,55/100 000 pour les plus de 65 ans [8,9].
Notre moyenne d’âge observée dans cette étude est largement inférieure à celle retrouvée dans la littérature et s’explique par la prédominance de cette catégorie d’âge dans la population générale africaine, et notamment dans la capitale de Madagascar.
La localisation thoracique isolée est fréquemment rapportée après un drainage thoracique per cutané d’un empyème pleural ou suite à une exploration invasive de la région thoracique ainsi qu’une chirurgie thoracique chez les patients immunodéprimés [6].
Le diabète (dans 25 à 30 % des cas, le risque relatif varie de 4 à 7), la présence d’une artérite (10 % des cas), l’éthylisme chronique (15 % des cas, le risque relatif est de 2), l’immunosuppression (sujets séropositifs pour le virus de l’immunodéficience humaine (VIH): le risque relatif peut varier de 9 à 49, antécédent de cancer: le risque relatif est de 7), la notion d’infection streptococcique récente dans l’entourage, la toxicomanie [9].
Dans 80 % des cas, le point de départ de ces infections est cutané [5] [9]. Cependant, dans 20 % des cas, la porte d’entrée n’est pas identifiée [9]. L’origine dentaire (78,57%) et la malnutrition (92,85%) représentent surtout les facteurs déterminants rencontrés dans notre série. Ces derniers reflètent à la fois l’ignorance et la négligence des patients ainsi que l’éternel manque de plateau technique dans les pays en développement rendant tardive la prise en charge.
La notion de prise d’AINS considérée comme facteurs de risques de survenu et/ ou un facteur aggravant de l’évolution des infections des parties molles reste encore un sujet de controverse [5]. La Food and Drug Administration (FDA) a enregistré entre 1969 et 1995, 33 cas de cellulites nécrosantes considérés comme attribuables à la prise d’AINS [10].
Chez les adultes, aucune étude n’a mis en évidence de lien entre la prise d’anti-inflammatoires et la survenue de la mortalité contrairement chez l’enfant oule rôle néfaste de l’utilisation d’ibuprofène a été très clairement montré dans la survenue d’une dermohypodermite bactérienne nécrosante ou dans son aggravation au cours des infections cutanées compliquant la varicelle (risque relatif à 11 pour les fasciites et à 16 pour le choc streptococcique) [9,11].
Pour certains auteurs, l’origine ethnique africaine est également identifiée comme un facteur de risque avec un risque relatif mesuré à 2 [9,12].
La durée d’incubation est habituellement courte, entre six et 48 heures [9].Les signes cutanés sont souvent pauvres: il n’y a pas de corrélation entre l’atteinte cutanée, qui peut être faussement rassurante, et la réalité des atteintes sous-jacentes [13]. Douleur localisée intense contrastant parfois avec le peu de signes physiques observés, érythème, œdème dépassant les limites peu précises de l’érythème, vésicules ou bulles parfois hémorragiques qui se voient également dans les érysipèles (les lésions dermatologiques).
Les examens d’imagerie peuvent être utiles pour confirmer une atteinte profonde et préciser sa localisation, mais elle ne doit en aucun cas retarder la prise en charge chirurgicale urgente des cas avérés.
L’examen radiographique standard est peu d’intérêt et peu contributif. Il permet de visualiser seulement un épaississement et une hyperdensité relative des tissus mous, avec présence des emphysèmes gazeux sous cutanés [5].
L’échographie peut être utile en âge pédiatrique contrairement chez l’adulte ou on retrouve un taux élevé de faux négatifs [13].
La TDM et l’IRM recherchent un épaississement supérieur à 3 mm et une absence partielle ou complète derehaussement de signal sous contraste des fascias épaissis (sensibilité et spécificité élevées) [5,13]. Ces derniers permettent également de distinguer l’œdème inflammatoire (œdème chaud) de l’œdème de stase (œdème froid) qui est de distribution symétrique; et ne présente pas de rehaussement de signalsous contraste[13,14]. Souvent, la difficulté d’accessibilité de l’IRM et sa durée de réalisation chez des patients en état de choc peuvent conduire à préférer le scanner en première intention en pratique courante [9].
Dans les formes subaiguës de diagnostic trompeur, les examens radiologiques prennent une place afin d’évoquer les diagnostiques différentiels comme différencier les infections plus superficielles (dermohypodermites), fasciites non nécrosantes et des affections non inflammatoires [13].
Les examens biologiques standards ont un double intérêt: évaluer le retentissement général du sepsis grave sur les différents organes et établir un score diagnostic (LRINEC: Laboratory Risk Indicator for Necrotizing Fasciitis). Un score plus de 8 est fortement prédictive d'une fasciite nécrosante (VPP= 93.4%) [15].
L’écologie bactérienne dans les fasciitesnécrosantes est souvent polymicrobienne[3,5] avec en moyenne 2,2 germes par prélèvement, 40 % des prélèvements demeurent mono bactériens, 20 % sont mixtes avec des germes aérobies et anaérobies cohabitant, 27 % avec des anaérobies seuls [9,16].
L’examen anatomo-pathologique des biopsies garde son intérêt seulement pour éliminer le diagnostic d’un pyodermagangrenosum (résistant aux ATB mais cortico-sensible), principal diagnostic différentiel des fasciites nécrosante dont leurs tableaux cliniques est similaires [17].
Lorsque l’infection est nosocomiale avec fort risque de colonisation par un SARM, l’ajout de la vancomycine ou du linézolide est conseillé. La durée habituelle est de 15 jours [9]. La non disponibilité de ces molécules dans notre centre justifie la multiplicité d’association des antibiotiques prescrits dans notre série qui sont dirigés à la fois contre les germes aérobies et anaérobies.
La chirurgie est le volet fondamental de la prise en charge. Cette dernière doit être précoce, agressive, exhaustive et itérative selon le principe « chercher et détruire » [9,18]. Elle permet à la fois de confirmer le diagnostic et dans un même temps effectuer un geste thérapeutique.
Dans l’analyse multivariée de 302 gangrènes de Fournier, Sugihara et al. en déduisent que la précocité de la prise en charge chirurgicale est un facteur significatif d’amélioration de la survie enmontrant une mortalité significativement moindre dans le groupe chirurgie précoce (< 2 jours) versus du groupe chirurgie retardée (> 3 jours) [19].
Les séries de la littérature rapportent des parages au bloc opératoire à trois reprises en moyenne pour les fasciites nécrosantes[20] [21] et tous les jours au cours de la première semaine selon Praba-Egge et al.[22]. L’existence probable d’une corrélation entre le nombre de reprise et le taux de mortalité est souvent débattu par les auteurs, malgré des données discordantes[23]. Dans notre série, le nombre moyen de parages chirurgicaux était de 12,60 avec des extrêmes entre 6 et 45 ce qui s’explique par la présence des cas de myonécrose dans notre série qui nécessite un nombre élevé de reprise chirurgicale au bloc opératoire par rapport aux fasciites nécrosantes. Ceci se justifie également par la durée d’hospitalisation de nos patients par rapport à celle de la littérature et le comptage des débridements effectués du côté du lit dans notre série parmi les reprises chirurgicales. Ces dernières nous permettent une réévaluation fréquente voire une reprise de principe dans les 24 h pour s’assurer de l’adéquation de la chirurgie et de l’absence de poursuite de l’extension des infections en profondeur [24]. Pour nos cas, le nombre de parages chirurgicaux a un impact clinique sur la bonne évolution des plaies, le nombre de séjour d’hospitalisation des patients tout en diminuant la charge bactérienne et augmentant l’efficacité des antibiotiques utilisés.
L’utilisation de l’oxygène hyperbarique (OHB) est débattue dans la littérature et la société Cochrane a publié en 2015 un rapport à partir de sa base de données ne parvenant pas à conclure quant à l’efficacité ou pas de l’OHB dans la prise en charge des fasciites nécrosantes [25]. Néanmoins, les données expérimentales démontrent que l’OHB associée à une antibiothérapie adaptée est plus efficace qu’une antibiothérapie seule dans un modèle de souris [9].
L'utilisation supplémentaire d'une thérapie par pression négative (TPN) pour la prise en charge de la NF de la paroi thoracique a récemment été rapportée avec succès [6]. Son utilisation permet le drainage des sécrétions, améliore le développement de la microcirculation et favorise la formation des granulations tissulaires pour la phase de cicatrisation.
La reconstruction pariétale retardée est justifiée lorsque le défaut de cicatrisation est présent. L'utilisation du lambeau libre du muscle grand dorsal semble être la technique de reconstruction de choix avec de bons résultats esthétiques et fonctionnels[26].
Dans notre série, aucun patient n’a bénéficié d’une chirurgie reconstructrice.
Les auteurs ont noté que la durée d’hospitalisation était plus courte chez les patients traités à l’aide de la TPN, mais que ces résultats provenaient d’études non randomisées [27,28]. Dans notre cas, le nombre de séjour d’hospitalisation certains malades est surestimé à cause leur éloignement géographique qui nous oblige à les garder en hospitalisation pour le suivi de la cicatrisation. Pham et ses coll. ont conclu que la technique semble être une alternative prometteuse pour le traitement de diverses plaies. Selon eux, la TPN semble améliorer la cicatrisation des plaies avec peu de complications sérieuses [29]. Dans notre série, nous n’avons pas relevé des complications à notre procédure de pansement aspiratif. Vikatmaa et ses coll. ont conclu dans leur étude que les preuves préliminaires indiquent que l’efficacité de la TPN est au moins aussi bonne, voire meilleure que le traitement local actuel pour les plaies [30].
CONCLUSION
Les trois pierres angulaires, qui garantirent l’évolution favorable de cette affection dévastatrice, sont constituées par une réanimation adéquate, une antibiothérapie appropriée et un parage chirurgical agressif. La rapidité d’évolution de ces infections impose d’établir un diagnostic le plus tôt possible afin de diminuer le risque de mortalité et les séquelles fonctionnelles souvent invalidantes. Le pansement aspiratif utilisé dans notre centre est une bonne option alternative de VAC (Vacuum Assisted Closure) qui reste inaccessible et onéreux pour nos patients. Cette méthode nous a permis, avec un bon résultat, de traiter les patients atteints des infections des tissus mous avec une grande perte de substance, souvent en mauvaise condition générale et ne conviennent pas pour une chirurgie reconstructive étendue.
CONFIT D’INTÉRÊT
Les auteurs déclarent ne pas avoir de conflits d’intérêts en relation avec cet article et indiquent que le consentement éclairé a été obtenu pour la publication des photos.
RÉFÉRENCES
1. Société de Pathologie Infectieuse de Langue Francaise. (2000). Société française de dermatologie. Conférence de consensus. Érysipèle et fasciitenécrosante: prise en charge. Med Mal Infect, 30(Suppl 4), 241-5.
2. Burge TS, Watson JD. Necrotising fasciitis. Br Med J 1994;308:1453–4.
3. Lu, M. S., Chen, C. M., Huang, Y. K., Liu, Y. H., & Kao, C. L. (2008). Devastating chest wall necrotizing fasciitis following pigtail catheter drainage. Respiratory Medi-cine CME, 1(2), 90-92.
4. FrotaFilho, J. D., Drews, C., Leães, P., Blacher, C., Tos-tes, F., Delatorre, N., & Lobo, R. (2001). Postoperative necrotizing fasciitis of the thorax in cardiac surgery. Arquivosbrasileiros de cardiologia, 76(3), 250-254.
5. Cazorla, C. (2000). De quelles données at-on besoin aujourd'hui pour prendre en charge les cellulites et fasciites nécrosantes?. Médecine et Maladies Infec-tieuses, 30, 389s-398s.
6. Birnbaum, David J., et al. "Necrotizing fasciitis of the chest wall." Interactive cardiovascular and thoracicsurge-ry 10.3 (2010): 483-484.
7. Ettalbi, S., Benchamkha, Y., Boukind, S., Droussi, H., Ouahbi, S., Soussou, M., & Sarf, I. (2013, August). Peri-neal-scrotal gangrene: epidemiological and therapeu-tic aspects. About 45 cases. In Annales de chirurgie plas-tique et esthetique (Vol. 58, No. 4, pp. 310-320).
8. Kaul, R., McGeer, A., Low, D. E., Green, K., Schwartz, B., &Simor, A. E. (1997). Population-based surveillance for group A streptococcal necrotizing fasciitis: clinical features, prognostic indicators, and microbiologic analysis of seventy-seven cases. The American journal of medicine, 103(1), 18-24.
9. Jarrassier A, Rouquie D, Libert N, Masson Y, Constantin P, de Rudnicki S. Cellulites, fasciites, myosites,gangrène gazeuse. EMC - Anesthésie-Réanimation 2016;13(3):1-14
10. Kahn, L. H., &Styrt, B. A. (1997). Necrotizing soft tis-sue infections reported with nonsteroidalantiinflam-matory drugs. Annals of Pharmacotherapy, 31(9), 1034-1039.
11. Zerr, D. M., Alexander, E. R., Duchin, J. S., Koutsky, L. A., & Rubens, C. E. (2000). Necrotizing fasciitis during primary varicella. Pediatrics, 105(6), 1373-1375.
12. Roujeau JC. Critères cliniques et facteurs de risque. Med Mal Infect 2000;30:399s–405s.
13. Malghem, J., Lecouvet, F. E., Omoumi, P., Maldague, B. E., & Berg, B. C. V. (2013). Fasciite nécrosante: dia-gnostic en imagerie et ses limites. Revue du rhuma-tisme, 80(2), 116-122.
14. Joseph, S. Y., & Habib, P. (2009). MR imaging of urgent inflammatory and infectious conditions affecting the soft tissues of the musculoskeletal system. Emergency radiology, 16(4), 267-276.
15. Razafimanjato, N. N. M., Rasoamampianina, L. E., Ravoatrarilandy, M., Rakototiana, A. F., Hunald, F. A., Samison, L. H., &Rakotovao, H. J. L. (2013). Fasciite nécrosante de la paroi thoracique compliquant un em-pyème. The Pan AfricanMedical Journal, 16.
16. Urschel, J. D. (1999). Necrotizing soft tissue infec-tions. Postgraduate medical journal, 75(889), 645-649.
17. Mahajan, A. L., Ajmal, N., Barry, J., Barnes, L., &Lawlor, D. (2005). Could your case of necrotisingfas-citis be Pyodermagangrenosum?. British journal of plastic surgery, 58(3), 409-412.
18. Martinschek, A., Evers, B., Lampl, L., Gerngroß, H., Schmidt, R., &Sparwasser, C. (2012). Prognostic as-pects, survival rate, and predisposing risk factors in patients with Fournier’s gangrene and necrotizing soft tissue infections: evaluation of clinical outcome of 55 patients. Urologiainternationalis, 89(2), 173-179.
19. Sugihara, T., Yasunaga, H., Horiguchi, H., Fujimura, T., Ohe, K., Matsuda, S., ...& Homma, Y. (2012). Im-pact of surgical intervention timing on the case fatali-ty rate for Fournier's gangrene: an analysis of 379 cas-es. BJU international, 110(11c).
20. Mallikarjuna, M. N., Vijayakumar, A., Patil, V. S., &Shivswamy, B. S. (2012). Fournier’s gangrene: cur-rent practices. ISRN surgery, 2012.
21. Benjelloun, E. B., Souiki, T., Yakla, N., Ousadden, A., Mazaz, K., Louchi, A., ...&Taleb, K. A. (2013). Four-nier’s gangrene: our experience with 50 patients and analysis of factors affecting mortality. World Journal of Emergency Surgery, 8(1), 13.
22. Praba-Egge, A. D., Lanning, D., Broderick, T. J., &Yelon, J. A. (2004). Necrotizing fasciitis of the chest and abdominal wall arising from an empyema. Journal of Trauma and Acute Care Surgery, 56(6), 1356-1361.
23. Cainzos, M., & Gonzalez-Rodriguez, F. J. (2007). Ne-crotizing soft tissue infections. Current opinion in criti-cal care, 13(4), 433-439.
24. May, A. K. (2011). Skin and soft tissue infections: the new surgical infection society guidelines. Surgical infections, 12(3), 179-184.
25. Levett D, Bennett MH, Millar I. Adjunctive hyperbaric oxygen for necrotizing fasciitis. Cochrane database Syst Rev 2015;(1):CD007937.
26. Barbosa, R. F., Pinho, C. J., Costa‐Ferreira, A., Cardo-so, A., Reis, J. C., &Amarante, J. M. (2006). Microsurgi-cal reconstruction of chest wall defect after necrotiz-ing fasciitis. Microsurgery, 26(7), 519-523.
27. Gregor, S., Maegele, M., Sauerland, S., Krahn, J. F., Peinemann, F., & Lange, S. (2008). Negative pressure wound therapy: a vacuum of evidence?. Archives of surgery, 143(2), 189-196.
28. Sauerland, S., S. Gregor, J. F. Krahn, M. Maegele, et E. A. M. Neugebauer. (2006). Negative Pressure Wound Therapy. Institute for Quality and Efficiency in Health Care (IQWIG), pp.Final report No.04).
29. Pham, C. T., Middleton, P. F., &Maddern, G. J. (2006). The safety and efficacy of topical negative pressure in non-healing wounds: a systematic review. Journal of wound care, 15(6), 240-250.
30. Vikatmaa, P., Juutilainen, V., Kuukasjärvi, P., &Malmivaara, A. (2008). Negative pressure wound therapy: a systematic review on effectiveness and safety. European Journal of Vascular and Endovascular-Surgery, 36(4), 438-448.
FIGURES - TABLES

REFERENCES
1. Société de Pathologie Infectieuse de Langue Francaise. (2000). Société française de dermatologie. Conférence de consensus. Érysipèle et fasciitenécrosante: prise en charge. Med Mal Infect, 30(Suppl 4), 241-5.
2. Burge TS, Watson JD. Necrotising fasciitis. Br Med J 1994;308:1453–4.
3. Lu, M. S., Chen, C. M., Huang, Y. K., Liu, Y. H., & Kao, C. L. (2008). Devastating chest wall necrotizing fasciitis following pigtail catheter drainage. Respiratory Medi-cine CME, 1(2), 90-92.
4. FrotaFilho, J. D., Drews, C., Leães, P., Blacher, C., Tos-tes, F., Delatorre, N., & Lobo, R. (2001). Postoperative necrotizing fasciitis of the thorax in cardiac surgery. Arquivosbrasileiros de cardiologia, 76(3), 250-254.
5. Cazorla, C. (2000). De quelles données at-on besoin aujourd'hui pour prendre en charge les cellulites et fasciites nécrosantes?. Médecine et Maladies Infec-tieuses, 30, 389s-398s.
6. Birnbaum, David J., et al. "Necrotizing fasciitis of the chest wall." Interactive cardiovascular and thoracicsurge-ry 10.3 (2010): 483-484.
7. Ettalbi, S., Benchamkha, Y., Boukind, S., Droussi, H., Ouahbi, S., Soussou, M., & Sarf, I. (2013, August). Peri-neal-scrotal gangrene: epidemiological and therapeu-tic aspects. About 45 cases. In Annales de chirurgie plas-tique et esthetique (Vol. 58, No. 4, pp. 310-320).
8. Kaul, R., McGeer, A., Low, D. E., Green, K., Schwartz, B., &Simor, A. E. (1997). Population-based surveillance for group A streptococcal necrotizing fasciitis: clinical features, prognostic indicators, and microbiologic analysis of seventy-seven cases. The American journal of medicine, 103(1), 18-24.
9. Jarrassier A, Rouquie D, Libert N, Masson Y, Constantin P, de Rudnicki S. Cellulites, fasciites, myosites,gangrène gazeuse. EMC - Anesthésie-Réanimation 2016;13(3):1-14
10. Kahn, L. H., &Styrt, B. A. (1997). Necrotizing soft tis-sue infections reported with nonsteroidalantiinflam-matory drugs. Annals of Pharmacotherapy, 31(9), 1034-1039.
11. Zerr, D. M., Alexander, E. R., Duchin, J. S., Koutsky, L. A., & Rubens, C. E. (2000). Necrotizing fasciitis during primary varicella. Pediatrics, 105(6), 1373-1375.
12. Roujeau JC. Critères cliniques et facteurs de risque. Med Mal Infect 2000;30:399s–405s.
13. Malghem, J., Lecouvet, F. E., Omoumi, P., Maldague, B. E., & Berg, B. C. V. (2013). Fasciite nécrosante: dia-gnostic en imagerie et ses limites. Revue du rhuma-tisme, 80(2), 116-122.
14. Joseph, S. Y., & Habib, P. (2009). MR imaging of urgent inflammatory and infectious conditions affecting the soft tissues of the musculoskeletal system. Emergency radiology, 16(4), 267-276.
15. Razafimanjato, N. N. M., Rasoamampianina, L. E., Ravoatrarilandy, M., Rakototiana, A. F., Hunald, F. A., Samison, L. H., &Rakotovao, H. J. L. (2013). Fasciite nécrosante de la paroi thoracique compliquant un em-pyème. The Pan AfricanMedical Journal, 16.
16. Urschel, J. D. (1999). Necrotizing soft tissue infec-tions. Postgraduate medical journal, 75(889), 645-649.
17. Mahajan, A. L., Ajmal, N., Barry, J., Barnes, L., &Lawlor, D. (2005). Could your case of necrotisingfas-citis be Pyodermagangrenosum?. British journal of plastic surgery, 58(3), 409-412.
18. Martinschek, A., Evers, B., Lampl, L., Gerngroß, H., Schmidt, R., &Sparwasser, C. (2012). Prognostic as-pects, survival rate, and predisposing risk factors in patients with Fournier’s gangrene and necrotizing soft tissue infections: evaluation of clinical outcome of 55 patients. Urologiainternationalis, 89(2), 173-179.
19. Sugihara, T., Yasunaga, H., Horiguchi, H., Fujimura, T., Ohe, K., Matsuda, S., ...& Homma, Y. (2012). Im-pact of surgical intervention timing on the case fatali-ty rate for Fournier's gangrene: an analysis of 379 cas-es. BJU international, 110(11c).
20. Mallikarjuna, M. N., Vijayakumar, A., Patil, V. S., &Shivswamy, B. S. (2012). Fournier’s gangrene: cur-rent practices. ISRN surgery, 2012.
21.Benjelloun, E. B., Souiki, T., Yakla, N., Ousadden, A., Mazaz, K., Louchi, A., ...&Taleb, K. A. (2013). Four-nier’s gangrene: our experience with 50 patients and analysis of factors affecting mortality. World Journal of Emergency Surgery, 8(1), 13.
22. Praba-Egge, A. D., Lanning, D., Broderick, T. J., &Yelon, J. A. (2004). Necrotizing fasciitis of the chest and abdominal wall arising from an empyema. Journal of Trauma and Acute Care Surgery, 56(6), 1356-1361.
23. Cainzos, M., & Gonzalez-Rodriguez, F. J. (2007). Ne-crotizing soft tissue infections. Current opinion in criti-cal care, 13(4), 433-439.
24. May, A. K. (2011). Skin and soft tissue infections: the new surgical infection society guidelines. Surgical infections, 12(3), 179-184.
25. Levett D, Bennett MH, Millar I. Adjunctive hyperbaric oxygen for necrotizing fasciitis. Cochrane database Syst Rev 2015;(1):CD007937.
26. Barbosa, R. F., Pinho, C. J., Costa‐Ferreira, A., Cardo-so, A., Reis, J. C., &Amarante, J. M. (2006). Microsurgi-cal reconstruction of chest wall defect after necrotiz-ing fasciitis. Microsurgery, 26(7), 519-523.
27. Gregor, S., Maegele, M., Sauerland, S., Krahn, J. F., Peinemann, F., & Lange, S. (2008). Negative pressure wound therapy: a vacuum of evidence?. Archives of surgery, 143(2), 189-196.
28. Sauerland, S., S. Gregor, J. F. Krahn, M. Maegele, et E. A. M. Neugebauer. (2006). Negative Pressure Wound Therapy. Institute for Quality and Efficiency in Health Care (IQWIG), pp.Final report No.04).
29. Pham, C. T., Middleton, P. F., &Maddern, G. J. (2006). The safety and efficacy of topical negative pressure in non-healing wounds: a systematic review. Journal of wound care, 15(6), 240-250.
30. Vikatmaa, P., Juutilainen, V., Kuukasjärvi, P., &Malmivaara, A. (2008). Negative pressure wound therapy: a systematic review on effectiveness and safety. European Journal of Vascular and Endovascular-Surgery, 36(4), 438-448.
ARTICLE INFO
DOI: 10.12699/jfvpulm.9.27.2018.23
Conflict of Interest
Non
Date of manuscript receiving
12/06/2018
Date of publication after correction
31/08/2018
Article citation
Razafimanjato N.N.M, Ravelomihary T.D, Ravoatrarilandy M, Rajaonera T.A, Hunald F.A, Samison L.H, Rakotovao H.J.L. Necrotizing fasciitis of the chest wall: our preliminary results on the 14 observations treated by negative pressure. J Func Vent Pulm 2018;27(9):23-30.