
 English
English
 French
French
The plastic bronchitis: about one case
La bronchite plastique: à propos d’un cas clinique
R. Taghlaoui, A. Hayoune, H. Kouismi
Service de Pneumologie. CHU Mohammed VI d'Oujda. Oujda, Maroc
Corresponding author
Dr. Hatim KOUISMI
Service de Pneumologie. CHU Mohammed VI d'Oujda. Maroc
E-mail: hatim.kouismi@gmail.com
ABSTRACT
Plastic bronchitis (BP) or bronchial mussel disease is a rare condition that is common at any age, with a predilection in children. The diagnosis is usually obvious and relies on the appearance of solid and branched sputum. However, etiological research is not easy and does not often lead to a diagnosis.
We report the case of a 16-year-old patient with a history of recurrent respiratory infections since childhood with persistent, solid and branched chronic sputum since January 2019; the symptomatology worsened two weeks before admission by the increased cough and the appearance of a dyspnea stage 3 of Sadoul. The thorax showed a left basal opacity associated with a predominant bronchial syndrome on the left. The CT sections demonstrated dilated cystic bronchi located at basal level of LSG and apical of LIG. Bronchial fibroscopy found thick, solid, whitish-like secretions obstructing the bronchi at the PB level of LIG and culmen. Histopathological examination of fibroscopic material revealed loose fibrotic tissue with some inflammatory cells. A few days after the bronchoscopy, the patient rejected more bronchial sputum, and so the dyspnea improved. The evolution was favorable under antibiotherapy and respiratory physiotherapy. The diagnosis of BP on a localized DDB focus is retained.
The presence of solid and branched sputum should be reminiscent of bronchial mussel disease and encourage bronchoscopic fibroscopy for diagnostic and therapeutic purposes. Management must be early to avoid complications.
KEYWORDS: Plastic bronchitis; Bronchial mold; Bronchial fibroscopy.
.RÉSUMÉ
La bronchite plastique (BP) ou maladie des moules bronchiques est une pathologie rare, rencontrée à tout âge, avec une prédilection chez l‘enfant. Le diagnostic est généralement évident et repose sur l’aspect des expectorations solides et ramifiées. Cependant, la recherche étiologique n’est pas facile et n’aboutit pas souvent à un diagnostic.
Nous rapportons le cas d’un patient de 16 ans, aux antécédents la notion d’infections respiratoires à répétition depuis l’enfance qui présente des expectorations chroniques persistantes solides et ramifiées depuis janvier 2019 ; la symptomatologie s’est aggravé deux semaines avant son admission par la majoration de la toux et l’apparition d’une dyspnée stade 3 de Sadoul .La radio thorax montrait une opacité basale gauche associée à un syndrome bronchique prédominant à gauche. Les coupes scannographiques misaient en évidence une dilatation des bronches kystique localisée au niveau basal de LSG et apical de LIG. La fibroscopie bronchique retrouvait des sécrétions épaisses solides d’aspect blanchâtre obstruant les bronches au niveau de PB de LIG et de culmen. L’examen anatomopathologique de matériel prélevé par fibroscopie montrait un tissu fibreux lâche avec présence de quelque cellules inflammatoires. Quelque jours après la bronchoscopie, le patient a rejeté davantage des expectorations bronchiques, et ainsi la dyspnée s'est améliorée. L’évolution était favorable sous antibiothérapie et kinésithérapie respiratoire. Le diagnostic de BP sur un foyer localisé DDB est retenu.
La présence d’expectorations solides et ramifiées doit faire penser à la maladie des moules bronchiques et inciter à réaliser une fibroscopie bronchique à visée diagnostique et thérapeutique. La prise en charge doit être précoce pour éviter des complications.
MOTS CLÉS: Bronchite plastique; Moule bronchique; Fibroscopie bronchique.
INTRODUCTION
La bronchite plastique (BP) est une affection rare, elle se caractérise par l’obstruction étendue de l’arbre bronchique par des moules bronchiques ; elle peut entraîner des détresses respiratoires parfois fatales.
Elle se rencontre essentiellement au cours d’affections respiratoires chroniques ou de cardiopathies cyanogènes.
Tous les niveaux bronchiques peuvent être atteints, en particulier les lobes inférieurs. La BP atteint aussi bien l’enfant que l’adulte, mais la plupart des cas ont été rapportés chez des enfants [1]. La prévalence exacte de la BP demeure inconnue et semble sousestimée [2].
OBSERVATION
Nous rapportons l’observation d’un adolescent hospitalisé dans notre service de pneumologie d’Oujda durant le mois Avril 2019.
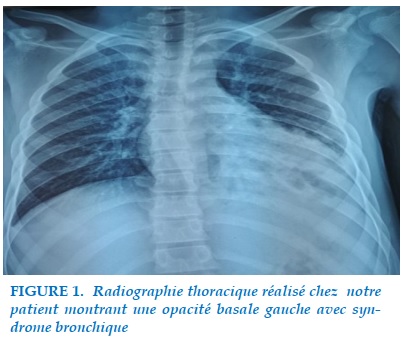
Il s’agit d’un jeune patient âgé de 16 ans ayant comme antécédents une notion de pneumopathies à répétitions depuis l’âge de 5 ans. Le patient se pré-sentait en consultation pour prise en charge d’une toux chronique trainante associé à une douleur basithoracique gauche, la symptomatologie s’est aggravée par la majoration des expectorations et l’apparition d’une dyspnée stade 3 de Sadoul. L’examen clinique: patient conscient stable sur le plan hémodynamique, polypneique à 24 c/min; SaO2: 94 % à l’air ambiant ; l’examen pleuropulmonaire : sans particularité. La Radiographie thoracique misait en évidence une opacité basale gauche avec un syndrome bronchique prédominant à gauche (Figure 1).
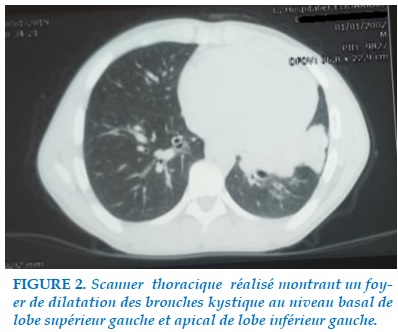
On a complété par une tomodensitométrie thoracique qui montrait un aspect de dilatation des bronches kystiques localisée au niveau basal de lobe supérieur gauche et apical de lobe inférieur gauche (Figure 2).
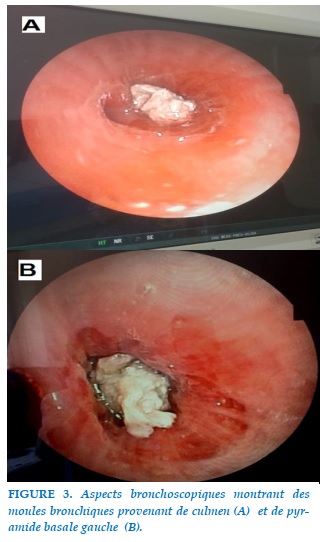
L’exploration bronchoscopique, réalisée à trois reprises, montrait au niveau de l’arbre bronchique gauche: une muqueuse d’aspect inflammatoire diffuse avec épaississement de l’éperon ILS (inter lobaire supérieur) et ICL (inter-culmeno-lingulaire) avec des moules blanchâtres collantes à la paroi et obstruant la lumière bronchique au niveau de culmen et au niveau de pyramide basale gauche (Figure 3).
On a réalisé une aspiration bronchique de matériel blanchâtre (Figure 4) dont l’étude bactériologique, parasitologique, mycologique et recherche de BK étaient négatives.
L’examen anatomopathologique de matériel prélevé par fibroscopie montre un tissu fibreux lâche avec quelque cellules inflammatoires.
En prenant compte les données cliniques de l’imagerie et la recherche étiologique négative : on a conclu qu’il s’agissant d’une bronchite plastique avec cause sous-jacente une dilatation des bronches localisée.
Le patient a été mis sous traitement antibiotique avec des séances de kinésithérapie ce qui a permis une évolution favorable avec régression de la toux et la dyspnée.
DISCUSSION
La maladie des moules bronchiques ou bronchite plastique (BP) est définie par l’obstruction étendue de l’arbre bronchique par des moules épais, ramifiés et fortement adhérents au mur bronchique [1]. Cette maladie, si elle est rare, n’en est pas moins connue depuis l’antiquité.
Elle a été décrite pour la première fois par Galien qui a considéré le produit d’expectoration comme; « venae arteriosae expectorantii », ce qui signifie, des expectorations artérielles et veineuses [3].
En 1956, Soulas et Mounier-Kuhn la dissocient des bronchites pseudo-membraneuses et la décrivent comme une maladie autonome et primitive [4].
Jusqu’à récemment, les mécanismes pathogènes sous-jacents à cette entité pathologique restent mal connus [5].
L’incidence réelle de la BP reste encore inconnue : moins de 600 cas sont signalés dans la littérature à ce jour [2].
C’est une maladie plus fréquente chez les enfants que les adultes [6].
Dans notre cas notre patient est très jeune âgé de 16 ans . La revue de la littérature retrouve chez l’adulte comme chez l’enfant le même schéma de classification simple, établi par Sear et al, divisant la BP en deux types [7].
Type 1, caractérisé par des moules contenant des infiltrats cellulaires (cellules épithéliales bronchiques, cellules inflammatoires et éosinophiles), de la Fibrine et peu de mucus.
La BP type 2 : caractérisée par des moules contenant peu de fibrine, de mucus avec très peu de cellules mononuclées [7-9].
Dans les formes décrites chez l’adulte, on retrouve une prédominance féminine dans les formes de type 2.
Trois études ont retrouvé chez des femmes, toutes ayant des antécédents de cardiopathies sévères ayant bénéficié d’un pontage aorto-coronarien à l’origine de la bronchite plastique de type 2 acellulaire [10— 11].
Chez l’adulte, l’origine tuberculeuse de la BP est dé- crite par d’autres auteurs tels que N. Amangar [12] et H. Kouismi [13].
Dans notre cas, on retrouve une cause sous jacente la plus probable devant l’existence d’un foyer de dilatation des bronches kystique localisé.
Dans d’autres cas, l’étiologie est non précisée et on conclut à une BP idiopathique.
Sur le plan thérapeutique, outre l’extraction endo -scopique du moule, souvent indispensable car le pronostic vital du patient peut être mis en jeu, le traitement dépend de l’étiologie.
Dans notre cas on a procédé à l’aspiration par bronchoscopie des matériaux bronchiques avec des sé-ances de kinésithérapie respiratoire et la mise sous antibiothérapie ce qui avait amélioré favorablement l’état clinique de notre patient.
Il ya d’autres moyens thérapeutiques décrit dans la littérature pour prévenir la récidive du moule:
Une corticothérapie inhalée ou générale est plutôt indiquée dans la BP de type acellulaire.
Une antibiothérapie au long cours par macrolides à faibles doses semble avoir une action bénéfique dans les BP inflammatoires [9].
Une correction chirurgicale d’une cardiopathie ou d’une anomalie lymphatique.
Un traitement local par instillation endoscopique de DNase recombinante humaine (rh-DNase) [14] ou par aérosols de l’activateur tissulaire de plasminogène (t-PA) [15] ou d’urokinase [16] ont fait état d’une certaine efficacité concernant des cas isolés ou de faibles séries de BP récidivantes.
Une meilleure compréhension de l'état de l’hypersécrétion bronchique lors de la bronchite plastique peut permettre d’adopter une bonne conduite thérapeutique spécifique et plus efficace.
CONCLUSION
La présence d’expectorations solides et ramifiées doit faire penser à la maladie des moules bronchiques et inciter à réaliser une fibroscopie bronchique à visée diagnostique et thérapeutique. La prise en charge doit être précoce pour éviter des complications.
CONFLIT D’INTERET
Aucun.
REFERENCES
1. Bowen A, Oudjhane K, Odagiri K, et al. Plastic bronchitis:large, branching, mucoid bronchial casts in children. AJR1985;144:371—5.
2. Downey GP, Aschner Y. Chasing the lymph: new clues for themanagement of idiopathic plastic bronchitis. Ann Am ThoracSoc 2016;3:1671—3.
3. Johnson R, Sita-Lumpsen EG. Plastic bronchitis. Thorax 1960;15:325–32.
4. Soulas A, Mounier-Kuhn P. Bronchologie technique endoscopique et pathologie trachéobronchique. Paris: Masson Ed;1956. p. 339—51.
5. Itkin MG, Mc Cormack FX, Dori Y. Diagnosis and treatment of lymphatic plastic bronchitis in adults using advanced lymphatic imaging and percutaneous embolization. Ann Am Thorac Soc2016;13:1689—96.
6. Castet D, Lavandier M, Asquier E, et al. Moules bronchiques associés à des anomalies lymphatiques pulmonaires. Rev MalRespir 1998;15:89—91.
7. Seear M, Hui H, Magee F, Bohn D, Cutz E. Bronchial casts in children: a proposed classification based on nine cases and review of the literature. Am J Respir Crit Care Med 1997;155: 364-70.
8. Eberlein MH, Drummond MB, Haponik EF. Plastic bronchitis: amanagement challenge. Am J Med Sci 2008;335:163—9.
9. Park JY, Elshami AA, Kang DS, et al. Plastic bronchitis. Eur Respir J 1996;9:612—4.
10. Patil MH, Siddiqi A, Jeffrey Mador M. Successful bronchoscopyin a pregnant patient with plastic bronchitis. Respir Med CaseRep 2016;18:8—9.
11. Stoddart A, Dincer HE, Iber C, et al. Chyloptysis causing plasticbronchitis. Respir Med Case Rep 2014;13:4—6.
12. N. Amangar, H. Moubachir, J.E. Bourkadi, et al.Plastic bronchitis: report of six pediatric cases Rev Fr Allergol, 53 (2013), pp. 624-627
13. Kouismi H, Zahraoui R, Bourkadi JE, et al. La bronchiteplastique : à propos d’une observation. J Fran Viet Pneu2013;04:1—44.
14. Manna SS, Shaw J, Tibby SM, Durward A. Treatment of plastic bronchitis in acute chest syndrome of sickle cell disease with intratracheal rhDNase. Arch Dis Child 2003;88:626-7.
15. Costello JM, Steinhorn D, Mc Colley S, Mark E, Kumar SP. Treatment of plastic bronchitis in a Fontan patient with tissue plasminogen activator: A case report and review of the literature. Pediatrics 2002;109:e67.
16. Quasney MW, Orman K, Thompson J, Ring JC, Salim M, Schoumacher RA, et al. Plastic bronchitis occurring late after the Fontan procedure treatment with aerosol-ized urokinase. Crit Care Med 2000;28:2107-1.
FIGURES

REFERENCES
1. Bowen A, Oudjhane K, Odagiri K, et al. Plastic bronchitis:large, branching, mucoid bronchial casts in children. AJR1985;144:371—5.
2. Downey GP, Aschner Y. Chasing the lymph: new clues for themanagement of idiopathic plastic bronchitis. Ann Am ThoracSoc 2016;3:1671—3.
3. Johnson R, Sita-Lumpsen EG. Plastic bronchitis. Thorax 1960;15:325–32.
4. Soulas A, Mounier-Kuhn P. Bronchologie technique endoscopique et pathologie trachéobronchique. Paris: Masson Ed;1956. p. 339—51.
5. Itkin MG, Mc Cormack FX, Dori Y. Diagnosis and treatment of lymphatic plastic bronchitis in adults using advanced lymphatic imaging and percutaneous embolization. Ann Am Thorac Soc2016;13:1689—96.
6. Castet D, Lavandier M, Asquier E, et al. Moules bronchiques associés à des anomalies lymphatiques pulmonaires. Rev MalRespir 1998;15:89—91.
7. Seear M, Hui H, Magee F, Bohn D, Cutz E. Bronchial casts in children: a proposed classification based on nine cases and review of the literature. Am J Respir Crit Care Med 1997;155: 364-70.
8. Eberlein MH, Drummond MB, Haponik EF. Plastic bronchitis: amanagement challenge. Am J Med Sci 2008;335:163—9.
9. Park JY, Elshami AA, Kang DS, et al. Plastic bronchitis. Eur Respir J 1996;9:612—4.
10. Patil MH, Siddiqi A, Jeffrey Mador M. Successful bronchoscopyin a pregnant patient with plastic bronchitis. Respir Med CaseRep 2016;18:8—9.
11. Stoddart A, Dincer HE, Iber C, et al. Chyloptysis causing plasticbronchitis. Respir Med Case Rep 2014;13:4—6.
12. N. Amangar, H. Moubachir, J.E. Bourkadi, et al.Plastic bronchitis: report of six pediatric cases Rev Fr Allergol, 53 (2013), pp. 624-627
13. Kouismi H, Zahraoui R, Bourkadi JE, et al. La bronchiteplastique : à propos d’une observation. J Fran Viet Pneu2013;04:1—44.
14. Manna SS, Shaw J, Tibby SM, Durward A. Treatment of plastic bronchitis in acute chest syndrome of sickle cell disease with intratracheal rhDNase. Arch Dis Child 2003;88:626-7.
15. Costello JM, Steinhorn D, Mc Colley S, Mark E, Kumar SP. Treatment of plastic bronchitis in a Fontan patient with tissue plasminogen activator: A case report and review of the literature. Pediatrics 2002;109:e67.
16. Quasney MW, Orman K, Thompson J, Ring JC, Salim M, Schoumacher RA, et al. Plastic bronchitis occurring late after the Fontan procedure treatment with aerosol-ized urokinase. Crit Care Med 2000;28:2107-1.
ARTICLE INFO
DOI: 10.12699/jfvpulm.10.30.2020.47
Conflict of Interest
Non
Date of manuscript receiving
15/12/2019
Date of publication after correction
15/02/2020
Article citation
Taghlaoui R, Hayoune A, Kouismi H. The plastic bronchitis: about one case. J Func Vent Pulm 2020;33(11):47-50