
 English
English
 French
French
Epidemiological, diagnostic and evolutive aspects of haemoptysis in Pneumology department of the Kara University Hospital in Togo
Aspects épidémio-cliniques, diagnostiques et évolutifs des hémoptysies dans le service de Pneumologie du Centre Hospitalier Universitaire de Kara au Togo
Efalou1, TAS. Adambounou2, M. Poko3, KA. Aziagbe2, T. Tchamdja4, MO. Abasse2, AG. Gbadamassi2, KS. Adjoh2
1: Service de Pneumologie du CHU Kara, Département de Médecine et Spécialités médicales de la FSS-Université de Kara. Togo
2: Service de Pneumo-phtisiologie du CHU Sylvanus Olympio de Lomé, Département de Médecine et Spécialités médicales de la FSS- Université de Lomé. Togo
3:Service d’Anesthésie-réanimation du CHU Sylvanus Olympio de Lomé. Togo
4:Service de Médecine interne du CHU Kara. Togo
Corresponding author:
EFALOU Pwèmdéou. Service de Pneumologie du CHU Kara, Département de Médecine et Spécialités médicales de la FSS-Université de Kara. Togo.
E-mail: jacquesefalou2002@yahoo.fr
ABSTRACT
Introduction. Hemoptysis is a frequent symptom in Pneumology. The aim of the study was to describe the epidemiological, clinical, diagnostic and evolutive aspects of hemoptysis at Kara’s University Hospital. Method. This was a cross-sectional, prospective study with a descriptive and analytical aim covering the period from July 1, 2018 to June 30, 2020. This study was carried out in the Pneumology department of Kara University Hospital and focused on the patients admitted for hemoptysis and those who experienced it during their hospitalization. Results. A total of 194 patients, with a mean age of 42 ± 8.6 years and extremes of 9 years and 84 years, had developed hemoptysis, ie a hospital frequency of 20.4%. There was a male predominance with an M/F ratio of 1.4. The medical history was dominated by pulmonary tuberculosis and heart disease. Hemoptysis was mild, moderate, abundant and cataclysmic in respectively 56%, 32%, 9% and 3% of the patients. Broncho-pulmonary causes were dominant with tuberculosis (38.66%) and acute bacterial pneumonia (18.04%). Mortality rate was 9.28%. Recurrences were short, medium and long term in respectively 11.34%, 11.85% and 10.31% of patients. Conclusion. The frequency of hemoptysis is significant in our settings. The etiologies are dominated by infectious causes with a significant recurrence rate. It is important to make our populations aware of this symptom and to monitor patients who experienced an episode of hemoptysis.
KEYWORDS: Hemoptysis; Kara; Togo.
RÉSUMÉ
Introduction. L’hémoptysie est un symptôme fréquent en Pneumologie. L’objectif de l’étude était de décrire les aspects épidémiologiques, cliniques, diagnostiques et évolutifs des hémoptysies au CHU de Kara. Méthode . Il s’est agi d’une étude transversale, prospective à visée descriptive et analytique sur la période du 1er juillet 2018 au 30 juin 2020. Cette étude s’est déroulée dans le service de Pneumologie du CHU Kara et a porté sur les patients admis pour hémoptysie ou l’ayant présentée en hospitalisation. Résultats. Au total, 194 patients, avec un âge moyen de 42 ± 8,6 ans et des extrêmes de 9 ans et 84 ans, avaient présenté une hémoptysie, soit une fréquence hospitalière de 20,4%. On notait une prédominance masculine avec ratio H/F de 1,4. Les antécédents étaient dominés par la tuberculose pulmonaire et les cardiopathies. L’hémoptysie était de faible, moyenne, grande abondance et cataclysmique chez respectivement 56%, 32%, 9% et 3% des patients. Les causes broncho-pulmonaires étaient dominantes avec la tuberculose (38,66%) et les pneumopathies aigues bactériennes (18,04%). La mortalité était de 9,28%. Les récidives étaient à court, moyen et long terme chez respectivement 11,34%, 11,85% et 10,31% des patients. Conclusion. La fréquence des hémoptysies est non négligeable dans nos milieux. Les étiologies sont dominées par les causes infectieuses avec une fréquence de récidive non négligeable. Il importe de sensibiliser nos populations sur ce symptôme et de surveiller les patients ayant présenté un épisode d’hémoptysie.
MOTS CLÉS: Hémoptysie; Kara; Togo.
INTRODUCTION
L’hémoptysie est définie comme le rejet de sang rouge aéré spumeux, provenant des voies respiratoires sous glottiques, lors d’un effort de toux [1]. C’est un symptôme alarmant fréquent en Pneumologie [1]. L’hémoptysie doit toujours être considérée comme une urgence, diagnostique et thérapeutique. La majorité des hémoptysies a pour origine une hypervascularisation ayant pour point de départ la circulation artérielle bronchique [1]. L’hémoptysie serait responsable de 6,8% des consultations ambulatoires et de 11% des hospitalisations dans un service de Pneumologie [2].
Une proportion de 38% des patients est référée pour une intervention endoscopique ou en chirurgie thoracique [3]. Les études estiment que 4,8 à 14 % des patients présentant des hémoptysies auront une récidive sous forme d’une hémoptysie massive [4,5].
La fréquence relative de chaque étiologie varie dans les différentes séries, notamment en fonction de la zone géographique. Les principales étiologies sont dominées par la tuberculose et les cancers broncho-pulmonaires. La tuberculose pulmonaire est particulièrement importante dans les pays en développement [6,7].
En revanche, dans les pays industrialisés, la néoplasie, la bronchectasie et la bronchite sont les principales étiologies identifiées [8,9]. Dans une étude réalisée en 2012 dans le service de Pneumologie du CHU-Sylvanus Olympio à Lomé au Togo, les principales étiologies retrouvées étaient la tuberculose pulmonaire évolutive, les pneumopathies aiguës bactériennes, les séquelles de tuberculose et les cancers broncho-pulmonaires [10]. La présente étude a été initiée en vue d’actualiser les données épidémiologiques sur les hémoptysies en milieu hospitalier au TOGO.
L’objectif général de l’étude était de décrire les aspects épidémiologiques, cliniques, diagnostiques et évolutifs des hémoptysies au Centre Hospitalier Universitaire (CHU) de Kara au Togo.
De façon spécifique, il s’est agi de
Déterminer la fréquence hospitalière des hémoptysies au CHU Kara ;
Décrire leurs profils épidémiologique et clinique ;
Dresser les principales pathologies en cause ;
Déterminer les aspects évolutifs des hémoptysies dans nos milieux.
METHODES
Cadre d’étude
Notre étude s’est déroulée dans le service de Pneumologie du Centre Hospitalier Universitaire de Kara au Togo. C’est le service de prise en charge des pathologies respiratoires dans la région septentrionale du pays. Ce nouveau service créé en 2017 reçoit environ 500 patients par an, en consultation et/ou hospitalisation.
Type et période d’étude
Il s’est agi d’une étude transversale, prospective à visée descriptive et analytique sur une période de 02 ans allant du 1er juillet 2018 au 30 juin 2020.
Population d’étude
Notre population d’étude était constituée de tous les patients admis dans le service de Pneumologie du CHU Kara pour hémoptysie ou ayant présenté une hémoptysie en cours d’hospitalisation.
Echantillonnage
Il s’est agi d’un échantillonnage exhaustif non probabiliste, prenant en compte tous les patients qui répondaient à nos critères.
Critères d’inclusion
Patient de tout sexe, de tout âge, hospitalisé pour hémoptysie ou ayant présenté un épisode d’hémoptysie au cours de l’hospitalisation, pendant la période de l’étude.
Critère de non inclusion
Tout patient non consentant à l’étude ou les cas d’hémoptysie n’ayant pas réalisé le bilan minimum notamment une radiographie thoracique et un hémogramme.
Collecte des données
La source des données :
A partir des registres de consultation et d’hospitalisation, nous avons identifié les patients qui ont été hospitalisés pour hémoptysie ou qui ont présenté une hémoptysie en cours d’hospitalisation.
Les outils de collecte
Les données ont été collectées et consignées sur une fiche individuelle d’enquête élaborée à cet effet.
Déroulement pratique
Les patients inclus ont été identifiés de façon quotidienne. Le diagnostic positif était confirmé par un médecin pneumologue ou tout autre médecin du service ayant assisté à l’épisode d’hémoptysie. Un interrogatoire a été mené à la recherche des caractéristiques sociodémographiques et des antécédents, suivi d’un examen physique complet. Une radiographie thoracique de face a été systématiquement réalisée au plus tard dans les 48 heures suivant l’hospitalisation ou l’apparition du symptôme. Le reste du bilan paraclinique était constitué systématiquement d’un hémogramme, bilan rénal, bilan hépatique et sérologie VIH. La recherche de germe tuberculeux (bacilloscopie, Genexpert TB lorsqu’il était réalisable notamment sur les sécrétions broncho-pulmonaires non hémoptoiques, culture), la fibroscopie bronchique, le scanner thoracique et/ou angioscanner thoracique et les autres explorations spécialisées ont été demandées en fonction de l’orientation étiologique. Tous les patients sortis d’hospitalisation, en dehors de toute récidive précoce, étaient revus systématiquement en contrôle dans un délai de 02 semaines, 01 mois puis à 06 mois en vue d’évaluer les récidives à court, moyen et long terme.
Variables étudiées :
Les variables suivantes ont été étudiées: sociodémographiques, cliniques, paracliniques, diagnostic étiologique retenu, traitement institué (symptomatique et étiologique) et données évolutives.
Définitions opérationnelles :
Le diagnostic de tuberculose pulmonaire était retenu soit sur la mise en évidence des bacilles alcoolo-acido-résistants (BAAR) à l’examen direct, soit sur la positivité du Genexpert TB ou à l’isolement d’une souche de Mycobacterium tuberculosis à la culture des expectorations ou du liquide d’aspiration bronchique sur milieu spécifique, soit l’existence de granulome gigantocellulaire avec nécrose caséeuse à l’examen histologique des biopsies bronchiques.
Le diagnostic de cancer broncho pulmonaire reposait sur l’examen histopathologique des pièces de biopsie bronchique.
Les métastases broncho-pulmonaires de néoplasie étaient évoquées sur des aspects radiographiques d’un lâcher de ballons avec l’existence de néoplasie connue ou non, sans autres étiologies compatibles.
La sarcoïdose était retenue sur l’existence d’une corrélation radioclinique et biologique compatible, la présence de granulome gigantocellulaire sans nécrose caséeuse à l’examen histologique de biopsie bronchique en l’absence d’arguments en faveur d’une tuberculose et/ou un test thérapeutique concluant au corticoïde.
L’aspergillome intracavitaire était retenu sur l’aspect scanographique évocateur (image en grelot) et/ou la mise en évidence d’aspergillus à la culture du liquide d’aspiration bronchique ou une sérologie aspergillaire positive.
Le diagnostic de mycobactériose atypique reposait sur la mise en évidence d’une mycobactérie atypique après culture des expectorations ou du liquide d’aspiration bronchique et test d’identification. Le diagnostic de l’embolie pulmonaire avait reposé sur la forte probabilité clinique et/ou l’angioscanner thoracique montrant un thrombus endoluminal de l’artère pulmonaire.
Pour cette étude, l’hémoptysie avait été classée en
Hémoptysie de petite abondance : lorsque la quantité de sang rejeté au cours des 24 heures est inférieure à 50 ml, parfois réduite à un simple crachat strié de sang ;
Hémoptysie de moyenne abondance : lorsque la quantité de sang rejeté par jour est comprise entre 50 et 200 ml ;
Hémoptysie de grande abondance lorsque : plus de 200 cc de sang est rejeté ou lorsque l’hémoptysie est accompagnée de signes de gravité tels que le choc hémorragique ;
Hémoptysie cataclysmique: lorsque l’importance du saignement entraine rapidement la mort.
Traitement et analyse des données
Les données recueillies ont été traitées à l’aide du logiciel Epi info version 3.5.1. Les textes et tableaux ont été édités à l’aide des Logiciels Microsoft Excel et Word 2010. L’analyse des données a été réalisée par le logiciel épi data 3.1 et leur comparaison par le test Chi 2 avec une valeur de p < 0,05 étant considérée comme significative.
Considérations éthiques
Les objectifs de l’étude étaient expliqués à tout patient inclus. Tous nos patients ont donné leur consentement à l’étude. L’anonymat et la confidentialité ont été rigoureusement respectés.
RESULTATS
Données générales
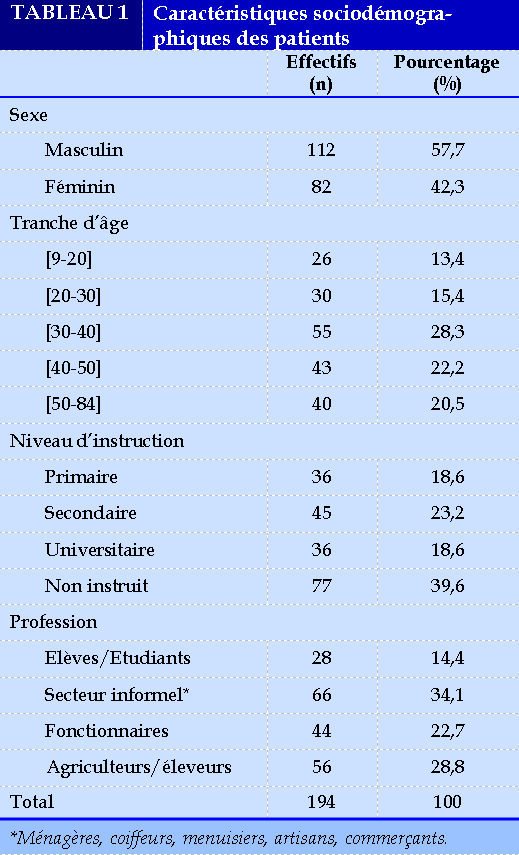
Durant notre période d’étude, le service a reçu au total 953 patients en consultation et/ou hospitalisation. Parmi ces patients, 194 avaient présenté une hémoptysie, soit une fréquence hospitalière de 20,4%. On notait une prédominance masculine avec une sex-ratio de 1,4. L’âge moyen de nos patients était de 42 ± 8,6 ans avec des extrêmes de 9 ans et 84 ans. Le Tableau 1 repartit les patients en fonction des données sociodémographiques.
Antécédents des patients
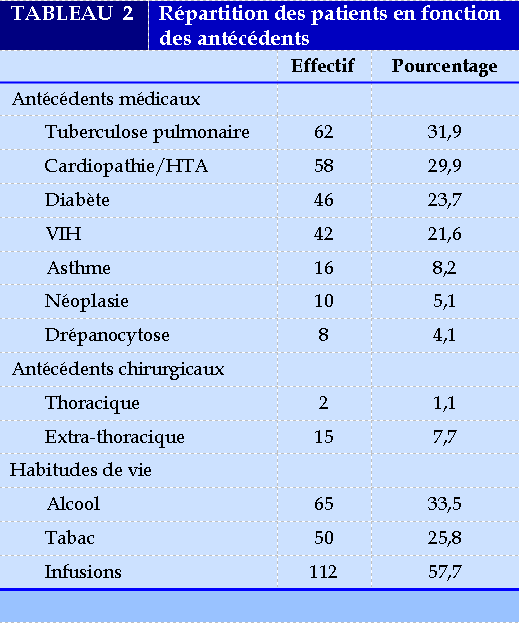
Les antécédents des patients (Tableau 2) étaient dominés par la tuberculose pulmonaire, les cardiopathies, le diabète et le VIH. Un effectif de 112 (57,7%) patients avait recours à l’indigénat par prise d’infusion de nature ignorée.
Parmi les personnes vivant avec le VIH (PVVIH), 35 étaient déjà connus avant l’hospitalisation et 7 étaient de découverte hospitalière récente. Trente et un pour cent (13 patients) avaient un taux de CD4 inférieur à 200 cellules/ul. Tous les PVVIH connus avant l’hospitalisation étaient sous traitement antirétroviral et prophylaxie au cotrimoxazole.
Durée d’évolution des symptômes
Un effectif de 112 patients (57,8%) avait une symptomatologie aigue, 42 patients (21,6%) une symptomatologie subaiguë et 40 patients (20,6%) avaient une symptomatologie d’évolution chronique.
Examen clinique
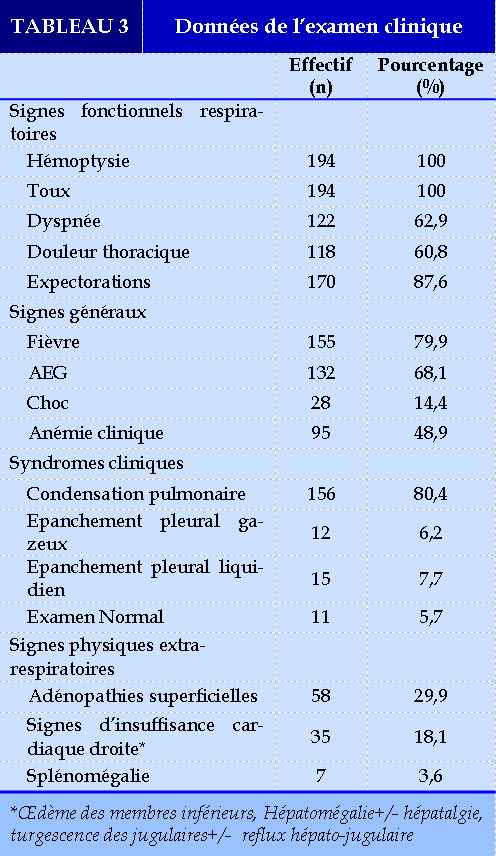
Le Tableau 3 relève les données de l’examen clinique. La toux, satellite de l’hémoptysie était présente chez tous les patients. Les expectorations et la dyspnée représentait respectivement 87,6% et 62,9%. Une proportion de 79,9% des patients présentait un syndrome infectieux et 68,1% avaient un état général altéré. On notait un syndrome de condensation pulmonaire dans 80,4% des cas. L’examen physique respiratoire était normal chez 11 patients (5,7%). Trente-cinq patients (18,1%) avaient présenté des signes de défaillance cardiaque droite.
Abondance de l’hémoptysie
Parmi les patients, 108 (56%) avaient présenté une hémoptysie de faible abondance, 62 (32%) une hémoptysie de moyenne abondance, 18 (9%) une hémoptysie de grande abondance et 6 patients (3%) avaient présenté une hémoptysie cataclysmique rapidement mortelle.
Bilan paraclinique
Radiographie thoracique
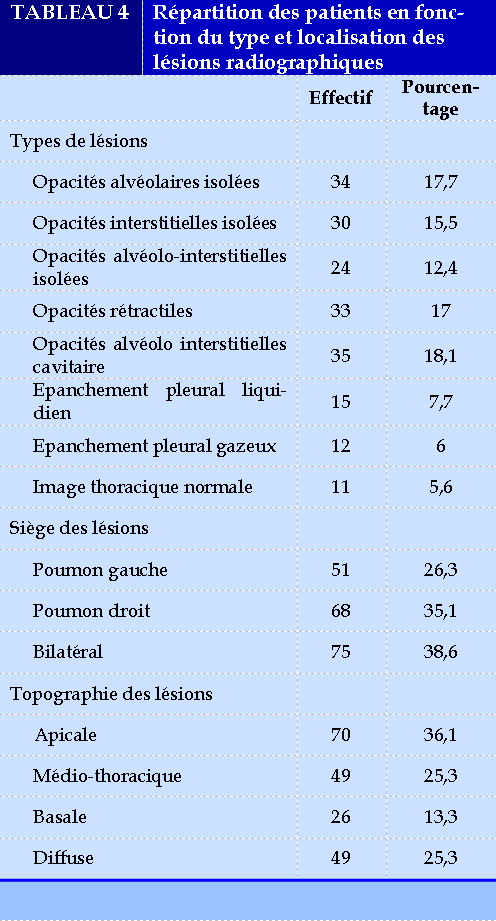
Tous les patients avaient réalisé une radiographie thoracique. Les lésions étaient prédominantes sur le poumon droit avec majoritairement des lésions alvéolo-interstitielles. Le Tableau 4 repartit les patients en fonction des types et localisation des lésions radiographiques.
Hémogramme
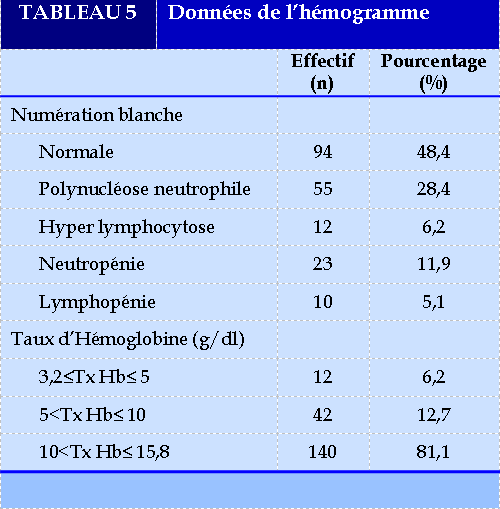
Les données de l’hémogramme (Tableau 5) ont concerné essentiellement la numération blanche et le taux d’hémoglobine.
Diagnostic étiologique
Examens paracliniques réalisés à visée étiologique
Un effectif de 34 patients a pu réaliser un scanner thoracique ou un angioscanner thoracique. La fibroscopie bronchique a été réalisée chez 20 patients. La bacilloscopie à la recherche de BAAR a été systématique chez tous les patients et le Genexpert TB réalisé chez 65 patients. La culture BK des sécrétions broncho-pulmonaires était réalisée chez 65 patients. L’examen cytobactériologique des sécrétions broncho-pulmonaires a été réalisé chez 135 patients. Des explorations cardio - vasculaires (Electrocardiogramme ± Echographie cardiaque) ont été réalisées chez 22 patients.
Etiologies des hémoptysies
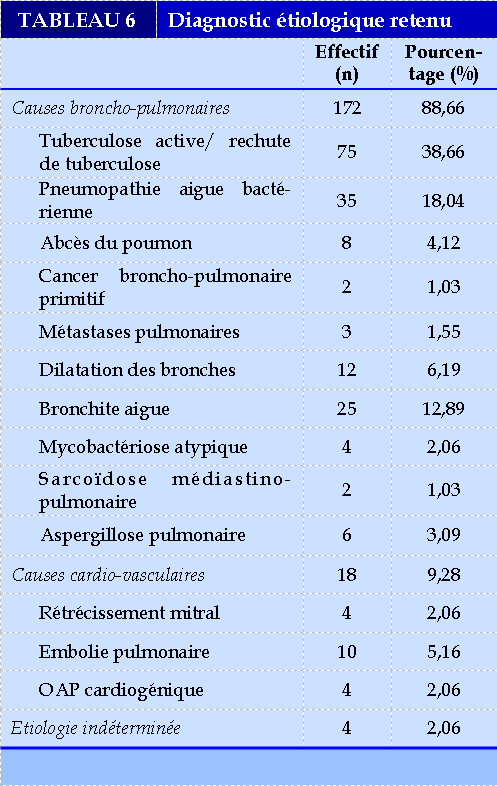
Les différents résultats de l’examen clinique et des explorations paracliniques nous ont permis d’établir les diagnostics étiologiques (Tableau 6). Les causes broncho-pulmonaires (88,66%) étaient dominantes avec en terme de fréquence la tuberculose (38,66%), les pneumopathies aigues bactériennes (18,04%) et les bronchites aigues (12,89%).
Aspects thérapeutiques
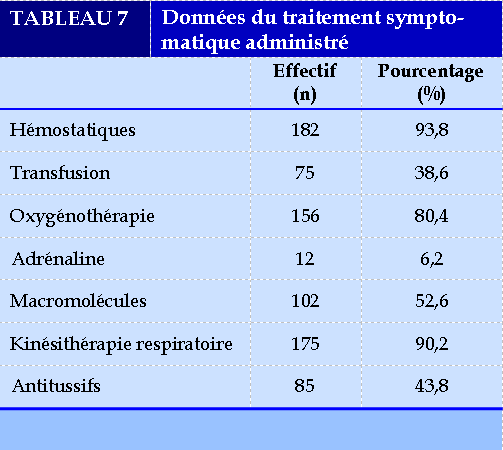
Le Tableau 7 décrit le traitement symptomatique administré aux patients. La majorité des patients a bénéficié d’un traitement hémostatique (93,5%), d’une kinésithérapie respiratoire (90,2%) et d’une oxygénothérapie (80,4%).
Les données du traitement spécifique étaient orientées vers l’étiologie. Il s’est agi essentiellement d’un traitement antituberculeux (38,66% des cas), une antibiothérapie non spécifique (35,05%), anticoagulant (5,16%), antifongique (3,09%), diurétique (2,06% des cas).
Evolution à court, moyen et long terme
Dans 51,55% (100 patients) des cas l’évolution était favorable avec régression des symptômes à la fin de l’hospitalisation et sans récidive après un suivi de 6 mois. Onze patients (5,67%) ont été transférés dans un service de chirurgie thoracique pour cause de persistance de l’hémoptysie avec menace du pronostic vital.
Nous avons déploré 18 décès soit une mortalité de 9,28%. Les mortalités spécifiques en fonction des étiologies et de l’abondance de l’hémoptysie sont répertoriées dans le tableau 8. Les récidives étaient à court terme chez 22 patients (11,34%), moyen terme chez 23 patients (11,85%) et à long terme chez 20 patients (10,31%).
Cause immédiate de décès
Parmi les cas de décès, 50% (9 décès) étaient secondaires à un choc hémorragique, 33,3% (6 décès) à une détresse respiratoire aigüe et 16,7% (3 décès) étaient secondaires à un arrêt cardiorespiratoire sans véritable cause immédiate identifiée.
DISCUSSION
La présente étude, menée dans le but de faire un état des lieux sur les hémoptysies dans nos milieux hospitaliers, a permis de ressortir plusieurs aspects diagnostiques et thérapeutiques.
Dans notre étude, nous avions retrouvé une fréquence hospitalière relativement élevée (20,4%). En 2012, Adjoh et al avaient trouvé dans une étude rétrospective une fréquence hospitalière plus basse de 8,08% dans le service de pneumologie du CHU SO à Lomé [10]. Rakotondrabe et al avaient trouvé une fréquence hospitalière de 14,4% au Madagascar en 2017 [11]. Gagara et al au Niger en 2018, avait retrouvé une fréquence hospitalière de 11,4% [12]. Ces taux font de l’hémoptysie un symptôme fréquent en milieu pneumologique.
La prédominance masculine retrouvée dans l’étude a été retrouvée par plusieurs auteurs africains, notamment Adjoh en 2012 (63,7% de sexe masculin), Rakotondrabe en 2017 (66,5%) et Gagara en 2018 (73%) [10,12].
Dans notre série, la tuberculose a été le principal antécédent médical retrouvé (31,9%). Ceci s’explique par le fait que l’infection tuberculeuse demeure une préoccupation de santé publique dans les pays en développement où elle sévit de façon endémique. Rakotondrabe avait fait le même constat avec 24,8% des cas [11]. Gagara avait retrouvé un antécédent de tuberculose pulmonaire chez 16,3% de ses patients [12]. La tuberculose entraine le plus souvent des séquelles broncho-pulmonaires notamment les dilatations de bronches pouvant s’infecter, les néoplasies, les séquelles pouvant également entraîner une greffe mycosique notamment l’aspergillome intracavitaire, toutes des affections très pourvoyeuses d’hémoptysie [1].
Un effectif de 25% des patients était des fumeurs. Abal et al au Koweït avaient retrouvé un résultat proche de 40,4% [13]. Dans les séries occidentales, Haro et al en Espagne et Tsoumakidou et al en Grèce avaient rapporté des taux plus élevés de tabagisme avec respectivement 75% et 78,8% [14,15].
L’infection à VIH, facteur d’immunodépression souvent associée à la tuberculose, a été retrouvée chez 21,6 % des patients. Elle est également à l’origine d’autres pathologies notamment infectieuses (bactériennes ou fongiques). Parmi les PVVIH, une immunodépression sévère était retrouvée chez 31% des patients. Cette immunodépression favorise les infections d’autant plus que le taux de CD4 est bas. Le VIH est identifié comme principal facteur d’immunodépression généralisée et constitue une préoccupation de santé publique surtout dans nos milieux noir africains.
Comme symptomatologie fonctionnelle respiratoire, la toux, indispensable au rejet des sécrétions broncho-pulmonaires notamment l’hémoptysie, était systématiquement associée à l’hémoptysie. Les autres types d’expectorations étaient présents chez 87,6% des patients. En effet, la majorité des étiologies étant d’origine infectieuse, sont à l’origine d’une hypersécrétion au niveau de la muqueuse broncho-pulmonaire ayant pour rôle l’évacuation des particules et germes pathogènes hors des voies aériennes.
Un syndrome infectieux était retrouvé chez près de 80% des patients et une AEG retrouvée chez 68% des patients. Gagara avait fait le même constat avec la fièvre chez 63,9% et l’AEG chez 54,6% [12]. La fièvre est un mécanisme de défense de l’organisme, surtout contre les agressions par des germes pathogènes. Dans nos milieux africains, on note un retard de consultation et les patients arrivent souvent dans un état grave, ce qui expliquerait l’altération de l’état général. En effet, nos populations s’adonnent souvent à l’indigénat en premier lieu et c’est seulement en cas de non amélioration des symptômes qu’ils arrivent dans une structure hospitalière. Ce qui explique dans notre série le taux élevé de patients prenant des infusions (57,7% des cas). Un anémie clinique a été retrouvée chez 48,9% des patients, secondaire soit à une spoliation sanguine liée au saignement, soit liée à l’inflammation secondaire à l’étiologie de l’hémoptysie, notamment en cas d’infection.
Plus de la moitié des patients avait une symptomatologie d’évolution aigue. L’hémoptysie est un symptôme alarmant, source d’angoisse pour le patient, ce qui motive une consultation dans un délai raisonnable pour prise en charge. En effet, plus de la moitié avaient une hémoptysie de faible abondance, situation souvent la plus fréquente amenant le patient à consulter. Plusieurs auteurs avaient fait le même constat, notamment Adjoh avec 56,76%, Rakotondrabe avec 48,6% et Gagara avec 73% de cas
d’hémoptysie de faible abondance [10,12].
Les lésions radiographiques étaient dominées par les opacités alvéolaires, interstitielles et alvéolo-interstitielles cavitaires. La radiographie thoracique était normale chez 5,6% des patients. Gagara avait retrouvé 4,7% de radiographie normale dans sa série [12]. Concernant le siège des lésions, ces dernières étaient en majorité bilatérales, cependant le poumon droit semblait le plus atteint (35,1%) que le gauche. L’équipe de Rakotondrabe au Madagascar, avait retrouvé des images de caverne chez 37,3% et 12,9 % de leurs patients présentaient des lésions radiologiques étendues et bilatérales [11]. Gagara avait trouvé des lésions bilatérales chez 33,8% des cas [12]. La bilatéralité des lésions témoigne de la gravité radiologique des affections en cause. Il faudra noter aussi que les hémoptysies seules pourraient expliquer la présence des opacités, surtout dans les atteintes alvéolaires par inondation.
Sur le plan hémodynamique, nos patients avaient relativement une bonne tolérance hémodynamique avec 81,1% des patients qui avaient un taux d’hémoglobine supérieur à 10g/dl. Gagara avait trouvé une anémie modérée dans 52,3% des cas [12]. Les explorations complémentaires à visée étiologique, notamment le scanner thoracique et la fibroscopie bronchique, qui devraient être systématiques en cas d’hémoptysie, n’ont été réalisées que chez un faible effectif. Rakotondrabe avait fait le même constat avec seulement 10,8% qui avaient pu réaliser le scanner thoracique dans leur série [11]. Ceci s’explique par le coût élevé de ces explorations, difficilement accessible à nos populations dont le revenu est faible. Les étiologies broncho-pulmonaires (88,66%) étaient dominantes sur les origines cardiovasculaires dans notre série. Parmi ces causes, les étiologies infectieuses prédominaient, notamment la tuberculose, les pneumopathies aigues bactériennes et les bronchites aigues. Ces infections seraient en rapport avec plusieurs facteurs favorisants, notamment le VIH, le tabagisme et le manque d’hygiène. Adjoh avait retrouvé comme étiologies la tuberculose pulmonaire évolutive (31,65%), les pneumopathies aiguës bactériennes dans (18,98%), les séquelles de tuberculose (12,66%) et les cancers broncho-pulmonaires (5,70%) [10]. Rakotondrabe avait trouvé comme principales étiologies des hémoptysies la tuberculose avec 32,4% suivie des pneumopathies aigues bactériennes dans 24,8% des cas [11]. Gagara avait fait le même constat avec la tuberculose (38,4%) et les pneumopathies aigue bactériennes (26,8%) [12]. Ghoul et al en 2015, avaient retrouvé dans une étude comparative en Tunisie, les causes infectieuses et les malformations vasculaires au premier plan chez les sujets jeunes et les causes néoplasiques prédominantes chez les sujets âgés [16]. Dans notre série, aucune étiologie n’était retrouvée dans 2,06% des cas. Rakotondrabe n’avait pas trouvé d’étiologie dans 13,5% des cas [11]. Une méta-analyse réalisée par Ittrich et al a révélé qu’environ 50% des hémoptysies n’ont pas d’étiologie identifiée [17].
Dans cette méta-analyse, les auteurs ont identifié les causes infectieuses et inflammatoires comme étant au premier plan dans la genèse de l’hémoptysie. Dans nos milieux, la tuberculose demeure la première cause pourvoyeuse d’hémoptysie. La non réalisation systématique d’une tomodensitométrie thoracique pourrait constituer dans notre étude un frein diagnostique, notamment en ce qui concerne les malformations vasculaires et autres lésions infra radiologiques.
La majorité des patients a bénéficié d’un traitement hémostatique (93,5%), d’une kinésithérapie respiratoire (90,2% des patients) et d’une oxygénothérapie (80,4%). L’oxygénothérapie a été indiquée du fait du risque d’asphyxie par inondation alvéolaire. Le traitement spécifique était orienté vers l’étiologie.
Dans notre série, l’évolution était favorable chez 51,55% des patients et la mortalité était de 9,28%. Adjoh et al avaient retrouvé un taux de mortalité de 20,39%, plus élevé que dans notre série [10]. Gagara et al avaient trouvé une évolution favorable chez 73% des cas avec une mortalité de 10,5% [12].
Parmi nos patients, 33,5% avaient présenté une récidive après hospitalisation. Adjoh et al avait retrouvé un taux de récidive plus bas avec 8,23% [10]. La récidive est classiquement de règle en cas d’hémoptysie, car «ce qui a saigné, saignera». Ceci soulève la nécessité d’un suivi régulier des patients, même en cas d’évolution favorable en post-hospitalisation.
En termes d’effectif, les étiologies de décès étaient dominées par la tuberculose, l’embolie pulmonaire et l’abcès pulmonaire. Cependant les pathologies les plus mortelles étaient les lésions néoplasiques, notamment le cancer broncho-pulmonaire primitif avec 50% de mortalité et les métastases pulmonaires (33,3% de mortalité). Le pronostic des hémoptysies d’origine tumorale serait plus sombre que pour les autres étiologies [18,19].
Les décès étaient étroitement liés à l’abondance de l’hémoptysie. En effet, l’hémoptysie cataclysmique n’a offert aucune possibilité de survie aux patients et 27,7% des patients qui avaient présenté une hémoptysie de grande abondance étaient décédés.
L’abondance de l’hémoptysie est essentielle à déterminer car étant le mieux corrélée à la mortalité [20,22]. Dans l’étude de Rakotondrabe, le taux de mortalité était de 6,4 % et les décès étaient liés à une hémoptysie de grande abondance avec comme étiologies les plus mortelles l’aspergillome et les dilatations de bronches post-tuberculeuses [11].
Ittrich avait fait le même constat dans sa méta-analyse [17]. Dans notre série, 3,7 % des patients, ayant présenté une hémoptysie de faible abondance, étaient décédés. Ceci confirme la gravité de l’hémoptysie, qui ne doit en aucun cas être négligée, quelle que soit son abondance. Dans certaines situations l’hémoptysie de faible abondance peut en effet être une hémoptysie d’abondance plus élevée mais non extériorisée.
Les causes immédiates de décès étaient dominées par un choc hémorragique (50%) et une détresse respiratoire (30%). Le choc hémorragique et l’asphyxie sont décrits dans la littérature comme étant les principales conséquences physiopathologiques pouvant être à l’origine du décès des patients présentant une hémoptysie [1].
CONCLUSION
La fréquence des hémoptysies est non négligeable dans nos milieux. Les étiologies sont dominées par les causes infectieuses avec la tuberculose en premier lieu. Les lésions radiographiques sont souvent étendues et bilatérales, témoignant de la gravité des affections en cause.
La mortalité est non négligeable et est corrélée avec l’abondance de l’hémoptysie, faisant des hémoptysies un facteur légendaire de mortalité. Les hémoptysies secondaires aux affections néoplasiques demeurent les plus mortelles.
Il importe de sensibiliser nos populations sur ce symptôme fréquent, à ne négliger quelle que soit son abondance. Ceci soulève l’importance d’une surveillance des patients ayant présenté un épisode d’hémoptysie.
CONFLIT D’INTERET
Aucun
REFERENCES
| 1. Charles-Hugo Marquette et al. Pneumologie, Orientation diagnostique : item n°317. Editions MED-LINE 2008 ; Page 209- 213. |
| 2. Dweik RA et Stoller JK. Role of bronchoscopy in massive hemoptysis. Clin Chest Med 1999; 20:89-105. |
| 3. Stoller JK. Diagnosis and management of massive hemoptysis. A review. Respir Care 1992;37:564-81 |
| 4. Corey R et Hla KM. Major and massive hemoptysis: reassessment of conservative management. Am J Med Sci 1987;294:301-9 |
| 5. Reisz G, Stevens D et Boutwell C. The causes of hemoptysis revisited. A review of the etiologies of hemoptysis between 1986 and 1995. Missouri Medicine 1997; 94:633-5 |
| 6. Reechaipichitkul W, Latong S. Etiology and treatment outcomes of massive hemoptysis. Southeast Asian. J Trop Med Public Health. 2005;36:474-80 |
| 7. Prasad R, Garg R et Singhal S. Lessons from patients with hemoptysis attending a chest clinic in India. Ann Thorac Med. 2009;4:10-2 |
| 8. Porzezinska M, Gorzewska A et Drozdowski J. Assessment of hemoptysis etiology among patients hospitalized in Pneumonology Department of Medical University of Gdansk in the years 1998-2002. Pol Arch Med Wewn. 2005;114:658-63 |
| 9. Takahashi N, Akusawa H et Kisohara A. A clinical review of hemoptysis. Journal of the Japan Broncho-Esophagological Society. 1999; 50:391-5 |
| 10. Adjoh KS, Wachinou PA, Gbadamassi G, Adambounou AS et Tidjani O. Hémoptysies: Caractéristiques épidémiologiques, étiologiques et évolutives au CHU Sylvanus Olympio de Lomé. Togo Rev Pneumol Trop 2012 ; 18 : 5-12 |
| 11. Rakotondrabe ID, Tiaray HM, Ravahatra K, Rasoafaranirina MO, Nandimbiniaina AM, Rakotomizao J et al. Profil épidémiologique et étiologique des hémoptysies au CHU d’Antananarivo. Rev mal Respir 2017; 10.35 :230-1 |
| 12. Gagara Issoufou MA, Assao Neino MM, Nacanabo NR, Sadou HA, Attahirou I et Maizoumbou D. Hémoptysies : aspects épidémiologiques, cliniques, étiologiques et évolutifs au service de pneumophtisiologie de l’Hôpital National Lamordé de Niamey. Rev Pneumol Trop 2018 ; 29 : 19-24 |
| 13. Abal AT, Nair PC et Cherian J. Haemoptysis: aetiology, evaluation and outcome- a prospective study in a third world country. Respir Med 2001; 95 : 548-52 |
| 14. Haro EM, Vizcaya SM, Jiménez LJ et Tornero MA. Etiology of hemoptysis: Prospective analysis of 752 cases. Rev ClinEsp 2001; 201:696-700. |
| 15. Tsoumakidou M, Chrysofakis G, Tsiligianni I, Maltezakis G, Siafakas NM, Tzanakis N et al. A prospective analysis of 184 hemoptysis cases: diagnostic impact of chest X-ray, computed tomography, bronchoscopy. Respiration 2006; 73:808-14. |
| 16. Ghoul, J, Ferjani, S et Sanaii, S. Étiologies actuelles des hémoptysies chez le sujet jeune: étude comparative à propos de 50 cas. Rev Mal Respir 2015. 10:365 |
| 17. Ittrich H, Bockhorn M, Klose H et Simon M. The Diagnosis and Treatment of Hemoptysis. |Dtsch Arztebl Int 2017; 114: 371-81 |
| 18. Kvale PA, Selecky PA et Prakash UB. Palliative care in lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 2007;132:368S-403S. |
| 19. Parrot A, Razazi K, Fartoukh M et Milleron B. Hémoptysies graves des cancers bronchiques. Rev Mal Respir2010 ; 2 : 264-8 |
| 20. Crocco JA, Rooney JJ, Fankushen DS, DiBenedetto RJ et Lyons HA. Massive hemoptysis. Arch Intern Med 1968: 121(6): 495-8. |
| 21. Hirshberg B, Biran I, Glazer M et Kramer MR. Hemoptysis: etiology, evaluation, and outcome in a tertiary referral hospital. Chest 1997: 112(2): 440-4. |
| 22. Parrot A, Fartoukh M et Mayaud C. Prise en charge des hémoptysies graves. Rev Med Suisse 2004; volume 0. 23721 |
FIGURE - TABLES
REFERENCES
| 1. Charles-Hugo Marquette et al. Pneumologie, Orientation diagnostique : item n°317. Editions MED-LINE 2008 ; Page 209- 213. |
| 2. Dweik RA et Stoller JK. Role of bronchoscopy in massive hemoptysis. Clin Chest Med 1999; 20:89-105. |
| 3. Stoller JK. Diagnosis and management of massive hemoptysis. A review. Respir Care 1992;37:564-81 |
| 4. Corey R et Hla KM. Major and massive hemoptysis: reassessment of conservative management. Am J Med Sci 1987;294:301-9 |
| 5. Reisz G, Stevens D et Boutwell C. The causes of hemoptysis revisited. A review of the etiologies of hemoptysis between 1986 and 1995. Missouri Medicine 1997; 94:633-5 |
| 6. Reechaipichitkul W, Latong S. Etiology and treatment outcomes of massive hemoptysis. Southeast Asian. J Trop Med Public Health. 2005;36:474-80 |
| 7. Prasad R, Garg R et Singhal S. Lessons from patients with hemoptysis attending a chest clinic in India. Ann Thorac Med. 2009;4:10-2 |
| 8. Porzezinska M, Gorzewska A et Drozdowski J. Assessment of hemoptysis etiology among patients hospitalized in Pneumonology Department of Medical University of Gdansk in the years 1998-2002. Pol Arch Med Wewn. 2005;114:658-63 |
| 9. Takahashi N, Akusawa H et Kisohara A. A clinical review of hemoptysis. Journal of the Japan Broncho-Esophagological Society. 1999; 50:391-5 |
| 10. Adjoh KS, Wachinou PA, Gbadamassi G, Adambounou AS et Tidjani O. Hémoptysies: Caractéristiques épidémiologiques, étiologiques et évolutives au CHU Sylvanus Olympio de Lomé. Togo Rev Pneumol Trop 2012 ; 18 : 5-12 |
| 11. Rakotondrabe ID, Tiaray HM, Ravahatra K, Rasoafaranirina MO, Nandimbiniaina AM, Rakotomizao J et al. Profil épidémiologique et étiologique des hémoptysies au CHU d’Antananarivo. Rev mal Respir 2017; 10.35 :230-1 |
| 12. Gagara Issoufou MA, Assao Neino MM, Nacanabo NR, Sadou HA, Attahirou I et Maizoumbou D. Hémoptysies : aspects épidémiologiques, cliniques, étiologiques et évolutifs au service de pneumophtisiologie de l’Hôpital National Lamordé de Niamey. Rev Pneumol Trop 2018 ; 29 : 19-24 |
| 13. Abal AT, Nair PC et Cherian J. Haemoptysis: aetiology, evaluation and outcome- a prospective study in a third world country. Respir Med 2001; 95 : 548-52 |
| 14. Haro EM, Vizcaya SM, Jiménez LJ et Tornero MA. Etiology of hemoptysis: Prospective analysis of 752 cases. Rev ClinEsp 2001; 201:696-700. |
| 15. Tsoumakidou M, Chrysofakis G, Tsiligianni I, Maltezakis G, Siafakas NM, Tzanakis N et al. A prospective analysis of 184 hemoptysis cases: diagnostic impact of chest X-ray, computed tomography, bronchoscopy. Respiration 2006; 73:808-14. |
| 16. Ghoul, J, Ferjani, S et Sanaii, S. Étiologies actuelles des hémoptysies chez le sujet jeune: étude comparative à propos de 50 cas. Rev Mal Respir 2015. 10:365 |
| 17. Ittrich H, Bockhorn M, Klose H et Simon M. The Diagnosis and Treatment of Hemoptysis. |Dtsch Arztebl Int 2017; 114: 371-81 |
| 18. Kvale PA, Selecky PA et Prakash UB. Palliative care in lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 2007;132:368S-403S. |
| 19. Parrot A, Razazi K, Fartoukh M et Milleron B. Hémoptysies graves des cancers bronchiques. Rev Mal Respir2010 ; 2 : 264-8 |
| 20. Crocco JA, Rooney JJ, Fankushen DS, DiBenedetto RJ et Lyons HA. Massive hemoptysis. Arch Intern Med 1968: 121(6): 495-8. |
| 21. Hirshberg B, Biran I, Glazer M et Kramer MR. Hemoptysis: etiology, evaluation, and outcome in a tertiary referral hospital. Chest 1997: 112(2): 440-4. |
| 22. Parrot A, Fartoukh M et Mayaud C. Prise en charge des hémoptysies graves. Rev Med Suisse 2004; volume 0. 23721 |
ARTICLE INFO DOI: 10.12699/jfvpulm.12.38.2021.21
Conflict of Interest
Non
Date of manuscript receiving
25/02/2021
Date of publication after correction
25/08/2021
Article citation
Efalou, TAS. Adambounou, M. Poko, KA. Aziagbe, T. Tchamdja, MO. Abasse, AG. Gbadamassi, KS. Adjoh. Epidemiological, diagnostic and evolutive aspects of haemoptysis in Pneumology department of the Kara University Hospital in Togo. J Func Vent Pulm 2021;38(12):21-29