
 English
English
 French
French
Extrapulmonary tuberculosis versus pulmonary tuberculosis: epidemiological and evolutionary aspects in an outpatient tuberculosis care center in Gabon
Tuberculose extrapulmonaire versus tuberculose pulmonaire : aspects épidémiologiques, et évolutifs dans un centre de prise en charge ambulatoire de la tuberculose au Gabon
Ulrich Davy KOMBILA1,2, Dieudonné MOUNGUENGUI3, Linda Danielle IBINGA3, Charlène MANOMBA BOULINGUI4, Fernand N’GOMANDA1, Jean Bruno BOGUIKOUMA1.
1: Service de Médecine Interne, CHU de Libreville
2: Centre de Diagnostic et de traitement de la Tuberculose (CDT), CHU de Libreville
3: Service de Médecine Interne, HIA Akanda, Libreville (Gabon)
4: Service d’Infectiologie, CHU de Libreville
Corresponding author: Ulrich Davy KOMBILA. Service de Médecine Interne, CHU de Libreville, Libreville (Gabon). Centre de Diagnostic et de traitement de la Tuberculose (CDT), CHU de Libreville.
E-mail: ulrichdavyk@gmail.com
ABSTRACT
Introduction. Extrapulmonary involvement is increasingly common with diagnostic and progressive polymorphism. Aim: to report the factors influencing the diagnostic and evolutionary aspects of extrapulmonary tuberculosis (PET) compared to pulmonary tuberculosis (PTB). Methods. The tuberculosis (TB) case notification register of the CDT of the University Hospital of Libreville between October 1, 2017 to September 30, 2019 was used. Bivariate and multivariate logistic regression analysis were performed to compare patients with PET and PTB and to assess site variations. Results. The average age was 35.17 years with extremes of 15 to 83 years. The proportions of PET of young (15 - 65 years) and elderly patients (> 65 years) were 95.3% (225/236) and 4.7% (11/236), respectively, p = 0.025. A diagnostic delay of more than 30 days was associated with a risk of PET (OR = 3.651 95% CI [1.901 - 7.015]. Diabetes was a risk factor for PET (OR = 16.188, 95% CI [2.100 - 24.790]). The female gender was positively associated with the risk of developing a PET (OR = 1.849, [1.251 - 2.734]). Patients infected with HIV (OR = 11.030, 95% CI [7.268 - 16.739]), and uneducated (OR = 1.901, 95% CI [1.288 - 2.807]) were associated with a PET. Localization was not associated with treatment success (OR = 0.346 [0.041 - 2.954]) and loss of follow-up (OR = 0.250 [0.029 - 2.170]). Conclusion. PET is on the rise in recent years. This progression is mainly due to the growth of immunosuppressive factors.
KEYWORDS: Tuberculosis; Extrapulmonary tuberculosis; Risk factors; Libreville.
RÉSUMÉ
Introduction. L’atteinte extrapulmonaire est de plus en plus fréquente avec un polymorphisme diagnostic et évolutif. But : rapporter les facteurs influençant les aspects diagnostiques et évolutif de la tuberculose extrapulmonaire (TEP) comparée à la tuberculose pulmonaire (TBP). Méthodes. Le registre de déclaration des cas de tuberculose (TB) du CDT du CHU de Libreville entre le 1er octobre 2017 au 30 septembre 2019 a été exploité. L’analyse en régression logistique bivariée et multivariée étaient effectuées pour comparer les patients souffrants de TEP et de TBP et évaluer les variations selon les sites. Résultats. La moyenne d’âge était de 35,17 ans avec des extrêmes de 15 à 83 ans. Les proportions de la TEP des jeunes (15 – 65 ans) et celle des patients âgés (>65 ans) étaient respectivement de 95,3% (225/236) et de 4,7% (11/236), p=0,025. Un délai diagnostique supérieur à 30 jours était associé à un risque de TEP (OR=3,651 IC95% [1,901 – 7,015]. Le diabète était un facteur de risque de la TEP (OR=16,188, IC95% [2,100 – 24,790]). Le genre féminin était positivement associé au risque de développer une TEP (OR=1,849, [1,251 – 2,734]). Les patients infectés par le VIH (OR=11,030, IC95% [7,268 – 16,739]), et non instruit (OR=1,901, IC95% [1,288 – 2,807]) étaient associés à une TEP. La localisation n’était pas associée avec le succès thérapeutique (OR=0,346 [0,041 – 2,954]) et les perdus de vue (OR=0,250 [0,029 – 2,170]). Conclusion. La TEP est en nette progression ces dernières années. Cette progression est due essentiellement à la croissance des facteurs d’immunodépression.
MOTS CLÉS: Tuberculose; Tuberculose extrapulmonaire; Facteurs de risque; Libreville.
INTRODUCTION
Bien que soit principalement considérée comme une maladie pulmonaire, la tuberculose (TB) a le potentiel d’infecter presque tous les systèmes d’organe par dissémination lymphohématogène au cours de l’infection initiale [1]. Définit par la localisation du bacille tuberculeux, dans un organe autre que le parenchyme pulmonaire, les tuberculoses extrapulmonaires (TEP) représentent un pourcentage croissant de toutes les formes de TB, atteignant 20 à 40% d’entre elles selon les séries [2]. L’atteinte extrapulmonaire peut survenir isolément ou associée à une atteinte pulmonaire. Les localisations pulmonaires constituent la grande majorité des cas de TB maladie et représentent la majorité des formes contagieuses [3]. Cependant les formes extrapulmonaires, de diagnostic plus difficile, connaissent cependant un regain d’intérêt en raison d’une augmentation de leur fréquence relative, phénomène mal expliqué mais qui a été observé dans des régions aux contextes épidémiologiques différents [1, 2, 4]. Ainsi, La prise en charge de la TEP dépend du plateau technique souvent obsolète dans les pays en développement et de la nécessité de la biopsie d’un organe d’accessibilité parfois difficile pour l’examen anatomopathologique à la recherche du follicule de Koester et/ou la culture sur milieu spécifique de Loewenstein-Jensen. Ces examens certes classiques restent de nos jours peu pratiqués dans certains pays en développement [5]. Le traitement de la TB fait appel à une polychimiothérapie et l’évolution est souvent favorable sous traitement. Par contre les formes extrapulmonaires sont de prise en charge difficile dans les conditions d’exercices en Afrique subsaharienne. Plusieurs facteurs peuvent influencer l’expression clinique et l’évolution de la TB [6]. Dans ce contexte, le but de ce travail était de rapporter les facteurs influençant les aspects diagnostiques et évolutifs de la TEP comparée à la tuberculose pulmonaire au centre de diagnostic et de traitement de la tuberculose (CDT) du centre hospitalier universitaire (CHU) de Libreville.
MATERIELS ET METHODES
Type et période d’étude
Il s’est agi d’une étude transversale, comparative, à visée analytique entre le 1er octobre 2017 et le 30 Septembre 2019, portant sur l’audit des registres de déclaration de la tuberculose (RDT).
Cadre et lieu de l’étude
L’étude s’est déroulée au CDT du CHU de Libreville. Ce dernier et le centres antituberculeux (CAT) de Nkembo, sont les centres les plus importants regorgeant le plus grand nombre de malades [7, 8]. Le CDT du CHU de Libreville, est sous la supervision d’un pneumologique, qui enregistre et coordonne tous les patients tuberculeux diagnostiqués en ambulatoire et dans les différents services que compose le CHU de Libreville en dehors du service de pédiatrie dont la prise en charge et le suivi est du ressort des médecins du service de pédiatrie. Il reçoit également les patients adressés par d’autres structures hospitalières de la capitale et de l’intérieur du pays. Les variables étudiées, obtenues à travers une fiche d’enquête, sont représentées par les caractéristiques sociodémographiques (âge, sexe et domicile), le diagnostic topographique de la tuberculose, le statut sérologique VIH, les comorbidités (diabète), le tabagisme et le devenir du patient. Tous les cas de tuberculose déclarés au CDT du CHU de Libreville pendant la période d’étude avaient été inclus. Nous avons exclu de cette étude les cas de tuberculose dont le site n’a été précisé et les cas de primo-infection tuberculeuse. Les patients de 15 – 65 ans étaient considérés comme des patients jeunes et ceux de plus de 65 ans des sujets âgés.
Définitions opérationnelles
Guérison. Un patient atteint de TPB chez qui l’affection a été confirmée bactériologiquement en début de traitement présente des résultats négatifs (selon l’examen des frottis ou la mise en culture) au cours du dernier mois de traitement et au moins une fois auparavant.
Traitement terminé. Le patient tuberculeux a terminé le traitement sans signe d’échec, mais on ne dispose pas de données indiquant que les résultats de l’examen des frottis ou de la mise en culture ont été négatifs au cours du dernier mois de traitement et au moins une fois auparavant, soit parce que les tests n’ont pas été réalisés soit parce que les résultats ne sont pas disponibles.
Décès. Le patient tuberculeux meurt pour une raison quelconque au cours du traitement ou avant de l’avoir commencé.
Perdu de vue. Le patient tuberculeux n’a pas entamé de traitement ou celui-ci a été interrompu pendant deux mois consécutifs ou plus.
Succès thérapeutique. Cas de guérison et traitement terminé.
Saisie et analyse des dossiers
Les données ont été saisies et analysées avec le logiciel SPSS pour Windows (IBM SPSS Statistics, version 20 ; Inc, Chicago, IL, USA). Nous avons effectué d’abord des analyses univariées pour le calcul des pourcentages. Ensuite nous avons procédé à des analyses bivariées entre la variable dépendante (TEP) et les variables indépendantes (caractéristiques sociodémographiques, comorbidités, mode de vie) afin de comparer la proportion de TEP selon les caractéristiques des patients. Le test du Chi2 et corrigé selon le test de Fisher Exact en fonction des effectifs de sous-groupes était utilisé pour l’analyse bivariée des variables qualitatives. Les variables qualitatives avec des variations significatives des sites de TEP, était intégrées dans un modèle de régression logistique pour l’analyse multivariée. Une différence a été considérée comme significative si p est inférieure à 0,05.
RESULTATS
Caractéristiques sociodémographiques de la population d’étude
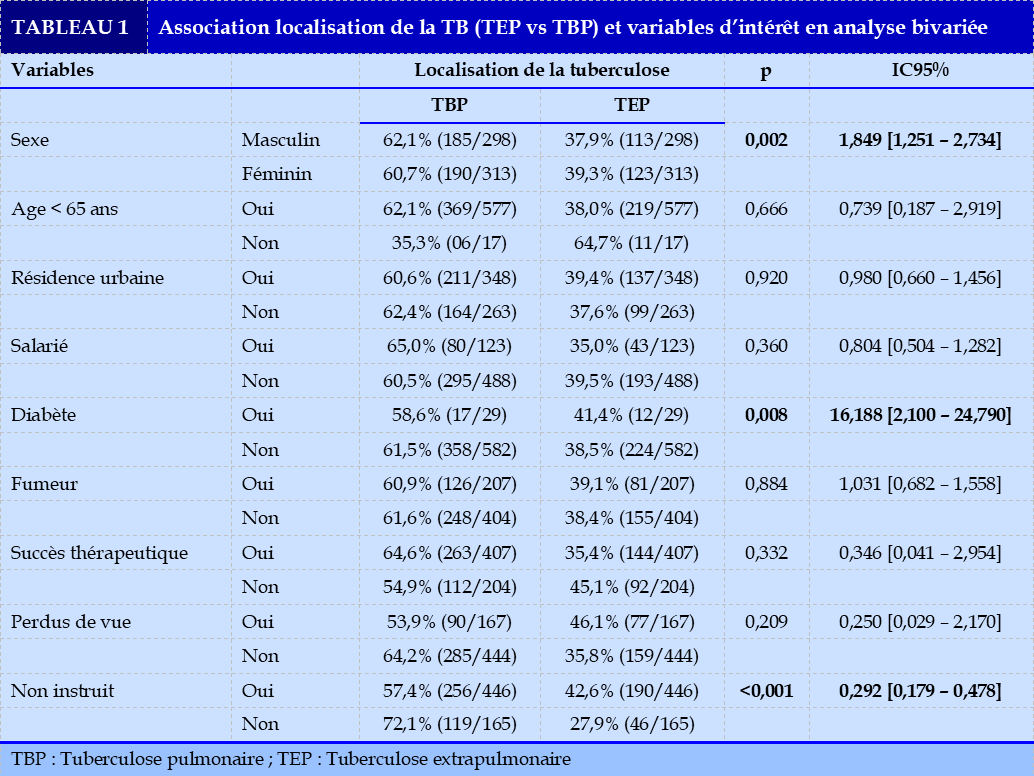
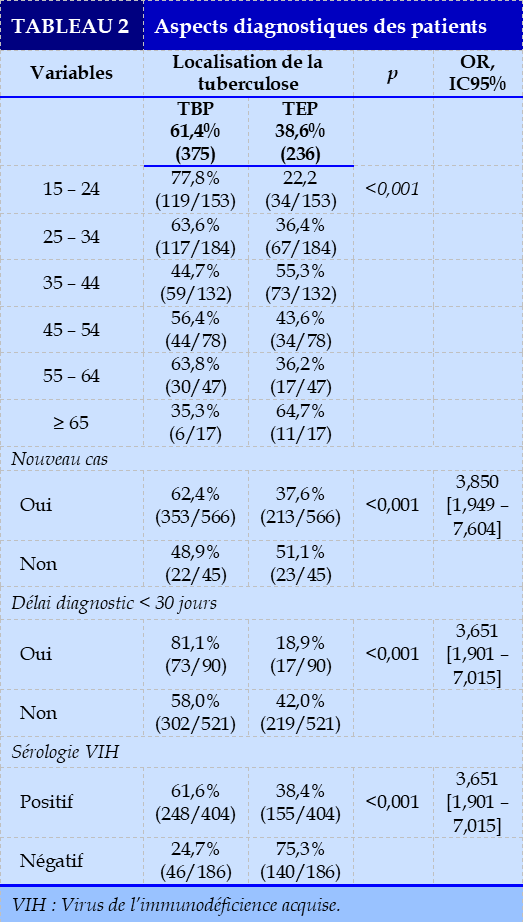
Durant la période d’enquête, 611 patients avaient été inclus, dont 236 (38,6%) cas de tuberculose pulmonaire (TBP) et 375 (61,4%) cas de TEP. La moyenne d’âge était de 35,17 ans avec des extrêmes de 15 à 83 ans, un écart type de 13,302. Les caractéristiques sociodémographiques étaient représentées dans le Tableau 1 . Les proportions de la TEP des jeunes (15 – 65 ans) et celle des patients âgés (>65 ans) étaient respectivement de 95,3% (225/236) et de 4,7% (11/236), p=0,025. La proportion des femmes avec une TEP était de 52,1% (123/236) avec un sex-ratio de 0,92, p=0,395.
Les patients avec TEP étaient résidents en zone urbaine dans 58,1% (137/236), p=0,364. Le délai diagnostique définit par la période séparant la date présumée des premiers symptômes et la date de la consultation au CDT étaient 114 jours avec un ET de 75,422 soit 3,8 mois en cas de TEP contre 99 jours avec un ET de 84,311 en cas de TBP, p=0,029. Les nouveaux cas avaient constitué 90,3% (213/236) des cas de TEP, p=0,053. Dans les localisations extrapulmonaires, les plus fréquentes étaient pleurales, ganglionnaires et osseuses respectivement dans les proportions de 36,1%, 14%, et 9%.
Les autres localisations étaient représentées respectivement par les atteintes bifocales (15,3%), multifocales (7,5%), miliaires (5,3%), péritonéales (5,3%), péricardiques (3,4%). Certaines localisations rares étaient respectivement représentées par les atteintes : cutanées (1,5%), méningées (1,1%), mammaires (0,6%), appendiculaires (0,3%), rectales (0,3%) et du cavum (0,3%). Devenir des patients (Tableau 1). Au terme du traitement, le devenir des patients avec TEP étaient : guérison : 36,9% (87/236), traitement terminé 24,2% (57/236), perdus de vue 32,6% (77/236), transférés 1,3% (3/236), décès 5,1% (12/236). Le succès thérapeutique avait constitué 61,1% (144/236) de l’issue du traitement.
Analyses des données
Les résultats des données sont consignés dans le Tableau 1. La proportion de TEP était de 39,2% et 37,9% au sein des femmes et des hommes. (p=0,002 ; OR=1,849, IC95% [1,251 – 2,734]. La prévalence de la TEP était de 38,0% au sein des patients de 15 – 65 ans contre 64,7% chez les plus de 65 ans [p=0,666 ; OR=0,739, [0,187 – 2,919]. Un délai diagnostique supérieur à 30 jours était associé à un risque de TEP dans 42,0% des cas (p<0,001 ; OR=3,651 IC95% [1,901 – 7,015]. La proportion de nouveau cas de TB, en cas de TEP était 37,6% des cas contre 51,1% dans les autres cas (p<0,001; OR=3,850; IC95% [1,949 – 7,604] (Tableau 2).
Au sein des patients non instruit définit par un niveau d’étude inférieur ou égale au secondaire, la proportion des TEP était de 42,6% contre 27,9% au sein des patients instruits (p<0,001 ; OR= 0,292, IC95% [0,179 – 0,478]). La proportion des patients diabétiques avec une TEP était de 41,4% (p=0,008 ; OR=16,188, IC95% [2,100 – 24,790]) (Tableau 1). Le genre féminin était
positivement associé au risque de développer une TEP (p=0,002 ; OR=1,849, [1,251 – 2,734]) (Tableau 1). En analyse multivariée, les sujets infectés par le VIH, étaient les plus atteints par la TEP (p<0,001 ; OR=11,030, IC95% [7,268 – 16,739] et avaient été non instruit (p=0,001 ; OR=1,901, IC95% [1,288 – 2,807]) (Tableau 3).
Devenir des patients
Les résultats thérapeutiques étaient favorables dans la majorité des cas (guérison : 40,8% (n=249) ; traitement terminé : 25,9% (n=158)). La localisation n’était pas associée avec le succès thérapeutique (p=0,332 ; OR=0,346 [0,041 – 2,954]) et les perdus de vue (p=0,209 ; OR=0,250 [0,029 – 2,170]) (Tableau 1).
DISCUSSION
Cette étude a permis de colliger 611 cas de TB sur une période de 3 ans. Elle avait pour but de rapporter les facteurs influençant les aspects épidémiologiques et évolutifs de la TEP comparée à la TBP au centre de diagnostic et de traitement de la TB dans un centre de prise en charge ambulatoire de la TB. Malgré le caractère rétrospectif et l’absence des données de la prise en charge de l’infection par le VIH, l’importance de la taille de l’effectif permet de donner l’importance aux résultats obtenus. Nous avons observé une légère prédominance féminine avec un sex ratio inversé de 0,92. Cette prédominance féminine avait été rapportée par certains auteurs Africains [9, 10, 11]. Ce constat a également été rapporté d’autres auteurs non africains qui montrent que les femmes étaient plus fréquemment touchées par la TEP, tandis que les hommes étaient principalement touchés par le TBP [12]. Ce qui vient corroborer les données de la littérature qui établissent clairement que les femmes développent plus volontiers des formes extrapulmonaires de TB que les hommes [2, 3, 4, 13], sans qu’aucune explication valable à ce jour n’a été reçu [4]. Trois localisations de la TEP sont fréquemment retrouvées dans la littérature, mais avec des proportions variables pour chaque site selon les études [2, 3, 13, 14]. Il s’est agi par ordre de fréquence décroissante dans notre étude, des localisations pleurales (36,1%), ganglionnaires (14,0%), et osseuses (9,0%). Bien que n’étant pas rare dans la littérature, les localisations digestives, urogénitales, et les tuberculoses intracrâniennes [2], n’ont pas été retrouvée dans notre série. Cela pourrait s’expliquer par la disponibilité des moyens d’explorations diagnostics du fait de l’insuffisance ou de l’obsolète du plateau technique dans les pays en développement, mais aussi du fait du coût des examens complémentaires qui ne sont pas toujours à la portée de nos patients qui ne disposent pas tous, de prise en charge sociale [5, 11], dans un contexte de paupérisation. D’autre part, étant donné que la présentation clinique des TEP est souvent atypique et insidieuse, les échantillons de tissu pour confirmation du diagnostic peuvent parfois être difficile à obtenir, et les méthodes de diagnostic conventionnelles ont un faible rendement, la culture, l’étalon d’Or classique de la TB, souffre des contraintes techniques et logistiques accrues dans les cas de TEP, le diagnostic est souvent retardé [15 – 16]. D’où un délai global de prise en charge moyen 3,8 mois en cas TEP dans notre étude. Ce retard diagnostic peut être source de séquelles invalidantes, de handicap physique dans les localisations médullaires et respiratoires dans les localisations pleurales et/ou pulmonaires avec son corollaire sur la paupérisation et la pauvreté dans les pays en développement. La proportion des patients instruits était 72,1% quand la localisation était pulmonaire contre 27,9% dans la localisation extrapulmonaire, p<0,001. Cette ignorance pourrait expliquer les consultations tardives dans les localisations extrapulmonaires. La sérologie VIH était positive dans 38,4% quand la localisation était extrapulmonaire contre 61,6% dans la localisation pulmonaire, p<0,001. Les pathologies respiratoires infectieuses restent la complication la plus fréquente des patients infectés par le virus de l’immunodéficience humaine (VIH) quelle que soit l’importance de l’immunodépression [17]. Et la TB reste la première infection opportuniste inaugurale du SIDA dans le monde ; le poumon est la cible privilégiée de TBP par infection directe mais aussi par réactivation [18, 19]. La TBP est la localisation viscérale la plus fréquente. Cependant, la TEP est plus fréquente chez les sujets immunodéprimés [20]. La TEP est plus fréquente depuis l’avènement de l’infection par le virus du VIH et que le risque de TEP augmente avec la progression de l’immunodépression [14 ; 21]. La TEP chez les personnes vivant avec le VIH a une expression clinique remarquable par la diffusion des lésions avec une dissémination des bacilles dans les sites autres que pulmonaire. La TEP et multifocale ou disséminée a vu donc sa fréquence augmentée avec l’avènement de l’infection à VIH; les localisations ganglionnaires (périphériques et/ou profondes), les atteintes des séreuses, surtout pleurale, mais aussi péricardique, péritonéale et méningée sont ainsi les plus fréquentes.
Cette expression clinique est surtout trompeuse, ce qui entraîne des retards de diagnostic. La plupart des TEP sont des tuberculoses de réactivation. La TEP est plus courante chez les personnes sévèrement immunodéprimées; dans les cas de co-infection par le VIH, la fréquence de la TEP augmente à mesure que le nombre de CD4 diminue [6].
Au plan thérapeutique, l’évolution sous traitement était favorable dans les deux groupes, à savoir dans la TEP et dans la TBP sans différence significative, p=0,332. Le site de la TB n’avait pas conditionné le résultat du traitement. D’autre part concernant les perdus vue ; il y avait plus de 10% des perdus autant dans la TEP (46,1%) que dans la TBP (53,9%), sans différence significative, p=0,209. Les difficultés organisationnelles du PNLT expliquent également les interruptions pour impression de guérison.
En effet, les insuffisances en ressources humaines mènent quasiment à l’absence de sensibilisation, d’éducation et de communication de masse sur cette maladie. Ce défaut de communication expliquerait les méconnaissances des populations sur cette maladie grave et sa curabilité, qui ont pour corollaire le manque d’adhésion au traitement comme observé ailleurs [8].
CONCLUSION
La TEP est habituellement l’apanage des sujets immunodéprimés notamment les patients infectés par le VIH, les femmes jeunes en pleine activité. En revanche, cette forme de TB peut survenir en dehors de tout contexte d’immunodépression. Les localisations pleurales, ganglionnaires, et osseuses sont les plus fréquente au Gabon.
L’infection à VIH et le niveau d’étude inférieur au secondaire sont des facteurs de risque de développer une TEP. Les résultats thérapeutiques sont comparables dans les deux groupes (TEP et TP).
CONFLITS D’INTERET
Les auteurs déclarent ne pas avoir de liens d’intérêts.
REFERENCES
| 1. Elder N.-C. Extrapulmonary tuberculosis. A review. Arch Fam Med. 1992; 1: 91 – 8. |
| 2. Mazza-Stalder M, Nicod L, Janssens J.-P. La tuberculose extrapulmonaire. Rev Mal Respir 2012 : 29 : 566 – 578. |
| 3. Mjid M, Cherif J, Salah N.-B, Toujani S, Ouahchi Y, Zakhama H et al. Epidémiologie de la tuberculose Rev Pneumol Clin 2015 ; 71 : 67 – 72. |
| 4. Ketata W, Rekik W.K, Ayadi H, Kammoun S. Les tuberculoses extrapulmonaires. Rev Pneumol Clin 2015 ; 71 : 83 – 92. |
| 5. N’Dhatz Sanogo M, Achi HV, Yao AN, Diaby M. La prise en charge de la tuberculose extrapulmonaire à l’hôpital militaire d’Abidjan (Côte d’Ivoire). Rev Pneumol Trop 2007 ; 8 : 36 – 39. |
| 6. Ossalé Abacka K.B, Koné A, Akoli Ekoya O, Bopaka R.G, Lankoande Siri H, Horo K. Tuberculose extrapulmonaire versus tuberculose pulmonaire ; aspects épidémiologiques, diagnostiques et évolutifs. Rev Pneumol Clin 2018. https://doi.org/10.1016/j.pneumo.2018.09.008. |
| 7. Kombila D.U, Moussavou – Kombila J.B, Grobusch M.-P, Lell B. Clinical and Laboratory features of tuberculosis within a hospital population in Libreville, Gabon. Infection 2013; 41: 737 – 739. |
| 8. Toung Mvé M, Bisvigou U, Diop Barry N.C, Ella Ondo C, Nkoghe D. les causes d’abandon et les motivations d’une reprise de traitement au Centre antituberculeux de Libreville (Gabon). Cahier Santé 2010 ; 20 (1) : 31 – 34. |
| 9. Gater N, Laouar L, Nafti S. Epidémiologie de la tuberculose extrapulmonaire à l’UCTMR d’Alger. Rev Mal Respir 2015 ; 32 : A232. |
| 10. Benmoussa N, Makhloufi N. Tuberculose à l’UCTMR d’Alger. Rev Mal Respir 2015 ; 33 : A234. |
| 11. Faye A, Djiba B, Kane B.S., Diagne N, Ndao A.C., Dieng M et al. La tuberculose extrapulmonaire dans un service de médecine interne en milieu tropical. RAFMI 2020 ; 7 : 20 – 25. |
| 12. Sunnetcioglu A, Sunnetcioglu M, Binici I, Baran A.-I, Karahocagil M.-K, and Saydan M.-R. Comparative analysis of pulmonary and extrapulmonary tuberculosis of 411 cases. Ann Clin Microbiol Antimicrob. 2015; 24:14:34. |
| 13. Pang Yu, An J, Shu W, Huo F, Chu N, Gao M., et al. Epidemiology of Extrapulmonary Tuberculosis among Inpatients, China 2008 – 2017. Emerg Infect Dis. 2019; 25: 457 – 464. |
| 14. Golden P.-M, Vikram H.-R. Extrapulmonary tuberculosis: an overview. Am Fam Physician 2005; 72: 1761 – 8. |
| 15. Norbis L, Alagna R, Tortoli E, Codecasa LR, Migliori GB, Daniela M Cirillo DM. Chanllenges and perspectives in the diagnosis of extrapulmonary tuberculosis. Expert Rev Anti Infect Ther. 2014; 12: 633 – 47. |
| 16. Sharma S.K., Mohan A. Extrapulmonary tuberculosis. Indian J Med Res 2004; 120: 316 – 53. |
| 17. Godet C, Beraud G, Cadranel J. Pneumonies bactériennes chez les personnes infectées par le VIH (hors mycobactéries). Rev Mal Respir 2012 ; 26 : 1059 – 1066. |
| 18. Ferrand H, Crockett F, Naccache J.-M, Rioux C, Mayaud C, Yazdanpanah Y, Cadranel J. Manifestations pulmonaires au cours de l’infection par le VIH : démarche diagnostique. Rev Mal Respir. 2014. http://dx.doi.org/10.1016/j.rmr.2014.04.106 |
| 19. Mayaud C, Cadranel J. Le poumon du VIH de 1982 à 2013. |
| 20. Kouassi B, N’gom A, Horo K, Godé C, Ahui A, Emvoudou N.M.L, Koffi N et al. Corrélations des manifestations de la tuberculose pulmonaire avec le gredré d’immunodépression au VIH. Rev Mal Respir 2013 ; 30 : 549 – 554. |
| 21. Qian X, Nguyen DT, Lyu J, Albers AE, Bi X, Graviss EA. Risk factors for extrapulmonary dissemination of tuberculosis and associated mortality during treatment for extrapulmonary tuberculosis. Emerg Microbes Infect. 2018; 6:102. |
TABLES

REFERENCES
| 1. Elder N.-C. Extrapulmonary tuberculosis. A review. Arch Fam Med. 1992; 1: 91 – 8. |
| 2. Mazza-Stalder M, Nicod L, Janssens J.-P. La tuberculose extrapulmonaire. Rev Mal Respir 2012 : 29 : 566 – 578. |
| 3. Mjid M, Cherif J, Salah N.-B, Toujani S, Ouahchi Y, Zakhama H et al. Epidémiologie de la tuberculose Rev Pneumol Clin 2015 ; 71 : 67 – 72. |
| 4. Ketata W, Rekik W.K, Ayadi H, Kammoun S. Les tuberculoses extrapulmonaires. Rev Pneumol Clin 2015 ; 71 : 83 – 92. |
| 5. N’Dhatz Sanogo M, Achi HV, Yao AN, Diaby M. La prise en charge de la tuberculose extrapulmonaire à l’hôpital militaire d’Abidjan (Côte d’Ivoire). Rev Pneumol Trop 2007 ; 8 : 36 – 39. |
| 6. Ossalé Abacka K.B, Koné A, Akoli Ekoya O, Bopaka R.G, Lankoande Siri H, Horo K. Tuberculose extrapulmonaire versus tuberculose pulmonaire ; aspects épidémiologiques, diagnostiques et évolutifs. Rev Pneumol Clin 2018. https://doi.org/10.1016/j.pneumo.2018.09.008. |
| 7. Kombila D.U, Moussavou – Kombila J.B, Grobusch M.-P, Lell B. Clinical and Laboratory features of tuberculosis within a hospital population in Libreville, Gabon. Infection 2013; 41: 737 – 739. |
| 8. Toung Mvé M, Bisvigou U, Diop Barry N.C, Ella Ondo C, Nkoghe D. les causes d’abandon et les motivations d’une reprise de traitement au Centre antituberculeux de Libreville (Gabon). Cahier Santé 2010 ; 20 (1) : 31 – 34. |
| 9. Gater N, Laouar L, Nafti S. Epidémiologie de la tuberculose extrapulmonaire à l’UCTMR d’Alger. Rev Mal Respir 2015 ; 32 : A232. |
| 10. Benmoussa N, Makhloufi N. Tuberculose à l’UCTMR d’Alger. Rev Mal Respir 2015 ; 33 : A234. |
| 11. Faye A, Djiba B, Kane B.S., Diagne N, Ndao A.C., Dieng M et al. La tuberculose extrapulmonaire dans un service de médecine interne en milieu tropical. RAFMI 2020 ; 7 : 20 – 25. |
| 12. Sunnetcioglu A, Sunnetcioglu M, Binici I, Baran A.-I, Karahocagil M.-K, and Saydan M.-R. Comparative analysis of pulmonary and extrapulmonary tuberculosis of 411 cases. Ann Clin Microbiol Antimicrob. 2015; 24:14:34. |
| 13. Pang Yu, An J, Shu W, Huo F, Chu N, Gao M., et al. Epidemiology of Extrapulmonary Tuberculosis among Inpatients, China 2008 – 2017. Emerg Infect Dis. 2019; 25: 457 – 464. |
| 14. Golden P.-M, Vikram H.-R. Extrapulmonary tuberculosis: an overview. Am Fam Physician 2005; 72: 1761 – 8. |
| 15. Norbis L, Alagna R, Tortoli E, Codecasa LR, Migliori GB, Daniela M Cirillo DM. Chanllenges and perspectives in the diagnosis of extrapulmonary tuberculosis. Expert Rev Anti Infect Ther. 2014; 12: 633 – 47. |
| 16. Sharma S.K., Mohan A. Extrapulmonary tuberculosis. Indian J Med Res 2004; 120: 316 – 53. |
| 17. Godet C, Beraud G, Cadranel J. Pneumonies bactériennes chez les personnes infectées par le VIH (hors mycobactéries). Rev Mal Respir 2012 ; 26 : 1059 – 1066. |
| 18. Ferrand H, Crockett F, Naccache J.-M, Rioux C, Mayaud C, Yazdanpanah Y, Cadranel J. Manifestations pulmonaires au cours de l’infection par le VIH : démarche diagnostique. Rev Mal Respir. 2014. http://dx.doi.org/10.1016/j.rmr.2014.04.106 |
| 19. Mayaud C, Cadranel J. Le poumon du VIH de 1982 à 2013. |
| 20. Kouassi B, N’gom A, Horo K, Godé C, Ahui A, Emvoudou N.M.L, Koffi N et al. Corrélations des manifestations de la tuberculose pulmonaire avec le gredré d’immunodépression au VIH. Rev Mal Respir 2013 ; 30 : 549 – 554. |
| 21. Qian X, Nguyen DT, Lyu J, Albers AE, Bi X, Graviss EA. Risk factors for extrapulmonary dissemination of tuberculosis and associated mortality during treatment for extrapulmonary tuberculosis. Emerg Microbes Infect. 2018; 6:102. |
ARTICLE INFO DOI: 10.12699/jfvpulm.12.38.2021.38
Conflict of Interest
Non
Date of manuscript receiving
25/02/2021
Date of publication after correction
25/08/2021
Article citation
Ulrich Davy KOMBILA, Dieudonné MOUNGUENGUI, Linda Danielle IBINGA, Charlène MANOMBA BOULINGUI, Fernand N’GOMANDA, Jean Bruno BOGUIKOUMA. Extrapulmonary tuberculosis versus pulmonary tuberculosis: epidemiological and evolutionary aspects in an outpatient tuberculosis care center in Gabon. J Func Vent Pulm 2021;38(12):38-43