
 English
English
 French
French
Epidemiological and etiological aspects of pyopneumothorax at Lomé - Togo
Aspects épidémiologique et étiologique des pyopneumothorax à Lomé - Togo
Ogounde N.A1,2, Adambounou T.A.S1,2, Ako A.M.E1, Aziagbe K.A1,2, Gbadamassi A.G1,2, Adjoh K.S1,2
1: Service de Pneumo-Phtisiologie - CHU Sylvanus Olympio
2: Faculté des sciences de la santé - Université de Lomé
Corresponding author:
OGOUNDE Nadjidé Aladé. Service de Pneumo-Phtisiologie. CHU Sylvanus Olympio.
E-mail: nogounde@gmail.com
ABSTRACT
Introduction: Pyopneumothorax is a relatively frequent reason for hospitalisation in our context. The aim of this study was to update the epidemiology and describe the aetiologies of pyopneumothorax in Togo.
Method: This was a descriptive cross-sectional study conducted from 1 January 2020 to 31 December 2022 in the Pneumo-Phtisiology Department of the Sylvanus Olympio University Hospital, Togo. All consenting patients hospitalised and managed for pyopneumothorax were included.
Results: Sixty-seven patients were enrolled in our study. Their mean age was 42.8±15.2 years. HIV seroprevalence was 20.9%. Seven patients (10.4%) had a history of tuberculosis. Pleural fluid was cloudy (20.9%) or frankly purulent (79.1%). It was foul-smelling in 40.3% of cases. Pyopneumothorax was located on the right (53.7%) or left (46.3%). It was associated with cavitary pulmonary lesions in 58.2% of cases. The main aetiologies were tuberculosis (29.9%), bacterial pneumonia (22.4%) and ruptured lung abscess (11.9%). Bacterial pneumonia was significantly more common than tuberculosis in people living with HIV (21.4% versus 14.3%; p = 0.043). The main non-tuberculous germs isolated were Streptococcus pneumoniae (7.5%), Escherichia coli (6.0%) and Klebsiella pneumonia (4.5%). One case (1.5%) of Aspergillus fumigatus was reported. No amoebic aetiology was found.
Conclusion: Pyopneumothorax occurs in fragile patients. It is a complication of an untreated or poorly treated infection. The aetiologies are diverse: tuberculous, bacterial, mycotic.
KEYWORDS: Epidemiology; Aetiology; Pyopneumothorax; Tuberculosis; Togo.
RÉSUMÉ
Introduction: Le pyopneumothorax constitue un motif d’hospitalisation relativement fréquent dans notre contexte. L’objectif de cette étude était d’actualiser l’épidémiologie et de décrire les étiologies du pyopneumothorax au Togo.
Méthode: Il s’est agi d’une étude transversale descriptive menée du 1er janvier 2020 au 31 décembre 2022 dans le service de Pneumo-phtisiologie CHU Sylvanus Olympio du Togo. Tous les patients consentants, hospitalisés et pris en charge pour un pyopneumothorax étaient inclus.
Résultats: Soixante-sept patients ont été enrôlés dans notre étude. Leur âge moyen était de 42,8 ± 15,2 ans. La séroprévalence du VIH était de 20,9% des cas. Sept patients (10,4%) avaient un antécédent de tuberculose. Le liquide pleural était trouble (20,9%) ou franchement purulent (79,1%). Il était fétide dans 40,3% des cas. Le pyopneumothorax était localisé à droite (53,7%) ou à gauche (46,3%). Il était associé à des lésions pulmonaires cavitaires dans 58,2% des cas. Les principales étiologies étaient la tuberculose (29,9%), la pneumonie bactérienne (22,4%) et l’abcès du poumon rompu (11,9%). La pneumonie bactérienne était significativement plus observée que la tuberculose chez les personnes vivant avec le VIH (21,4% versus 14,3% ; p = 0,043). Les principaux germes non tuberculeux isolés étaient : Streptococcus pneumoniae (7,5%), Escherichia coli (6,0%), Klebsiella pneumonia (4,5%). Un cas (1,5%) d’Aspergillus fumigatus était rapporté. L’étiologie amibienne n’avait pas été retrouvée.
Conclusion: Le pyopneumothorax survient sur des terrains fragiles. C’est une complication d’un foyer infectieux non ou mal traité. Les étiologies sont diverses : tuberculeuses, bactériennes, mycosiques.
MOTS CLÉS: Epidémiologie; Étiologie; Pyopneumothorax; Tuberculose; Togo.
INTRODUCTION
Le pyopneumothorax (PPT) se définit par la présence du pus et d’air dans la cavité pleurale [1]. Il est souvent considéré comme une complication des infections bronchopulmonaires. Plusieurs étiologies peuvent être en cause notamment la tuberculose, les infections bactériennes, les parasitoses et les mycoses [2]. Cette affection est parfois associée à une morbidité importante (hospitalisation prolongée, complications iatrogènes). Ces dernières années, il y’a eu d’énormes progrès dans la prise en charge des pathologies pleurales infectieuses de sorte que la littérature internationale du PPT est devenue rare. La majorité des données était des rapports de cas isolés. En Afrique subsaharienne, les conditions d’insalubrité et d’endémicité de la tuberculose entretiennent les maladies infectieuses, notamment le PPT [3].
Au Sénégal, une étude réalisée en 2021, avait retrouvé l’étiologie tuberculeuse dans 58,3% [4] tandis qu’en Tunisie en 2018, l’étiologie était dominée par les abcès pulmonaires rompus (64,7%) [2]. Au Togo, une étude réalisée sur les pneumothorax avait rapporté un hydropneumothorax dans 82,5% [5]. Il nous a paru judicieux de mener la présente étude afin d’actualiser les données épidémiologiques et étiologiques du PPT au Togo.
METHODES
Il s’est agi d’une étude transversale descriptive à recueil prospectif, menée du 1er janvier 2020 au 31 décembre 2022. La population source de notre étude était constituée de tous les patients hospitalisés ou suivis durant la période d’étude dans le service de pneumologie-phtisiologie du Centre Hospitalier Universitaire Sylvanus Olympio (CHU SO) pour un PPT, quelle que soit la cause, à l’issu d’un bilan radiologique et d’une ponction pleurale exploratrice.
Nous avons enrôlé tous les patients des deux sexes, âgés d’au moins 15 ans et consentants de participer à l’étude.
Le liquide pleural a fait objet d’examens microbiologiques (examen direct, geneXpert MTB®, culture mycobactériologique et examen cytobactériologique). Les variables étudiées étaient d’ordre sociodémographique (sexe, âge, profession), clinique (antécédents, signes cliniques), radiologique, microbiologique.
Les données ont été recueillies au moyen d’un formulaire préétabli et testé en format papier puis mis en format électronique grâce à la plateforme KoboToolbox. Elles ont été épurées et analysées avec le logiciel R 4.1.2 dans l’environnement de développement RStudio 2022.7.1.554.
Les variables qualitatives ont été présentées sous forme d’effectifs et de pourcentages. Les quantitatives ont été décrites sous forme de moyennes et écart-types, de médianes et intervalles interquartiles ou encore d’extrêmes selon le cas. Le test de Student a été utilisé pour la comparaison des moyennes ou médianes. Les tests de Chi2 et de Fisher ont été utilisés pour la comparaison des proportions. Pour la comparaison des variables quantitatives, après vérification de la normalité par méthode graphique et test de Shapirow, des tests non paramétriques ont été employés si besoin.
Dans cette étude, la purulence du liquide pleural était retenue devant l’aspect trouble ou purulent, épais, parfois fétide ou puriforme, contenant une majorité de polynucléaires neutrophiles.
L’anonymat des patients a été fait par la codification des fiches d’enquête.
RESULTATS
Caractéristiques socio-démographiques
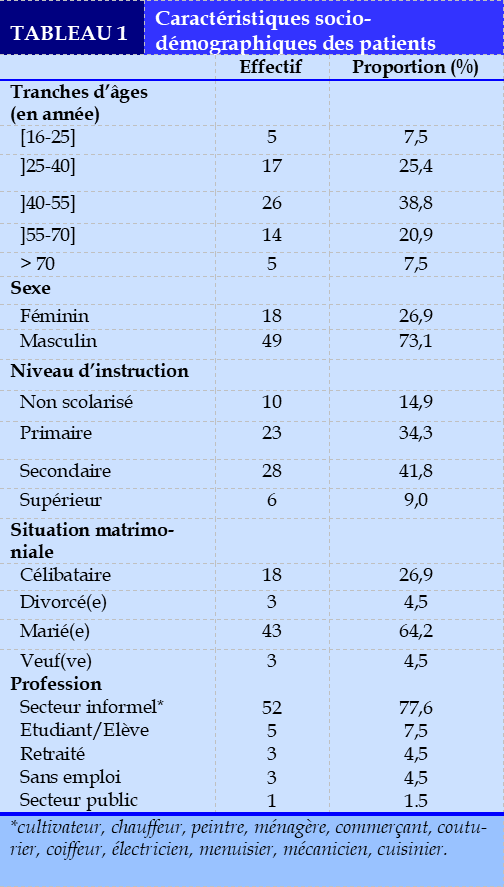
Sur notre période d’étude, 1102 patients ont été hospitalisés. Soixante-sept patients, répondant à nos critères ont été enrôlés dans l’étude. La fréquence hospitalière du PPT était de 6,1%.
L’âge moyen des patients était de 42,8±15,2 ans avec des extrêmes de 16 et 80 ans. La tranche d’âge la plus représentée était celle des 40-55 ans. La sexe-ratio était de 2,7. Cinquante-deux (77,6%) patients travaillaient dans le secteur informel (Tableau 1).
Antécédents et comorbidités
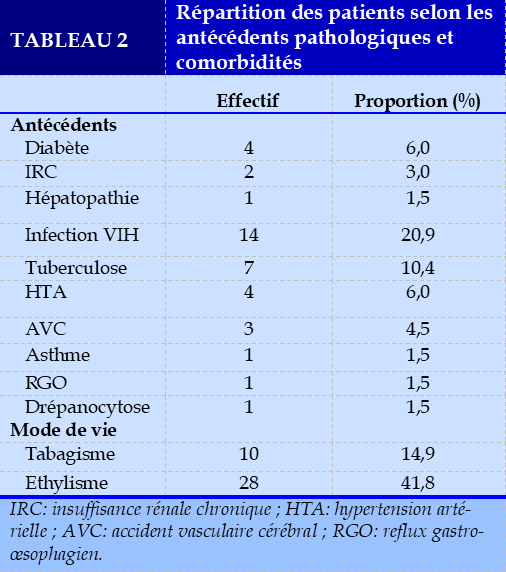
L’infection par le VIH était retrouvée chez 14 (20,9%) patients. La numération moyenne des lymphocytes T CD4+ était de 230,5±117,6 cellules/µl avec des extrêmes de 34 et 429 cellules/µl. Sept patients (10,4%) avaient un antécédent de tuberculose. Les tabagiques étaient de 14,9%. Vingt-huit patients (48,1%) consommaient régulièrement de l’alcool (Tableau 2).
L’indice de masse corporelle (IMC) moyen était de 19,6±4,5 kg/m² avec des extrêmes de 13,3 et 39,3 kg/m². Trente patients (44,8%) avaient une insuffisance pondérale avec IMC ≤ 18 kg/m2.
Signes cliniques
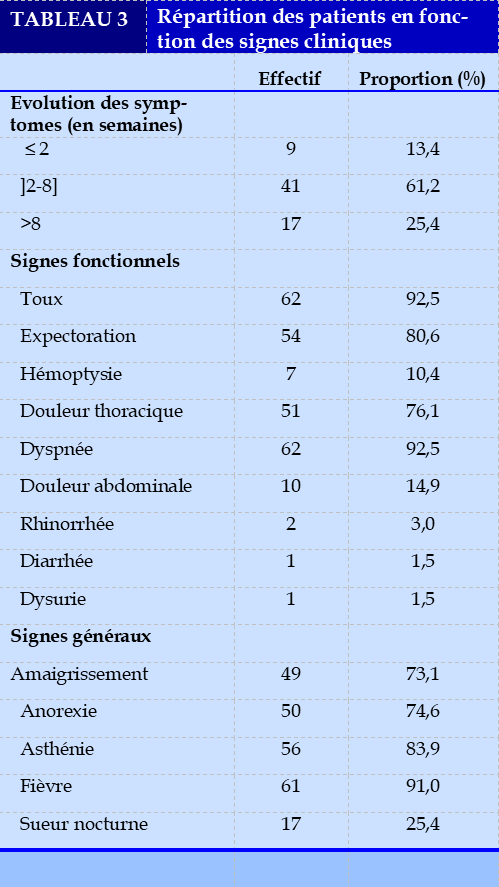
Le Tableaux 3 résume les signes cliniques des patients. L’évolution des symptomes étaient subaigüe dans 61,2% des cas. Le liquide pleural était trouble (20,9%) ou franchement purulent (79,1%). Il était fétide chez 27 (40,3%) patients.
Aspects paracliniques
La radiographie thoracique initiale permettait d’objectiver une localisation de l’épanchement pleural à droite (53,7%) ou à gauche (46,3%). Cet épanchement était compressif dans 38,8% des cas. Le scanner thoracique était réalisé chez 11 patients (16,4%).
Les clichés thoraciques, après évacuation de l’épanchement pleural, permettaient d’objectiver d’autres lésions. Il s’agissait de lésions parenchymateuses (89,5%): un niveau hydro-aérique intra-parenchymateux et les cavernes étaient respectivement retrouvés dans 11,9% et 46,3% des cas.
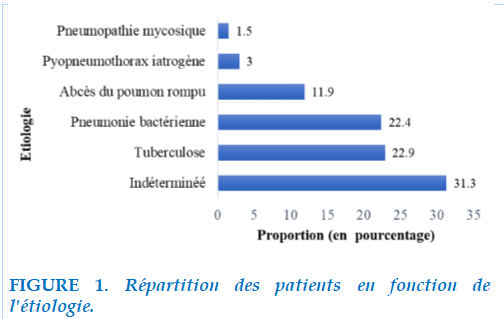
Aspects étiologiques
La tuberculose (29,8%), la pneumonie bactérienne (22,4%) et l’abcès du poumon rompu (11,9%) étaient les principales étiologies. Deux cas (3,0%) de PPT iatrogènes étaient rapportés : un cas de PPT post-ponction pleurale et un cas de PPT post-œsophagoscopie par perforation œsophagienne (Figure 1). La pneumopathie bactérienne à germe banal était significativement plus observée que la tuberculose chez les personnes vivant avec le VIH (21,4% versus 14,3% ; p = 0,043). Il n’existe pas de différence significative de l’étiologie selon le sexe (p = 0,2), ni l’âge (p = 0,9)
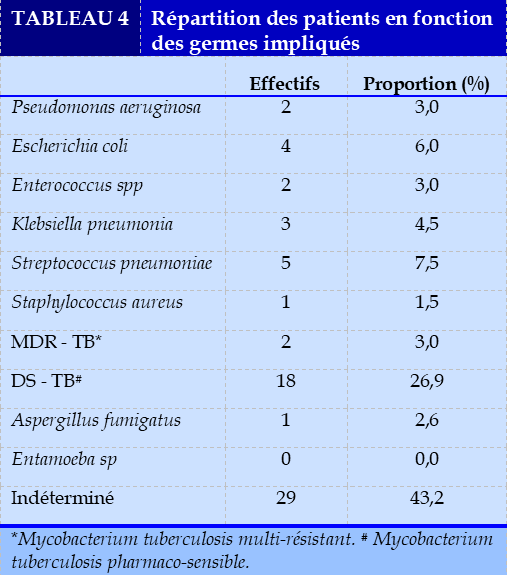
Le Mycobacterium tuberculosis pharmaco-résistant (multi-résistant) était observé chez 2 patients (3,0%). Les germes non tuberculeux isolés étaient : Streptococcus pneumoniae (7,5%), Escherichia coli (6,0%), Klebsiella pneumonia (4,5%). Un cas (1,5%) d’Aspergillus fumigatus était enregistré. L’étiologie amibienne n’avait pas été retrouvée (Tableau 4).
Les foyers infectieux régionaux retrouvés étaient stomatologiques (35,8%), cutanées (5,9%), oto-rhino-laryngologiques (3,0%), urinaires (1,5%) et digestifs (1,5%).
DISCUSSION
Nous avons réalisé une étude prospective portant sur les PPT dans le service de pneumo-phtisiologie du CHU SO. Les limites de notre travail sont liées au manque des moyens financiers de certains patients avec des incidences sur la réalisation des examens paracliniques. Le PPT est une entité clinique peu documenté. La majorité des données sont des rapports de cas isolés. En effet, il existe peu d’étude à grande échelle.
Environ 4% de toutes les pneumonies acquises dans la communauté sont nécrosantes, lesquelles se compliquent généralement (dans 85% des cas) d’empyèmes ou de fistules broncho-pleurales [6,7].
Ainsi, 5 à 10% de patients hospitalisés atteints de pneumonie évoluent vers ces complications [7,8]. Des études portant sur les PPT tuberculeux avaient retrouvé des fréquences variables, relativement faible (entre 1 à 3%) [9–11]. Dans notre étude, elle était de 6,1%. Cependant, le PPT reste relativement fréquent dans les pays en développement, en particulier au Togo.
Dans notre étude, la moyenne d’âge des patients était de 42,8 ± 15,2 ans. La tranche d’âge la plus représentée était celle de 40 à 55 ans. Ce résultat est superposable à celui retrouvé par Kasargod et al. [12] en Inde (44,2 ± 16,3 ans) et à celui de Chaabouni et al. [2] en Tunisie (44,5 ans). Ces données montrent que le sujet jeune reste l’un des facteurs favorisants le développement des PPT. En effet, les principales étiologies du PPT, les pneumonies nécrosantes, sont les pathologies des sujets jeunes en Afrique.
La sexe-ratio était de 2,7. Cette prédominance masculine a été rapporté par El Kihal et al. [13] au Maroc et Singh et al. [14] en Inde avec une sexe-ratio respective de 1,8 et 3,0. Cette prédominance s’expliquerait par le fait que le sujet masculin s’expose plus à l’intoxication tabagique et alcoolique, à l’abus de drogues par voie intraveineuse et à l’infection à VIH qui sont des facteurs de risque des infections pleuro-pulmonaires en occurrence des PPT [15,16].
Ces données montrent que, le PPT touche essentiellement les sujets masculins en période d’activité professionnelle dans le pays en développement, ce qui pourrait engendrer des pertes économiques considérables pour les familles et le pays.
L’antécédent de tuberculose, dans notre étude a été retrouvé dans 10,4% des cas, inférieur à celui retrouvé par Kasargod et al. [12] en Inde (31,6%). Cette différence montre que la prévalence de la tuberculose varie selon les régions. Cependant, les antécédents de tuberculose avec des lésions séquellaires surtout cavitaires périphériques peuvent être la cause d’un PPT par rupture de ces cavités dans l’espace pleural. De même, l’infection à VIH expose au risque de développer une pneumonie cavitaire avec comme complication le PPT [17]. Dans notre étude, l’infection à VIH était retrouvée dans 20,9% des cas.
Dans notre étude, les tabagiques étaient de 14.9%. Cette prévalence semble être largement inférieure aux études précédemment réalisées en Afrique du Nord où elle varie entre 64,3 à 73% selon les régions [2,3,18]. En Inde, elle est de 51,9% [14]. Ces taux plus élevés par rapport au nôtre seraient dus à un tabagisme plus élevé dans ces pays.
Cependant l’intoxication tabagique favorise la fragilisation du parenchyme pulmonaire et altère les défenses immunitaires des voies aériennes [19]. Une étude réalisée par Manewa et al. en Côte d’Ivoire [20] avait montré que les sujets tabagiques étaient exposés de façon significative aux infections respiratoires basses en général, aux pneumopathies aiguës bactériennes et à la tuberculose pulmonaire en particulier, lesquelles sont pourvoyeurs de PPT.
La consommation régulière d’alcool était retrouvée dans 41,8% des cas. Ce résultat est supérieur à celui retrouvé par de Chaabouni et al. [2] en Tunisie (11,7%), où l’alcool est moins consommé. Cependant l’intoxication alcoolique entraine des troubles prédisposants à l’inhalations des secrétions oropharyngées. Cette dernière constitue un facteur de risque indépendant des pneumonies cavitaires, en occurrence l’abcès du poumon avec évolution vers les PPT [8,21]. En plus, il a été constaté que la consommation chronique d’alcool diminue la réponse immunitaire, ce qui entraîne un risque accru d’infections pleuropulmonaires [22].
Ces résultats montrent que les facteurs de risque de développement du PPT sont semblables à ceux des infections bronchopulmonaires.
Dans notre étude, une insuffisance pondérale avec IMC ≤ 18 kg/m2 était retrouvée dans 44,8% des cas. En effet, la dénutrition accroît le risque d’infections pleuropulmonaires par des mécanismes multiples faisant intervenir une altération des défenses immunitaires, notamment l’immunité à médiation cellulaire et des mécanismes non immunitaires (augmentation de l’adhérence bactérienne) [23].
Des lésions parenchymateuses pulmonaires étaient associées à l’hydropneumothorax dans 89,5% des cas. Ce résultat est similaire à celui retrouvé par Chaabouni et al. [2] en Tunisie (70,6%). Les lésions cavitaires, dans notre étude, étaient retrouvées dans 58,2% des cas (cavernes : 46,3% ; niveaux hydro-aériques intra-parenchymateuse : 11,9 %). Singh et al. [14] en Inde avaient retrouvés un résultat similaire (65,4%). Ces données montrent que le PPT reste une complication des infections bronchopulmonaires surtout des pneumonies cavitaires, témoignant le plus souvent d’une fistule bronchopleurale. Cependant, l’absence d’atteinte parenchymateuse renforce l’hypothèse d’une infection pleurale par des germes pyogènes productrices de gaz dans la pathogénèse du PPT [24].
Dans notre étude, la cause la plus fréquente était la tuberculose (29,9%) suivi de la pneumonie bactérienne (22,4%). Ce même constat était fait, avec des proportions variables par : Singh et al. [14] en Inde (tuberculose : 61,5% ; pneumonie bactérienne : 26,9%). El Kihal et al. [16] au Maroc (tuberculose : 49,6% ; pneumonie bactérienne : 40,0%).
Cependant, la tuberculose, endémique dans ces régions (avec des incidences variables), domine l’étiologie des PPT.
L’abcès du poumon rompu était retrouvé dans 11,9% des cas. Ce résultat est nettement inférieur à celui retrouvé en 2019 par Chaabouni et al. [2] (64,7%). Cependant l’implication de l’abcès du poumon dans la pathogénèse des PPT dépend de certains facteurs notamment la localisation de l’abcès, le poumon sous-jacent. En effet, l’incidence des abcès pulmonaires a nettement diminué au cours de ces dernières années suite à la généralisation de l’utilisation de l’antibiothérapie. Toutefois, la fréquence de cette affection varie en fonction des terrains (alcoolisme, immunodépression, sujets âgés) et des pays.
Le PPT d’origine mycosique est une forme clinique rare. Il se développe habituellement chez les sujets immunodéprimés [25]. Cependant, du fait de la recrudescence du VIH en Afrique, certains cas de PPT d’origine mycosique ont été documentés. Dans notre étude, l’origine mycosique était retrouvée chez un patient, soit 1,5% des cas (le germe étant l’Aspergillus fumigatus). Ce résultat est similaire à celui de El Kihal et al. [13] au Maroc qui avaient retrouvé le PPT d’origine aspergillaire dans 1,8% des cas. Il s’agit d’un germe responsable d’une pneumopathie cavitaire. Aux vues de ces résultats, il est judicieux de penser à l’origine mycosique des PPT surtout devant une absence de réponse malgré une couverture antibiotique à large spectre et une immunosuppression pré-existante.
Le Mycobacterium tuberculosis multi-résistant était retrouvé dans 3,0% des cas. Ce résultat est similaire à celui de Singh et al. [14] qui avaient retrouvé une proportion de 5,8%. En effet, à l'échelle mondiale, la tuberculose pharmacorésistante reste un problème de santé publique. Toutefois, malgré sa faible proportion retrouvée dans notre étude, il serait judicieux de rechercher systématiquement la résistance à la rifampicine et à l’isoniazide en cas de suspicion de PPT d’origine tuberculeuse.
L’étude bactériologique du liquide pleural avait permis d’isolé essentiellement : Streptococcus pneumoniae (7,5%), Escherichia coli (6,0%), Klebsiella pneumonia (4,5%). L’étude de Gupta et al. [26] en 2013 avait plutôt retrouvé principalement le Pseudomonas aeruginosa (22,0%), Staphylococcus aureus (16,0%), Escherichia coli (12,0%). Le Streptococcus pneumoniae était de 2,0% et le Klebsiella pneumonia n’étaient pas isolés dans cette étude. Cette différence s’explique par le fait que plusieurs patients dans cette étude étaient des enfants et la taille de l’échantillon était moindre. Ainsi, la fréquence des différents germes isolés varie selon l’écologie microbienne locale, du terrain et de la taille des échantillons. En effet, ce sont des germes nécrosants. Le PPT constitue cependant une forme évolutive des infections broncho-pulmonaires à germes nécrosants.
CONCLUSION
Le PPT est relativement fréquent dans notre contexte. Il survient sur des terrains fragiles. C’est une complication d’un foyer infectieux non ou mal traité.
Conflits d’intérêts
Nous n’avons aucun conflit d'intérêts.
REFERENCES
TABLE - FIGURES
REFERENCES
ARTICLE INFO DOI: 10.12699/jfvpulm.15.46.2024.53
Conflict of Interest
Non
Date of manuscript receiving
25/03/2024
Date of publication after correction
26/06/2024
Article citation
Ogounde N.A, Adambounou T.A.S, Ako A.M.E, Aziagbe K.A, Gbadamassi A.G, Adjoh K.S. Epidemiological and etiological aspects of pyopneumothorax at Lomé - Togo. J Func Vent Pulm 2024;46(15):53-58