
 English
English
 French
French
Particularities of tuberculosis in diabetics observed at the University Hospital Center of Fenoarivo, Antananarivo, Madagascar
Particularités de la tuberculose chez les diabétiques vues au Centre Hospitalier Universitaire de Fenoarivo, Antananarivo Madagascar
Kiady Ravahatra1*, Henintsoa Olivah Rakotonirainy2, Finaritra Princy Parfait Andriamahenina1, Rafitoharson Norohasina Liantsoa Erica4, Ruth Alida Rasendranirina1, Marie Odette Rasoafaranirina3, Martin Fidy Arneaud1, Anjara Mihaja Nandimbiniaina4, Jobeline Rajaoarifetra5, Jocelyn Rakotomizao4, , Harison Michel Tiaray4, Joelson Lovaniaina Rakotoson4, Rondro Nirina Raharimanana1
1: Service de Pneumologie Centre Hospitalier Universitaire de Fenoarivo, Antananarivo Madagascar
2: Service de Rhumatologie Centre Hospitalier Universitaire de Befeletanana, Antananarivo Madagascar
3: Service de Pneumologie Centre Hospitalier Universitaire de Fianarantsoa, Fianarantsoa, Madagascar
4: Service de Pneumologie Centre Hospitalier Universitaire de Befeletanana, Antananarivo Madagascar
5: Service de Pneumologie Centre Hospitalier Universitaire de Toamasina, Madagascar
Corresponding author: RAVAHATRA Kiady. Faculté de Médecine d’Antananarivo. Mandagascar
E-mail: ravahatrakiady@yahoo.fr
ABSTRACT
Introduction. Diabetes is a known risk factor for development of tuberculosis. The objective of this study was to identify the particularity epidemiologic, clinics, radiologics and evolutive of pulmonary tuberculosis among diabetics patients.
Methods. A retrospective case-control study was realized at department of Pneumology Fenoarivo between 6 January 2017 and 11 October 2019.
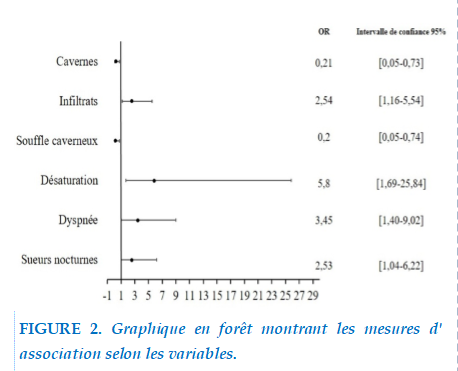
Results. We included 32 cases of pulmonary tuberculosis with diabetes and the control were 64 patients without diabetes. The prevalence of diabetes was 3.03%. Diabetic patients had less night sweats (p=0.03, OR: 2.53), desaturation (p=0.003, OR:5.8) , dyspnea (p=0.006 OR:3.45) and pleuretic syndrom (p=0.03, OR:7.15) than non-diabetics. Furthermore, infiltrates (p= 0.0015, OR: 2.54) and cavitation (p=0.009 OR=0.21) were more frequently found on chest radiography among diabetics compared to non-diabetic patients.
Conclusion. The clinical presentations and atypical imaging radiography were the particularity of tuberculosis among diabetics patients.
KEYWORDS: Characteristics; Diabete; Madagascar; Tuberculosis.
RÉSUMÉ
Introduction. Le diabète constitue un facteur de risque pour le développement de la tuberculose. L’objectif de cette étude est d’identifié les particularités épidémiologiques, cliniques, radiologiques, et évolutives de la tuberculose pulmonaire chez les diabétiques.
Méthodes. il s'agit d'une étude rétrospective type cas-témoin réalisée au niveau du service de pneumologie de Fénoarivo pendant la période du 06 janvier 2017 au 11 octobre 2019.
Résultats. Pendant l’étude 32 patients tuberculeux diabétiques (cas) a été retrouvés et appariés avec 64 tuberculeux non diabétiques. La prévalence du diabète était de 3,03% parmi les patients tuberculeux. Par rapport aux patients tuberculeux non diabétiques, les diabétiques présentent moins de sueur nocturne (p=0,03, OR: 2,53), moins de dyspnée (p=0,006 OR:3,45), moins de désaturation (p=0,003, OR:5,8), moins de syndrome pleurétique (p=0,03, OR:7,15), plus d'infiltrat (p= 0,0015, OR: 2,54) et plus de caverne (p=0,009 OR=0,21) sur la radiographie du thorax.
Conclusion. les signes cliniques ainsi que la fréquence inhabituelle des lésions radiologiques, été les principales particularités de la tuberculose chez les diabétiques.
MOTS CLÉS: Caractéristiques; Diabète; Madagascar; Tuberculose.
INTRODUCTION
La tuberculose est une infection due à Mycobacterium tuberculosis dont la localisation la plus fréquente est pulmonaire [1,2]. La tuberculose reste un problème de santé publique majeur, car elle affecte un tiers de la population mondiale dont le nombre de nouveaux cas de tuberculose est estimé à 10,4 millions selon les données de l’OMS en 2016 avec 1.8 million de cas de décès enregistrés [3,4].
En 2015, la fédération internationale du diabète (IDF) a estimé qu’il y avait 415 millions diabétiques dans le monde, non diagnostiqués dans la plupart des cas. La plupart se trouvent dans les pays à faible et à moyens revenus où la tuberculose est la plus répandue. Le diabète est l’un des facteurs de risque de survenue de la tuberculose. Les diabétiques ont deux à trois fois plus de risque de développer la tuberculose que les personnes non diabétiques, d’autant plus que le diabète est déséquilibré avec un taux élevé d’HbA1c supérieur ou égal à 7% [5].
Dans les pays industrialisés, la prévalence du diabète était de 19,7 % chez les patients atteints de la tuberculose active et le diabète de type 2 était fortement associé à la mortalité et à l’échec du traitement de la tuberculose (TB) [4]. En 2016, la prévalence du diabète chez les tuberculeux nouveaux cas est de 13% en Afrique [5]. Pour le cas de Madagascar, 30.000 cas de tuberculose ont été enregistrés en 2016, soit 12 % de la population générale [6].
La question que se pose est alors de savoir s’il y a une particularité sur la présentation de la tuberculose chez les patients diabétique.
L’objectif d’identifier de cette étude est de déterminer les particularités épidémiologiques, cliniques, radiologiques, et évolutives de la tuberculose pulmonaire chez les diabétiques au Centre Hospitalier Universitaire de Fenoarivo, Antananarivo Madagascar.
MÉTHODES
Il s’agit d’une étude rétrospective analytique de type cas témoins réalisée dans le service de Pneumologie du centre hospitalier universitaire de Fenoarivo pendant une durée de 21 mois, allant du 06 janvier 2017 à 11 octobre 2019.
Cette étude a évalué les particularités de la tuberculose chez les diabétiques. L’étude a été réalisée à partir de la consultation des dossiers des malades pris en charge au Service de Pneumologie CHU Fenoarivo. Les cas étaient représentés par les patients diabétiques présentant une tuberculose pulmonaire et les témoins représentés par les patients sans diabète et présentant une tuberculose à bacilloscopie positive.
Pour chaque cas, deux dossiers pendant le même mois d’hospitalisation ont été tirés au sort pour constituer les témoins.
Ont été inclus dans cette étude, tous les patients hospitalisés pendant la période d’étude, présentant:
- Pour les cas, un diagnostic de tuberculose pulmonaire associé à un diabète connu, ou de découverte fortuite lors des bilans systématiques demandés dans le service, avec une glycémie à jeun supérieure ou égale à 1,26 g/l (ou 7 mmol/l) et vérifiée par un deuxième examen glycémique de contrôle.
- Pour les témoins, un diagnostic de tuberculose pulmonaire bactériologiquement confirmée non associée au diabète.
Les données ont été obtenues après la demande d’autorisation auprès du chef de service.
Elles étaient exploitées de façon à respecter le secret professionnel par tous les gens qui ont un accès aux données à respecter la confidentialité des patients (anonymat et sécurisation des archivages des données).
Les données ont été saisies sur le logiciel Microsoft Excel® 2010. L’étude statistique a été faite avec le logiciel EPI info 7®. L’analyse statistique a été faite en utilisant le test du Chi2 ou le test de Fisher. Le test était significatif pour une valeur de p < 0,05.
RÉSULTATS
Durant la période d’étude, mille cinquante-six (1056) patients présentaient une tuberculose toutes formes confondues dont cinq cent cinq (505) sont diagnostiqués comme tuberculose pulmonaire bactériologiquement confirmée.
Après randomisation, notre population d’étude était constituée de trente-deux (32) cas de tuberculose pulmonaire bactériologiquement confirmée associée à un diabète et soixante-quatre (64) témoins (tuberculose pulmonaire bactériologiquement confirmée sans diabète). La prévalence de l’association tuberculose et diabète était de 6,33 %.
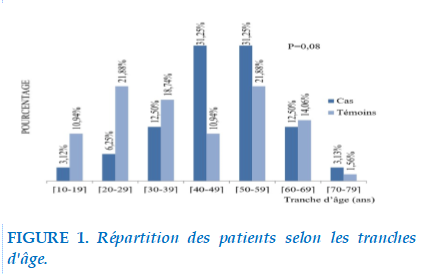
Nous avons noté une prédominance masculine dans les deux groupes avec un sex-ratio de 1,1 pour les témoins et 2,36 pour les cas. Il n’y avait pas de différence statistiquement significative entre les deux groupes concernant le genre. L’âge moyen était de 42,30 ans dans l’ensemble avec un extrême allant de 15 ans à 71 ans. L’âge moyen pour les cas était de 46,59 ans, il était de 40,15 ans pour ceux des témoins.
Il n’y avait pas de différence statistiquement significative entre les deux groupes concernant l’âge. La figure 1 montre la répartition des patients selon leur tranche d’âge. Quinze patients tuberculeux avaient déjà un diabète connu et traité avant le diagnostic de la tuberculose pulmonaire.
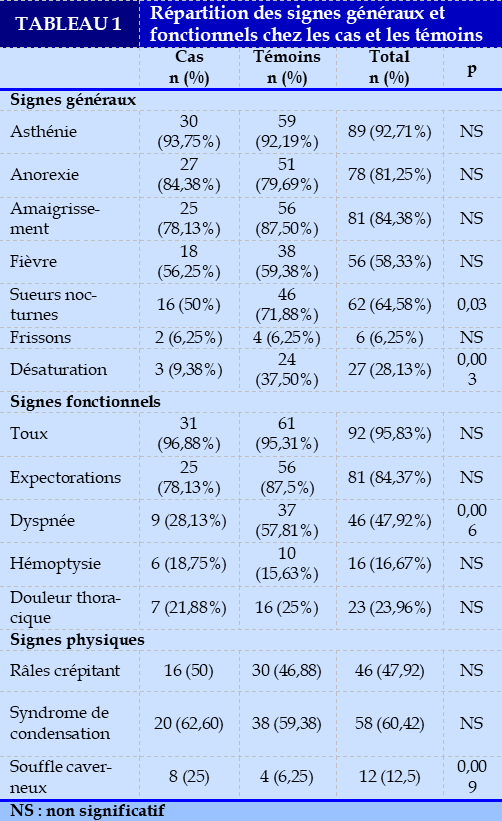
La durée moyenne du diagnostic de diabète et l’apparition de la tuberculose était de 5,16 ans avec un extrême allant de 0,25 à 25 ans. Chez 17 patients (53,13%), le diabète était de découverte fortuite lors des bilans systématiques effectués durant son hospitalisation. les signes généraux et les signes fonctionnels sont présentés dans le Tableau 1.
La désaturation était moins fréquent chez les diabétiques, avec une différence statistiquement significative. La toux et l’expectoration prédominaient chez les patients dans les deux groupes avec des proportions respectives de 95,83% et de 84,37%.
Nous avons trouvé une différence statistiquement significative entre les 2 groupes concernant la dyspnée, c’est-à-dire que la dyspnée était moins fréquente chez les diabétiques au cours de la tuberculose pulmonaire. Nous n’avons pas trouvé de différence statistiquement significative chez les deux groupes de patients concernant la richesse bacillaire des crachats (Tableau 2).
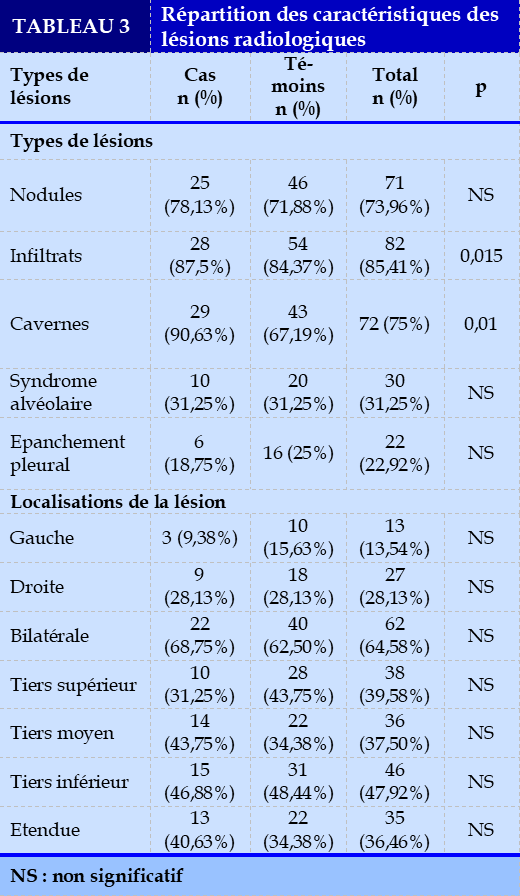
Sur la radiographie du thorax, La lésion infiltrative était la lésion prédominante avec un pourcentage de 85,41% dont 87,5% pour les cas et de 84,37% pour les témoins, suivie par la lésion à type de caverne avec un pourcentage de 75%, dont 90,63% pour les cas et 67,19% pour les témoins.
Nous avons trouvé une différence statistiquement significative entre les deux groupes concernant la présence d’une lésion à type d’infiltrat et de caverne. L’infiltrat et la caverne étaient plus fréquents chez les diabétiques.
Par contre, il n’y avait pas de différence statistiquement significative chez les deux groupes de patients concernant les localisations des lésions radiologiques (Tableau 3).
La durée d’hospitalisation entre 1 à 10 jours était la plus fréquente, avec une proportion de 33,33%, dont 28,13% chez les cas et 35,94% chez les témoins, suivis de la durée d’hospitalisation entre 11 à 20 jours, avec une proportion de 28,13%, dont 21,87% pour les cas et 31,25% pour les témoins. Nous n’avons pas trouvé de différence statistiquement significative entre les deux groupes concernant la durée d’hospitalisation. Les mésures d’association des variables significatifs sont présentés dans la Figure 2.
DISCUSSION
Dans la littérature, la prévalence de l’association tuberculose et diabète est variable selon les pays: 0,38% à 14% pour les pays asiatiques, 3,4% à 6,2% pour Les pays africains, 13,6 à 19,7% en Amérique [4, 7-9]. Pour la présente étude, 32 cas d’association tuberculose et diabète étaient retrouvé parmi les 505 cas de TPB(+) hospitalisés pendant la période d’étude, donnant une prévalence de 6,33%.
Ce résultat est semblable à celui retrouvé par Amare H et al lors de son étude réalisée en Ethiopie en 2013, rapportant une prévalence de 6,2% [10]. De même pour Swai AB et al, en 1999, en Tanzanie et de Ahmet et al à N’Djamena, la prévalence respective de la tuberculose chez les diabétiques était de 5,4% et 5.6% [11,12].
Une prévalence plus élevée par rapport à notre étude a été rapportée par Jovana MP et al, en Serbie, lors d’une étude rétrospective observationnelle de type cas-témoins menée entre 2011 et 2015. Ils ont retrouvé que pour un total de 889 patients avec tuberculose pulmonaire active, 88 patients étaient diabétiques, avec une prévalence à 9,8% [13].
L’étude de Mave V et al, en Inde, réalisée entre 2013 et 2017 retrouvaient 162 diabétiques parmi les 890 patients tuberculeux bactériologiquement confirmés. Ils ont calculés des prévalences différentes selon l’âge des patients, qui étaient de 2% pour les patients âgés de moins de 25 ans, 12% entre 25 et 40 ans et 45% pour les patients plus de 40 ans [14].
Pour l’étude de Hoa N. B.et al en 2016 au Vietnam, une prévalence de l’association de tuberculose et de diabète à 13,7% était retrouvé [15].
Ces variations de prévalence peuvent être liées à l’âge, au changement des modes de vie et aux facteurs socio-économiques dans les différents pays.
Une autre étude aussi montrée que la prévalence des patients tuberculeux diabétiques chez les Africains est relativement plus faible comparée à celle des Asiatiques. Cette différence peut être expliquée par le fait que dans le continent asiatique, il y a une forte participation de la population au dépistage du diabète chez les patients tuberculeux grâce à l’existence d’une structure de collaboration pour la prise en charge et le contrôle de l’association tuberculose et diabète (Collaborative Framework for the care and control of Diabetes and Tuberculosis) [16].
Dans notre série, dix-sept (53,12%) patients tuberculeux diabétiques présentaient déjà un diabète avant le diagnostic de la tuberculose pulmonaire. La durée moyenne du diagnostic était de 4,58 ans avec un extrême allant de 1 mois à 25 ans.
Il a été indiqué dans la littérature que le diabète se développait avant la tuberculose et contribue à l’éclosion de celle-ci. Le déséquilibre du diabète était surtout le facteur qui augmente le risque de contracter la tuberculose d’autant plus que le diabète soit chronique, c’est-à-dire qu’en moyenne le diabète existait au moins 7 ans chez le sujet et que les autres complications du diabète peuvent y coexister [17].
Mona A et al, en Soudan en 2017, a trouvé qu’il y avait une augmentation évidente du risque de développement de la tuberculose chez les patients diabétiques non ou mal contrôlés. La durée moyenne du diagnostic du diabète avant la tuberculose est de 6,92 ans dont 78,3% étaient diagnostiqués durant les dix premières années de son évolution, 16,7% étaient découverts entre 10 ans à 20 ans et 5% entre 21ans à 30 ans [18].
Abera et al a rapporté que 35,5% des patients tuberculeux étaient déjà un diabétique connu depuis 5 à 10 ans, et 54,5% avaient un diabète évoluant depuis plus de 10 ans. Ils ont conclu que les diabétiques diagnostiqués depuis plus de 10 ans avaient sept fois plus de risque de développer une tuberculose comparés aux diabétiques dépistés depuis moins de 5 ans (OR : 7,03 ; IC 95% : 1,357-73,6) [19]. Quant à l'antériorité de la tuberculose par rapport au diabète, elle demeure exceptionnelle [20].
Par ailleurs, l’étude faite par Ahandar et al a trouvé un diagnostic simultané de diabète et de tuberculose, respectivement chez 36% des patients [21]. Probablement chez ces patients, le diabète existait déjà avant et la tuberculose constitue la circonstance de découverte.
Dans la présente étude, les symptômes les plus représentés pour les cas étaient la toux (96,88%), l’asthénie (93,75%), l’anorexie (84,38%), l’amaigrissement (78,13%), les expectorations (78,13%) et la fièvre (56,25%). Nous avons trouvé une différence statistiquement significative entre les deux groupes de patient concernant la présence de sueurs nocturnes (p=0,03), et la dyspnée (p=0,006).
Le même résultat a été aussi constaté par l’étude Almeida-Junior et al, en 2016, au Brésil. Les sueurs nocturnes ont été retrouvées chez 15,6% des tuberculeux diabétiques (n=205), 7,5% des patients en état de pré-diabète (n=358), et 3,3% pour les non-diabétiques (p˂0,0001). Pour la dyspnée, 11,7% l’ont présenté pour les diabétiques, 6,7% étaient en état de pré-diabète et 3,9% pour les non-diabétiques (p=0 ,007) [22].
Pour l’étude mené par Manjareeka et al En 2016 dans le district d’Odisha. Les manifestations cliniques étaient similaires pour les patients présentant une tuberculose seule et celles présentant une association de tuberculose et diabète. Les symptômes les plus présentés étaient la toux (87,1%), la perte du poids (80,2%), les troubles digestifs (60,4%), les sueurs nocturnes (46,5%), et l’hémoptysie (10 ,9%) [23].
En 2016, l’étude de Workneh et al en Ethiopie a aussi trouvé un résultat différent. Pour un total de 109 cas et de 642 témoins, les signes les plus représentés chez les patients présentant l’association tuberculose et diabétiques étaient l’amaigrissement, l’asthénie, l’anorexie, la fièvre et la toux. Il n’y avait pas de différence chez les deux groupes concernant les signes cliniques [24].
Le résultat de la présente étude a révélé la prédominance de la richesse bacillaire à une croix chez les témoins avec un pourcentage de 45,31% et la richesse bacillaire à trois croix était la plus retrouvée chez les cas soit 46,88%. Nous n’avons pas trouvé de différence statistiquement significative chez les deux groupes de patients concernant la richesse bacillaire des crachats. Ce même résultat était constaté par Mave et al, en Inde, en 2017, qui ont rapporté que la richesse bacillaire n’est pas différente chez les tuberculeux seuls et les tuberculeux diabétiques. Pour un total de 890 patients inclus dans l’étude ; la richesse bacillaire à une croix était prédominante, dont 24% chez les non-diabétiques (n=432), 26% pour les pré-diabètes (n=296) et 35% pour les diabétiques (n=162), suivie de la richesse bacillaire à deux croix, dont 16% chez les non-diabétiques, 19% chez les pré-diabètes et 19% chez les diabétiques (p=0,17).Le reste des patients était à trois croix ou recherche de BAAR négative [14].
Par contre pour l’tude de Mejri et al, les groupes de patients tuberculeux et diabétiques étaient plus bacillifères (richesse bacillaire à trois croix) que les groupes des patients non diabétiques : 37 % versus 24 %, avec une différence statistiquement significative (p = 0,017) [25].
Selon une autre étude, les patients tuberculeux et diabétiques sont accompagnés d’une richesse bacillaire élevée du fait de la fréquence des cavernes tuberculeuses chez ces patients par rapport aux sujets non diabétiques, et les cavernes sont les réservoirs de Mycobacterium tuberculosis [17].
Sur la radiographie du thorax notre étude a trouvé que la lésion infiltrative (87,5%), ainsi que les cavernes étaient plus fréquentes chez les cas (90,63%) par rapport au témoin, avec une différence statistiquement significative (p= 0,015 et 0,01).
Mejri et al a trouvé les mêmes résultats dans son étude, les excavations étaient plus fréquentes chez les diabétiques (69% versus 51% ; p=0,032) avec des lésions plus étendues (77% versus 63% ; p=0,02) et touchant les deux poumons (55% versus 41%) [25]. Une étude cas-témoins réalisée par Bopaka et al au Brazzaville a aussi trouvé une association fréquente d’une image de caverne chez les patients atteint d’une association tuberculose et diabéète (OR : 2.83, IC : 1.38-6.22) [26]. Par contre, un résultat différent de notre étude était retrouvé par Sahraoui et al en Algérie, en 2017. Sur les 110 patients tuberculeux et diabétiques inclus, 62% ont présenté la lésion ulcéro-infiltrative, 22% pour les condensations alvéolaires et 15% pour les excavations [27].Touré NO et al, en Sénégal, en 2007, lors d’une étude rétrospective comparative cas-témoins ont conclu que les atteintes parenchymateuses et les images cavitaires constituaient les types de lésions les plus fréquents dans les deux groupes. Cependant, la tendance à la cavitation est plus importante chez les patients tuberculeux sans diabète (84%) contre 72% chez les patients présentant une association tuberculose et diabète, p=0,04 [28].
Les résultats de notre étude révélaient que les lésions radiologiques étaient souvent bilatérales chez les deux groupes de patients avec un pourcentage de 64,58%, et étaient observés principalement sur le tiers inférieur et le tiers moyen du champ pulmonaire avec un pourcentage respectif de 47,92% et 37,50%. Il n’y avait pas de différence statistiquement significative chez les deux groupes de patients concernant les localisations des lésions radiologiques.
Des résultats différents à la présente étude étaient retrouvés dans la littérature. Touré et al ont découvert lors d’une étude rétrospective cas-témoins, que la diffusion des lésions radiologiques était plus significative chez les patients tuberculeux sans diabète (66% contre 48% pour les cas ; p=0,01), et l’atteinte basale était significativement plus rencontrée parmi les patients présentant une association tuberculose et diabète (15% contre 3% pour les témoins ; p=0,006) [28].
Sahraoui et al ont également trouvé que chez un total de 110 patients tuberculeux diabétiques, les lésions siégeaient dans les lobes inférieurs dans 70% des patients et bilatérales dans 46,36% des malades [27].
Feza B et al, a trouvé que l’atteinte du champ pulmonaire inférieur était les plus observés chez les diabétiques, particulièrement chez les femmes et les patients âgés de plus de 40 ans [29].
La prédominance des lésions bilatérales dans notre étude peut être lié au retard diagnostique de a tuberculose.
CONCLUSION
La relation entre la tuberculose et le diabète a été bien établie. Lorsque la tuberculose pulmonaire s’associe au diabète, l’un va aggraver l’autre. Quelques particularités sont notifiées et doivent être prises en compte chez les diabétiques en cas d’association avec la tuberculose. Sur le plan clinique, nous avons trouvé que les diabétiques présentent moins de sueur nocturne, moins de dyspnée, moins de désaturation, moins de syndrome pleurétique comparés à ceux des non diabétiques. Sur le plan radiologique, les diabétiques tuberculeux ont une présentation particulière avec une prédominance des lésions à type de caverne et d’infiltrat.
Les patients tuberculeux diabétiques peuvent bien évoluer si le diabète est équilibré et la tuberculose pulmonaire est correctement traitée. Afin de détecter précocement une tuberculose pulmonaire chez les diabétiques et vice versa, une collaboration étroite du Pneumo-Phtisiologue et d’Endocrinologue est nécessaire.
CONFLIT D’INTÉRÊTS
Aucun.
RÉFÉRENCES
| 1. Haddaoui H. Zahraoui R, Soualhi M, Marc K, Benamor J, Bourkadi JE. Profil épidémiologique et clinique de la tuberculose chez les patients diabétique. Rev Mal Respir. Janvier 2019; 36 (S): A168. |
| 2. Maïga S, Ouédraogo KO, Nacanabo RN, Sawadogo A, Ouédraogo AR, Boncoungou Ket al. Epidemio-clinical profile and therapeutic outcome of tuberculosis in the city of Ouahigouya - Burkina Faso. J Func Vent Pulm 2021; 36(12): 1-75 |
| 3. Toujania S, Ben Salahb N, Cherifa J, MjidaYM, Ouahchya, Zakhamaa H, et al. La primo-infection et la tuberculose pulmonaire. Rev Pneumol Clin. Avril 2015;71(2-3): 73-82. |
| 4. Leila B, Natasha S, Evan O, Sen P, Julie J, Stephen. Diabetes Mellitus in adult patients with active tuberculosis in Canada: Presentation and treatment outcomes. Can J Respir Crit Care Med. 2018: 2474-5340. |
| 5. Grint D, Alisjhabana B, Ugarte-Gil C, Riza AL, Walzl G, Pearson F, et al.Accuracy of diabetes screening methods used for people with tuberculosis, Indonesia, Peru, Romania, South Africa. Bull World Health Organ. 2018 Novembre; 96, 11: 738–49. |
| 6. World Health Organization. Statistiques pour Madagascar. WHO. 2016. Disponible à https://www.who.int/countries/mdg/fr/ (accès le 02/10/2020) |
| 7. Fasil W, Setegn E, Animut A, Getenet D, Cheru T, Amanuel AA. Meta-analysis of the prevalence of tuberculosis in diabetic patients and its association with cigarette smoking in African and Asian countries. BMC Res Notes. May 2018;11(1):298. |
| 8. Leal BS, Gleide SA, Joilda SN, Carlos ATS, Maeli GO, Mauricio LB et al. Clinical and epidemiological aspects of cases of tuberculosis associated with diabetes in Salvador, Bahia, Brazil. Rev Soc Bras Med Trop. 2017; 50(3):408-12. |
| 9. Dooley KE, Tang T, Golub JE, Dorman SE, Cronin W.Impact of Diabetes Mellitus on Treatment Outcomes of Patients with Active Tuberculosis.Am J Trop Med Hyg. April 2009 ; 80(4): 634–9. |
| 10. Amare H, Gelaw A, Anagaw B, Gelaw B. Smear positive pulmonary tuberculosis among diabetic patients at the Dessie referral hospital, Northeast Ethiopia. Infect Dis Poverty. 2013;2(1):6. |
| 11. Swai A B, McLarty D G, Mugusi F. Tuberculosis in diabetic patients in Tanzania. Tropical Doct. Oct 1990; 20(4): 147-50. |
| 12. Ahmet A, Ngakoutou R, Oumar A, Dieudonne D, Alim M. Tuberculosis pulmonary and diabetes: Epidemiological, clinical, paraclinical, therapeutic and evolutionary in the pneumology department of the CHU-RN of N’Djame. J Func Vent Pulm 2024; 45(15): 1-65. |
| 13. Jovana MP, Aleksandar DP, Milica VB, Dragica PP. Prevalence of diabetes mellitus (DM) in tuberculosis (TB) patients: clinical and radiologic features in the TB-DM association based on a five-year hospital study. Le Infezioni in Medicina.2018 ; 1; 22-7. |
| 14. Mave V, Meshram S, Lokhande R, Kadam D, Dharmshale S, Bharadwaj R et al. Prevalence of dysglycemia and clinical presentation of pulmonary tuberculosis in Western India. Int J Tuberc Lung Dis. 2017; 21(12): 1280–7. |
| 15. Hoa NB, Phuc PD, Hien NT, Hoa VQ, Thuong PH, Anh PT et al. Prevalence and associated factors of diabetes mellitus among tuberculosispatients in Hanoi, Vietnam. BMC Infectious Diseases. 2018;18: 603. |
| 16. Lin Y, Li L, Mi F, Du J, Dong Y, Li Z et al. Screening patients with diabetes mellitus for tuberculosis in China. Tropical Med Int Health. 2012;17(10):1302-8. |
| 17. Restrepo BI. Diabetes and tuberculosis . Microbiol Spectr. December 2016; 4(6): 1-19. |
| 18. Mona A, Ibtihal O., Osman S. M. A., Ahmed-Abakur, Eltayib H. Association between pulmonary tuberculosis and type 2 diabetes in Sudanese patients. Int J Mycobacteriol. 2017; 6(1): 97-101. |
| 19. Abera A, Ameya G. Pulmonary Tuberculosis and Associated Factors Among Diabetic Patients Attending Hawassa Adare Hospital, Southern Ethiopia. The Open Microbiology Journal. 2018 ; 12 : 333-42. |
| 20. Baldé NM, Camara A,Camara LM, Diallo MM, Kaké A, Bah-Sow OY. Tuberculose et diabète à Conakry, Guinée : prévalence et caractéristiques cliniques de l’association. Int J Tuberc Lung Dis. 2006 ; 10(9): 1036-40. |
| 21. Ahandar H, Aziz ES, Chadli A. Tuberculose et diabete. SFE Angers 2015. Annales d'Endocrinologie. 2015: 520-58. |
| 22. Almeida-Junior JL, Gil-Santana L, Oliveira CAM, Castro S, Cafezeiro AS, Daltro C et al. Glucose Metabolism Disorder Is Associated with Pulmonary Tuberculosis in Individuals with Respiratory Symptoms from Brazil. PLoS ONE. 2016 ;11(4): 1-14. |
| 23. Majareeka M., Palo K. S., Swain S., Sandipana P., Sanghamitra P. Diabetes Mellitus among Newly Diagnosed Tuberculosis Patients in Tribal Odisha: an exploratory study. J Clin Diagn Res. 2016; 10(10):LC06-8. |
| 24. Workneh MH, Bjune GA, Yimer SA. Prevalence and associated factors of diabetes mellitus among tuberculosis patients in South-Eastern Amhara region, Ethiopia: a cross sectional study. PLoS One. January 2016;11(1):e0147621. |
| 25. Mejri I, Ben Saad S, Daghfous H, Megdiche L,Tritar F. Particularités de la tuberculose. chez les diabétiques: étude comparative. Rev Mal Respir. Janvier 2017; 34 (S): A235. |
| 26. Bopaka RG, Ndziessi G, Okemba Okombi FH, Bemba ELP, Andzouana Mbamognoua NG, Niama AC et al. Predictive factors of pulmonary tuberculosis in type 2 diabetic subjects at the Brazzaville University Hospital from 2017 to 2022. J Func Vent Pulm 2023; 43(14): 1-64 |
| 27. Sahraoui K, Bourkadi D, Zaoui A, Bennani M.A. Particularité de la tuberculose chez les diabétiques à Oran, expérience de service de Pneumologie CHU Oran. Rev Mal Respir. Janvier 2019; 36: A169. |
| 28. Touré NO, Kane DY, Diatta A, Ba SD, Niang A, Ndiaye EM et al. Tuberculose et diabète. Rev Mal Respir. 2007 ; 24 (7) : 869-75. |
| 29. Feza B, Özen K B, Gürsel C, Abdullah S, Mahmut A. Pulmonary Tuberculosis in Patients with Diabetes mellitus. Respiration. Avril 2001; 68: 595-600. |
TABLE - FIGURES

RÉFÉRENCES
| 1. Haddaoui H. Zahraoui R, Soualhi M, Marc K, Benamor J, Bourkadi JE. Profil épidémiologique et clinique de la tuberculose chez les patients diabétique. Rev Mal Respir. Janvier 2019; 36 (S): A168. |
| 2. Maïga S, Ouédraogo KO, Nacanabo RN, Sawadogo A, Ouédraogo AR, Boncoungou Ket al. Epidemio-clinical profile and therapeutic outcome of tuberculosis in the city of Ouahigouya - Burkina Faso. J Func Vent Pulm 2021; 36(12): 1-75 |
| 3. Toujania S, Ben Salahb N, Cherifa J, MjidaYM, Ouahchya, Zakhamaa H, et al. La primo-infection et la tuberculose pulmonaire. Rev Pneumol Clin. Avril 2015;71(2-3): 73-82. |
| 4. Leila B, Natasha S, Evan O, Sen P, Julie J, Stephen. Diabetes Mellitus in adult patients with active tuberculosis in Canada: Presentation and treatment outcomes. Can J Respir Crit Care Med. 2018: 2474-5340. |
| 5. Grint D, Alisjhabana B, Ugarte-Gil C, Riza AL, Walzl G, Pearson F, et al.Accuracy of diabetes screening methods used for people with tuberculosis, Indonesia, Peru, Romania, South Africa. Bull World Health Organ. 2018 Novembre; 96, 11: 738–49. |
| 6. World Health Organization. Statistiques pour Madagascar. WHO. 2016. Disponible à https://www.who.int/countries/mdg/fr/ (accès le 02/10/2020) |
| 7. Fasil W, Setegn E, Animut A, Getenet D, Cheru T, Amanuel AA. Meta-analysis of the prevalence of tuberculosis in diabetic patients and its association with cigarette smoking in African and Asian countries. BMC Res Notes. May 2018;11(1):298. |
| 8. Leal BS, Gleide SA, Joilda SN, Carlos ATS, Maeli GO, Mauricio LB et al. Clinical and epidemiological aspects of cases of tuberculosis associated with diabetes in Salvador, Bahia, Brazil. Rev Soc Bras Med Trop. 2017; 50(3):408-12. |
| 9. Dooley KE, Tang T, Golub JE, Dorman SE, Cronin W.Impact of Diabetes Mellitus on Treatment Outcomes of Patients with Active Tuberculosis.Am J Trop Med Hyg. April 2009 ; 80(4): 634–9. |
| 10. Amare H, Gelaw A, Anagaw B, Gelaw B. Smear positive pulmonary tuberculosis among diabetic patients at the Dessie referral hospital, Northeast Ethiopia. Infect Dis Poverty. 2013;2(1):6. |
| 11. Swai A B, McLarty D G, Mugusi F. Tuberculosis in diabetic patients in Tanzania. Tropical Doct. Oct 1990; 20(4): 147-50. |
| 12. Ahmet A, Ngakoutou R, Oumar A, Dieudonne D, Alim M. Tuberculosis pulmonary and diabetes: Epidemiological, clinical, paraclinical, therapeutic and evolutionary in the pneumology department of the CHU-RN of N’Djame. J Func Vent Pulm 2024; 45(15): 1-65. |
| 13. Jovana MP, Aleksandar DP, Milica VB, Dragica PP. Prevalence of diabetes mellitus (DM) in tuberculosis (TB) patients: clinical and radiologic features in the TB-DM association based on a five-year hospital study. Le Infezioni in Medicina.2018 ; 1; 22-7. |
| 14. Mave V, Meshram S, Lokhande R, Kadam D, Dharmshale S, Bharadwaj R et al. Prevalence of dysglycemia and clinical presentation of pulmonary tuberculosis in Western India. Int J Tuberc Lung Dis. 2017; 21(12): 1280–7. |
| 15. Hoa NB, Phuc PD, Hien NT, Hoa VQ, Thuong PH, Anh PT et al. Prevalence and associated factors of diabetes mellitus among tuberculosispatients in Hanoi, Vietnam. BMC Infectious Diseases. 2018;18: 603. |
| 16. Lin Y, Li L, Mi F, Du J, Dong Y, Li Z et al. Screening patients with diabetes mellitus for tuberculosis in China. Tropical Med Int Health. 2012;17(10):1302-8. |
| 17. Restrepo BI. Diabetes and tuberculosis . Microbiol Spectr. December 2016; 4(6): 1-19. |
| 18. Mona A, Ibtihal O., Osman S. M. A., Ahmed-Abakur, Eltayib H. Association between pulmonary tuberculosis and type 2 diabetes in Sudanese patients. Int J Mycobacteriol. 2017; 6(1): 97-101. |
| 19. Abera A, Ameya G. Pulmonary Tuberculosis and Associated Factors Among Diabetic Patients Attending Hawassa Adare Hospital, Southern Ethiopia. The Open Microbiology Journal. 2018 ; 12 : 333-42. |
| 20. Baldé NM, Camara A,Camara LM, Diallo MM, Kaké A, Bah-Sow OY. Tuberculose et diabète à Conakry, Guinée : prévalence et caractéristiques cliniques de l’association. Int J Tuberc Lung Dis. 2006 ; 10(9): 1036-40. |
| 21. Ahandar H, Aziz ES, Chadli A. Tuberculose et diabete. SFE Angers 2015. Annales d'Endocrinologie. 2015: 520-58. |
| 22. Almeida-Junior JL, Gil-Santana L, Oliveira CAM, Castro S, Cafezeiro AS, Daltro C et al. Glucose Metabolism Disorder Is Associated with Pulmonary Tuberculosis in Individuals with Respiratory Symptoms from Brazil. PLoS ONE. 2016 ;11(4): 1-14. |
| 23. Majareeka M., Palo K. S., Swain S., Sandipana P., Sanghamitra P. Diabetes Mellitus among Newly Diagnosed Tuberculosis Patients in Tribal Odisha: an exploratory study. J Clin Diagn Res. 2016; 10(10):LC06-8. |
| 24. Workneh MH, Bjune GA, Yimer SA. Prevalence and associated factors of diabetes mellitus among tuberculosis patients in South-Eastern Amhara region, Ethiopia: a cross sectional study. PLoS One. January 2016;11(1):e0147621. |
| 25. Mejri I, Ben Saad S, Daghfous H, Megdiche L,Tritar F. Particularités de la tuberculose. chez les diabétiques: étude comparative. Rev Mal Respir. Janvier 2017; 34 (S): A235. |
| 26. Bopaka RG, Ndziessi G, Okemba Okombi FH, Bemba ELP, Andzouana Mbamognoua NG, Niama AC et al. Predictive factors of pulmonary tuberculosis in type 2 diabetic subjects at the Brazzaville University Hospital from 2017 to 2022. J Func Vent Pulm 2023; 43(14): 1-64 |
| 27. Sahraoui K, Bourkadi D, Zaoui A, Bennani M.A. Particularité de la tuberculose chez les diabétiques à Oran, expérience de service de Pneumologie CHU Oran. Rev Mal Respir. Janvier 2019; 36: A169. |
| 28. Touré NO, Kane DY, Diatta A, Ba SD, Niang A, Ndiaye EM et al. Tuberculose et diabète. Rev Mal Respir. 2007 ; 24 (7) : 869-75. |
| 29. Feza B, Özen K B, Gürsel C, Abdullah S, Mahmut A. Pulmonary Tuberculosis in Patients with Diabetes mellitus. Respiration. Avril 2001; 68: 595-600. |
ARTICLE INFO DOI: 10.12699/jfvpulm.15.47.2024.10
Conflict of Interest
Non
Date of manuscript receiving
20/06/2024
Date of publication after correction
25/11/2024
Article citation
Kiady Ravahatra, Henintsoa Olivah Rakotonirainy, Finaritra Princy Parfait Andriamahenina, Rafitoharson Norohasina Liantsoa Erica, Ruth Alida Rasendranirina, Marie Odette Rasoafaranirina, Martin Fidy Arneaud, Anjara Mihaja Nandimbiniaina, Jobeline Rajaoarifetra, Jocelyn Rakotomizao, , Harison Michel Tiaray, Joelson Lovaniaina Rakotoson, Rondro Nirina Raharimanana. Particularities of tuberculosis in diabetics observed at the University Hospital Center of Fenoarivo, Antananarivo, Madagascar. J Func Vent Pulm 2024;47(15):11-17