
 English
English
 French
French
Evaluation of the cost of care of patients with multidrug resistant tuberculosis at the Niamey Unit, Niger
Evaluation de la prise en charge des patients atteints de tuberculose multirésistante a l’Unité de Niamey, Niger
Halidou Moussa1, MA. Gagara Issoufou1, M. Bassirou Souleymane2, A. Cheikh Aboubacar3, P.Tchibara Kougbada1, D. Maizoumbou1, M. Ouédraogo4.
1: Service de Pneumologie, Hôpital National Amirou Boubacar Diallo de Niamey, Niger
2: Damien Foundation, Niamey, Niger
3: Programme National de Lutte Contre la Tuberculose
4: Service de Pneumologie, Centre Hospitalier Universitaire Yalgado. Ouagadougou – Burkina Faso
Corresponding author: Souleymane HALIDOU MOUSSA, Service de Pneumologie, Hôpital National Amirou Boubacar Diallo de Niamey - Niger.
E-mail: hmsouley14@gmail.com
ABSTRACT
Introduction. Multidrug-resistant tuberculosis constitutes a major public health problem worldwide. The objective of this work was to evaluate the management of patients with multidrug-resistant tuberculosis in Niamey (Niger).
Methods. This was a retrospective cohort study with descriptive and analytical aims of patients followed for multidrug-resistant tuberculosis at the Niamey treatment unit. This study spanned a period of 10 years, from January 1, 2011 to December 31, 2020.
Results. A total of 334 patients were included in the study, including 321 cases of rifampicin-resistant tuberculosis (RR-TB) and 13 cases of extensively drug-resistant tuberculosis (XDR-TB). The frequency was 6.3% of all cases of tuberculosis, all forms combined. The average age of the patients was 35.6 years ± 13.68 with a male predominance of 83.1%. HIV serology was positive in 6% of patients and 1.5% of patients were diabetic. Tuberculosis cases were found in 94.6% of cases. Undernutrition was found in 55.7% of cases. The radiographic lesions were bilateral in 86.4% of patients. Adverse effects were found in 92.81% of cases and digestive disorders were at the forefront (72.46%). The therapeutic success rate for RR-TB patients was 78.82% and for XDR-TB it was 84.62%.There was a statically significant link between death, age (p=0.03) and sex (p=0.006).
Conclusion. The results of the treatment of the short diet were very encouraging despite the appearance of numerous adverse effects which remained manageable.
KEYWORDS: Multidrug-resistant tuberculosis; Short regimen; Niamey.
RÉSUMÉ
Introduction. La tuberculose multirésistante constitue un problème majeur de santé publique dans le monde. L’objectif de ce travail était d’évaluer la prise en charge des patients atteints de tuberculose multirésistante à Niamey (Niger).
Méthodes. Il s’agissait d’une étude de cohorte rétrospective à visée descriptive et analytique des patients suivis pour une tuberculose multirésistante à l’unité de prise en charge de Niamey. Cette étude s’étendait sur une période de 10 ans, du 1er janvier 2011 au 31 décembre 2020.
Résultats. Au total, 334 patients étaient inclus dans l’étude dont 321 cas de tuberculose résistante à la rifampicine (TB-RR) et 13 cas de tuberculose ultrarésistant (TB-XDR). La fréquence était de 6,3% de tous les cas de tuberculose toutes formes confondues. La moyenne d’âge des patients était de 35,6 ans ± 13,68 avec une prédominance masculine de 83,1%. La sérologie VIH était positive chez 6% des patients et 1,5% des patients étaient diabétiques. Les antécédents de tuberculose étaient retrouvés dans 94,6% des cas. Une dénutrition était retrouvée dans 55,7% des cas. Les lésions radiographiques étaient bilatérales chez 86,4% des patients. Des effets indésirables étaient retrouvés dans 92,8% des cas et les troubles digestifs étaient au premier plan (72,5%).Le taux de succès thérapeutique des patients TB-RR était de 78,8% et pour les TB-XDR il était de 84,6%.Il existait un lien statiquement significatif entre le décès, l’âge (p=0, 03) et le sexe (p=0, 006).
Conclusion. Les résultats du traitement du régime court étaient forts encourageants malgré la survenue de nombreux effets indésirables qui restent gérables.
MOTS CLÉS: Tuberculose multirésistante; Régime court; Niamey.
INTRODUCTION
La résistance de Mycobacterium tuberculosis (MTB) aux antituberculeux est un phénomène mondial, qui met en danger l’objectif de l’Organisation mondiale de la santé (OMS) d’éradiquer la tuberculose (TB) dans le monde en 2035 [1].
La tuberculose multirésistante (TB-MR/RR) se définit comme une résistance à au moins la rifampicine et à l’isoniazide. Jusqu’en décembre 2020, la tuberculose ultrarésistante (XDR-TB) se définissait par une TB-MR/RR résistante à une fluoroquinolone et à au moins un des trois médicaments injectables de deuxième intention (Amikacine, Capréomycine et Kanamycine), et la tuberculose pré-ultrarésistante (Pré-XDR-TB) par une TB-MR/RR résistante à une fluoroquinolone ou à un des trois médicaments injectables de deuxième intention [2]. Ces définitions ont connu une évolution et depuis le 1er janvier 2021 la Pré-XDR-TB se définit comme toute TB-MR/RR résistante aux fluoroquinolones. Quant à la XDR-TB elle correspond à une TB-MR/RR résistante aux fluoroquinolones et à un des médicaments du groupe A (lévofloxacine, moxifloxacine, bédaquiline et linézolide) [3].
Plusieurs facteurs ont contribué à l’apparition et à l’exacerbation de ce phénomène de résistance notamment des schémas thérapeutiques inappropriés, une posologie inférieure à celle recommandée, une qualité douteuse des médicaments, la mauvaise application de la Directly Observed Treatment Short-course (DOTS) [4].
Le nombre de nouveaux cas de TB-pharmaco-résistante détectés dans le monde en 2020 par l’OMS était de 157 903 cas (132 222 cas de TB-MR/RR et 25 681 cas de TB pré-XDR /XDR) et le taux de succès thérapeutique était estimé à 59%.
Au NIGER en 2020, 79 cas de TB-MR/RR ont été confirmés et 71 ont été mis sous traitement, 2 cas de TB pré-XDR /XDR ont été confirmés et mis sous traitement [5].Le Niger fait partie des pionniers de la mise en route du traitement court de la TB-MR/RR. Le régime de traitement court a été développé pour être utilisé dans des contextes présentant un faible niveau de résistance aux médicaments de deuxième ligne. Il a l’avantage d’être court (9-11 mois), peu coûteux et le fait qu’il soit standardisé constitue également un avantage important.
Ainsi, après 10 ans d’activités il nous est paru opportun d’évaluer la prise en charge des patients atteints de la TB multirésistante à l’unité de prise en charge de Niamey.
MÉTHODES
Type et cadre de l’étude
Il s’est agi d’une étude de cohorte rétrospective des patients suivis pour une tuberculose multirésistante. Cette étude a été réalisée au Centre National De Lutte Contre La Tuberculose et les Maladies Respiratoires (CNLT/MR) de Niamey qui est le principal centre de prise en charge des cas de tuberculose multirésistante à Niamey.
Population et période de l’étude
La population cible était l’ensemble des patients atteints de tuberculose multirésistante confirmée par un test génotypique ou phénotypique et pris en charge à l’unité TB-MR de Niamey pendant la période de l’étude.
Étaient inclus les patients mis sous régime court.
Les patients dont les dossiers n’étaient pas retrouvés ont été exclus de l’étude.
Recueil des données
Les données ont été recueillies à partir d’une fiche d’enquête anonyme. La fiche d’enquête a été remplie à partir des informations contenues dans les dossiers médicaux individuels des patients, les fiches individuelles de suivi thérapeutique des patients, le registre de la tuberculose à bacilles résistant du laboratoire national de référence, le registre de traitement de la tuberculose à bacilles résistants de l’unité TB-MR de Niamey.
Définitions opérationnelles
Définitions selon les résultats thérapeutiques pour les patients atteints de TB pharmaco-résistante [6] :
Guérison : le traitement a été mené à bien conformément aux recommandations nationales, sans signe d’échec, et après la phase intensive, trois cultures ou plus ont été réalisées à au moins 30 jours d’intervalle et elles ont donné des résultats négatifs.
Traitement terminé : le traitement a été mené à bien conformément aux recommandations nationales, sans signe d’échec, mais rien n’indique qu’après la phase intensive trois cultures ou plus aient été réalisées à au moins 30 jours d’intervalle et qu’elles aient produit des résultats négatifs.
Décès : le patient meurt pour une raison quelconque au cours du traitement.
Échec thérapeutique : il a été mis fin au traitement ou le schéma doit être modifié pour deux antituberculeux au moins, en raison:
Perdu de vue: patient dont le traitement a été interrompu pendant 2 mois consécutifs ou plus.
Non évalué: patient pour lequel aucun résultat de traitement n’est attribué (cela inclut les patients « transférés » vers une autre unité de traitement et dont le résultat de traitement est inconnu).
Succès thérapeutique: somme des patients guéris et des patients ayant terminé leur traitement.
Protocole thérapeutique utilisée et prise en charge des patients
La prise en charge de la TB-MR est gratuite au Niger.
La prise en charge se fait en ambulatoire hormis pour les cas grabataires qui étaient hospitalisés dans les structures de référence. Le traitement directement observé (TDO) est obligatoire pendant tout le traitement.
Les patients recevaient tous les mois un soutien nutritionnel et financier pour leur transport.
Le système de pharmacovigilance (DSM) est bien en place pour la notification et la prise en charge des effets indésirables.
Le même schéma thérapeutique a été utilisé pour tous les cas de TB-MR/RR :
4-6 Amikacine(Am) - Moxifloxacine (Mfx) ou (Gantifloxacine (Gfx)) – Prothionamide (Pto) –Isoniazide à dose élevée (Hh) – Clofazimine(Cfz) – Ethambutol(E) – Pyrazinamide(Z) /5 Mfx (ou Gfx) – Cfz – E – Z.
Pour les patients TB pré-XDR/XDR-TB, trois régimes thérapeutiques avaient été utilisés en fonction des cas et de la période:
Une évaluation clinique et un prélèvement des crachats pour la bacilloscopie et la culture étaient réalisés chaque mois tout le long du traitement. La glycémie, l’ionogramme sanguin, la fonction hépatique et la fonction rénale ont été évalués chaque mois durant les phases intensives. La fonction de la thyroïde et l’audition ont été évalués au début du traitement et à la fin de la phase intensive. Une radiographique thoracique a été réalisée lors de l’enrôlement et à la fin du traitement, tandis que les tests de grossesse, la sérologie VIH et l’électrocardiogramme (ECG) ont été réalisés lors de l’enrôlement.
Les patients co-infectés par le VIH recevaient, en plus des antituberculeux, des antirétroviraux et du Cotrimoxazole à dose préventive. La première ligne thérapeutique antirétrovirale était constituée de ténofovir, de lamivudine et d’efavirenz selon le protocole du Programme national de lutte contre le VIH au Niger en son temps. Actuellement le protocole en vigueur est : Ténofovir, Lamivudine,Dolutégravir.
Analyse des données
Les données ont été analysées à l’aide du logiciel Epi-info dans sa version 7.2.2.6. La liaison entre les variables qualitatives avait été estimée à l’aide du test statistiques de chi carré de Pearson, le test est statiquement significatif si p-value est inférieure à 0,05.
Considérations éthiques et déontologiques
La confidentialité des informations recueillies à partir des dossiers médicaux et fiches de suivi des patients avait été respectée.
RÉSULTATS
Données générales et sociodémographiques
Sur une période de 10 ans, 5101 cas de tuberculose toutes formes confondues ont été notifiées dont 321 cas de TB- MR/RR (6,3%) et 13 cas de TB-XDR (0,2%). Au total 334 (6,5%) patients avaient été colligés.
Les bacilloscopies et les cultures étaient positives chez tous les patients.
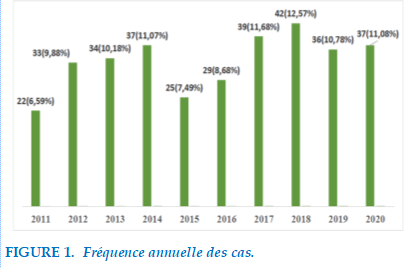
La Figure 1 donne la répartition du nombre de cas de TB pharmacorésistante diagnostiquées de 2011 à 2020. La fréquence la plus élevée était colligé en 2018 avec 42 cas soit 12,57%.
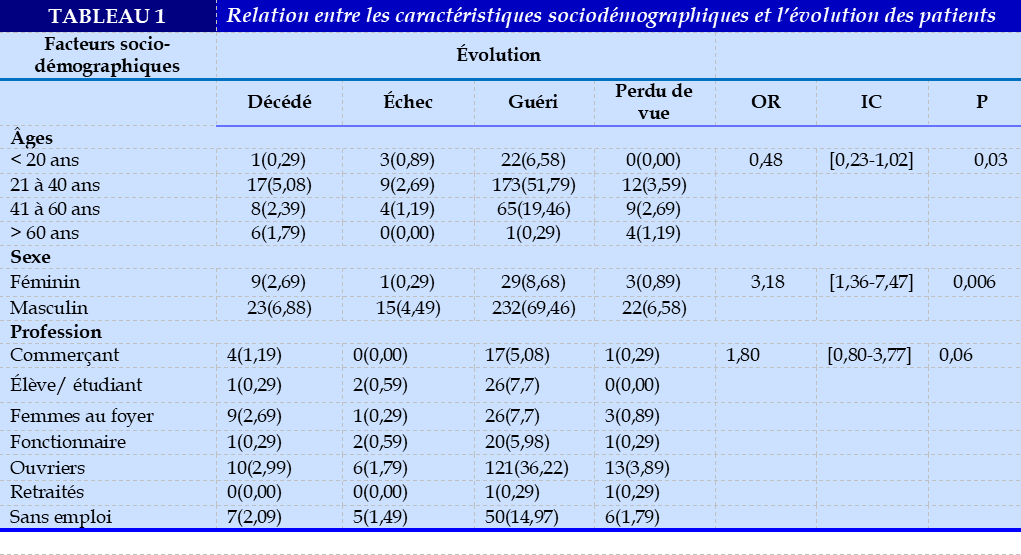
Les patients de sexe masculin représentaient 84,1% (281/334) de l’effectif. La moyenne d’âge des patients était de 35,5 ans ± 13,68 ans avec des extrêmes d’âge de 6 ans et 70 ans (Tableau 1).
Soixante-cinq virgule six pour cent (65,6%) des cas provenaient de la ville de Niamey et les ouvriers représentaient 36,5% de l’effectif.
Données cliniques et paracliniques
Les antécédents de tuberculose étaient retrouvés chez 316 patients (94,6%).
La sérologie VIH était positive chez 6% des patients et 1,5% des patients étaient diabétiques. La dénutrition (IMC< 18,5) a été retrouvée chez 186 patients (55, 7%).Le délai diagnostique moyen était de 7,6 mois avec des extrêmes de 1 mois et 18 mois. Les clichés radiographiques étaient retrouvés chez 295 patients (88%) et les lésions étaient essentiellement alvéolo-interstitielles et bilatérales dans 86,4% des cas. Les résultats de l’audiométrie ont été retrouvés chez 321 patients (96,10%) et une surdité moyenne et sévère avaient été retrouvées dans respectivement 2,8% et 0,3 % des cas.
Données thérapeutiques et évolutives
Tous les patients colligés avaient été mis sous traitement.
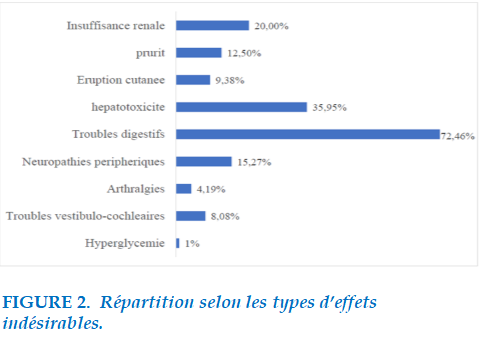
Pour les patients TB-XDR, 3 types de régimes ont été utilisés dont le régime thérapeutique 2 a été utilisé dans 46,2% des cas. La conversion du frottis a été obtenue dès le premier mois chez 36,1 % des patients. A la fin du traitement 17% des patients n’avaient pas convertis leurs frottis et 13,1% des patients n’avaient pas convertis leurs cultures. Des effets indésirables étaient observés dans 92,8% des cas et les troubles digestifs étaient au premier plan (72,5%).Il s’agissait de troubles à type de vomissements, nausées, epigastralgies. La figure 2 donne la répartition des patients selon le type des effets indésirables. Quatre patients (1,2%) avaient présenté des effets indésirables sévères. A l’issue du traitement pour les patients TB-MR/RR, le taux de succès thérapeutique était de 78, 8%, le taux de décès 9% et le taux de perdu de vue à 7,5%. Pour les patients TB-XDR, le taux de succès thérapeutique était de 84, 6% et le taux de perdu de vue de 7,7% .Aucun décès n’avait été enregistré dans ce groupe.
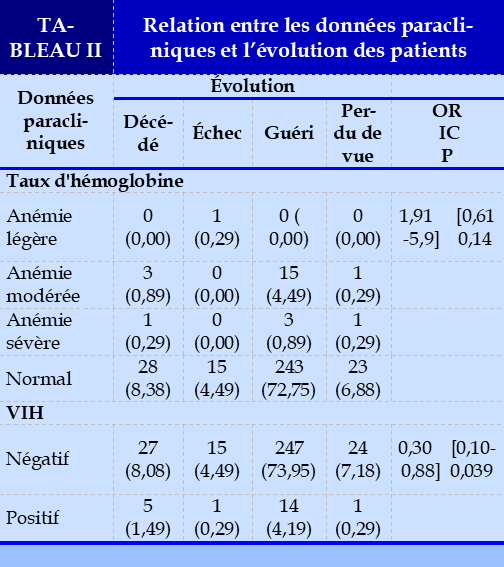
Le nombre de décès était plus fréquent dans la tranche d’âge de 21 à 40 ans avec 5,1% des cas. Il existait un lien statiquement significatif entre l’âge et le décès avec p =0,03.Le tableau I illustre la relation entre les caractéristiques sociodémographiques et l’évolution des patients. Le nombre de décès était significativement plus fréquent chez le sexe masculin ave 6,9%. Il existait un lien significatif entre le décès et le sexe avec p =0,006. Parmi les données paracliniques, la sérologie VIH était significativement liée à l’évolution avec p=0,039. Le tableau II donne la relation entre les données paracliniques et l’évolution des patients.
DISCUSSION
Les limites de notre étude étaient essentiellement liées à son caractère rétrospectif. En effet certaines données étaient incomplètement renseignées notamment les données sociodémographiques (profession), les antécédents (notion de contage, tabagisme, alcoolisme), les données cliniques (signes fonctionnels, délai diagnostic).Cette étude pourrait concerner aussi tous les centres de prise en charge de la tuberculose résistante au Niger.
La fréquence de TB-MR était de 6,3%. Les plus grandes inclusions ont été faites de 2017 à 2020. Ceci s’expliquerait par le fait qu’à partir de 2017 avec l’acquisition des nouvelles machines Xpert, le diagnostic des cas TB-MR a été plus facile. En effet les tests moléculaires ont été utilisés en routine chez les patients présumés TB et TB-MR.
Le sexe masculin prédominait dans 84,1% avec un sexe ratio de 5,30. Cette prédominance masculine dans la population tuberculeuse a été rapportée par plusieurs auteurs. C’est ainsi que Abdoulaye O et al [7] au Niger en 2021 et Harouna S.H et al [8] au Niger en 2018 avaient rapporté respectivement une prédominance masculine dans 83,1% et 84% des cas. Cette prédominance masculine pourrait s’expliquer par le mode de vie des hommes pouvant les exposer plus facilement au bacille tuberculeux: tabagisme, conditions de travail précaire, environnement mal aéré.
L’âge moyen des patients était de 35,5 ans. Notre résultat était proche de ceux de Moussa G [9] au Niger en 2014, Koumbila U.D et al [10] au Gabon en 2021, Elmghari M [11] au Maroc en 2016 qui avaient rapporté respectivement 32ans, 32,6 ans et 36 ans d’âge moyen. Ceci indique que la TB-MR est l’apanage des sujets de la troisième et quatrième décade.
Dans notre série les ouvriers étaient la couche socio-professionnelle la plus représentée avec 36,5%. Cette situation socio-professionnelle faible cadre avec la littérature à propos du profil épidémiologique de la tuberculose multirésistante dans les zones de forte prévalence. En effet la tuberculose est souvent considérée comme une maladie de la pauvreté du fait des conditions de vies des patients défavorables et précaires [12].
Dans notre série, 1,5% de nos patients étaient diabétiques. Selon l’OMS en 2021, le diabète fait partie des 5 facteurs de risque de survenue de la tuberculose, d’où l’intérêt d’un dépistage systématique du diabète dans la population tuberculeuse.
La majorité des patients étaient des échecs de primo-traitement ou de retraitement. Ceci pourrait s’expliquer par le fait que la plupart des patients ne terminent pas le traitement quand ils commencent à se sentir mieux.
Face à ces situations d’abandon, des mesures doivent être prises pour permettre non seulement à ces malades de bien se traiter, mais aussi de ne pas propager cette maladie. Le dépistage systématique des cas de tuberculose par le test Xpert/Rif permettra de dépister précocement les cas de résistance.
Une résistance primaire avaient avait été retrouvée chez 5,4% de nos patients. Cela pourrait s’expliquer par la notion de contage avec le cas index qui était probablement TB-MR diagnostiqué ou non, d’où l’intérêt de dépister précocement les cas de TB et de les mettre sous traitement, il y’a une nécessité de faire aussi une enquête autour des cas.
La sérologie VIH était positive dans 6% des cas. La relation entre la TB et le VIH a été évoquée dans la littérature. Il est prouvé que le VIH est le facteur de risque le plus important dans la survenue de la TB qui elle-même est la première infection opportuniste au cours de l’infection par le VIH [13]. Kenyon et al [14] au Botswana en 1999 rapportaient que l’infection à VIH n’avait pas d’impact sur la survenue de la TB-MR. Cependant, l’inobservance du traitement suite aux nombres importants de comprimés (antirétroviraux et antituberculeux) à avaler avec tous les effets secondaires que cela comporte, pourraient être un facteur de risque de développement de la tuberculose pharmaco-résistante.
La majorité des patients (55,7 %) avait un IMC < 18 kg/m². Cet état nutritionnel est observé dans plusieurs études à des degrés variables [15,16]. Ceci pourrait s’expliquer par le fait que la majorité des patients (316) avaient des antécédents de tuberculose ce qui les expose vers un état cachectique.
Dans notre série la quasi-totalité des patients (86,4%) avaient des lésions bilatérales à la radiographie thoracique. Notre résultat était similaire à celui d’Ahui.B.J.M et al [17] en côte d’ivoire en 2013 qui avait rapporté 87,5% de lésions bilatérales. L’atteinte bilatérale des poumons à la radiographie thoracique démontre la gravité des formes cliniques [12].
Un régime court de 9 mois a été instauré dans notre étude conformément aux nouvelles recommandations de l’OMS publiée en 2016 sur le traitement de la tuberculose multirésistante. Ces recommandations se basaient sur les résultats préliminaires d’études parmi lesquelles celle menée au Bangladesh et qui avait montré un très bon succès thérapeutique (> 80 %) y compris chez les patients infectés par le VIH, avec des effets indésirables relativement limités [18]. Le taux de guérison global sur une période de 10 ans à l’unité TB-MR de Niamey était de 78,8% et était fort encourageant.
Nous avons obtenu la conversion de la culture de nos patients dès le 1er mois de traitement dans 49,66% des cas. L’efficacité du traitement administré aux patients a été apprécié par le délai de négativation de la culture dès le 1er mois, ceci témoigne de la bonne observance du traitement des patients par les prises supervisées des antituberculeux [12].
Quatre-vingt-douze virgule huit pour cent (92,8%) des patients avaient présenté des effets indésirables(EI) avec au premier plan les troubles digestifs (72,5%) à type de vomissements, nausées, epigastralgies. Bien que presque tous les médicaments puissent provoquer des nausées et des vomissements, le Thionamide (Prothionamide ou Ethionamide) en est la principale cause. Même si ces événements ne mettent pas la vie en danger, ils sont une cause importante d'abandon de traitement.
Sur 77 patients évalués, on notait 5,2% (4 patients) d’EI sévères (Hépatotoxicité, troubles vestibulo-cochléaire, troubles digestifs) qui avaient entrainé l’arrêt du traitement et étaient probablement la cause d’abandon de ses patients.
La plupart de ces EI ont été observés au cours des 4 premiers mois du traitement. Ceci peut être dû au nombre de médicaments utilisés pendant la première phase (7 molécules). Ces effets diminuent avec le temps mais peuvent être sévères et nécessiter l’adjonction de traitements complémentaires symptomatiques, voire la modification du régime thérapeutique.Tous les schémas thérapeutiques de la TB-MR provoquent des EI plus ou moins sévères, et l'OMS recommande la mise en place d'une pharmacovigilance et la collecte d'informations sur la DSM (surveillance et gestion actives de la sécurité des médicaments) des EI (effets indésirables) [19].
Les méthodes de définition et de surveillance des EI diffèrent, mais la plupart des études utilisent des échelles internationales pour évaluer la gravité. Nous avions utilisé l’échelle de l’Agence Nationale et de Recherche sur le Sida (ANRS) [20].
Le taux de perdu de vue dans notre série était de 7,5%.Ce taux élevé pourrait s’expliquer par la survenue de beaucoup d’effets indésirables au cours du traitement. En effet 92,8% des patients avaient présenté des effets indésirables.
Dans notre étude, nous avons enregistrée 9% de décès. Il existait un lien statiquement significatif entre le décès, l’âge (p=0, 03) et le sexe masculin (p=0, 006).Cette mortalité serait multifactorielle comme l’expliquerait certains auteurs qui citent entre autres : le retard de diagnostic et de la prise en charge ; Les lésions pulmonaires diffuses et les autres comorbidités [12].
CONCLUSION
L’évaluation du régime court au cours de notre étude nous permet d’affirmer que les adultes jeunes de sexe masculin étaient les plus touchés, la majorité des patients provenaient de la communauté urbaine de Niamey, avec pour la plupart un antécédent d’échec de traitement. Les résultats du régime de traitement court sont fort encourageants ; en plus du taux de guérison élevé, il a aussi l’avantage d’être court et peu coûteux. Ce régime est accompagné de nombreux effets indésirables qui nécessitent une surveillance régulière mais qui reste gérables. Cependant les nouvelles directives de l’OMS préconisent un régime long entièrement oral. Il serait judiciable de mener des vastes essais cliniques au vue des résultats probants du régime court.
CONFLICTS D”INTERET
Aucun.
REFERENCE
| 1. Organisation mondiale de la sante. Rapport sur la lutte contre la tuberculose dans le monde. Genève: OMS; 2016 (Consulté le 26/10/23) [En ligne] Disponible sur http://www.who.int/tb/publications/global_report/fr/. |
| 2. World Health Organization. Global TB Report. WHO/HTM/TB/2020.20. Geneva, Switzerland: WHO, 2020. (Consulté le 26/11/23) [En ligne] Disponible sur http://www.who.int/tb/publications/global_report/fr/ |
| 3. World Health Organization. Concept note: Expert Consultation on the definition of extensively drug resistant tuberculosis 27-29 October 2020 Global TB Programme. Geneva, Switzerland: WHO, 2020. |
| 4. Kim DH, Kim HJ, Park S.K, et al. Treatment outcomes and survival based on drug resistance patterns in multidrug-resistant tuberculosis. Am J Respir Crit Care Med. 1 juill 2010; 182(1):113‑9. |
| 5. Global tuberculosis report 2021 (Consulté le 26/10/22) [En ligne] Disponible sur http:www.who.int. |
| 6. Organisation Mondiale de la Santé (OMS). Définitions et cadre de notification pour la tuberculose. Révision 2013 (Mise à jour Décembre 2014). WHO/HTM/TB/2013.2 Geneva, Switzerland. |
| 7. Abdoulaye O, Yaou M. M, Yacouba A. Prévalence et facteurs prédictifs de la résistance aux antituberculeux de 2eme ligne chez les patients tuberculeux résistants à la rifampicine au Niger. Rev Mali infect Microbiol 2021, Vol 16 N°3: 88-92 . |
| 8. Harouna S.H, Ortuno- Gutierrez N, Souleymane M.B. Short – course Treatment out comes and adverse events in adults and children- adolescents With MDR- TB in Niger.INT J TUBERC LUNG Dis 23 (5): 625-630. |
| 9. Moussa Garba Almou. Devenir des patients traités contre la tuberculose Multirésistante après la phase de continuation à l’unité TB-MR au Niger Etude rétrospective à propos de 65 patients de Juillet 2008 à décembre 2010. Thèse : Med, Université Abdou Moumouni de Niamey ,2014. N°2298. 57p |
| 10. Koumbila U.D, Boulingui M.C, Ibinga D.L. Difficultés et obstacles dans la prise en charge de la tuberculose Multirésistante au Centre Hospitalier et Universitaire de Libreville. Etude rétrospective de 2017-2020.Health sci. Dis: vol 22 (11) Novembre 2021: 46-50 |
| 11. Elmghari M, Zaghba N, Benjelloun H. Tuberculose Multirésistante. Revue des Maladies Respiratoires2017.Vol34.P.A218. [En ligne] Disponible sur Http://dx.doi/10.1016/j.rmr.2016.10.519. |
| 12. Ouédraogo S. M, Ouédraogo A. R, Birba Emile. Tuberculose multirésistante à Bobo-Dioulasso: Aspects épidémiologiques, cliniques, radiologiques et évolutifs. RAFMI:2014,1 (2): 1- 44 |
| 13. Organisation Mondiale de la Santé. TB/VIH Manuel clinique 2ième Ed. WHO/HTM/TB/2004.329. Genève . |
| 14. Kenyon A, Mwasekaga J, Huebner R. Faible taux de résistance médicamenteuse dans un environnement de progression rapide de co-épidémies tuberculose et VIH au Bostwana. Int J Tuberc Lung Dis. 1999; 3 :4-11 |
| 15. Kuaban C, Noeske J, Rieder HL, Aït-Khaled N, Abena Foe JL,Trébucq A. High effectiveness of a 12-month regimen for MDR-TB patients in Cameroon. Int J Tuberc Lung Dis. 2015 May;19(5):517-24 |
| 16. Piubello A, Harouna SH, Souleymane MB, Boukary I, Morou S, Daouda M, Hanki Y, Van Deun A. High cure rate with standardised short-course multidrug-resistant tuberculosis treatment in Niger: no relapses. Int J Tuberc Lung Dis. 2014 Oct;18(10):1188-94. |
| 17. Ahui B.J.M, Horo K, Bakayoko A.S. Evaluation du traitement de la tuberculose multirésistante en côte d’ivoire de 2008 à 2010. Rev ES (2013) 69: 315-319. |
| 18. Bulletin de la tuberculose en Afrique francophone. 2016, numéros 1-7, juillet 2013-juillet 2016. https://dokumen.tips/documents/ bulletin-tb-afrique francophone.html [Consulté le 26/03/2024]. |
| 19. Borisov S , Danila E , Maryandyshev A . Surveillance des événements indésirables dans le traitement des Tuberculose résistante: premier rapport mondial. EUR. Respir. J. 2019 |
| 20. ANRS. Echelle ANRS de cotation de la gravité des évènements indésirables chez l’adulte. Version numéro 6 du 09 Septembre 2003. [Cité 17 août 2023]. Disponible sur: http://www.anrs.fr/sites/default/files/201707/fr_anrs_grade_ei_v6_2003.pdf |
TABLE - FIGURES
REFERENCE
| 1. Organisation mondiale de la sante. Rapport sur la lutte contre la tuberculose dans le monde. Genève: OMS; 2016 (Consulté le 26/10/23) [En ligne] Disponible sur http://www.who.int/tb/publications/global_report/fr/. |
| 2. World Health Organization. Global TB Report. WHO/HTM/TB/2020.20. Geneva, Switzerland: WHO, 2020. (Consulté le 26/11/23) [En ligne] Disponible sur http://www.who.int/tb/publications/global_report/fr/ |
| 3. World Health Organization. Concept note: Expert Consultation on the definition of extensively drug resistant tuberculosis 27-29 October 2020 Global TB Programme. Geneva, Switzerland: WHO, 2020. |
| 4. Kim DH, Kim HJ, Park S.K, et al. Treatment outcomes and survival based on drug resistance patterns in multidrug-resistant tuberculosis. Am J Respir Crit Care Med. 1 juill 2010; 182(1):113‑9. |
| 5. Global tuberculosis report 2021 (Consulté le 26/10/22) [En ligne] Disponible sur http:www.who.int. |
| 6. Organisation Mondiale de la Santé (OMS). Définitions et cadre de notification pour la tuberculose. Révision 2013 (Mise à jour Décembre 2014). WHO/HTM/TB/2013.2 Geneva, Switzerland. |
| 7. Abdoulaye O, Yaou M. M, Yacouba A. Prévalence et facteurs prédictifs de la résistance aux antituberculeux de 2eme ligne chez les patients tuberculeux résistants à la rifampicine au Niger. Rev Mali infect Microbiol 2021, Vol 16 N°3: 88-92 . |
| 8. Harouna S.H, Ortuno- Gutierrez N, Souleymane M.B. Short – course Treatment out comes and adverse events in adults and children- adolescents With MDR- TB in Niger.INT J TUBERC LUNG Dis 23 (5): 625-630. |
| 9. Moussa Garba Almou. Devenir des patients traités contre la tuberculose Multirésistante après la phase de continuation à l’unité TB-MR au Niger Etude rétrospective à propos de 65 patients de Juillet 2008 à décembre 2010. Thèse : Med, Université Abdou Moumouni de Niamey ,2014. N°2298. 57p |
| 10. Koumbila U.D, Boulingui M.C, Ibinga D.L. Difficultés et obstacles dans la prise en charge de la tuberculose Multirésistante au Centre Hospitalier et Universitaire de Libreville. Etude rétrospective de 2017-2020.Health sci. Dis: vol 22 (11) Novembre 2021: 46-50 |
| 11. Elmghari M, Zaghba N, Benjelloun H. Tuberculose Multirésistante. Revue des Maladies Respiratoires2017.Vol34.P.A218. [En ligne] Disponible sur Http://dx.doi/10.1016/j.rmr.2016.10.519. |
| 12. Ouédraogo S. M, Ouédraogo A. R, Birba Emile. Tuberculose multirésistante à Bobo-Dioulasso: Aspects épidémiologiques, cliniques, radiologiques et évolutifs. RAFMI:2014,1 (2): 1- 44 |
| 13. Organisation Mondiale de la Santé. TB/VIH Manuel clinique 2ième Ed. WHO/HTM/TB/2004.329. Genève . |
| 14. Kenyon A, Mwasekaga J, Huebner R. Faible taux de résistance médicamenteuse dans un environnement de progression rapide de co-épidémies tuberculose et VIH au Bostwana. Int J Tuberc Lung Dis. 1999; 3 :4-11 |
| 15. Kuaban C, Noeske J, Rieder HL, Aït-Khaled N, Abena Foe JL,Trébucq A. High effectiveness of a 12-month regimen for MDR-TB patients in Cameroon. Int J Tuberc Lung Dis. 2015 May;19(5):517-24 |
| 16. Piubello A, Harouna SH, Souleymane MB, Boukary I, Morou S, Daouda M, Hanki Y, Van Deun A. High cure rate with standardised short-course multidrug-resistant tuberculosis treatment in Niger: no relapses. Int J Tuberc Lung Dis. 2014 Oct;18(10):1188-94. |
| 17. Ahui B.J.M, Horo K, Bakayoko A.S. Evaluation du traitement de la tuberculose multirésistante en côte d’ivoire de 2008 à 2010. Rev ES (2013) 69: 315-319. |
| 18. Bulletin de la tuberculose en Afrique francophone. 2016, numéros 1-7, juillet 2013-juillet 2016. https://dokumen.tips/documents/ bulletin-tb-afrique francophone.html [Consulté le 26/03/2024]. |
| 19. Borisov S , Danila E , Maryandyshev A . Surveillance des événements indésirables dans le traitement des Tuberculose résistante: premier rapport mondial. EUR. Respir. J. 2019 |
| 20. ANRS. Echelle ANRS de cotation de la gravité des évènements indésirables chez l’adulte. Version numéro 6 du 09 Septembre 2003. [Cité 17 août 2023]. Disponible sur: http://www.anrs.fr/sites/default/files/201707/fr_anrs_grade_ei_v6_2003.pdf |
ARTICLE INFO DOI: 10.12699/jfvpulm.15.47.2024.31
Conflict of Interest
Non
Date of manuscript receiving
20/06/2024
Date of publication after correction
25/11/2024
Article citation
Halidou Moussa, MA. Gagara Issoufou, M. Bassirou Souleymane, A. Cheikh Aboubacar, P.Tchibara Kougbada, D. Maizoumbou, M. Ouédraogo. Evaluation of the cost of care of patients with multidrug resistant tuberculosis at the Niamey Unit, Niger. J Func Vent Pulm 2024;47(15):31-37