
 English
English
 French
French
Spontaneous endometriotic hemothorax - A difficult diagnosis in a former tuberculosis patient
L’hémothorax spontané endométriosique - Un diagnostic difficile chez une ancienne tuberculeuse
Rachid Benchanna₁, Rachid Bouchentouf₁, Abdelfattah Zidane₂, Hicham Janah₁, Jamal Oujaber₁, Soufiane Sassi₁, Amine Benjelloune₁
1: Service de pneumologie Hôpital Militaire Avicenne Marrakech
2: Service de chirurgie thoracique Hôpital Militaire Avicenne Marrakech
Corresponding author: Rachid Benchanna. Service de pneumologie Hôpital Militaire Avicenne Marrakech
E-mail: rachid.benchanna@hotmail.com
ABSTRACT
Introduction. Thoracic endometriosis is the ectopic presence of endometrial tissue in the thoracic cavity. The most common form is catamenial pneumothorax, accounting for approximately 75% of cases. Endometriotic hemothorax is a less frequent form and is exceptionally complicated by a hemopneumothorax. The authors report a new case of endometriotic hemothorax complicated by a hemopneumothorax, which was difficult to diagnose in a patient with a history of tuberculosis.
Observation. The patient was 30 years old and had a history of pulmonary tuberculosis. The time between symptom onset and diagnosis was almost two years. Symptoms were dominated by dyspnea, chest pain, pelvic pain, and a decline in general health status. Emergency drainage of a large right-sided hemothorax resulted in a complication of hydropneumothorax. Investigation for a relapse of tuberculosis was negative. Thoracoscopy established the diagnosis of pleural endometriosis, leading to surgical treatment including pleurectomy, atypical resection of the right apical lung, and pleural symphysis. Post-surgical management included hormonal treatment with Triptorelin 3 mg/month for three months and continuous combined therapy with Dienogest (0.2 mg) and Ethinylestradiol (0.03 mg), resulting in favorable outcomes.
Conclusion. Through this case, the authors emphasize the importance of diagnostic thoracoscopy in cases of spontaneous hemothorax of unknown etiology, with comprehensive sampling for bacteriological and histopathological examinations.
KEYWORDS: Endometriosis; Hemopneumothorax; Tuberculosis; Thoracoscopy.
RÉSUMÉ
Introduction. L’endométriose thoracique est l’ectopie de l’endomètre au niveau du thorax. La forme la plus fréquente est le pneumothorax cataménial qui représente environ 75%. L’hémothorax endométriosique est une forme peu fréquente exceptionnellement compliqué d’un hémopneumothorax.
Les auteurs rapportent une nouvelle observation d’un hémothorax endométriosique compliqué d’un hémopneumothorax de diagnostic difficile, chez une ancienne tuberculeuse.
Patient et observation. L’âge de la patiente était de 30 ans, elle avait un antécédent de tuberculose pulmonaire. Le délai entre le début des symptômes et le diagnostic était presque de deux ans. La symptomatologie était dominée par la dyspnée, les douleurs thoraciques et pelviennes et l’altération de l’état général. Le drainage thoracique en urgence d’un hémothorax droit de grande abondance s’est compliqué d’un hydropneumothorax. La recherche d’une rechute tuberculeuse était négative. La thoracoscopie a posé le diagnostic de l’endométriose pleurale, avec indication d’un traitement chirurgical de type pleurectomie et résection atypique apicale droite et une symphyse pleurale, puis un traitement hormonal à base de Triptoréline 3 mg/mois pendant 3 mois, et un oestroprogestatif (Diénogest 0,2 mg + Ethinylestradiol 0,03) en continu, avec une évolution favorable.
Conclusion. A travers ce cas, les auteurs insistent sur l’intérêt de la thoracoscopie diagnostique devant un hémothorax spontané d’étiologie inconnu avec multiplicité des prélèvements pour des examens bactériologiques et anatomopatho -logiques.
MOTS CLÉS: Endométriose; Hémopneumothorax; Tuberculose; Thoracoscopie.
INTRODUCTION
L’endométriose est l’ectopie du tissu endométriale en dehors de l’utérus. Les localisations les plus fréquentes sont : le péritoine pelvien ou l’endométriose superficielle, l’ovaire ou l’endométriome, et l’espace rétro péritonéal avec l’atteinte des organes pelviens réalisant l’endométriose profonde [1], notamment les localisations rectrosigmoïdienne, vésicale, iléo caecale et appendiculaire.
L’atteinte pleuropulmonaire est peu fréquente, elle peut être isolée, ou associée à une localisation pelvienne.
Le syndrome d’endométriose thoracique est l’ensemble des manifestations cliniques et radiologiques de l’atteinte endométriosique pleurale, bronchique, parenchymateuse, péricardique, diaphragmatique ou pariétale.
L’hémothorax endométriosique est une entité peu fréquente, et constitue environ 15 % de l’atteinte thoracique. L’association spontanée à un pneumothorax reste exceptionnelle [2].
Les auteurs rapportent une nouvelle observation d’un hémothorax endométriosique compliqué d’un hémopneumothorax, chez une femme en âge de procréer, ancienne tuberculeuse, et dont le diagnostic étiologique évoquerait initialement une rechute tuberculeuse.
OBSERVATION
Information de la patiente: Il s’agit d’une patiente âgée de 30 ans célibataire cuisinière.
Elle a comme antécédent une tuberculose pulmonaire confirmée bactériologiquement en 2007 traitée pendant six mois selon le protocole 2RHZE/4RH et déclarée guérie à la fin du traitement.
Elle consulte pour une dyspnée chronique depuis 2 ans dans un contexte d’altération de l’état général.
Résultats cliniques : L’examen clinique initial trouve une patiente en mauvais état général, avec un poids à 55 kg pour une taille de 1,72m et un IMC à 18 Kg/m2.
La saturation est à 94% à l’air ambiant, avec une tension artérielle normale et un pouls à 95bpm.
L’examen pleuropulmonaire trouve une matité de l’hémithorax droit, une abolition de la perception des murmures vésiculaires et de la transmission des vibrations vocales du même côté.
L’examen de l’abdomen et de l’air ganglionnaire trouve une matité des deux flancs déclive avec une adénopathie sus-claviculaire droite.
Le reste de l’examen somatique est sans particularité.
Chronologie: L’histoire de sa maladie remonte en Mars 2019, par l’installation progressive d’une dyspnée d’effort, avec une douleur basithoracique droite et pelvienne intermittente, accompagnée d’une toux sèche et nocturne, dans un contexte de sueurs nocturnes, fièvre vespérale et altération de l’état général avec un amaigrissement chiffré à 17 kg en 02 ans.
En Mars 2021 le diagnostic d’un hémothorax de grande abondance a été posé avec mise en place d’un drain thoracique.
Au 4ème jour du drainage thoracique le contrôle radiologique montre un hyro-pneumothorax de moyenne abondance.
Le diagnostic de l’endométriose pleurale a été posé au 10ème jour du drainage par thoracoscopie chirurgicale.
A un mois du recollement du poumon à la paroi, l’évolution était marquée par la récidive de l’hémopneumothorax droit, ce qui a motivé une prise en charge médicochirurgicale.
L’évolution était favorable avec un contrôle clinique et radiologique tous les six mois.
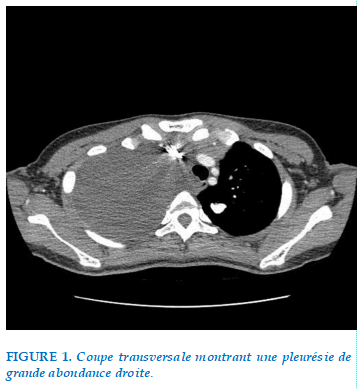
Démarche diagnostique: Devant la présentation clinique initiale, on a demandé une TDM thoraco-abdomino-pelvienne qui a montré un épanchement pleural droit de grande abondance avec atélectasie passive du poumon, déviation médiastinal et un épanchement péritonéal de moyenne abondance (Figure 1).
La ponction pleurale exploratrice a montré un aspect hématique avec un sang coagulable, en l’absence d’une notion de traumatisme thoracique récent, ce qui a motivé l’hospitalisation de la patiente et la mise en place d’un drain thoracique axillaire en siphonage, ayant ramené 3 l de liquide brun hématique en 4h avec apparition de bullage.
L’analyse biochimique du liquide pleural montre un liquide exudatif avec 60 g/l de protides, des leucocytes incomptables, et de nombreuses sidérophages sans germe à la culture aérobie et anaérobie, avec l’absence de mycobactérium tuberculosis qui a été recherché par PCR.
L’hémogramme montre une hémoglobine à 10,1 g/dl, des leucocytes à 8,8 GIGA, et des plaquettes à 364 GIGA. Le TP est à 97% et une CRP négative.
Une biopsie ganglionnaire sus claviculaire droite a été réalisé mais elle était non contributive.
La recherche des BK à l’expectoration et au lavage broncho-alvéolaire par PCR (EXPERT MTB RIF) était négative.
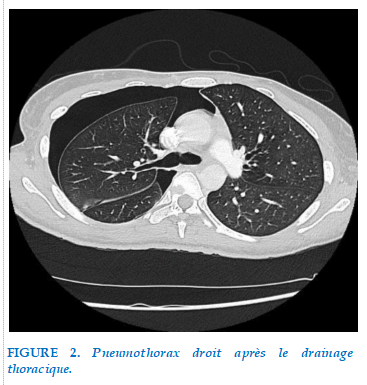
Le contrôle radiologique au 4ème jour de la mise en place du drain montre un pneumothorax droit de moyenne abondance (Figure 2), puis un hydo-pneumothorax du même côté.
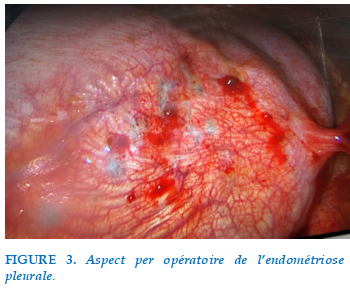
Il a été décidé de réaliser une thoracoscopie à visée diagnostique, et qui a montré un aspect macroscopique parsemé blanchâtre de siège pleural, pariétal et diaphragmatique (Figure 3), dont l’examen anatomopathologique des biopsies montre la présence d’une petite formation glandulaire bordée d’un revêtement cylindrique unistratifié de type endométrial, entouré d’une fine couronne de chorion siège de suffusions hémorragiques. En immunohistochimie, ce revêtement épithélial est marqué par la CK AE1/AE3 (Cytokeratin) et RO (Estrogen Receptor), sans marquage par la Calrétinine. Les cellules du chorion au pourtour sont marquées par CD 10.
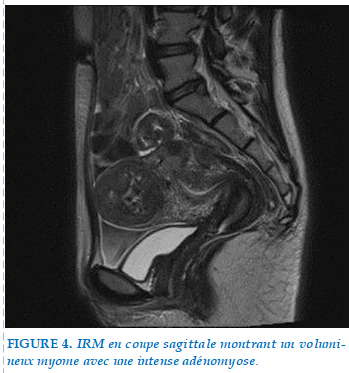
On a posé le diagnostic d’une endométriose thoracique, et on a complété par une IRM pelvienne et qui a montré la présence d’implants endométriosiques sur la séreuse utérine avec un épanchement péritonéal et une adénomyose intense et des myomes utérins (Figure 4).
Intervention thérapeutique et suivi: L’évolution était marquée par la récidive de l’hémopneumothorax après une période de rémission et recollement du poumon à la paroi, ce qui a posé l’indication d’une symphyse pleurale par talcage sous thoracotomie, avec résection atypique de l’apex et une pleurectomie apicale.
On a complété par un traitement hormonal à base de Triptoréline 3 mg/mois pendant 3 mois, et un oestroprogestatif (Diénogest 0,2 mg + Ethinylestradiol 0,03) en continu.
Le contrôle clinique et radiologique à six mois de l’intervention chirurgicale était favorable avec une prise pondérale, et absence de récidive de l’hydropneumothorax.
DISCUSSION
Le syndrome d’endométriose thoracique est l’ensemble des manifestations cliniques et radiologiques en rapport avec la localisation ectopique de l’endomètre sur les structures anatomiques endothoracique. Le pneumothorax cataménial est la forme clinique la plus fréquente avec près de 73% de l’ensemble des formes thoraciques, suivi d’hémothorax cataménial de 14%, l’hémoptysie cataméniale de 7% et le nodule pulmonaire endométriosique de 6% [3].
Il a été rajouté à ces entités anatomo clinique, quelques cas isolés de douleur thoracique cataméniale et des hernies diaphragmatiques [2].
Les manifestations cliniques de ces atteintes peuvent être isolées, associées, cataméniales ou se produire en dehors des règles, elles peuvent avoir un caractère évolutif l’un vers l’autre, [4] comme c’est le cas de l’hémothorax rapporté qui s’est compliqué d’un hémopneumothorax.
L’endométriose pelvienne est une maladie fréquente, estimée à 15 % des femmes en âge de procréer [5], inversement à la localisation thoracique qui reste peu fréquente, sous diagnostiquée, et dont les données épidémiologiques proviennent des séries ou des cas cliniques isolés [2].
La voie par laquelle le tissu endométriosique gagne le thorax reste controversée. On a proposé trois théories essentielles : la métaplasie cœlomique (transformation des cellules péritonéales pluripotentes qui dériveraient du tissu embryologique cœlomique en un tissu endométriale), l’embolisation lymphatique ou hématogène, et les menstruations rétrogrades [6].
Ce dernier mécanisme étiopathogénique, traduit une migration menstruelle du tissu endométrial par voie péritonéale puis transdiaphragmatique pour s’implanter au niveau du thorax. Le trajet des fluides passe du pelvis à travers la gouttière pariéto colique droite vers l’espace sous diaphragmatique droit, puis à travers des déhiscences congénitales, ce qui explique en grande partie la fréquence des localisations pulmonaires droites comme c’est le cas de notre patiente [7].
La physiopathologie de l’hémothorax est surtout en rapport avec un saignement des implants pleuraux hyper vascularisés, mais aussi du au passage intravasculaire brusque des fluides avec éclatement des capillaires [8].
L’hémothorax est la présence du sang dans la cavité pleurale coagulable lors de la ponction exploratrice. Il peut être spontané ou d’origine traumatique.
La forme spontanée est une urgence diagnostique et thérapeutique par la mise en place d’un drain thoracique, la correction des troubles de la crase sanguine le cas échéant, et un bon remplissage avec une surveillance hémodynamique. Les symptômes sont peu spécifiques : Dyspnée, douleur thoracique, toux avec parfois un choc hypovolémique [9]. L’étiologie dans ce cas est surtout tumorale, tuberculeuse ou en rapport avec certaines hémopathies comme la thrombophilie.
L’hémothorax endométriosique est une forme rare et le plus souvent localisé à droite, exceptionnellement à gauche ou associer à un pneumothorax [2].
Notre patiente présentait initialement un hémothorax droit de grande abondance, laissant penser à une origine tuberculeuse en premier lieu. Un hémopneumothorax compliquait le tableau clinique et le diagnostic définitif n’était qu’anatomopathologique après une biopsie sous thoracoscopie chirurgicale.
La vidéothoracoscopie est la pierre angulaire du diagnostic, avec une exploration de la plèvre pariétale, viscérale, le poumon et le diaphragme. L’aspect est souvent brun ou violet avec parfois des perforations millimétriques [10] [11].
La mise en évidence à la coloration de Hématéine Eosine Safran (HES) des glandes endométriales entourées d’un chorion cytogène pose le diagnostic. En présence d’une atypie histologique, on a recours à l’immunohistochimie en marquant les récepteurs de l’œstrogène et de la progestérone pour les glandes, et le CD10 marquant le chorion [12].
Le traitement pharmacologique de l’endométriose est essentiellement hormonal à base d’estroprogestatifs, progestatifs, agonistes de la GnRH et le Danazol.
D’autres traitements dont les résultats sont controversés peuvent être discutés comme les antiaromatases et les modulateurs sélectifs des récepteurs à la progestérone [1].
Une étude rétrospective a comparé l’association de 20 mg d’éthinylestradiol et de 3 mg de drospirénone chez 75 femmes à l’absence d’un traitement hormonal chez 31 femmes, toutes atteintes d’endométriose profonde. Les douleurs et la taille des nodules endométriosique étaient stables dans le groupe traité contre une augmentation marquée dans le groupe non traité [13].
Les effets secondaires sont généralement une prise de poids, des céphalées, risque faible de maladie thromboembolique veineuse, des troubles digestifs et des spottings.
L’utilisation prolongée des agonistes de la GnRH provoquent la castration chimique en provoquant un hypogonadisme hypogonadotrope. Trois molécules principales reconnues dans le traitement de l’endométriose : la triptoréline, la leuproréline, et la nafaréline [1]. Une méta-analyse a montré que les agonistes de la GnRH sont quatre fois plus efficace sur la douleur que l’abstention thérapeutique. En revanche la durée et la dose du traitement n’est pas codifié [14]. Dans la série colligée par Joseph et Sahn [3], les taux de récidives du pneumothorax endométriosique à six mois était de 50 %, et à 12 mois était de 60 % pour un traitement médical seul, d’où l’intérêt d’un traitement médico-chirurgical.
La résection diaphragmatique partielle et de toute lésion macroscopiquement suspecte de greffe endométriosique doit être réalisée. Une symphyse pleurale par talcage est aussi indiquée en même temps chirurgical [2] [15].
CONCLUSION
L’endométriose thoracique est une forme rare qui peut être associée ou non à une localisation pelvienne.
L’hémothorax endométriosique compliqué d’un hémopneumothorax est peut décrit, de diagnostic difficile, nécessitant souvent le recours à la thoracoscopie.
Le traitement médical hormonal de cette entité clinique est similaire à la forme pelvienne malgré l’absence des recommandations précises.
En raison de la fréquence des récidives et des implantations microscopiques du tissu endométrial, la chirurgie avec une résection des structures macroscopiquement atteintes associée à une symphyse pleurale sont indiquées.
CONFLITS D’INTERETS
Les auteurs ne déclarent aucun conflit d’intérêt.
REFERENCE
| 1. Azoulay C, Bardy C, Lasserre M, Brun JL. Traitements médicamenteux de l’endométriose (adénomyose exclue). EMC - Gynécologie 2017;12(4):1-14 |
| 2. Bobbio A, Mansuet-Lupo A, Damotte D, Alifano M. Endométriose thoracique. EMC - Pneumologie 2018;15(4):1-9 |
| 3. Joseph J, Sahn SA. Thoracic endometriosis syndrome: new observations from an analysis of 110 cases. Am J Med 1996;100:164–70. |
| 4. Alifano M, Roth T, Camilleri-Broet S, Schussler O, Magdeleinat P, Regnard JF. Catamenial pneumothorax. A prospective study. Chest 2003;124:1004–8. |
| 5. Olive DL, Schwartz LB. Endometriosis. N Engl J Med 1993;328: 1759–69. |
| 6. Legras A, Mansuet-Lupo A, Rousset-Jablonski C, Bobbio A, Mag-deleinat P, Roche N, et al. Pneumothorax in women of child-bearing age: an update classification based on clinical and pathologic findings. Chest 2014;145:354–60. |
| 7. Sampson JA. Peritoneal endometriosis due to the menstrual dissemi-nation of endometrial tissue into the peritoneal cavity. Am J Obstet Gynecol 1927;14:422–69. |
| 8. Foster DC, Stern JL, Buscema J, Rock JA, Woodruff JD. Pleu-ral and parenchymal pulmonary endometriosis. Obstet Gynecol 1981;58:552–6. |
| 9. G. Vuvan, T Phung Thi. The clinical and paraclinical of the pneumothorax xith respiratoru failure in respiratory center bach Mai Hospital. J Fran Vitet Pneu 2016 ; 20(7) : 1-78 |
| 10. Rousset-Jablonski C, Alifano M, Plu-Bureau G, Camilleri-Broet S, Rousset P, Regnard JF, et al. Catamenial pneumothorax and endometriosis-related pneumothorax: clinical features and risk factors. Hum Reprod 2011;26:2322–9. |
| 11. S. Rabiou et col. Management of spontaneous hemothorax and hemopneumothorax. J Func Vent pulm 2018; 28(9). |
| 12. Flieder DB, Moran CA, Travis WD, Koss MN, Mark EJ. Pleuro-pulmonary endometriosis and pulmonary ectopic deciduosis: a clinico-pathologic and immunohistochemical study of 10 cases with emphasis on diagnostic pitfalls. Hum Pathol 1998;29:1495–503. |
| 13. Mabrouk M, Frascà C, Geraci E, Montanari G, Ferrini G, Raimondo D, et al. Combined oral contraceptive therapy in women with posterior deep infiltrating endometriosis. J Minim Invasive Gynecol 2011;18:470–4. |
| 14. Brown J, Pan A, Hart RJ. Gonadotrophin-releasing hormone analogue for pain associated with endometriosis. Cochrane Database Syst Rev 2010, (12): CD008475. |
| 15. J A. Farin Correa et al. Thoracic endometroosis: about three cases. J Func Vent pulm 2018; 26 (9): 44-48. |
TABLE - FIGURES
REFERENCE
| 1. Azoulay C, Bardy C, Lasserre M, Brun JL. Traitements médicamenteux de l’endométriose (adénomyose exclue). EMC - Gynécologie 2017;12(4):1-14 |
| 2. Bobbio A, Mansuet-Lupo A, Damotte D, Alifano M. Endométriose thoracique. EMC - Pneumologie 2018;15(4):1-9 |
| 3. Joseph J, Sahn SA. Thoracic endometriosis syndrome: new observations from an analysis of 110 cases. Am J Med 1996;100:164–70. |
| 4. Alifano M, Roth T, Camilleri-Broet S, Schussler O, Magdeleinat P, Regnard JF. Catamenial pneumothorax. A prospective study. Chest 2003;124:1004–8. |
| 5. Olive DL, Schwartz LB. Endometriosis. N Engl J Med 1993;328: 1759–69. |
| 6. Legras A, Mansuet-Lupo A, Rousset-Jablonski C, Bobbio A, Mag-deleinat P, Roche N, et al. Pneumothorax in women of child-bearing age: an update classification based on clinical and pathologic findings. Chest 2014;145:354–60. |
| 7. Sampson JA. Peritoneal endometriosis due to the menstrual dissemi-nation of endometrial tissue into the peritoneal cavity. Am J Obstet Gynecol 1927;14:422–69. |
| 8. Foster DC, Stern JL, Buscema J, Rock JA, Woodruff JD. Pleu-ral and parenchymal pulmonary endometriosis. Obstet Gynecol 1981;58:552–6. |
| 9. G. Vuvan, T Phung Thi. The clinical and paraclinical of the pneumothorax xith respiratoru failure in respiratory center bach Mai Hospital. J Fran Vitet Pneu 2016 ; 20(7) : 1-78 |
| 10. Rousset-Jablonski C, Alifano M, Plu-Bureau G, Camilleri-Broet S, Rousset P, Regnard JF, et al. Catamenial pneumothorax and endometriosis-related pneumothorax: clinical features and risk factors. Hum Reprod 2011;26:2322–9. |
| 11. S. Rabiou et col. Management of spontaneous hemothorax and hemopneumothorax. J Func Vent pulm 2018; 28(9). |
| 12. Flieder DB, Moran CA, Travis WD, Koss MN, Mark EJ. Pleuro-pulmonary endometriosis and pulmonary ectopic deciduosis: a clinico-pathologic and immunohistochemical study of 10 cases with emphasis on diagnostic pitfalls. Hum Pathol 1998;29:1495–503. |
| 13. Mabrouk M, Frascà C, Geraci E, Montanari G, Ferrini G, Raimondo D, et al. Combined oral contraceptive therapy in women with posterior deep infiltrating endometriosis. J Minim Invasive Gynecol 2011;18:470–4. |
| 14. Brown J, Pan A, Hart RJ. Gonadotrophin-releasing hormone analogue for pain associated with endometriosis. Cochrane Database Syst Rev 2010, (12): CD008475. |
| 15. J A. Farin Correa et al. Thoracic endometroosis: about three cases. J Func Vent pulm 2018; 26 (9): 44-48. |
ARTICLE INFO DOI: 10.12699/jfvpulm.15.47.2024.47
Conflict of Interest
Non
Date of manuscript receiving
20/06/2024
Date of publication after correction
27/11/2024
Article citation
Rachid Benchanna, Rachid Bouchentouf, Abdelfattah Zidane, Hicham Janah, Jamal Oujaber, Soufiane Sassi, Amine Benjelloune. Spontaneous endometriotic hemothorax - A difficult diagnosis in a former tuberculosis patient . J Func Vent Pulm 2024;47(15):47-51