
 English
English
 French
French
Contribution of cytopathological examination to the diagnosis of malignant pleurisies at the university hospital of Conakry - Guinea
Apport de l’examen cytopathologique au diagnostic des pleurésies malignes au CHU de Conakry - Guiné
Sylla1,3, D. Touré2,3, M. Sylla1, LM. Camara2,3, M. Kaba1
1: Service d’Anatomie et de Cytologie Pathologiques de l’Hôpital National Donka-Guinée
2: Service de Pneumo-Phtisiologie de l’Hôpital National Ignace Deen. Conakry-Guinée
3: Université Gamal Abdel Nasser de Conakry-Guinée
Corresponding author:
Demba TOURE. Université Gamal Abdel Nasser de Conakry-Guinée. Service de Pneumo-Phtisiologie de l’Hôpital National Ignace Deen.
E-mail: touredemba11@gmail.com
ABSTRACT
Introduction. Malignant pleurisy remains a major public health problem due to its serions complications of primary or secondary malignant tumour pathology.
Methods. This was a retrospective descriptive study covering a period of 6 years, from1 January to 31 December 2023. The aim of this study was to contribute to the cytological diagnosis of malignant pleurisy at Conakry University Hospital.
Results. In 6 years, we diagnosed 378 patients with malignant pleurisy, i.e. 3.82%. Patients in the 70.79 age group were the most affected 103 patients, i.e. 27.24%. The average age of patients was 56.23 years. The extremes were 6 and 83 years. 230 patients, or 60.85%, were male. The sex ratio was 1.55. Stitch was the most frequently reported reason, with 362 cases (95.76%). The yellow-citrine appearance of the pleural effusion fluid was the most common finding 207 cases (54.76%). Adenocarcinoma was the most frequently reported cytological diagnosis in 212 cases (56.08%).
Conclusion. Cytopathological examination of pleural effusion fluid is the fundamental step in the diagnosis of malignant pleurisy.
KEYWORDS: Diagnosis; cytology; malignant pleurisy; Conakry University Hospital.
RÉSUMÉ
Introduction. Les pleurésies malignes restent un problème majeur de santé publique par ses complications gravissimes de pathologie tumorale maligne primitive ou secondaire.
Méthodes. Il s’agissait d’une étude rétrospective de type descriptif qui a couvert une période de 6 ans, allant du 1er Janvier au 31 Décembre 2023. L’objectif de ce travail était de contribuer au diagnostic cytologique des pleurésies malignes au CHU de Conakry.
Résultats. Nous avons diagnostiqué en 6 ans 378 patients pour pleurésie maligne, soit 3,82%. Les patients de la tranche d’âge de 70,79 ans ont été le plus touchés 103 patients, soit 27,24%. L’âge moyen des patients a été 56,23 ans. Les extrêmes ont été 6 et 83 ans. Le sexe masculin a été plus touché 230 patients, soit 60,85%. Le sex-ratio a été 1,55. Le point de côté a été le motif le plus rapporté 362 cas soit 95,76%. L’aspect jaune-citrin du liquide d’épanchement pleural a été le plus constate 207 cas soit 54,76%. L’adénocarcinome a été le diagnostic cytologique le plus rapporté 212 cas, soit 56,08%.
Conclusion. L’examen cytopathologique du liquide d’épanchement pleural constitue le temps fondamental du diagnostic les pleurésies malignes.
MOTS CLÉS: Diagnostic; cytologie; pleurésies malines; CHU- Conakry.
INTRODUCTION
Les pleurésies représentent l’épanchement du liquide dans la cavité pleurale et celles malignes constituent l’épanchement dans la cavité pleurale dues à un processus tumoral malin [1].
Les pleurésies malignes sont une cause fréquente d’épanchement pleural, représentant 45 % des étiologies des pleurésies. Leur fréquence de survenue augmente avec l'âge et elles sont la première cause d épanchement pleural après 60 ans [2]. Les cancers bronchiques, mammaires et les digestifs étant les principaux sites primitifs retrouvés [2]. Les épanchements pleuraux métastatiques sont habituellement découverts dans le cadre d’une pathologie néoplasique connue évolutive et la pleurésie signe alors l'extension locale ou métastatique de la maladie. Cependant, ils peuvent aussi révéler l’affection maligne. La constitution d’un épanchement pleural est traditionnellement attribuée à un défaut de drainage lymphatique occasionné par l’envahissement tumoral des vaisseaux lymphatiques dû à l’envahissement direct local de la plèvre avec exfoliation de cellules malignes par une métastase, greffée sur la plèvre [3]. La pleurésie maligne constitue un motif fréquent de consultation en pneumologie. Ainsi, les pleurésies néoplasiques sont définies par la présence des cellules tumorales dans l'espace pleural [3].
On estime que 20% de 150.000 patients qui décèdent de cancer annuellement en France sont porteurs d'une pleurésie néoplasique. Le cancer du sein et du poumon en France sont responsables à eux seuls d'environ 50 pourcents des pleurésies néoplasiques [4].
Les pleurésies malignes constituent un motif fréquent de consultation en pneumologie ainsi on estime que 20% de 15 mille patients décédés de cancers annuelle ment en France sont porteurs d’une pleurésies néoplasique le cancer de sein et poumon en France sont responsables à eux seules d’environ 50,2% de pleurésie néoplasique [5].
Les pleurésies malignes représentent entre 42 et 77 % des étiologies des pleurésies exsudatives [6]. Les causes le plus souvent retrouvées sont les cancers bronchiques, mammaires et les lymphomes malins, rassemblant ensemble 65 % des étiologies [6].
La présentation clinique diffère selon que, la pleurésie est révélatrice d’une néoplasie ou qu’elle survient lors de la phase pré terminale de la maladie [7]. Habituellement, les signes cliniques retrouvés sont ceux d’une pleurésie insidieuse chronique et récidivante [7].
L’examen physique constitue un moyen d’orientation diagnostique permettant de faire une ponction pour l’analyse cytopathologique [8]. L’examen physique peut apprécier la présence de la matité, de l’abolition des murmures vésiculaires. La ponction permet apprécier l’aspect du liquide souvent hématique ou hémorragique [8].
La radiographie standard permet de visualiser l’épanchement pleural et d’indiquer la ponction évacuatrice [8]. La radiographie conventionnelle met en évidence une opacité homogène des champs pulmonaires avec comblement du cul de sac coxo-diaphramatique dessinant une opacité à concavité inférieure en ligne de Damoiseau [9]. Le scanner thoracique permet surtout de rechercher la métastase médiastinale [10]. Nous avons trouvé utile de réaliser ce travail dont l’objectif était de contribuer au diagnostic cytologique des pleurésies malignes au CHU de Conakry.
PATIENTS ET METHODES
Il s’agit d’une étude prospective, descriptive qui a couvert une période de 6 ans, allant du 1er janvier 2017 au 31 décembre 2022. Elle a concerné, les fiches de compte-rendu des patients diagnostiqués pendant la période de l’étude. Elle a intéressé, les fiches de compte-rendu des patients diagnostiqués pendant la période de de l’étude sur lesquelles, le diagnostic de pleurésie a été porté. Ont été incluses, les fiches de compte-rendu de pleurésie sur lesquelles le diagnostic cytologique de pleurésie maligne a été porté au CHU de Conakry.
Nous avons élaboré les fiches d’enquête qui ont permis de recueillir les données épidémiologiques, cliniques et cytopathologiques.
Nos données ont été traitées, saisies et analysées à l’aide des logiciels Microsoft
Word, Excel et Power point du Pack office 2007.
Les fiches ont été numéroté porté et même numéro a été porté sur l’étiquette du tube contenant le prélèvement. Ce numéro a servi le seul élément d’identification du prélèvement jusqu’au compte rendu final.
Les fiches de compte rendu ont été remises soit au patient, soit à un proche du patient pour les patients à l’état passif.
RESULTATS
Nous avons colligé en 10 ans 378 cas d’épanchements liquidiens pleuraux malins sur 1444 cas de pleurésie de toute étiologie confondue soit 3,82%.
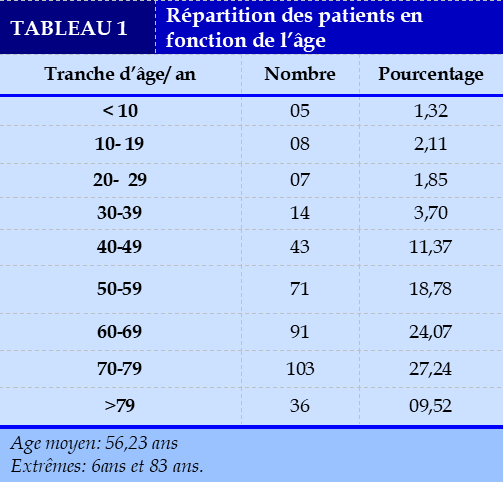
La tranche d’âge de 50 à 59 ans 71 patients, soit 18,78%. L’âge moyen: 56,23 ans et les extrêmes: 6ans et 83 ans.
L’aspect jaune-citrin du liquide a été le plus constaté 207 54,76.
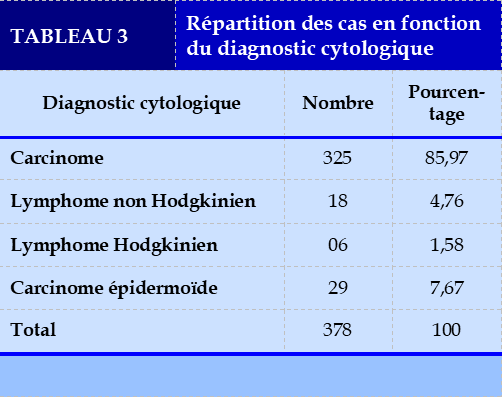
Le diagnostic cytologique du carcinome a été le plus rapporté 325, soit 85,97%.
Les formes primitives étaient dominées par le mésothéliome.
DISCUSSIONS
Nous avons colligé en 10 ans 378 cas des liquides d’épanchements pleuraux malins sur 1444 cas de pleurésie de toute étiologie confondue. La majorité des cas de pleurésies malignes sont métastatiques.
Les formes primitives sont dominées par le mésotheliome malin. Nos résultats ont été similaires à ceux de Sugiura. S., et coll [11]. qui ont trouvé dans leur recherche de pleurésie maligne 3,21% par rapport aux autres liquides d’épanchements analysés en 15 ans. Les résultats ont été en-dessous de Yilmaz. U et coll [12] qui ont trouvé en 15 mois une fréquence de pleurésie maligne de 5,25% par rapport aux autres liquides d’épanchement pleural l’analysés. Le plus grand nombre de pleurésies malignes ont été retrouvées dans la tranche d’âge 70 à 79 ans 103 patients, soit 27,34%.
L’âge moyen des patients a été 56, 23 ans et que les extrêmes ont été 6 ans et 83 ans. Les patients ont été majoritairement jeunes. Plus de ¾ des patients, soit 63% ont l’âge supérieur ou égal à 50 ans.
Plus des 2/3 des patients, soit 60,75% ont l’âge supérieur ou égal à 60 ans. Plus du tiers des patients, soit 86,77% ont l’âge supérieur ou égal à 70 ans. La tranche d’âge dominante de notre série a été différente de celle de Yilmaz.U., et coll [12] qui ont trouvé que, la tranche d’âge 56 à 67 ans a été la plus touchée, soit 24,32%.
L’âge moyen de notre série a été similaire de celui de Sire.JM., et coll [13] qui ont trouvé l’âge moyen des patients 56 ans. Rouetbi. M., et coll [14] ont trouvé que, l’âge moyen des patients a été 55 ans. Gary de Londres [15] a trouvé l’âge moyen des patients 43 ans et que les extrêmes ont été 15ans et 75ans. Johnson.W.W., et coll [16] ont trouvé l’âge moyen des patients 36,6 ans avec des extrêmes de 15 ans et 75 ans.
Les patients de sexe masculin ont été les plus touchés 230 patients, soit 60,85%. Le sex-ratio a été 1,55.
Nos résultats ont été proches à ceux de Sugiura. S., et coll [11] qui ont trouvé que, les patients du sexe masculin ont été les plus diagnostiqués 51,35%. Le sex-ratio a été 1,05. Cette prédominance masculine a été notée par rapport à une prédominance de sexe masculin dans 73%. Achia. V.H., et coll. [17] ont trouvé une prédomina nce du sexe masculin dans 66,66%.
Nos résultats ont été contraires à ceux de Johnson.W.W. [25] qui a trouvé une prédominance du sexe féminin 52,63% avec un sex-ratio de 0,86%. Et aussi contraire à ceux de Celerin. L, et coll [18] qui ont trouvé une prédominance du sexe féminin 61,2% avec un sex-ratio de 0,55.
Les femmes au foyer ont représenté la couche socio-professionnelle la plus touchée 96 patients, soit 25,40%. Différentes couches socioprofessionnelles ont été touchées avec prédominance de celle des femmes au foyer. Nos résultats ont été contraires à ceux de Sugiura. S., et coll [11] qui a trouvé que, la couche socio-professionnelle libérale a été la plus touchée 11 patients, soit 29,72%. Nous ne possédons pas d’explication portant sur le taux élevé des patients appartenant à la couche socioprofessionnelle libérale. Les épanchements pleuraux carcinomateux peuvent être primitifs ou secondaires. De nombreuses professions ont un risque accru de développer des pleurésies malignes que sont les ouvriers des mines d’amiante, des industries plastiques, des ouvriers agricoles représentent des professions à haut risque [19].
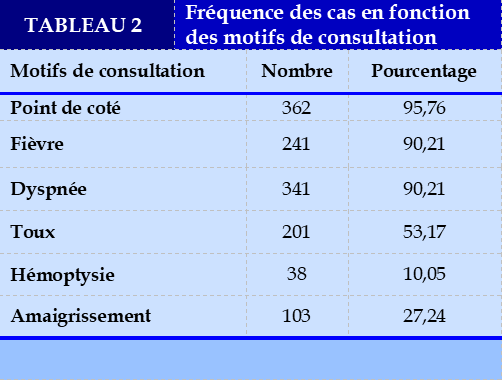
Les points de côté ont été le principal motif de consultation 362 cas, soit 95,62% , puis de dyspnée et de la fièvre 241 cas , soit respectivement 90,21% et 90,21%. Ceci a montré que, différents motifs de consultation ont été rapportés.
Nos résultats ont été comparables à ceux de Sugiura. S., et coll [11] qui ont trouvé que, les points de côte ont représenté le principal motif de consultation 100% des cas ; puis suivis de dyspnée 86,48% et de toux 37,83%. Les mêmes auteurs ont rapporté qu’aucun de ces motifs de consultation n’est pathognomonique, car les mêmes motifs sont retrouvés dans d’autres causes d’épanchements pleuraux non malins. Certaines de ces affections sont les pneumonies non spécifiques, les embolies pulmonaires, les infarctus pulmonaires et ainsi les fibroses pulmonaires.
Nos données ont été en harmonie avec celle de Ngo Quy Chau., et coll [20] qui ont trouvé que,les points de côte ont été les plus rapportés 85% ; puis la dyspnée 80% et la toux seche 58%. La pleurésie a été le plus rapporté 210 cas soit 55,55%. Différents diagnostics cliniques ont été rapportés au cours de notre recherche.
Nos résultats ont été différents à ceux de Sugiura. S., et coll [11] qui ont trouvé que, le diagnostic clinique de tuberculose a été le plus évoqué 9 cas, soit 24,32%. *
Ce diagnostic clinique a été suivi de celui de métastase pleurale 18,91%. Le même auteur a évoqué que, la pleurésie maligne n’est pas un syndrome ou un signe pouvant évoquer un diagnostic précieux. Choubi. M., et coll [21] ont trouvé que, sur 1758 épanchements pleuraux et que 13,6% étaient d’origine maligne. Bren. DP., et coll. [22] ont trouvé que, la fréquence d’épanchements pleuraux malins était de 17,9% des cas.
Les ponctions à l’aveugle à l’aide de l’aiguille 24 G ont été les plus employées 349 cas, soit 92,33%. Les différentes techniques de prélèvement ont été utilisées portant sur les ciels-ouverts et les ciels-fermés.
Nos résultats ont été proches à ceux de Sugiura. St coll [11] qui ont trouvé que, 81,08% des liquides d’épanchements pleuraux malins ont été prélevés par la ponction à l’aveugle. Ceci a constitué à la ponction trans pariétale de la cavité thoracique, à l’aide d’une seringue munie d’aiguille 24 G. Nos résultats ont été différents à ceux Brouchet.L., et coll[23] qui ont trouvé que, la pleurotomie a été la technique la plus employée pour la pleurésie maligne 60% des cas.
Nos résultats ont été proches à ceux de Lee.YC., et coll [24] qui ont noté que, la ponction pleurale a été la technique la plus employée pour pleurésies malignes 77% des cas. Les pleurésies malignes localisées dans la cavité pleurale gauche ont été les plus diagnostiquées 175 cas, soit 46,30% ?
Les pleurésies malignes de localisation gauche ont été les plus dominantes. Nos résultats ont été contraires à ceux de Sugiura. S., et coll [11 qui a trouvé que, les pleurésies malignes localisées à droite ont été plus colligées 13 cas, soit 47,88%. Nos résultats ont été aussi proches à ceux Ny C., et coll[8] qui ont trouvé que les pleurésies malignes localisées au côté gauche ont représenté 48,49% et contre 36,54% localisées sur le côté droit.
La majorité des liquides d’épanchements pleuraux diagnostiqués cytologiquement malin ont présenté les aspects jaune-citrins 207 cas, soit 54,76%. Les liquides d’épanchements pleuraux malins ont présenté les aspects différents. Les résultats ont été contraire à ceux de Sugiura. S., et coll [11] qui a trouvé que la majorité des liquides d’épanchement des pleurésies malignes analysés ont présenté des aspects serohématiques 48,64% ; suivis de celui jaune-citrin 18,91% et hémorragique 16,21%. Les résultats ont été contraires à ceux de Bambara.SM., et coll. [19] qui ont trouvé que, les aspects serohématiques et hémorragique ont été les plus colligés 60%.
Le diagnostic cytologique du carcinome a été plus rapporté au cours de notre analyse cytologique 212 cas, soit 86,97%. Nos résultats ont été similaires à ceux de Sahan. S.A., et coll [25] qui ont trouvé que le diagnostic cytologique du carcinome a été le plus porté 77,2%.
Nos résultats ont été similaires à ceux de Celerin L., et coll[18] qui ont trouvé dans leur recherche que la pleurésie métastasique faite du carcinome a été la plus portée 65,2% de cas. Galateau-Salle.F. [26] a rapporté dans son étude portant sur les étiologies de pleurésie maligne, une large prédominance des carcinomes et principalement adénocarcinome dans 63,2% des cas.
CONCLUSION
Les patients de toutes tranches d’âge confondues ont été colligés avec prédominance de ceux de 6ème décennie. Les patients du sexe différents ont été observés avec prédominance de celui du sexe masculin. Les patients des couches socioprofessionnelles différentes ont été observés, dont les femmes au foyer ont été les plus observées. De nombreux motifs de consultation ont été rapportés avec prédominance de la dyspnée.
Différentes techniques ont été utilisées pour la ponction cytologique du liquide d’épanchement, mais celle à l’aveugle a été la plus employée. Différents aspects du liquide d’épanchement malin ont été observés, dont celui du jaune-citrin a été plus constaté.
Les diagnostics cytologiques différents ont été rapportés, dont l’adénocarcinome a été le plus retenu.
CONFLITS D’INTERETS
Aucun
REFERENCES
| 1. Ebata T., Okuma Y., Nakahara Y., Yomota. M., Takagi. Y., Hosomi. Y. Retrospective analysis of unknown primary cancers with malignant pleural effusion at initial diagnosis. Thorac Cancer 2016; 7: 39-43. |
| 2. Abbruzzese JL, Abbruzzese MC, Hess KH et al. Unknown primary carcinoma: natural history and prognostic factors in 657 consecutive patients, J Clin Oncol 2014; 12: 1272-1280. |
| 3. A.M.Abumossalam, T.T.Abdelgawad et A.M.Shebl (2014), Malignant pleural effusion: Relationship between thoracoscopic findings and type of malignancy, Eguptian Journal of Chest Diseases and Tuberculosis, 2016; 64 : 399-404. |
| 4. Chulin. Wu., Zeng. Y. et Wu. P. Diagnostic accuracy of cell-block or tissue-fragment histology and cytology by fine needle lung aspiration, Chinese journal of pathology. |
| 5. Nythyananda AN, Eddie N, BApp Sci. Improved preparation and it's efficacy in diagnostic cytology. American Journal of Clinical Pathology 2013;14:99-06. |
| 6. Udasimath S, Surekha UA, Mahes HK. The role of the cell-block method in the diagnosis of malignant ascitic fluid effusions. Journal of Clinical and Diagnosis Research 2012;23 :1-4. |
| 7. Kangleon RG. A review of cell block and cytology reports of patients with pleural effusion admitted at Metro Cebu community hospital, The science and Technology Information Network of the Philippines 2012 ;45 :23-27. |
| 8. Ny.C., Mangiapan.C., Fuhrman.C., Atassi.K., Monnet.I. Talcage pleural dans les pleurésies néoplasiques service de pneumologie, CHIC de crétail.France SPLF. Édité par Elsevier Masson SAS. 2014 ;34 :45-49. |
| 9. JHONSTON WW. The malignant pleural effusion.a rewiew of cytopathologie diag dignoses of 5845 specimen from 472 consecutive patients.J.Cancer 2015;56:905-9. |
| 10. Molinié. F., Velten. M., Remontet. L., Bercelli. P. le Réseau FRANCIM. Évolution de l’incidence du cancer broncho-pulmonaire en France. Rev Mal Respir2016; 23 : 127-34. |
| 11. Sugiura. S., Ando. Y., Minami. H., Ando. M., Sakai. S., Shimokata. K. Prognostic value of pleural effusion in patients with non small cell lung cancer. Clin Cancer Res 2017; 13 : 47-50. |
| 12. Yilmaz. U., Polat. G., Sahin. N., Soy. O., Gulay. U. CT in differential diagnosisof benign and malignant pleural disease. Monaldi Arch Chest Dis 2015 ; 63 : 17-22. |
| 13. Sire. JM., Sow. PS., Chartier L., N’diaye. B., Ndiaye. M., Dièrre. S. F., et Al. Étiologie des pneumopathies BAAR négatives chez les patients infectés par le VIH hospitalisés à Dakar. Sénégal. Rev Mal Resp 2016;27:1015-21. |
| 14. Rouetbi.N., Daami.M., Sboui.L., Battikh.MH., Braham.W., HERGLI.W. Les aspects étiologiques des pleurésies service de pneumologie CHUF Bourguiba Monastir , Tunisie.2014 S PLF.2015 ;45 :23-27. |
| 15. Le Dr Gary Lee de Londres. Talc et épanchements pleuraux Métastatiques France. Rev Mal Respir 2017 ; 24 : 135-138. |
| 16. Johnson WW.The malignant pleural effusion. A review of cytopathologic diagnoses of 584 specimen from 474 consecutive patients. J.Cancer 2015; 57: 905-9. |
| 17. Achia.VH., Brou Ahuib.JC., Kouassib.AB. Service de pneumologie,(centre Hospitalier université Bouaké ( Cote d’Ivoire) 2013. 69, 121-125. |
| 18. Cellerin.L., Marcq.M., Sagan.C., Calleux.E. Pleurésies malignes révélatri ces d’un cancer.comparaison des étiologies avec les pleurésies métastatiques d’un cancer connu. France Rev Mal Respir 2018 ; 25 : 1104-9. |
| 19. Bambara.AT.,Ouédraogo.SM.,Maïga.S., K.A. Sondo.K.A.Survie des pleurésies malignes et paramalignes à Ouagadougou. J.pneumo.2016.8:56-58 |
| 20. Ngo Quy Chau, Hoang Hong Thai, Chu ThiHanh, Nguyen Thanh Hoi. Traitement d’épanchement pleural néoplasique par la thoracoscopie. Hopital Bacb Mai 2015 SPLF Vietnam.J.Pathol 2017 ;34 :56-59. |
| 21. Choubi.M.,W.El Khattabi.W.,K.Choukry.K.Pleurésies malignesrévélatrices d’un cancer. J.Med 2014;10:26-34. |
| 22. BREEN DP, Mallawathantris, FraticelliA, GreillierL, AstoulP. un draina ge thoraxique de courte durée est –il envisageable après thoracoscopie médicale diagnostiqué Monaldi Arch chestdiss 2019; 71 :54-8. |
| 23. Brouchet.L.,Humeau.M.Prise en charge de l’épanchement pleural malin CHU de toulouse. France. Rev Mal Respir Actual 2019 ; 1 : 325-330. |
| 24. Lee YC, Light RW: Management of malignant pleural effusions.Respirology 2014;9:148-56. |
| 25. Sahnn .SA malignancy métastatique to theur pleural .American review of respiratory disease 2018;19:351-61. |
| 26. Galateau-Salle F. Données récentes dans le diagnostic des mésothéliomes pleuraux, un spectre lésionnel qui n’a pas fini de nous étonner.Hopital nord saint-etienne Ann Pathol2013, 34 :45-50. |
TABLES
REFERENCES
| 1. Ebata T., Okuma Y., Nakahara Y., Yomota. M., Takagi. Y., Hosomi. Y. Retrospective analysis of unknown primary cancers with malignant pleural effusion at initial diagnosis. Thorac Cancer 2016; 7: 39-43. |
| 2. Abbruzzese JL, Abbruzzese MC, Hess KH et al. Unknown primary carcinoma: natural history and prognostic factors in 657 consecutive patients, J Clin Oncol 2014; 12: 1272-1280. |
| 3. A.M.Abumossalam, T.T.Abdelgawad et A.M.Shebl (2014), Malignant pleural effusion: Relationship between thoracoscopic findings and type of malignancy, Eguptian Journal of Chest Diseases and Tuberculosis, 2016; 64 : 399-404. |
| 4. Chulin. Wu., Zeng. Y. et Wu. P. Diagnostic accuracy of cell-block or tissue-fragment histology and cytology by fine needle lung aspiration, Chinese journal of pathology. |
| 5. Nythyananda AN, Eddie N, BApp Sci. Improved preparation and it's efficacy in diagnostic cytology. American Journal of Clinical Pathology 2013;14:99-06. |
| 6. Udasimath S, Surekha UA, Mahes HK. The role of the cell-block method in the diagnosis of malignant ascitic fluid effusions. Journal of Clinical and Diagnosis Research 2012;23 :1-4. |
| 7. Kangleon RG. A review of cell block and cytology reports of patients with pleural effusion admitted at Metro Cebu community hospital, The science and Technology Information Network of the Philippines 2012 ;45 :23-27. |
| 8. Ny.C., Mangiapan.C., Fuhrman.C., Atassi.K., Monnet.I. Talcage pleural dans les pleurésies néoplasiques service de pneumologie, CHIC de crétail.France SPLF. Édité par Elsevier Masson SAS. 2014 ;34 :45-49. |
| 9. JHONSTON WW. The malignant pleural effusion.a rewiew of cytopathologie diag dignoses of 5845 specimen from 472 consecutive patients.J.Cancer 2015;56:905-9. |
| 10. Molinié. F., Velten. M., Remontet. L., Bercelli. P. le Réseau FRANCIM. Évolution de l’incidence du cancer broncho-pulmonaire en France. Rev Mal Respir2016; 23 : 127-34. |
| 11. Sugiura. S., Ando. Y., Minami. H., Ando. M., Sakai. S., Shimokata. K. Prognostic value of pleural effusion in patients with non small cell lung cancer. Clin Cancer Res 2017; 13 : 47-50. |
| 12. Yilmaz. U., Polat. G., Sahin. N., Soy. O., Gulay. U. CT in differential diagnosisof benign and malignant pleural disease. Monaldi Arch Chest Dis 2015 ; 63 : 17-22. |
| 13. Sire. JM., Sow. PS., Chartier L., N’diaye. B., Ndiaye. M., Dièrre. S. F., et Al. Étiologie des pneumopathies BAAR négatives chez les patients infectés par le VIH hospitalisés à Dakar. Sénégal. Rev Mal Resp 2016;27:1015-21. |
| 14. Rouetbi.N., Daami.M., Sboui.L., Battikh.MH., Braham.W., HERGLI.W. Les aspects étiologiques des pleurésies service de pneumologie CHUF Bourguiba Monastir , Tunisie.2014 S PLF.2015 ;45 :23-27. |
| 15. Le Dr Gary Lee de Londres. Talc et épanchements pleuraux Métastatiques France. Rev Mal Respir 2017 ; 24 : 135-138. |
| 16. Johnson WW.The malignant pleural effusion. A review of cytopathologic diagnoses of 584 specimen from 474 consecutive patients. J.Cancer 2015; 57: 905-9. |
| 17. Achia.VH., Brou Ahuib.JC., Kouassib.AB. Service de pneumologie,(centre Hospitalier université Bouaké ( Cote d’Ivoire) 2013. 69, 121-125. |
| 18. Cellerin.L., Marcq.M., Sagan.C., Calleux.E. Pleurésies malignes révélatri ces d’un cancer.comparaison des étiologies avec les pleurésies métastatiques d’un cancer connu. France Rev Mal Respir 2018 ; 25 : 1104-9. |
| 19. Bambara.AT.,Ouédraogo.SM.,Maïga.S., K.A. Sondo.K.A.Survie des pleurésies malignes et paramalignes à Ouagadougou. J.pneumo.2016.8:56-58 |
| 20. Ngo Quy Chau, Hoang Hong Thai, Chu ThiHanh, Nguyen Thanh Hoi. Traitement d’épanchement pleural néoplasique par la thoracoscopie. Hopital Bacb Mai 2015 SPLF Vietnam.J.Pathol 2017 ;34 :56-59. |
| 21. Choubi.M.,W.El Khattabi.W.,K.Choukry.K.Pleurésies malignesrévélatrices d’un cancer. J.Med 2014;10:26-34. |
| 22. BREEN DP, Mallawathantris, FraticelliA, GreillierL, AstoulP. un draina ge thoraxique de courte durée est –il envisageable après thoracoscopie médicale diagnostiqué Monaldi Arch chestdiss 2019; 71 :54-8. |
| 23. Brouchet.L.,Humeau.M.Prise en charge de l’épanchement pleural malin CHU de toulouse. France. Rev Mal Respir Actual 2019 ; 1 : 325-330. |
| 24. Lee YC, Light RW: Management of malignant pleural effusions.Respirology 2014;9:148-56. |
| 25. Sahnn .SA malignancy métastatique to theur pleural .American review of respiratory disease 2018;19:351-61. |
| 26. Galateau-Salle F. Données récentes dans le diagnostic des mésothéliomes pleuraux, un spectre lésionnel qui n’a pas fini de nous étonner.Hopital nord saint-etienne Ann Pathol2013, 34 :45-50. |
ARTICLE INFO DOI: 10.12699/jfvpulm.16.48.2025.28
Conflict of Interest
Non
Date of manuscript receiving
10/01/2025
Date of publication after correction
20/03/2025
Article citation
Sylla, D. Touré, M. Sylla, LM. Camara, M. Kaba. Contribution of cytopathological examination to the diagnosis of malignant pleurisies at the university hospital of Conakry - Guinea. J Func Vent Pulm 2025;48(16):28-33