
 English
English
 French
French
Side effects of antituberculous treatment in patients monitored at the antituberculosis center of Adjame - Ivory Coast
Effets secondaires du traitement antituberculeux chez des patients suivis au centre antituberculeux d’Adjamé - Côte d’Ivoire
BJM. Ahui1,2, AE. Djegbeton1,2, E. Akouatia1,2, MOI. Koffi1,2, A. Kone1,2, B. Kouraogo1, ALNH. Mobio1, CV. Brou-Gode1,2, A. Ngom1,2, K. Horo1,2, BA. Kouassi1,2,3, N. Koffi1,2
1: Service de Pneumologie, CHU de Cocody, Abidjan Côte d'Ivoire
2: UFR Sciences Médicales Abidjan, Université Félix Houphouët Boigny
3: ONG « Sauvons le Poumon » BP 1105 Abidjan
Corresponding author: BJM. Ahui. University Félix Houphouët Boigny.
E-mail: ahuib@hotmail.fr
ABSTRACT
Background. Tuberculosis is an endemic disease in sub-Saharan Africa. Its treatment requires the combination of 3 or 4 drugs for several months. Although the efficacy of these currently available drugs is undeniable, their poor tolerance is often a worry for the practitioner and patient.
Objective. To determine the incidence of side effects of anti-tuberculosis treatment and identify the most frequent side effects.
Methods. This is a prospective cohort study of side effects related to anti-tuberculosis treatment. It consists of a successive recruitment of patients with tuberculosis, irrespective of the location of the tuberculosis, undergoing a standard antituberculosis treatment.
Results. Of the 342 patients, 45.3% were HIV+ and 54.7% were HIV- patients. In our study, 38% of patients reported experiencing at least one type of side effect. Joint pain (22.5%), of the 342 patients, 45.3% were HIV+ and 54.7% were HIV- patients. In our study, 38% of patients reported having experienced at least one type of side effect. Joint pain (22.5%), pruritus with or without rash (15%), flu-like syndrome (8.8%) were the most frequent minor side effects. Most patients experienced a staien effect within the first two months of treatment. Of the 130 patients who experienced at least one side effect, 68 or 52.3% were co-infected and these co-infected patients had significantly more major side effects.
Conclusion. The occurrence of side effects related to anti-tuberculosis treatment is higher in HIV+ patients than in HIV- patients.
KEYWORDS: Anti-tuberculosis treatment; Side effects; Frequency; HIV.
RÉSUMÉ
Contexte. La tuberculose est une maladie endémique en Afrique subsaharienne. Son traitement fait appel à l’association de 3 ou 4 médicaments durant plusieurs mois. Si l'efficacité de ces médicaments actuellement disponibles est indéniable, leur mauvaise tolérance constitue souvent une hantise pour le praticien.
Objectif. Déterminer l’incidence des effets secondaires au cours du traitement antituberculeux et identifier les effets secondaires les plus fréquents.
Méthodes. C’était une étude prospective de cohorte portant sur les effets secondaires survenus au cours du traitement antituberculeux. C’était un recrutement successif de malades atteints de tuberculose, quel que soit la localisation de la tuberculose, mis sous traitement antituberculeux standard. Dans notre étude, 342 patients ont été recrutés du 18 mars au 30 avril 2020, ces patients ont été suivis jusqu’à la fin de leur traitement.
Résultats. Sur les 342 patients, 45,3% étaient VIH+ et 54,7% de patients VIH-,38% des patients ont rapporté avoir présenté au moins un type d’effet secondaire. Les douleurs articulaires (22,5%), les prurits avec ou sans éruption cutanée (15%), le syndrome pseudo-grippal (8,8%) sont les effets secondaires mineurs les plus fréquents. La plupart des patients ont présenté un effet secondaire les deux premiers mois du traitement. Parmi les 130 patients qui ont présenté au moins un effet secondaire, 52,3% étaient co-infectés et ces patients co-infectés présentaient significativement des effets secondaires majeurs.
Conclusion. l’apparition d’effet secondaire lié au traitement antituberculeux était plus élevée chez le patient VIH+ que le patient VIH-.
MOTS CLÉS: Traitement antituberculeux; Effets secondaires; Fréquence; VIH.
INTRODUCTION
Pour une lutte antituberculeuse efficace, l’OMS a développé et promu une stratégie mondiale nommée DOTS (Directly Observed Treatment Short-course). Cette stratégie représente aujourd’hui la stratégie la plus efficace dont on dispose pour lutter contre l’épidémie mondiale de la tuberculose [1, 2].
En Côte d’Ivoire, malgré la mise en œuvre de la stratégie DOTS sur l’ensemble du territoire national depuis 2006, l’on note un accroissement constant du taux annuel d’incidence des cas de tuberculose et une émergence accrue des cas de tuberculose multi résistante [3, 4]. Des données rapportées au Center for Disease Control (CDC) à Atlanta montrent que seulement 60% des patients qui débutent un traitement le poursuivent au moins 6 mois [5] et que la bonne observance du traitement dépend de la durée du traitement, de sa complexité et de sa toxicité. Cette dernière composante peut constituer un obstacle majeur au succès thérapeutique. Dans le but de prévenir les abandons du traitement et d’encourager l’observance au traitement, il nous est apparu opportun de rechercher l’incidence des effets secondaires des traitements antituberculeux au centre antituberculeux (CAT) d’Adjamé.
L’objectif de notre étude était d’évaluer l’incidence des effets secondaires au cours du traitement antituberculeux et d’identifier les effets secondaires les plus fréquents.
METHODES
Cadre de l’étude
Notre étude s’est déroulée au centre antituberculeux d'Adjamé situé au centre de la ville d’Abidjan. C’est un centre de référence de prise en charge de la tuberculose. Il reçoit plus de 6000 patients par an.
Type de l’étude
Il s’agissait d’une étude prospective longitudinale d’une cohorte de 342 patients sous traitement antituberculeux. Elle visait à rechercher les effets secondaires liés aux antituberculeux.
Période de l’étude
Nous avions recruté tous les patients tuberculeux venus en consultation du 18 mars 2020 au 30 avril 2020, ces patients ont été suivis jusqu’à la fin de leur traitement antituberculeux.
Population d’étude
C’était les malades suivis dans le centre antituberculeux sous traitement antituberculeux classique.
Critère d’inclusion
Nous avons inclus tous les patients tuberculeux nouveaux cas sous traitement standard (RHZE), âgés d’au moins 5 ans et quel que soit le sexe et le statut VIH.
Critères de non inclusion
N’ont été inclus les patients qui
- ont abandonné ou qui ont un suivi irrégulier,
débuté le traitement avant le début de notre étude et transférés.
Echantillonnage
La prévalence des effets secondaires des antituberculeux était de 14% [6].
Nous avons déterminé la taille de l’échantillon à l’aide de la formule de Schwartz :
N= , avec N=nombre de sujets nécessaire dans notre étude.
= 1,96 (), p = Prévalence globale (ici 14%), q = 1 – p ; q = 1 – 0,14 = 0,86 (86%)
D2 = différence (précision) = 5%
N = = 185
N=185 malades sous traitement antituberculeux au minimum à interroger pour notre étude. Sur le terrain, nous avons interrogé 342 patients.
Recueil des données
Notre étude était réalisée au moyen d’un questionnaire anonyme et éclairé. Ce questionnaire comportait des :
-données sociodémographiques ;
-données cliniques
-effets secondaires des antituberculeux de M1 à M6
Saisie et analyse des résultats
La saisie des données a été effectuée avec les logiciels Excel.
Le traitement des données et la production des résultats ont été réalisés avec le logiciel SPSS 17.0. Le test du KHI DEUX (χ2) au seuil α = 5% a été le test statistique utilisé ou le test de Fisher Exact quand le test de χ2 n’est pas applicable.
Définition opérationnelle
« Effet secondaire » : c’est une réponse indésirable à un médicament lorsqu’il est pris à des doses normales. Il peut être léger (mineur) ou grave (majeur), temporaire ou permanent.
Considération éthique
Nous avions observé à toutes les étapes de la recherche, des principes éthiques et déontologiques .
Caractéristiques sociodémographiques
Durant la période d’étude, 592 patients ont été recrutés dont 342 patients ont été retenus. L’âge minimum était de 09 ans et un âge maximum de 78 ans avec une moyenne d’âge de 33,73 ans. Les tranches d’âge de 25 à 45 ans étaient les plus touchées dans une proportion de 67,8%. On notait une prédominance du sexe masculin (53% d’hommes contre 47% de femmes) avec un sexe ratio de 1,13. Les patients étaient de niveau socioéconomique modeste : 49,7%, du secteur informel et 22,8% étaient des sans emploi ou ménagères. Ils vivaient dans des cours communes (59,7%) ou dans des maisons en bois (24,9%).
Caractéristiques cliniques
Au plan clinique, il s’agissait en majorité d’une tuberculose pulmonaire à microscopie positive (92%). La sérologie VIH était positive chez 45,3% des patients de l’étude dont 44,5% étaient sous traitement antirétroviral.
Caractéristiques thérapeutiques
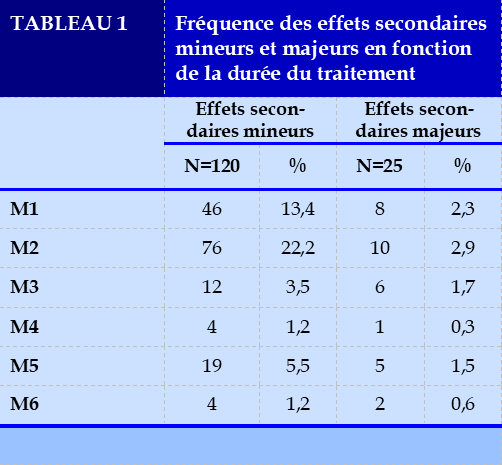
Sous traitement antituberculeux, des effets secondaires étaient mentionnés par 38% des patients. Le délai d’apparition et la sévérité des effets secondaires sont mentionnés dans le Tableau 1. La plupart des effets secondaires étaient mineurs : 120 (35%) contre 25 (7,3%) cas d’effets secondaires majeurs. Ils survenaient majoritairement aux deux premiers mois ; c’est-à-dire pendant la phase d’attaque du traitement antituberculeux (35,6% mineurs ; 5,2% majeurs).
S’agissant des effets secondaires mineurs, on notait surtout des arthralgies (22,5%), des prurits (15%), de syndrome pseudo grippal (30 cas soit 8,8%), des douleurs abdominales (7%), des neuropathies périphériques (5,6%).
Pour les effets secondaires majeurs, on notait 14 cas
de vertiges (4,2%), 3 cas de baisse de l’acuité visuelle (0,9%), 1 cas d’ictère (0,3%), et 1 cas de cécité (0,3%)
Effets secondaires et statut VIH
D’une façon générale, les effets secondaires apparaissent significativement chez les patients co-infectés par le VIH sous traitement antirétroviral (Tableau 2).
Le Tableau 3 montre que les effets secondaires majeurs était significativement retrouvés chez les patients VIH positifs sous ARV (p=0,047) avec un OR=1,614 [1,101-2,3366]. De même, les effets secondaires mineurs étaient aussi significativement plus fréquents chez le patient VIH sous ARV (p = 0,0001 OR= 1,971 [1,387 – 2,802]). Ces effets secondaires mineurs survenaient préférentiellement aux deux premiers mois du traitement. Par ailleurs, les patients co-infectés sous antirétroviral faisaient plus d’effets secondaires que les co-infectés sans ARV (P =0,001 OR : 1,895 IC [1,320-2,720] (Tableau 2).
DISCUSSION
Nous rapportons ici des données obtenues dans une étude prospective sur 342 patients sous traitement antituberculeux. Ces patients ont été suivis cliniquement pendant 6 mois, selon le calendrier de suivi en vigueur en Côte d’Ivoire.
Les résultats de notre étude montraient une prédominance de patients jeunes avec une moyenne d’âge de 33,7 ans et confirmaient ainsi les données de la littérature [7]. Cette maladie prédominait chez les sujets de sexe masculin. Cependant, on note une baisse du sex-ratio homme/femme retrouvée dans notre série (1,13) par rapport aux données de la littérature [8].
Ceci pourrait se justifier par le fait que les femmes se retrouvent de plus en plus exposées aux mêmes risques d’éclosion de la tuberculose que les hommes, à savoir la tendance à la féminisation de l’infection à VIH observée ces dernières années [9]. Les recommandations du Programme National de Lutte contre la Tuberculose (PNLT) inspirées de celles de l’OMS, ont été respectées puisque 100% des patients sous traitement antituberculeux ont été dépistés pour le VIH. Nous avions respectivement 45,3% de VIH+ et 54,7% de VIH-.
Dans cette série, 38% des patients avaient rapporté avoir présenté au moins un type d’effet secondaire. Le résultat de notre étude est nettement inférieur à celui de l'étude clinique et biologique fait en Inde [10], qui retrouve 80% d’effets secondaires. Le résultat pourrait s’expliquer par le petit effectif de Kuth (77 patients contre 342 dans notre série). Mais, cela -pourrait s’expliquer aussi par une sous-estimation de notre part. Le patient qui est soulagé de sa toux et sa fièvre, ne trouve pas utile de signaler des symptômes mineurs tels que les prurits, des vertiges ou des douleurs articulaires ; mais aussi par le fait des conditions de travail de tel sorte qu’il est difficile pour le malade de consulter le médecin en dehors des jours de rendez-vous plutôt que de payer un supplément de transport pour signaler un effet secondaire.
La plupart des réactions étaient mineures et ne nécessitaient pas de modification de traitement. Les principaux effets secondaires, dans notre étude, apparaissent 4 à 8 semaines après le début de la médication. La douleur articulaire dans 77 des cas (22,5%), les prurits avec ou sans éruption cutanée dans 51 des cas (15%), syndrome pseudo-grippal dans 30 des cas (8,8%) et ces effets ont été prise en charge de manière symptomatique. Notre étude est en conformité avec celle de Menzies et al. [11].
Les effets secondaires majeurs étaient peu signalés dans notre étude, à savoir 1 cas d’ictère (0,3%), 3 cas de baisse de l’acuité visuelle (0,9%) et 14 cas de vertiges (4,2%). Les effets secondaires étaient significativement retrouvés chez les sujets vivant avec le VIH (43,6% ; p=0,031).
Dans notre étude, parmi les 155 patients VIH positifs, 67 (43,2%) déclaraient avoir présenté au moins un effet secondaire attribuable au traitement antituberculeux. Cette analyse est statistiquement significative (p=0,045) par rapport aux patients non infectés par le VIH (33,7%). Les tuberculeux VIH positif, avaient donc moins bien toléré le traitement antituberculeux. Cela venait confirmer les données de la littérature [12, 13] à savoir que sur les 130 patients ayant subi au moins un effet secondaire, 68 (52,3%) étaient co-infectés (p=0,013). Cela pourrait s’expliquer aussi par le fait d’une polychimiothérapie du patient co-infecté. En effet, en plus des antituberculeux, il doit prendre des antirétroviraux, du cotrimoxazole et aussi des traitements pour d’autres affections opportunistes. Ce même constat a été fait par Touré qui trouvait que 59% des patients ayant présenté un effet secondaire étaient sous poly thérapie [14].
Les effets secondaires majeurs étaient plus fréquents chez les patients co-infectés (p=0,005) et, on notait une différence significative entre l’apparition de la neuropathie périphérique (p=0,001), le syndrome grippal (p=0,020) chez les patients VIH + et les patients non VIH. Les autres effets secondaires survenaient avec une fréquence similaire chez les patients infectés par le VIH et les patients non infectés. Notre étude était en accord avec celle de Ram Breen et al. Aux Etats-Unis [15] qui retrouvait 40% d’effets secondaires chez les patients co-infectés, avec une survenue significative de la neuropathie périphérique.Les effets secondaires étaient plus fréquents chez les patients co-infectés sous traitement antirétroviral (54,9%) et survenaient surtout au cours des deux premiers mois de traitement antituberculeux comme l’atteste les données de la littérature [16, 1].
CONCLUSION
Les effets secondaires des traitements antituberculeux n’étaient pas rares et étaient variés dans notre étude. L’identification de ces effets secondaires est importante si nous voulons réduire les abandons de traitement avec un risque de survenue de tuberculose multi résistante. Ils s’observaient volontiers les deux premiers mois du traitement antituberculeux et sont en général mineurs (77,4%), préférentiellement chez les co-infectés sous traitement antirétroviral. Les effets secondaires majeurs survenaient en majorité chez les patients co-infectés par le VIH/SIDA, cela nous interpelle sur le moment propice du démarrage des ARV chez les patients co-infectés.
CONFLICT OF INTEREST
Non.
REFERENCES
| 1. OMS. Stratégie DOTS : un cadre élargi pour lutter efficacement contre la tuberculose. Halte à la tuberculose maladie transmissibles. Genève 2003.24p. Who/CDS/TB/2002.297. |
| 2. OMS-DOTS : un guide pour comprendre la stratégie DOTS contre la tuberculose recommandée par l’oms.37p. Genève 1999. |
| 3. WHO/CDS//CPC/TB/99.270 Côte d’Ivoire. PNLT. Atelier bilan annuel de la lutte antituberculeuse : termes de référence. Bassam 2008. 7p. Code : CIV 304-G03-T ; 0.S.4-1 |
| 4. Programme National de Lutte contre la Tuberculose : Côte d’Ivoire. Atelier bilan annuel de la lutte antituberculeuse : bilan 2007 du PNLT. Bassam 2008. |
| 5. ATS/CDC: Targed Tuberculin Testing and Treatment of latent Tuberculosis Infection. AMJ Resp. Crit. Care Med, 161 S 221- S 247. |
| 6. Adimi N, Hocine I, Bourekoua W, Laouar L, afti S, Makhloufi T. Les effets indésirables des antituberculeux. Rev Mal Respir, 34, Sup, J2017, A214-A215 |
| 7. Perriota J, Chambonnetb É, Eschalierb A. Les effets indésirables des antituberculeux ; prise en charge. Rev Mal Respir (2011) 28, 542—555 |
| 8. Holmes CB. Une revue des différences dans l’épidémiologie de la tuberculose selon le sexe. Int J Tuberc Lung Dis 1998 ; 2(2) : 96-104. |
| 9. Aka-Danguy E et col : situation de la tuberculose dans les dix communes d’Abidjan à l’an 2000. Rev Pneumol Trop ; 4 : 17-20 |
| 10. Prasad R, Singh A, Gupta N. Adverse drug reactions in tuberculosis and management. Indian J Tuberc 2019 ;66(4) :520-532 |
| 11. Dick M. Respiratory epidemiology unit, side effects of common antituberculosis drugs. Am J Resp Crit Care Med 2003. |
| 12. Ormerod IP and Horfied N. “frequency and type of reactions to antituberculosis drugs: observation in routine treatment.” Tubercle and lung Disease 1996; 77:37-42. |
| 13. Pelletier, Yee et al. Incidence of serious side effects from first line antituberculosis drugs among patients treated for active tuberculosis. AJP and Crit Care Med 2003 |
| 14. Toure N O, Kane Y D, Diatta A and all. Association tuberculose- VIH. Bilan de 10 années de surveillance sentinelle à la clinique de pneumologie du CHU de DAKAR (1989- 1999).Pneumologie Tropicale 2005 ; 3 : 29-33 |
| 15. Diallo M, Camara A, Kourouma P, Camara L M, Diallo M B, Bah Boubacar, Barry M D, Sow O Y. Etude des effets secondaires des antituberculeux chez les patients co-infectés Tuberculose VIH à Conakry ; GUINEE MEDICALE (2010), 69 ; 60 – 64 |
| 16. Yee D, Valiquette C, Pelletier M, Parisien I, Rocher I, Menzies D |
| 17. Incidence of serious side effects from first-line antituberculosis drugs among patients treated for active tuberculosis Am. J. Respir. Crit. Care Med., 167 (11) (2003), pp. 1472-1477. |
| 18. H.M. Blumberg, W.J. Burman, R.E. Chaisson, C.L. Daley, S.C. Etkind, L.N. Friedman, et al.American Thoracic Society/Centers for Disease Control and Prevention/Infectious Diseases Society of America: treatment of tuberculosis Am. J. Respir. Crit. Care Med., 167 (4) (2003), pp. 603-662 |
FIGURES- TABLES


REFERENCES
| 1. OMS. Stratégie DOTS : un cadre élargi pour lutter efficacement contre la tuberculose. Halte à la tuberculose maladie transmissibles. Genève 2003.24p. Who/CDS/TB/2002.297. |
| 2. OMS-DOTS : un guide pour comprendre la stratégie DOTS contre la tuberculose recommandée par l’oms.37p. Genève 1999. |
| 3. WHO/CDS//CPC/TB/99.270 Côte d’Ivoire. PNLT. Atelier bilan annuel de la lutte antituberculeuse : termes de référence. Bassam 2008. 7p. Code : CIV 304-G03-T ; 0.S.4-1 |
| 4. Programme National de Lutte contre la Tuberculose : Côte d’Ivoire. Atelier bilan annuel de la lutte antituberculeuse : bilan 2007 du PNLT. Bassam 2008. |
| 5. ATS/CDC: Targed Tuberculin Testing and Treatment of latent Tuberculosis Infection. AMJ Resp. Crit. Care Med, 161 S 221- S 247. |
| 6. Adimi N, Hocine I, Bourekoua W, Laouar L, afti S, Makhloufi T. Les effets indésirables des antituberculeux. Rev Mal Respir, 34, Sup, J2017, A214-A215 |
| 7. Perriota J, Chambonnetb É, Eschalierb A. Les effets indésirables des antituberculeux ; prise en charge. Rev Mal Respir (2011) 28, 542—555 |
| 8. Holmes CB. Une revue des différences dans l’épidémiologie de la tuberculose selon le sexe. Int J Tuberc Lung Dis 1998 ; 2(2) : 96-104. |
| 9. Aka-Danguy E et col : situation de la tuberculose dans les dix communes d’Abidjan à l’an 2000. Rev Pneumol Trop ; 4 : 17-20 |
| 10. Prasad R, Singh A, Gupta N. Adverse drug reactions in tuberculosis and management. Indian J Tuberc 2019 ;66(4) :520-532 |
| 11. Dick M. Respiratory epidemiology unit, side effects of common antituberculosis drugs. Am J Resp Crit Care Med 2003. |
| 12. Ormerod IP and Horfied N. “frequency and type of reactions to antituberculosis drugs: observation in routine treatment.” Tubercle and lung Disease 1996; 77:37-42. |
| 13. Pelletier, Yee et al. Incidence of serious side effects from first line antituberculosis drugs among patients treated for active tuberculosis. AJP and Crit Care Med 2003 |
| 14. Toure N O, Kane Y D, Diatta A and all. Association tuberculose- VIH. Bilan de 10 années de surveillance sentinelle à la clinique de pneumologie du CHU de DAKAR (1989- 1999).Pneumologie Tropicale 2005 ; 3 : 29-33 |
| 15. Diallo M, Camara A, Kourouma P, Camara L M, Diallo M B, Bah Boubacar, Barry M D, Sow O Y. Etude des effets secondaires des antituberculeux chez les patients co-infectés Tuberculose VIH à Conakry ; GUINEE MEDICALE (2010), 69 ; 60 – 64 |
| 16. Yee D, Valiquette C, Pelletier M, Parisien I, Rocher I, Menzies D |
| 17. Incidence of serious side effects from first-line antituberculosis drugs among patients treated for active tuberculosis Am. J. Respir. Crit. Care Med., 167 (11) (2003), pp. 1472-1477. |
| 18. H.M. Blumberg, W.J. Burman, R.E. Chaisson, C.L. Daley, S.C. Etkind, L.N. Friedman, et al.American Thoracic Society/Centers for Disease Control and Prevention/Infectious Diseases Society of America: treatment of tuberculosis Am. J. Respir. Crit. Care Med., 167 (4) (2003), pp. 603-662 |
ARTICLE INFO DOI: 10.12699/jfvpulm.16.48.2025.66
Conflict of Interest
Non
Date of manuscript receiving
10/01/2025
Date of publication after correction
20/03/2025
Article citation
BJM. Ahui, AE. Djegbeton, E. Akouatia, MOI. Koffi, A. Kone, B. Kouraogo, ALNH. Mobio, CV. Brou-Gode, A. Ngom, K. Horo, BA. Kouassi, N. Koffi. Side effects of antituberculous treatment in patients monitored at the antituberculosis center of Adjame - Ivory Coast. J Func Vent Pulm 2025;48(16):66-70