
 English
English
 French
French
COVID-19 and tuberculosis co-infection: About 3 cases at the Amirou Boubacar Diallo National Hospital (HNABD) in Niamey - Niger
Co-Infection COVID-19 et Tuberculose: À propos de trois cas à l’Hôpital National Amirou Boubacar Diallo (HNABD) de Niamey- Niger
Halidou Moussa1, MA. Gagara Issoufou1,5, I. Hamidou2, A. Cheikh Aboubacar3, Ramadan A1, D. Maizoumbou1, M. Ouédraogo4
1: Service de Pneumologie, Hôpital National Amirou Boubacar Diallo de Niamey. Niger
2: Université André Salifou de Zinder. Niger
3: Programme National de Lutte Contre la Tuberculose. Niger
4: Service de Pneumologie, Centre Hospitalier Universitaire Yalgado Ouedraogo. Ouagadougou. Burkinafaso
5: Université Abdou Moumouni de Niamey. Niger
Corresponding author:
HALIDOU MOUSSA Souleymane
Service de Pneumologie, Hôpital National Amirou Boubacar Diallo de Niamey - Niger.
E-mail: hmsouley14@gmail.com
ABSTRACT
COVID-19 and pulmonary tuberculosis are a major public health problem. This co-infection had developed in three patients, including two refugees. The main clinical manifestations were fever and cough. The diagnosis of Covid-19 was confirmed by GeneXpert SARS-CoV-2 nasopharyngeal swab, and that of tuberculosis by GeneXpert sputum swab. Treatment was hydroxychloroquine, azythromycin and first-line anti-tuberculosis drugs. Two patients had a favourable outcome, while one died.
We report the clinical, paraclinical, therapeutic and evolutionary characteristics of this co-infection in three patients. TB-COVID-19 coinfection added to the complexity of managing severe COVID-19 has a significant impact on health systems. Since both pathologies present the same clinical signs, simultaneous screening would be desirable. Their mutual influence and the presence of comorbidity (diabetes) is a factor of poor prognosis.
KEYWORDS: COVID-19-Pulmonary Tuberculosis co-infection; HNABD ; Refugee.
RÉSUMÉ
La COVID-19 et la tuberculose pulmonaire constituent un problème majeur de santé publique. Cette co-infection s’était développée chez trois patients dont deux refugiés. Les manifestations cliniques principales étaient la fièvre et la toux. Le diagnostic de la Covid-19 a été confirmé par le GeneXpert SARS-CoV-2 par prélèvent naso-pharyngé et celui de la tuberculose par le GeneXpert des expectorations. Le traitement instauré était l’hydroxychloroquine, l’azythromycine et les antituberculeux de première ligne. L’évolution a été favorable chez deux patients, un patient était décédé.
Nous rapportons les caractéristiques cliniques, paracliniques, thérapeutiques et évolutives de cette co-infection chez trois patients. La coïnfection TB-COVID-19 ajoutée à la complexité de la prise en charge de la forme grave de la COVID-19 a un impact significatif sur les systèmes de santé. Les deux pathologies présentant les mêmes signes cliniques, un dépistage simultané serait souhaitable. Leur influence mutuelle et la présence de comorbidité (diabète) est un facteur de mauvais pronostic.
MOTS CLÉS: Coïnfection COVID-19-Tuberculose pulmonaire; HNABD; Refugié.
INTRODUCTION
La maladie à coronavirus 2019 (COVID-19) causée par le nouveau coronavirus 2 du syndrome respiratoire aigu sévère (SARS-CoV-2) se propage toujours dans le monde depuis son début en décembre 2019 dans la ville de Wuhan, en Chine. Les caractéristiques cliniques sont dominées par des symptômes respiratoires.
Le Niger a aussi connu une pandémie de la COVID-19 ; dont le premier cas a été déclaré le 19 mars 2020 à Niamey la capitale et à la date du 3 mai 2021, le pays comptait 5 251 cas et 191 décès [1].
Pendant ce temps, la tuberculose est toujours un fardeau mondial avec 9,9 millions cas en 2020 dont 1,4 millions de décès Le taux d’incidence de la tuberculose au Niger en 2020 était de 83 cas pour 100 000 habitants par an [2].
Les deux pathologies ont des symptômes en commun et leur conjonction a suscité de nombreuses préoccupations en termes de prise en charge clinique, de diagnostic différentiel, de traitement et de pronostic, en particulier dans les pays où la tuberculose est endémique comme le Niger.
Au Niger, la première étude portant sur la coïnfection TB-COVID-19 a été faite à l’hôpital national de Zinder et portait sur deux cas [3]. Notre étude est un fait clinique rapportant sur trois cas de coïnfection COVID-19 et tuberculose observés à l’hôpital National Amirou Boubacar Diallo de Niamey.
OBSERVATION N°1
Patiente de 48ans, femme au foyer, originaire du Niger, résidente à Niamey , hypertendue (HTA) et diabétique de type 2 connue depuis 3ans ,admise en unité Covid pour douleur thoracique diffuse, polyurie, polydipsie, fièvre, dyspnée, asthénie et toux avec expectoration muco- purulente, évoluant depuis un mois. Cette symptomatologie s’était aggravée il y avait dix jours par l’apparition d’une douleur thoracique gauche d’intensité 3/6 de siège basithoracique gauche, à type de point de côté, sans irradiation, ni facteur déclenchant et calmant. On ne notait pas de voyage récent, ni de contact avec un cas confirmé de la COVID-19, pas de notion de contage tuberculeux, ni de vaccination au SARS-COV2.
A l’admission, la Patiente était consciente avec un état général au stade 4 PS OMS, des conjonctives et des muqueuses colorées, on ne notait pas d’ictère, ni de cyanose.
La température (T°) était à 39°C (fièvre), la tension artérielle (TA) à 130/83 mmHg (normale), la fréquence respiratoire (FR) à 30cycles/min (polypnée), la fréquence cardiaque (FC) à 117 battements/min (tachycardie); une dyspnée stade 3 MRCm avec une SpO2 à 94% à l’air ambiant; poids à 61kg avec IMC: 24kg/m2 (normal); bandelette urinaire: cétonurie à 3 croix; glycémie capillaire: 6,02 g/l. L’examen physique notait, un syndrome infectieux, un syndrome de condensation pulmonaire gauche, une acidocétose (cétonurie +++, glycémie capillaire à 6,02 g/l).
Sur le plan biologique, le Gene Xpert SARS-CoV-2 par prélèvent naso-pharyngé était positif et le Test Xpert/RIF des expectorations avait identifié Mycobactérium tuberculosis très bas, sensible à la rifampicine. L’hémogramme montrait une hyperleucocytose a 21000/ mm3 à prédominance granulocytaire 75,9 %; des plaquettes à 400 000/mm3, un taux d’hémoglobine à 12g/dl.
La protéine C-réactive (CRP) était à 75mg/l. L’ionogramme sanguin montrait une hyponatrémie a 121 mmol/l. Le taux de prothrombine (TP), le temps de céphaline activée (TCA), la fonction rénale, la goutte épaisse, l’acide urique, les transaminases, la sérologie du virus de l’immunodéficience humaine (VIH), l’antigène de l’hépatite B(AgHBs) étaient sans anomalies. L’examen cytobactériologique des urines étaient en cours.
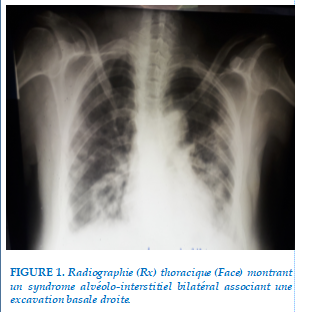
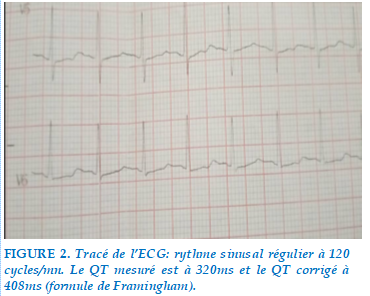
Sur le plan radiologique, on observait un syndrome alvéolo-interstitiel bilatéral avec une excavation basale droite (voir Figure 1). L’électrocardiogramme (ECG) (Figure 2 ) montrait un rythme sinusal régulier à 120 cycles/mn. Le QT mesuré est à 320ms et le QT corrigé à 408ms (formule de Framingham).
Le diagnostic d’une coïnfection COVID-19 forme critique et tuberculose pulmonaire confirmée bactériologiquement nouveau cas pharmaco-sensible sur terrain diabétique compliqué d’acidocétose a été posé.
Sur le plan thérapeutique la patiente avait reçu : une réhydratation à base du sérum salé 0,9%, un apport en Chlorure de sodium, de l’actrapid puis du mixtard, du ceftriaxone, un traitement antituberculeux (Rifampicine(R)-Isoniazide(H)-pyrazinamide(Z)-Ethambutol (E) association à dose fixe en raison de 4 cp/j), de l’hydroychloroquine 200mg: 1comprimé(cp) toutes les 8h, de l’azithromycine 500mg: 1cp/jour , de l’énoxaparine 6000UI toutes les 12 heures.
L’évolution dans les 48heures a été marquée par la négativation des corps cétoniques, une glycémie revenue à 1,96g/l, mais la persistance de la fièvre et l’apparition d’une détresse respiratoire avec une SpO2 à 84% à l’air ambiant. Une corticothérapie sous contrôle glycémique et une oxygénothérapie ont été instaurées .Le tableau s’est aggravé davantage au 4ème jour et la patiente était décédée dans un tableau de détresse respiratoire.
OBSERVATION N°2
Patient âgé de 22 ans, de nationalité guinéenne, migrant, résident dans le centre des migrants depuis un mois, pas de vaccination au SARS-COV2, référé au centre Covid pour fièvre, toux avec expectoration mucopurulente et asthénie physique évoluant depuis 03 semaines.
A l’admission, le patient était conscient avec un état général stade 2 PS OMS, conjonctives et muqueuses colorées, pas d’ictère, ni cyanose. La T° était à 39°C (hyperthermie), la TA à 130/80mmhg (normale), la FC à 102 battements/min (tachycardie), la FR à 28cycles/min (tachypnée); une SpO2: 98% à l’air
ambiant; Poids: 51kg; Taille: 1m70; IMC: 17,64kg/m2 (dénutrition).
L’examen physique retrouvait un syndrome infectieux et un syndrome de condensation pulmonaire.
Sur le plan biologique, le Gene Xpert SARS-CoV-2 par prélèvent naso-pharyngé était positif et le Test Xpert/RIF des expectorations avait identifié Mycobactérium tuberculosis très bas, sensible à la rifampicine.
L’hémogramme montrait une anémie légère microcytaire normochrome (Hb: 11g/dl) avec des Plaquettes : 300 000/ mm3 (normal). Les transaminases, l’urée, la créatininémie, l’acide urique, la glycémie, la Sérologie VIH, le test de l’hépatite B (Aghbs) étaient sans anomalies.
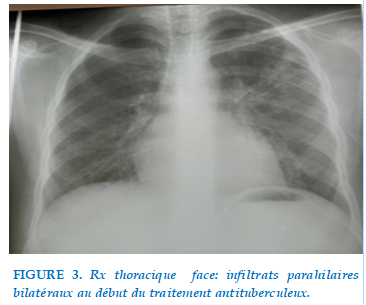
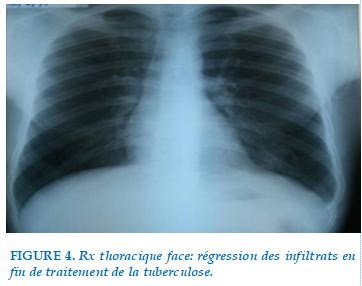
Sur le plan radiologique, on notait des infiltrats parahilaires bilatéraux au début du traitement antituberculeux, qui avaient régressé en fin de traitement (Figure 3 et Figure 4).
Le diagnostic d’une coïnfection COVID-19 modérée et tuberculose pulmonaire confirmée bactériologiquement nouveau cas pharmaco-sensible a été retenu.
Sur le plan thérapeutique le patient avait bénéficié de l’hydroychloroquine 200mg: 1cp toutes les 8h pendant 10 jours, de l’azithromycine 500mg: 1cp/jour pendant 3 jours, de l’énoxaparine 4000UI toutes les 24h pendant 15 jours, du Sérum glucosé 5% 500 cc/12H, de la vitamine C 1000 mg: 1cp/j le matin et un traitement antituberculeux pour une durée de 6 mois (2 mois de RHZE: 3cp/jour le matin à jeun et 4 mois de RH ).
L’évolution était favorable avec amendement des signes et la négativation à j15 du test PCR SARS-CoV-2.Le patient a été libéré et suivi en ambulatoire. Le contrôle des expectorations du 2ème ,5ème et 6ème mois étaient revenu négatif.
Le patient a été déclaré guéri pour la tuberculose. Aucun effet indésirable lié au traitement n’a été notifié. Le patient a été vacciné pour COVID-19 par le vaccin à vecteur viral Janssen Johnson & Johnson, une semaine après la fin du traitement antituberculeux.
OBSERVATION N°3
Patient âgé de 22ans, de nationalité somalienne, migrant, résident dans le centre des migrants depuis 4 mois, référé au centre Covid pour un syndrome pseudo grippal fait de toux, asthénie, fièvre, céphalées d’installation progressive, évoluant depuis 7 jours. Le patient était sous traitement antituberculeux pendant 3 mois (RH 4cp/j) pour une tuberculose pulmonaire confirmée bactériologiquement nouveau cas pharmaco-sensible.
Le contrôle du 2ème mois était négatif. On ne notait pas de vaccination au SARS-COV2.A l’examen le patient était conscient, La T° était à 38°7C (hyperthermie); la TA à 120/70 (normale) ; la FC à 99 battements/min (tachycardie); la FR à 27cycles/min (tachypnée); une SpO2: 98% a l’air ambiant; Poids : 59kg; avec IMC à 25kg/m2 (normale).
Sur le plan biologique, le Gene Xpert SARS-CoV-2 par prélèvent naso-pharyngé était positif. L’hémogramme montrait une anémie légère microcytaire normochrome (Hb: 11,2g/dl) avec des plaquettes à 350 000/ mm3 (normal).
Les transaminases, l’urée, la créatininémie, l’acide urique, la glycémie, la sérologie VIH, le test de l’hépatite B (Aghbs) étaient sans anomalies.
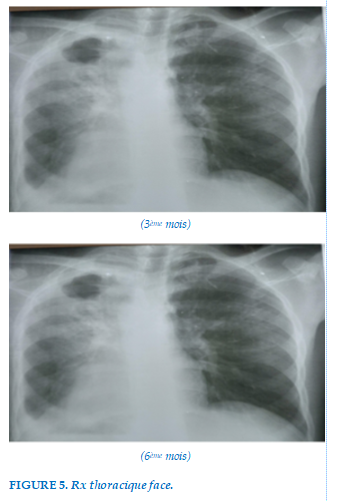
Sur le plan radiologique, on notait une atélectasie du poumon droit avec une excavation apicale et un poumon gauche compensateur. Les lésions étaient stationnaires à la fin du traitement antituberculeux (Figure 5).
Atélectasie du poumon droit avec une excavation apicale et un poumon gauche compensateur au 3ème mois Lésions restées stationnaires au 6ème mois .
Le diagnostic d’une coïnfection COVID-19 modérée et tuberculose pulmonaire bactériologiquement confirmée nouveau cas pharmaco-sensible en phase de continuation a été retenu.
Sur le plan thérapeutique, le patient avait bénéficié de: l’hydroychloroquine 200mg: 1cp toutes les 8h pendant 10 jours, de l’azithromycine 500mg: 1cp/jour pendant 3 jours, de l’enoxaparine 4000UI toutes les 24h, de la Rifampicine (R) et de l’Isoniazide (H) à raison de 4cp par jour.
L’évolution était favorable avec l’amendement des symptômes et la négativation à j14 du test PCR SARS-CoV-2. Le patient a été exéaté au 14ème jour d’hospitalisation et suivi en ambulatoire .Le contrôle des expectorations du 5ème, 6ème mois étaient revenu négatif.
Le patient a été déclaré guéri. Aucun effet indésirable lié au traitement n’a été notifié. Le patient a été vacciné pour COVID-19 par le vaccin à vecteur viral Janssen Johnson & Johnson, une semaine après la fin du traitement antituberculeux.
Une tomodensitométrie thoracique a été demandée pour bilan séquelle de tuberculose.
DISCUSSION
Aspects sociodémographiques
La majorité de nos patients (66,67%) étaient des migrants .Dans l’étude de la description de la cohorte mondiale en 2021 ; 11,16% (80/717) étaient des migrants [4]. Le Niger de par sa position géographique est une zone de transit pour les migrants en partance pour l’Europe. A cet effet, tous ceux qui avaient le statut de réfugiés étaient pris en charge à travers l’organisation internationale de la migration (OIM) et ses partenaires. Ils étaient regroupés dans des camps où ils y vivent en promiscuité. Un patient (33,33%) avait une tuberculose pulmonaire en cours de traitement avant le diagnostic de la COVID-19. Les deux autres patients (66,67%) étaient diagnostiqués simultanément dans la même semaine. Par contre Doutchi et al au Niger [3] en 2021 avaient eu un diagnostic simultané dans 100% des cas. Dans l’étude de la description de la cohorte mondiale [4] ; sur 767 patients, 553 (72,10 %) avaient une tuberculose avant la COVID-19, 71 patients (9,26 %) avaient d'abord la COVID-19 et 123 (16,04 %) ont eu les deux maladies diagnostiquées dans la même semaine.
Nous avons observé une prédominance masculine dans 66,67% des cas dans notre étude. Nos résultats étaient similaires à ceux de Claudia S et al en Italie en 2020 [5] et Tham et al à Singapour en 2020 [6] qui avaient retrouvé une prédominance masculine dans respectivement 60% et 100 % des cas. L’étude de la description de la cohorte mondiale retrouvait aussi une prédominance masculine dans 70,4% des cas [4]. Cette prédominance masculine observée dans toutes ces études pourrait s’expliquer par l’exposition de l’homme de par sa profession mais aussi son rôle dans la famille.
L’âge moyen de nos patients était de 30,66 ans avec des extrêmes de 22 ans à 48 ans. Nos résultats étaient similaires à ceux d’Aazri et al au Maroc en 2021 qui avaient retrouvé un âge moyen de 32 ans avec des extrêmes de 19 ans à 39 ans [7]. Par contre Zhi Y et al à Wuhan (chine) en 2020 avaient retrouvé dans leur étude un âge moyen de 50,33 ans avec des extrêmes de 44 ans à 57 ans [8]. La population africaine est très jeune contrairement à la population asiatique qui est de plus en plus vieillissante.
Aspect clinique
L’hypertension artérielle (33,33%) et le diabète (33,33%) étaient les principales comorbidités retrouvées Nos résultats étaient similaires à ceux de Zhi Y et al à Wuhan (chine) en 2020 avec 33,3% de diabétique [8]. Ils étaient inférieurs à ceux de Doutchi et al au Niger en 2021 qui avaient rapportés respectivement 50% pour le diabète et 50% pour l’HTA [3].
Selon De Greef et al les risques de complications et de décès liés à la COVID-19 sont plus importants chez les personnes atteintes de maladies chroniques dont les maladies pulmonaires, le diabète, l’hypertension artérielle et les maladies cardiovasculaires [9].
Les principaux signes fonctionnels observés étaient, la fièvre (100%), la toux (100%), la douleur thoracique (33,33%) , la dyspnée (33,33%) et l’asthénie (100%).Nos résultats diffèrent de ceux de Song W et al avec les caractéristiques cliniques suivants , la fièvre (77,78%) ,la toux (64,2%) , la douleur thoracique (9,88%) , la dyspnée (35,8%) et l’asthénie (11,11%) [10]. Dans notre étude le délai diagnostic moyen était de 19 jours avec des extrêmes entre 7 et 30 jours. Nos résultats étaient supérieurs à ceux de Tadolini et al en Italie en 2020 avec un délai diagnostic moyen qui était de 4 jours avec des extrêmes entre 2 et 10 jours [11]. Nos résultats étaient inférieurs à ceux de Claudia S et al en Italie en 2020 avec un délai diagnostic moyen de 30 jours avec des extrêmes de 19 et 69 jours [5].
Au vue de la difficulté diagnostic entre ces deux affections respiratoires, faudrait-il tester simultanément la COVID-19 et la tuberculose dans les pays à forte endémicité tuberculeuse. A cette question l’OMS a été affirmative sous certaines conditions et en fonction des pays, en présence de caractéristiques cliniques communs aux deux maladies, d’exposition simultanées aux deux maladies ou d’un facteur de risque de gravite pour l’une et l’autre maladie [12].
Aspect radiologique
Les principales lésions observées au cours de notre étude étaient, un syndrome alvéolaire et un syndrome alvéolo-interstitiel. Les lésions étaient bilatérales chez tous les patients (100%) témoignant de la gravité des lésions. L’image excavée n’a pas été rapportée dans le cadre de la COVID-19, ce qui nous a permis de la lier à la tuberculose chez deux de nos patients.
Un de nos patients garde des lésions séquellaires de sa tuberculose qui nécessiteront la réalisation d’une Tomodensitométrie thoracique dans le cadre du bilan lésionnel.
Aspect thérapeutique
À ce jour, aucun traitement n’est pour le moment spécifique vis-à-vis de ce type d’infection à coronavirus et la prise en charge reste symptomatique. Les directives nationales de prise en charge des cas de maladies à coronavirus au Niger recommandent pour la prise en charge l’utilisation de l’association
hydroxychloroquine-azithromycine [13]. Ces deux molécules utilisées respectivement dans le traitement du paludisme et des maladies inflammatoires ont montré leur activité in vitro sur le virus, en bloquant son entrée dans la cellule et son endocytose par différents mécanismes [14,15]. C’est de Chine que sont parvenues les premières informations d’efficacité clinique potentielle de la chloroquine avec amélioration radiographique, amélioration de la clairance virale et diminution de la progression de la maladie sur base de données préliminaires de 100 patients [16]. Par la suite, plusieurs études successives du groupe du Pr. Raoult sont venues étayer la thèse d’un effet sur la clearance virale et d’une efficacité clinique. Toutefois, ces résultats n’ont pas pu être reproduits à grande échelle et ces études ont été fortement critiquées pour leur méthodologie [17].
Dans notre étude l’Hydroxychloroquine et l’Azithromycine avaient été prescrits chez tous les patients (100%).Dans l’étude de la description de la cohorte mondiale, l’azithromycine était utilisé dans 63,1% (212/336) et l’hydroxychloroquine dans 56,85% (191/336) des cas [4].
Le traitement standard de la tuberculose pulmonaire confirmée bactériologiquement pharmaco-sensible conformément aux directives nationales du Niger est de 2RHZE/4RH avec un contrôle des expectorations aux 2ème ,3ème et 5ème mois par la bacilloscopie. Le Niger dispose des formes combinées des antituberculeux et la posologie est fonction du poids [18]. Aucun effet indésirable n’a été notifié au cours de notre étude et la durée d’hospitalisation moyenne était de 10,67 jours. Nos résultats étaient inférieurs à ceux de Doutchi au Niger en 2021, avec une durée d’hospitalisation moyenne de 21 jours [3] et ceux de l’étude de la description de la cohorte mondiale où la durée d’hospitalisation moyenne était de 16 jours [4].
Evolution
L’évolution clinique et thérapeutique étaient favorable chez deux de nos patients soit 66,67 % des cas. Une patiente était décédée (33,33%). Dans l’étude de la description de la cohorte mondiale, Sur 767 patients de la cohorte, 85 (11,08 %) étaient décédés ; 41 (14,2%) sur 289 en Europe et 44 (9,2%) sur 478 hors Europe.
Globalement, l'âge médian des patients en Europe était plus élevé qu'en dehors de l'Europe : 49 (36–63) ans versus 39 (29–54) ans. En Europe, plus de patients âgés de plus de 65 ans étaient décédés par rapport au reste du monde (26 sur 41, 63,4 % contre 18 sur 44, 40,9 %).Plus d'hommes étaient présents parmi ceux qui étaient décédés que parmi ceux qui avaient survécu (70 sur 85, 82,4 % contre 470 sur 682, 68,9 %).Les patients avec plus d'une comorbidité étaient plus fréquemment observés parmi ceux décédés (73 sur 85, 85,9 % versus 343 sur 682, 50,3 %) [4].
En ce qui concerne les patients atteints de COVID-19 en général, le spectre de la maladie chez les patients atteints de COVID-19 atteints de tuberculose peut varier d’une maladie respiratoire modérée à une maladie respiratoire grave et même à la mort. Les affections sous-jacentes, notamment le diabète, l’hypertension artérielle, ont été associées à des résultats plus graves chez les patients atteints de COVID-19 et de tuberculose. Selon la Fédération française des diabétiques (FFD), en cas de diabète (diabète de type 1 ou de type 2), l’élévation permanente de la glycémie peut altérer le système immunitaire et rendre les patients plus vulnérables aux maladies infectieuses et à leurs complications. Les infections peuvent également déséquilibrer la glycémie et/ou aggraver certaines complications du diabète déjà présentes [19].
Notre patiente décédée était âgée de 48 ans, diabétique, hypertendue, avec des lésions radiologiques bilatérales étendues à tous les deux champs pulmonaires. Dans notre étude, aucun patient n’a été vacciné d’où l’intérêt de promouvoir la vaccination afin de se protéger et de protéger la population, mais aussi d’éviter la survenue des formes graves.
CONCLUSION
La coïnfection TB-COVID-19 ajoutée à la complexité de la prise en charge de la forme grave de la COVID-19 a un impact significatif sur les systèmes de santé. Les deux pathologies présentant les mêmes signes cliniques, un dépistage simultané serait souhaitable.
Leur influence mutuelle et la présence de comorbidité (diabète) est un facteur de mauvais pronostic.
CONFLIT D’INTERETS: Aucun.
RÉFÉRENCES
| 1. WHO Coronavirus Disease (COVID-19) Dashboard. Consulté le 16/10/2022. Disponible sur : https://covid19.who.int. |
| 2. Rapport sur la tuberculose dans le monde 2021 : résumé d’orientation (Global tuberculosis report 2021 : exécutive summary). Consulte le 16/10/22. Disponible à l’adresse http://apps.who.int/iris. |
| 3. Doutchi M, Abdoul-Aziz G, Laminou IM, Issa AK, Abdoul-Aziz AB, Hamidou I, et al. Co-Infection COVID-19 et Tuberculose: à propos de deux Cas à l’Hôpital National de Zinder-Niger. Health Sci. Dis. 2021 ; 22(2) :92-96. |
| 4. The TB/COVID-19 Global study group. Tuberculosis and COVID-19 coïnfection: description of the global cohort. Eur Respir J. 2022 ; 59(3) : 2102538 |
| 5. Stochino C, Villa S, Zucchi P, Parravicini P, Gori A, Raviglione MC. Clinical characteristics of COVID-19 and active tuberculosis co-infection in an Italian reference hospital. Eur Respir J.2020 ; 56(1) :2001708 |
| 6. Tham SM, Lim WY, Lee CK, Loh J, Premkumar A, Yan B, et al. Four Patients with COVID-19 and Tuberculosis, Singapore. Emerging Infectious Diseases.2020 ; 26 (11) : 2763- 2765. |
| 7. Aazri L, Ijim M, Ait Batahar S, Amro L. Co-infection tuberculose et COVID-19 : à propos de 3 cas rares. Revue des Maladies Respiratoires Actualités.2021 ; 13(1) : 142. |
| 8. Zhi Y, Chen J, Wang Q, Liu W, Zhang Q, Nan J, et a. Three patients with COVID-19 and pulmonary tuberculosis, Wuhan, China. Emerging infectious diseases.2020 ; 26(11) : 2754-2757. |
| 9. De Greef J, Pothen L, Yildiz H, Pocin W, Reychler G, Brilot S, et al. COVID-19 : infection par le virus SARS-CoV-2. Louvain Med .2020 ; 139 (6) : 290-301 |
| 10. Song WM, Zhao JY, Zhang QY, Liu SQ, Zhu XH, An Qq, et al. COVID-19 and tuberculosis coïnfection : An overview of case reports/case series and meta-analysis. Frontiers in medicine .2021 ; 82(3): 65-70. |
| 11. Tadolini M, Codecasa LR, Garcia-Garcia JM, Blanc FX, Borisov S, Alffenaar JW, et al. Active tuberculosis,sequelae and COVID-19 co-infection : first cohort of 49 cases.Eur Respir J.2020 ; 56(1) : 2001398 |
| 12. Organisation mondiale de la Santé. Note d’information de l’OMS : COVID-19 : considérations relatives à la prise en charge de la tuberculose.2021. Consulté le 16/10/2022. Disponible sur : https://apps.who.int/iris/handle/10665/341426 |
| 13. Ministère de la santé publique du Niger. Directive nationale de prise en charge des cas de maladie à coronavirus Disease 2019 (COVID-19). 2021. Page 7-15 |
| 14. Wang M, Cao R, Zhang L, Yang X, Liu J, Xu M, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Research. 2020;30:269-271 |
| 15. Yao X, Ye F, Zhang M, Cui C, Huang B, Niu P, et al. In Vitro Antiviral Activity and Projection of Optimized Dosing Design of Hydroxychloroquine for the Treatment of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2). Clin Infect Dis. 2020; 71(15) : 732-739 |
| 16. Gao J, Tian Z, Yang X. Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies. BioScience Trends. 2020 ; 14(1):72-73 |
| 17. Gautret P, Lagier JC, Parola P, Hoang VT, Meddeb L, Mailhe M, et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial. Int J Antimicrob Agents. 2020 ; 56(1) : 105949 |
| 18. Programme National de lutte contre la Tuberculose. Guide technique national de la tuberculose au Niger.2023 ; 4éme édition : 64p |
| 19. Fédération française des diabétiques. Coronavirus et diabète, ce qu’il faut savoir. Consulté le 16/10/2022. Disponible sur : www.federationdesdiabetiques.org/federation/actualites/coronavirus-et-diabete-ce-quil-faut-savoir |
FIGURES
RÉFÉRENCES
| 1. WHO Coronavirus Disease (COVID-19) Dashboard. Consulté le 16/10/2022. Disponible sur : https://covid19.who.int. |
| 2. Rapport sur la tuberculose dans le monde 2021 : résumé d’orientation (Global tuberculosis report 2021 : exécutive summary). Consulte le 16/10/22. Disponible à l’adresse http://apps.who.int/iris. |
| 3. Doutchi M, Abdoul-Aziz G, Laminou IM, Issa AK, Abdoul-Aziz AB, Hamidou I, et al. Co-Infection COVID-19 et Tuberculose: à propos de deux Cas à l’Hôpital National de Zinder-Niger. Health Sci. Dis. 2021 ; 22(2) :92-96. |
| 4. The TB/COVID-19 Global study group. Tuberculosis and COVID-19 coïnfection: description of the global cohort. Eur Respir J. 2022 ; 59(3) : 2102538 |
| 5. Stochino C, Villa S, Zucchi P, Parravicini P, Gori A, Raviglione MC. Clinical characteristics of COVID-19 and active tuberculosis co-infection in an Italian reference hospital. Eur Respir J.2020 ; 56(1) :2001708 |
| 6. Tham SM, Lim WY, Lee CK, Loh J, Premkumar A, Yan B, et al. Four Patients with COVID-19 and Tuberculosis, Singapore. Emerging Infectious Diseases.2020 ; 26 (11) : 2763- 2765. |
| 7. Aazri L, Ijim M, Ait Batahar S, Amro L. Co-infection tuberculose et COVID-19 : à propos de 3 cas rares. Revue des Maladies Respiratoires Actualités.2021 ; 13(1) : 142. |
| 8. Zhi Y, Chen J, Wang Q, Liu W, Zhang Q, Nan J, et a. Three patients with COVID-19 and pulmonary tuberculosis, Wuhan, China. Emerging infectious diseases.2020 ; 26(11) : 2754-2757. |
| 9. De Greef J, Pothen L, Yildiz H, Pocin W, Reychler G, Brilot S, et al. COVID-19 : infection par le virus SARS-CoV-2. Louvain Med .2020 ; 139 (6) : 290-301 |
| 10. Song WM, Zhao JY, Zhang QY, Liu SQ, Zhu XH, An Qq, et al. COVID-19 and tuberculosis coïnfection : An overview of case reports/case series and meta-analysis. Frontiers in medicine .2021 ; 82(3): 65-70. |
| 11. Tadolini M, Codecasa LR, Garcia-Garcia JM, Blanc FX, Borisov S, Alffenaar JW, et al. Active tuberculosis,sequelae and COVID-19 co-infection : first cohort of 49 cases.Eur Respir J.2020 ; 56(1) : 2001398 |
| 12. Organisation mondiale de la Santé. Note d’information de l’OMS : COVID-19 : considérations relatives à la prise en charge de la tuberculose.2021. Consulté le 16/10/2022. Disponible sur : https://apps.who.int/iris/handle/10665/341426 |
| 13. Ministère de la santé publique du Niger. Directive nationale de prise en charge des cas de maladie à coronavirus Disease 2019 (COVID-19). 2021. Page 7-15 |
| 14. Wang M, Cao R, Zhang L, Yang X, Liu J, Xu M, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Research. 2020;30:269-271 |
| 15. Yao X, Ye F, Zhang M, Cui C, Huang B, Niu P, et al. In Vitro Antiviral Activity and Projection of Optimized Dosing Design of Hydroxychloroquine for the Treatment of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2). Clin Infect Dis. 2020; 71(15) : 732-739 |
| 16. Gao J, Tian Z, Yang X. Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies. BioScience Trends. 2020 ; 14(1):72-73 |
| 17. Gautret P, Lagier JC, Parola P, Hoang VT, Meddeb L, Mailhe M, et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial. Int J Antimicrob Agents. 2020 ; 56(1) : 105949 |
| 18. Programme National de lutte contre la Tuberculose. Guide technique national de la tuberculose au Niger.2023 ; 4éme édition : 64p |
| 19. Fédération française des diabétiques. Coronavirus et diabète, ce qu’il faut savoir. Consulté le 16/10/2022. Disponible sur : www.federationdesdiabetiques.org/federation/actualites/coronavirus-et-diabete-ce-quil-faut-savoir |
ARTICLE INFO DOI: 10.12699/jfvpulm.16.48.2025.88
Conflict of Interest
Non
Date of manuscript receiving
10/01/2025
Date of publication after correction
20/03/2025
Article citation
Halidou Moussa, MA. Gagara Issoufou, I. Hamidou, A. Cheikh Aboubacar, Ramadan A, D. Maizoumbou, M. Ouédraogo. COVID-19 and tuberculosis co-infection: About 3 cases at the Amirou Boubacar Diallo National Hospital (HNABD) in Niamey - Niger. J Func Vent Pulm 2025;48(16):88-94