
 English
English
 French
French
Extensively resistant tuberculosis (XDR-TB) and Pre-Extensively resistant tuberculosis (Pre-XDR-TB): About 3 cases from the same family in Burkina Faso
Tuberculose Ultrarésistante (XDR-TB) et Pré-Ultrarésistante (Pré-XDR-TB): À propos de 3 cas issus d’une même famille au Burkina Faso
S.Halidou Moussa1, AR.Ouédraogo2, D.Zida3, K.Boncoungou4, G.Ouédraogo4, G.Badoum4,M.Ouédraogo4
1: Service de Pneumologie, Hôpital National Amirou Boubacar Diallo de Niamey-Niger
2: Service de Pneumologie, Centre Hospitalier Universitaire de TENGANDOGO. Ouagadougou – Burkina Faso
3: Service de Pneumologie, Centre Hospitalier Universitaire de BOGODOGO. Ouagadougou – Burkina Faso
4: Service de Pneumologie, Centre Hospitalier Universitaire Yalgado OUEDRAOGO. Ouagadougou – Burkina Faso
Corresponding author: Souleymane HALIDOU MOUSSA, Service de Pneumologie, Hôpital National Amirou Boubacar Diallo de Niamey-Niger.
E-mail: hmsouley14@gmail.com
ABSTRACT
Introduction. Pre-extensively drug-resistant tuberculosis (Pre-XDR-TB) and extensively drug-resistant tuberculosis (XDR-TB) constitute a major public health problem. We report two cases of Pre-XDR-TB and one case of XDR-TB from the same family in which the index case was the father. Case report 1. It was a 44-year-old patient, Burkinabé, fashion designer, married, father of 6 children, the last born at 2 years old. Smoking at 10PA weaned 12 years ago, immunocompromised with HIV type 1 since 2009 on Atripla. Would not have had a prison past. Would be the index case of his wife and child. Patient treated for multidrug-resistant tuberculosis (MDR-TB), short regimen in November 2015, then long regimen in June 2016, who in September 20I7, was diagnosed pre-XDR-TB with additional resistance to fluoroquinolones. A 20-month treatment containing bedaquiline was started. Minor adverse effects such as nausea and vomiting were observed during the first month. He completed his treatment on 06/14/2019. Case report 2. It was the wife of the first patient, aged 39, Burkinabé, housewife, mother of 6 children, the last born at 2 years old. Immunocompromised by HIV type 1 since 2009 on Atripla. Diagnosed 09/13/2017 pre-XDR tuberculosis with primary resistance. The treatment was initiated on 09/14/2017. The course was punctuated by adverse effects. At the fourteenth month of treatment the patient was declared a failure and screened for XDR-TB. XDR-TB treatment was initiated on 01/18/2019. The patient died in the third month of her treatment due to severe anemia. Sputum and cultures were always positive. Case report 3. It was a 21-year-old patient, son of the first case presented, student in second grade, smoking at 0.25PA weaned in 2017, notion of contagion (index case was the father). He was diagnosed pre-XDR and the treatment initiated on 01/18/2019.The adverse effects noted during the first month were: arthralgia, skin rash in the form of papules localized on the face which improved.The patient was declared treatment completed at the end of 20 months of treatment.
KEYWORDS: Extensively drug; Resistant tuberculosis; Pre-extensively drug; Primary resistance.
RÉSUMÉ
Introduction. La tuberculose pré-ultrarésistante (Pré-XDR-TB) et ultrarésistante (XDR-TB) constituent un problème majeur de santé publique. Nous rapportons deux cas de Pré-XDR-TB et un cas de XDR-TB issus d’une même famille dont le cas index était le père de famille. Observation 1. Il s’agissait d’un patient de 44 ans, Burkinabé, couturier, marié, père de 06 enfants dont le dernier né à 2 ans. Tabagique à 10PA sevré il y a 12 ans, immunodéprimé au VIH type 1 depuis 2009 sous Atripla .N'aurait pas eu de passé carcéral. Serait le cas index de sa femme et de son enfant. Patient traité pour une tuberculose multirésistante (TB-MR), régime court en novembre 2015, puis régime long en juin 2016, qui en septembre 20I7, était diagnostiqué pré-XDR-TB avec une résistance supplémentaire aux fluoroquinolones. Un traitement de 20 mois contenant la bédaquiline a été instauré. Des effets indésirables mineurs à type de nausées et de vomissements étaient observés au .cours du premier mois.IL a terminé son traitement le 14/06/2019. Observation 2. Il s’agissait de la femme du premier patient, âgée de 39 ans, Burkinabé, femme au foyer, mère de 06 enfants dont le dernier né à 2 ans. Immunodéprimée au VIH type 1 depuis 2009 sous Atripla. Diagnostiquée la 13/09/2017 tuberculose pré-XDR avec une résistance primaire. Le traitement a été initié le 14/09/2017 .L’évolution a été émaillée d’effets indésirables. Au quatorzième mois du traitement la patiente a été déclarée échec et dépister XDR-TB. Un traitement TB-XDR a été initié le 18/01/2019. La patiente était décédée au troisième mois de son traitement dans un tableau d’anémie sévère. Les expectorations et les cultures étaient toujours positives. Observation 3. Il s’agissait d’un patient de 21ans, fils du premier cas présenté, élève en classe de seconde, tabagique à 0,25PA sevré en 2017, notion de contage (cas index était le père). Il a été diagnostiqué pré-XDR et le traitement initié le 18/01/2019. Les effets indésirables notés au cours du premier mois étaient : arthralgies, éruption cutanées à type de papules localisées au visage qui se sont amendés. Le patient a été déclaré traitement terminé à la fin de 20 mois de traitement.
MOTS CLÉS: Tuberculose ultrarésistante; Tuberculose résistante; Ultrarésistante; Résistance primaire.
INTRODUCTION
La tuberculose pré-ultrarésistante (Pré-XDR-TB) et ultrarésistante (XDR-TB) constituent un problème majeur de santé publique.
La tuberculose multirésistante (TB-MR/RR) se définit comme une résistance à au moins la rifampicine et à l’isoniazide. Jusqu’en décembre 2020, la tuberculose ultrarésistante (XDR-TB) se définissait par une TB-MR résistante à une fluoroquinolone et à au moins un des trois médicaments injectables de deuxième intention (Amikacine, Capréomycine et Kanamycine), et la tuberculose pré-ultrarésistante (Pré-XDR-TB) par une TB-MR résistante à une fluoroquinolone ou à un des trois médicaments injectables de deuxième intention [1]. Ces définitions ont connu une évolution et depuis le 1er janvier 2021 la Pré-XDR-TB se définit comme toute TB-MR/RR résistante aux fluoroquinolones. Quant à la XDR-TB elle correspond à une TB-MR/RR résistante aux fluoroquinolones et à un des médicaments du groupe A (lévofloxacine, moxifloxacine, bédaquiline et linézolide) [2].
Au Burkina Faso les premiers cas de tuberculose ultrarésistante ont été notifiés en 2009[3]. Selon les données de l’organisation mondiale de la santé 8,5% des cas de tuberculose multirésistante sont susceptibles de développer une tuberculose ultrarésistante [4]. Nous rapportons deux cas de Pré-XDR-TB et un cas de XDR-TB issus d’une même famille dont le cas index était le père de famille. Ces patients étaient issus de la deuxième cohorte des patients pré et ultrarésistantes (2017-2020) du Burkina Faso [5].
PATIENTS ET OBSERVATIONS
Observation 1
Il s’agissait d’un patient de 44 ans, Burkinabé, couturier, marié, père de 06 enfants dont le dernier né à 2 ans. Le patient était tabagique à 10PA sevré il y a 12 ans, immunodéprimé au VIH type 1 depuis 2009 sous Atripla (Tenovofir-Emtricitabine-Effavirenz) avec un dernier taux de CD4 a 385 Cell/mm3. N'aurait pas eu de passé carcéral.
L’itinéraire thérapeutique du patient était :
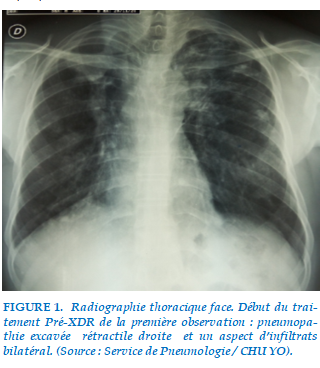
L’examen clinique retrouvait un Indice de Masse Corporel (IMC) à 19,5 Kg/m2 de surface corporelle (normal), un syndrome de condensation pulmonaire bilatéral. Le délai diagnostic était de 15 mois. La radiographie thoracique de face montrait une pneumopathie excavée rétractile droite et un aspect d’infiltrats bilatéral (Figure 1). Le bilan pré-thérapeutique était normal. Le traitement pré-XDR-TB a été initié le 14/09/2017 selon le protocole suivant : 6(Amikacine(Amk)-Bédaquiline(Bdq)-Lfx-Linézolide(Lzd)-Cfz-Z-Eto-Paraaminosalycilique(PAS))/14(Lfx-Cfz-Z-Eto-PAS). Les effets indésirables notés au cours du premier mois étaient des nausées et des vomissements classés grade 1.Le traitement Antirétroviral(ARV) a été modifié pour éviter l’interaction entre la Bédaquiline et l’Effavirenz selon le schéma suivant: Tenovofir-Emtricitabine-Dolutégravir. On a observé une conversion des expectorations au troisième mois et de la culture au sixième mois. IL a terminé son traitement le 14/06/2019.
Observation 2
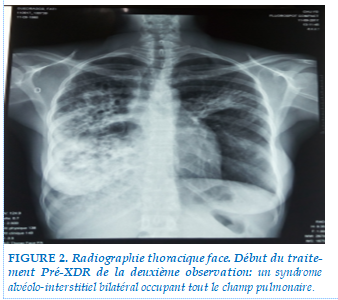
Il s’agissait de la femme du premier patient, âgée de 39 ans, Burkinabé, femme au foyer, mère de 06 enfants dont le dernier né à 2 ans. Immunodéprimée au VIH type 1 depuis 2009 sous Atripla avec dernier taux de CD4 à 82 Cell/mm3 et une charge virale inférieure à 50 copies. La patiente a été dépistée le 13/09/2017, tuberculose pré-XDR avec une résistance supplémentaire aux fluoroquinolones. Notons qu’il s’agissait d’un cas de résistance primaire. L’examen clinique montrait un IMC à 14,87 Kg/m2 de surface corporelle (dénutrition), un syndrome infectieux, un syndrome anémique (pâleur conjonctivale et une anémie microcytaire hypochrome avec un taux d’hémoglobine à 8,4gdl), un syndrome de condensation pulmonaire bilatérale. Le délai diagnostic était de 2 mois. La radiographie thoracique de face montrait un syndrome alvéolo-interstitiel bilatéral occupant tout le champ pulmonaire droit et le tiers supérieur du champ pulmonaire gauche avec comblement du cul de sac costo-diaphragmatique droit (figure 2). Le traitement a été initié le 14/09/2017 selon le protocole : 6 (Amk- Bdq-Lfx-Lzd-Cfz-Z-Et-Pas)/14(Lfx-Cfz-Z-Et-Pas). Le traitement ARV a été modifié pour éviter l’interaction entre la Bédaquiline et l’Effavirenz en : Tenovofir-Emtricitabine-Dolutégravir. L’évolution a été émaillée d’effets indésirables à type de nausées et vomissement depuis l’initiation du traitement jusqu’au quatorzième mois du traitement où les résultats de la bacilloscopie et de la culture demeuraient positifs. Une deuxième SL-LPA (line–probe assay sur la 2ème ligne) réalisée en Novembre 2018 soit à M14 classait la patiente tuberculose XDR. Un traitement TB-XDR a été initié le 18/01/2019 selon le même protocole Pré-XDR : 6 (Amk- Bdq-Lfx-Lzd-Cfz-Z-Et-PAS)/14(Lfx-Cfz-Z-Et-PAS). La patiente était décédée au troisième mois de son traitement dans un tableau d’anémie sévère avec un taux d’hémoglobine à 5g/dl. Les expectorations et les cultures étaient toujours positives.
Observation 3
Il s’agissait d’un patient de 21ans, fils du premier cas présenté, élève en classe de seconde, tabagique à 0,25PA sevré en 2017, notion de contage (cas index était le père).Notons que les autres enfants de la famille étaient dépistés négatifs. L’examen clinique retrouvait un IMC à 18 Kg/m2 de surface corporelle (normale), un syndrome de condensation pulmonaire gauche.Le délai diagnostic était de 1 mois.
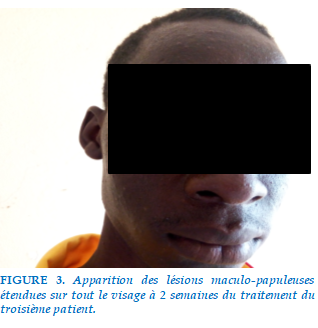
Il a été diagnostiqué pré-XDR et le traitement initié le 18/01/2019 selon le protocole suivant : 6(Amk-Bdq-Lzd-Lfx-Cfz-Z-Eto-PAS)/14(Lfx-Cfz-Z-Eto-PAS).Notons qu’il s’agissait aussi d’un cas de résistance primaire Les effets indésirables notés au cours du premier mois étaient : arthralgies, éruption cutanées à type de papules localisées au visage (figure 3). On a observé une conversion des expectorations au cinquième mois et de la culture au sixième mois. Les effets indésirables se sont amendés. Le patient a été déclaré traitement terminé à la fin de 20 mois de traitement.
DISCUSSION
Il s’est agi de deux cas de tuberculose pré-XDR et d’un cas de tuberculose ultrarésistante rapportés au sein d’une même famille dont le cas index était le chef de famille.
Ces cas mettent en exergue la problématique du diagnostic et de la prise en charge de la tuberculose pré-XDR et XDR en Afrique subsaharienne.
Les accompagnants du cas index étaient sa femme et son fils. Contrairement aux pays à revenus « élevés» où les patients sont assistés par du personnel qualifié.
Des cas de contamination hospitalière ou communautaire avaient été rapportés dans la littérature notamment Andrews et al [6] et Ming Zhao et al [7].
On notait un retard important dans le délai diagnostique de nos cas rapportés.
Le délai de diagnostique moyen des trois cas était de 6 mois avec un minimum de 1 mois et un maximum de 15 mois.
Le retard important dans le délai diagnostique et la mise sous traitement de nos patients a d’importantes répercussions dans une perspective de santé publique. En effet les patients dépistés tuberculose pulmonaire bactériologiquement confirmés sont contagieux, et promiscuité aidant, on pourrait être confronté à une dissémination de la maladie dans la population. La meilleure prévention de la tuberculose demeure le dépistage précoce et le traitement des cas. Et qui dit diagnostic précoce, dit ensemble des mesures permettant, par l’éducation du public, l’amélioration de l’accès aux soins et la rationalisation de la prise de décisions, de raccourcir les délais dans le diagnostic des malades déjà symptomatiques, de telle sorte que le traitement en soit plus facile, plus efficace et moins onéreux [8].
Une analyse sur la transmission de la tuberculose indique que le retard au diagnostic est le plus important obstacle pour le contrôle de l’épidémie de la tuberculose [9].
Avec l’acquisition de la LPA (GenoType MTBDRplus et GenoType MTBDRsl) en 2017, le Programme National de la lutte contre la Tuberculose du Burkina Faso avait initié la recherche systématique de la résistance chez les patients bacillifères conformément aux directives de l’Organisation Mondiale de la Santé (OMS). Ceci permettra de palier à ce problème de diagnostic tardif.
La relation entre la tuberculose et le VIH n’est plus à démonter, celle-ci a été abondamment évoquée dans la littérature. Il est prouvé que le VIH est le facteur de risque le plus important de survenue de la tuberculose et que la tuberculose est la première infection opportuniste au cours de l’infection par le VIH [10].
La prévalence du VIH parmi les patients co-infectés tuberculose toute forme-VIH au Burkina Faso était de 9,10% en 2018) [11].
L’Organisation Mondiale de la Santé(OMS) estime que 920 000 personnes vivant avec le VIH avaient contracté la tuberculose en 2017 [4].
Les patients infectés par le VIH plus fragiles au point de vue immunitaire auraient une mortalité plus élevée que ceux VIH négatifs avant le dépistage et le traitement de leur XDR-TB.
Plusieurs auteurs avaient rapporté des cas de VIH positif chez les XDR-TB : Ulrich Davy KOMBILA, et al au Gabon [12], Gallo et al à Sao Paulo au Brésil [13] et Gandhi et al au Kwazulu-Natal en Afrique du Sud [14] retrouvaient respectivement 20%, 18,7% et 98%.
Par contre d’autres études ne rapportaient pas de cas de VIH mais il s’agissait des petites séries notamment : Diarra et al au Mali [15], Bakayoko et al en Côte d’ivoire [16], Okemba-Okombi FH, et al au Congo [17].
Le tabagisme est un fléau au Burkina Faso avec une prévalence nationale à 19,8% en 2014 [18]. Il est non seulement une des causes majeures de morbidité et de mortalité mais également un des facteurs de risque pour le développement de la TB comme décrit dans la littérature [19].
Okemba-Okombi FH, et al au Congo(Brazzaville) avait rapporté le tabagisme chez 46,2% des patients multirésistants [20].
Selon certains auteurs, le tabagisme jouerait un rôle dans l’apparition de la résistance aux antituberculeux [21,22]. Il s’avère donc nécessaire d’intégrer un programme d’aide au sevrage tabagique dans la lutte antituberculeuse.
Le schéma thérapeutique utilisé ,était un schéma standardisé d’une durée de 20 mois contenant la Bédaquiline et le Linézolide comme la décrit José A. Caminero et al [23] dans le traitement des pré-XDR et XDR-TB.
L’idéal des régimes est le traitement individualisé à partir des résultats de la culture avec Test De Sensibilité(DST).
Concernant La femme du cas index, l’échec du traitement Pré-XDR était lié en partie à un problème d’absorption intestinale. Le même protocole a été reconduit quand elle était devenue TB-XDR au vu des molécules disponibles.
Il a été décrit dans la littérature[24,25] beaucoup des effets indésirables, du traitement qui est long et contraignant pour les patients.
Un de nos patients était décédé dans un tableau d’anémie sévère probablement dû à l’utilisation prolongé (11mois) du linézolide(Lzd) dont son rôle était connu dans la survenue des aplasies médullaires [26]. Le Lzd était arrêté bien avant son décès, une transfusion avait été aussi faite.
Ce cas reflète aussi la disponibilité des molécules adéquates pour la prise en charge des patients. Le Lzd était utilisé de façon prolongée.
CONCLUSION
La Pré-XDR-TB et la XDR-RB sont des formes graves de tuberculose par le risque de contagion pour l’entourage familial, mais également par le fait que le traitement est contraignant et couteux.
L’amélioration du pronostic des patients passe par un diagnostic précoce et une prise en charge adaptée aux recommandations internationales.
CONFLIT D’INTERETS
Aucun.
RÉFÉRENCES
| 1. World Health Organization. Global TB Report. WHO/HTM/TB/2020.20. Geneva, Switzerland: WHO, 2020. |
| 2. World Health Organization. Concept note: Expert Consultation on the definition of extensively drug resistant tuberculosis 27-29 October 2020 Global TB Programme. Geneva, Switzerland: WHO, 2020. |
| 3. Saleri N, Badoum G, Ouedraogo M, Dembélé SM, Nacanabo R, Bonkoungou V, et al . Extensively drug-resistant tuberculosis, Burkina Faso. Emerg Infect Dis. 2010;16(5):840. |
| 4. WHO | Global tuberculosis report 2018 [Internet]. [Cité 13 mai 2019]. Disponible sur: https://www.who.int/tb/publications/global_report/en/ |
| 5. Boncoungou K, Halidou MS, Maiga S, Ouédraogo AR, Ouédraogo GA, Ouédraogo M, et al. J Func Vent Pulm 2023;43(14):13-18 |
| 6. Andrews JR, Gandhi NR, Moodley P, Shah NS, Bohlken L, Moll AP, et al. Exogenous Reinfection as a Cause of Multidrug-Resistant and Extensively Drug-Resistant Tuberculosis in Rural South Africa. J Infect Dis. 1 déc 2008;198(11):1582‑9. |
| 7. Zhao M, Li X, Xu P, Shen X, Gui X, Wang L, et al. Transmission of MDR and XDR Tuberculosis in Shanghai, China. PLOS ONE. 3 févr 2009;4(2):e4370. |
| 8. Grodos D. Prévention, dépistage, diagnostic précoce: mise au point théorique et terminologique.Health and community,Working paper,n°21,1988,révision 1991. |
| 9. Uys PW, Warren RM, Helden PD van. A Threshold Value for the Time Delay to TB Diagnosis. PLOS ONE. 22 août 2007 ;2(8):e757. |
| 10. Nkurunziza J, Karstaedt AS, Louw R, Padanilam X. Treatment outcomes of pre- and extensively drug-resistant tuberculosis in Johannesburg, South Africa. The International Journal of Tuberculosis and Lung Disease, Volume 22, Number 12, 1 December 2018, pp. 1469-1474(6). |
| 11. Programme National de lutte contre la Tuberculose Burkina Faso. Rapport annuel d'activités de lutte contre la tuberculose, edition.2018, 29p. |
| 12. Ulrich Davy KOMBILA, Charlene MANOMBA BOULINGUI, Fernand N’GOMANDA, Jéconias Ver-lain MOUITY MAVOUNGOU, Chelma NGUIA NKILIKISSA, Nicole BIVIGOU, et al. Profil épidémiologique et devenir des patients suivis en ambulatoire pour Tuberculose pré et ultra-résistante à Libreville, Gabon. J Func Vent Pulm 2024;46(15):33-37 |
| 13. Gallo JF, Pinhata JMW, Simonsen V, Galesi VMN, Ferrazoli L, Oliveira RS. Prevalence, associated factors, outcomes and transmission of extensively drug-resistant tuberculosis among multidrug-resistant tuberculosis patients in São Paulo, Brazil: a cross-sectional study. Clin Microbiol Infect. 1 août 2018;24(8):889‑95. |
| 14. Gandhi NR, Moll A, Sturm AW, Pawinski R, Govender T, et al. Extensively drug-resistant tuberculosis as a cause of death in patients co-infected with tuberculosis and HIV in a rural area of South Africa. The Lancet. 4 nov 2006; 368(9547):1575‑80. |
| 15. Diarra B, Toloba Y, Konate B, Sanogo M, Togo ACG, Camara F, et al. Extensively drug resistant tuberculosis in Mali: a case report. BMC Res Notes. 2017;10(1):561. |
| 16. Bakayoko AS, Ahui BJ, Kone Z, Daix AT, Samake K, Domoua KM, et al. Extensively drug resistant tuberculosis in Ivory Coast. Rev Pneumol Clin. 2015;71(6):350–353. |
| 17. Okombi FHO, Bemba E, Bopaka RG, Abacka KBO, Kaswa M. Extensively resistant tuberculosis: Four cases in the Republic of Congo. Médecine Santé Trop. 1 juill 2018;28(3):289‑91. |
| 18. Au Burkina Faso, la consommation de cigarettes a atteint des proportions élevées dans certaines couches (ministre) #aOuaga_com [Internet]. [cité 17 août 2019]. Disponible sur: http://news.aouaga.com/h/28053.html |
| 19. Zellweger J-P. Tuberculose et tabagisme : quand deux épidémies convergent. Rev Med Suisse 2008 ; 4 : 2576-80. |
| 20. Okemba-Okombi FH, Ndinga Essango E ,Kaswa Kayomo M, Ossale Abacka BK, Bopaka RG, Atipo Ibara BI. Tuberculose multi résistante à Brazzaville: Aspects épidémiologiques, cliniques, radiographiques et évolutifs. J Func Vent Pulm 2020;33(11):1-6 |
| 21. Shin SS, Pasechnikov AD, Gelmanova IY, Peremitin GG, Strelis AK, Mishustin S, et al. Adverse reactions among patients being treated for MDR-TB in Tomsk, Russia. Int J Tuberc Lung Dis Off J Int Union Tuberc Lung Dis. déc 2007;11(12):1314‑20. |
| 22. Raoufi M, Souhaib H, Kouissmi H, Benamor J, Marc K, Soualhi M, et al. Facteurs de risques de la tuberculose multi-résistante : étude à l’hôpital Moulay Youssef de Rabat. Rev Mal Respir. 1 janv 2015;32:A212‑3. |
| 23. Caminero JA, Piubello A, Scardigli A, Migliori GB. Proposal for a standardised treatment regimen to manage pre- and extensively drug-resistant tuberculosis cases. Eur Respir J. 1 juill 2017;50(1):1700648. |
| 24. Borisov SE, Dheda K, Enwerem M, Leyet RR, D’Ambrosio L, Centis R, et al. Effectiveness and safety of bedaquiline-containing regimens in the treatment of MDR- and XDR-TB: a multicentre study. Eur Respir J. 1 mai 2017;49(5):1700387. |
| 25. Singh JA, Upshur R, Padayatchi N (2007) .XDR-TB in South Africa: No Time for Denial or Complacency. PLoS Med 4(1): e50. |
| 26. Piubello A, Aït-Khaled N, Caminero JA, Chiang C-Y, Dlodlo RA, Fujiwara PI, et al. Guide pratique pour la prise en charge de la tuberculose résistante. Paris, France: Union Internationale contre la Tuberculose et les Maladies Respiratoires, 2018. |
FIGURES
RÉFÉRENCES
| 1. World Health Organization. Global TB Report. WHO/HTM/TB/2020.20. Geneva, Switzerland: WHO, 2020. |
| 2. World Health Organization. Concept note: Expert Consultation on the definition of extensively drug resistant tuberculosis 27-29 October 2020 Global TB Programme. Geneva, Switzerland: WHO, 2020. |
| 3. Saleri N, Badoum G, Ouedraogo M, Dembélé SM, Nacanabo R, Bonkoungou V, et al . Extensively drug-resistant tuberculosis, Burkina Faso. Emerg Infect Dis. 2010;16(5):840. |
| 4. WHO | Global tuberculosis report 2018 [Internet]. [Cité 13 mai 2019]. Disponible sur: https://www.who.int/tb/publications/global_report/en/ |
| 5. Boncoungou K, Halidou MS, Maiga S, Ouédraogo AR, Ouédraogo GA, Ouédraogo M, et al. J Func Vent Pulm 2023;43(14):13-18 |
| 6. Andrews JR, Gandhi NR, Moodley P, Shah NS, Bohlken L, Moll AP, et al. Exogenous Reinfection as a Cause of Multidrug-Resistant and Extensively Drug-Resistant Tuberculosis in Rural South Africa. J Infect Dis. 1 déc 2008;198(11):1582‑9. |
| 7. Zhao M, Li X, Xu P, Shen X, Gui X, Wang L, et al. Transmission of MDR and XDR Tuberculosis in Shanghai, China. PLOS ONE. 3 févr 2009;4(2):e4370. |
| 8. Grodos D. Prévention, dépistage, diagnostic précoce: mise au point théorique et terminologique.Health and community,Working paper,n°21,1988,révision 1991. |
| 9. Uys PW, Warren RM, Helden PD van. A Threshold Value for the Time Delay to TB Diagnosis. PLOS ONE. 22 août 2007 ;2(8):e757. |
| 10. Nkurunziza J, Karstaedt AS, Louw R, Padanilam X. Treatment outcomes of pre- and extensively drug-resistant tuberculosis in Johannesburg, South Africa. The International Journal of Tuberculosis and Lung Disease, Volume 22, Number 12, 1 December 2018, pp. 1469-1474(6). |
| 11. Programme National de lutte contre la Tuberculose Burkina Faso. Rapport annuel d'activités de lutte contre la tuberculose, edition.2018, 29p. |
| 12. Ulrich Davy KOMBILA, Charlene MANOMBA BOULINGUI, Fernand N’GOMANDA, Jéconias Ver-lain MOUITY MAVOUNGOU, Chelma NGUIA NKILIKISSA, Nicole BIVIGOU, et al. Profil épidémiologique et devenir des patients suivis en ambulatoire pour Tuberculose pré et ultra-résistante à Libreville, Gabon. J Func Vent Pulm 2024;46(15):33-37 |
| 13. Gallo JF, Pinhata JMW, Simonsen V, Galesi VMN, Ferrazoli L, Oliveira RS. Prevalence, associated factors, outcomes and transmission of extensively drug-resistant tuberculosis among multidrug-resistant tuberculosis patients in São Paulo, Brazil: a cross-sectional study. Clin Microbiol Infect. 1 août 2018;24(8):889‑95. |
| 14. Gandhi NR, Moll A, Sturm AW, Pawinski R, Govender T, et al. Extensively drug-resistant tuberculosis as a cause of death in patients co-infected with tuberculosis and HIV in a rural area of South Africa. The Lancet. 4 nov 2006; 368(9547):1575‑80. |
| 15. Diarra B, Toloba Y, Konate B, Sanogo M, Togo ACG, Camara F, et al. Extensively drug resistant tuberculosis in Mali: a case report. BMC Res Notes. 2017;10(1):561. |
| 16. Bakayoko AS, Ahui BJ, Kone Z, Daix AT, Samake K, Domoua KM, et al. Extensively drug resistant tuberculosis in Ivory Coast. Rev Pneumol Clin. 2015;71(6):350–353. |
| 17. Okombi FHO, Bemba E, Bopaka RG, Abacka KBO, Kaswa M. Extensively resistant tuberculosis: Four cases in the Republic of Congo. Médecine Santé Trop. 1 juill 2018;28(3):289‑91. |
| 18. Au Burkina Faso, la consommation de cigarettes a atteint des proportions élevées dans certaines couches (ministre) #aOuaga_com [Internet]. [cité 17 août 2019]. Disponible sur: http://news.aouaga.com/h/28053.html |
| 19. Zellweger J-P. Tuberculose et tabagisme : quand deux épidémies convergent. Rev Med Suisse 2008 ; 4 : 2576-80. |
| 20. Okemba-Okombi FH, Ndinga Essango E ,Kaswa Kayomo M, Ossale Abacka BK, Bopaka RG, Atipo Ibara BI. Tuberculose multi résistante à Brazzaville: Aspects épidémiologiques, cliniques, radiographiques et évolutifs. J Func Vent Pulm 2020;33(11):1-6 |
| 21. Shin SS, Pasechnikov AD, Gelmanova IY, Peremitin GG, Strelis AK, Mishustin S, et al. Adverse reactions among patients being treated for MDR-TB in Tomsk, Russia. Int J Tuberc Lung Dis Off J Int Union Tuberc Lung Dis. déc 2007;11(12):1314‑20. |
| 22. Raoufi M, Souhaib H, Kouissmi H, Benamor J, Marc K, Soualhi M, et al. Facteurs de risques de la tuberculose multi-résistante : étude à l’hôpital Moulay Youssef de Rabat. Rev Mal Respir. 1 janv 2015;32:A212‑3. |
| 23. Caminero JA, Piubello A, Scardigli A, Migliori GB. Proposal for a standardised treatment regimen to manage pre- and extensively drug-resistant tuberculosis cases. Eur Respir J. 1 juill 2017;50(1):1700648. |
| 24. Borisov SE, Dheda K, Enwerem M, Leyet RR, D’Ambrosio L, Centis R, et al. Effectiveness and safety of bedaquiline-containing regimens in the treatment of MDR- and XDR-TB: a multicentre study. Eur Respir J. 1 mai 2017;49(5):1700387. |
| 25. Singh JA, Upshur R, Padayatchi N (2007) .XDR-TB in South Africa: No Time for Denial or Complacency. PLoS Med 4(1): e50. |
| 26. Piubello A, Aït-Khaled N, Caminero JA, Chiang C-Y, Dlodlo RA, Fujiwara PI, et al. Guide pratique pour la prise en charge de la tuberculose résistante. Paris, France: Union Internationale contre la Tuberculose et les Maladies Respiratoires, 2018. |
ARTICLE INFO DOI: 10.12699/jfvpulm.16.48.2025.105
Conflict of Interest
Non
Date of manuscript receiving
10/01/2025
Date of publication after correction
20/03/2025
Article citation
S.Halidou Moussa, AR.Ouédraogo, D.Zida, K.Boncoungou, G.Ouédraogo, G.Badoum,M.Ouédraogo. Extensively resistant tuberculosis (XDR-TB) and Pre-Extensively resistant tuberculosis (Pre-XDR-TB): About 3 cases from the same family in Burkina Faso. J Func Vent Pulm 2025;48(16):105-110